¿ INTRODUCCIÓN
La detección de cáncer de próstata en Estados Unidos ha aumentado en las últimas dos décadas debido a que anualmente se realizan aproximadamente un millón de biopsias. A pesar de esto, durante 2007 se registraron 28 000 muertes por esta enfermedad.1 En México es la segunda causa de muerte por cáncer en hombres, con una tasa de 17.9 por 100 000 habitantes.2 Sabemos que la especificidad del antígeno prostático especifico total (APEt) y el tacto rectal (TR) va de 24% a 37%; más de 75% de los hombres con valores de APEt en el rango de 2.5 ng/mL a 10 ng/mL o con TR sospechoso, tienen una primera biopsia negativa,3,4 por lo que el valor predictivo positivo de la biopsia es muy bajo. De persistir la sospecha de CaP, se recomienda una biopsia de repetición.5
Sin embargo, esta nueva muestra resultará nuevamente negativa a cáncer en aproximadamente 80%, aunado al costo, la ansiedad, malestar del procedimiento y las complicaciones asociadas a la misma.6 Considerando el uso del APEt y sus derivaciones, la correlación del APEt con el volumen de la próstata, el tiempo de duplicación, la densidad del APE y sofisticados modelos estadísticos mejoran la especificidad, pero aún así no resuelven este problema. El valor predictivo positivo del APE en "zona gris" (2.5 ng/dL a 10 ng/dL) es menor a 25%.7,8 La fracción libre del APE (%flAPE) sólo ha proporcionado incremento de 20% en la especificidad.3 Los hombres con niveles séricos elevados de APE y los resultados de la biopsia de próstata negativa presentan un dilema ante la carencia de un estudio diagnóstico exacto.
Por la necesidad de pruebas para aumentar la probabilidad de la detección de CaP y reducir el número de biopsias de repetición innecesarias se han estudiado numerosos marcadores tumorales.
Bussemaker en 1999, fue el primero en describir el gen del cáncer de próstata 3, llamado inicialmente DD3 y actualmente PCA3, el cual es uno de los genes más específicos. Su transcripción es un ARNm no codificante localizado en el cromosoma 9 (9q21.22) es sobreexpresado de 60 a 100 veces más en el CaP, comparado con el tejido prostático benigno.9 Demostrando que las pruebas moleculares para la expresión de este gen tienen una mayor especificidad para la detección de cáncer comparándolas con el APE.10 Al examen histopatológico, la determinación de PCA3 puede separar tejidos benignos de las células malignas de la próstata con una precisión cercana a 100%.11 La posibilidad de realizar la prueba para el PCA3 en orina como marcador tumoral para CaP fue sugerida por Kok en 2002.12. En 2003, Hessels reportó que el PCA3 es sobreexpresado en 95% de las células examinadas y demostró la potencial utilidad clínica para PCA3 en orina, generando un score con un punto de corte de 35.10 Se menciona que este gen ha sido superior al APE logrando a una especificidad de 72% y una sensibilidad de 58%. Hasta la fecha, diversos estudios señalan una alta especificidad y sensibilidad a diferentes cortes del score de PCA3, observando que el incremento en esté aumenta la probabilidad de una biopsia de positiva, determinando al PCA3 en orina, como una posible prueba que pueda mejora la exactitud en la detección del CaP, especialmente en la zona gris del APE.10,12-14
Existen algunas pruebas en el mercado las cuales son costosas y por el momento sin disponibilidad en México (uPM3, APTIMA PCA3, PROGENSA PCA3). El empleo de estas pruebas han sido limitadas principalmente para el análisis de la utilidad clínica del PCA3 en la predicción y detección del CaP en biopsias de repetición.7-13
¿ OBJETIVOS
Establecer la utilidad clínica de la prueba PCA3 en orina para la detección de CaP en la biopsia de pacientes mexicanos.
Evaluar el prototipo desarrollado en el INMEGEN, unidad de alta tecnología, siendo una prueba de bajo costo, capaz de detectar concentraciones mínimas de ARNm, con posibilidades de amplificación y cuantificación del ARNm PCA 3 y ARNm APE en orina obtenida posterior a masaje prostático.
Analizar los resultados inicialmente obtenidos de los 78 pacientes que se han incluido hasta agosto 2009.
Validar la prueba y su rendimiento como apoyo en la detección del CaP en pacientes mexicanos sometidos a biopsias prostáticas. Por último, debe distinguirle por ser de un enfoque sólido, reproducible y que pueda ser implementada en un laboratorio clínico.
¿ MÉTODOS
Es un estudio prospectivo y experimental, realizado entre abril de 2008 y agosto de 2010. Se consideró este periodo de tiempo para que el tamaño de la muestra fuera estadísticamente significativo, con base en la cantidad de biopsias prostáticas calculadas en nuestro servicio. Hasta el momento, se han incluido 78 pacientes con un APE sérico elevado (mayor a 4 ng/mL) y/o tacto rectal anormal, programados a biopsia prostática transrrectal guiada por ultrasonido (BxTRUS), sin importar primera serie o de repetición, estipulando a estos como los criterios de inclusión. El protocolo obtuvo la aprobación del Comité Institucional de Ética y el consentimiento informado para participación de cada paciente. Los criterios de exclusión fueron la presencia de urolitiasis, infección urinaria, obstrucción del tracto urinario inferior, catéter transuretral permanente e imposibilidad de logar una emisión espontánea de orina.
Se recolectaron los primeros 20 a 30 mL de orina posterior al masaje prostático como lo describe Groskopf,14 previo a la realización de la BxTRUS. Las biopsias fueron realizadas por urólogos con un equipo de ultrasonido ALOKA Pro Sound SSD-400 plus tomando 12 cilindros en cada paciente y analizadas por el servicio de patología de la institución.
Las muestras se depositaron en tubos que contenían 20 mL de una solución estabilizadora de ácidos nucléicos; los tubos se centrifugaron a 3000 rpm, desechando el sobrenadante, el botón celular se lavó dos veces con solución amortiguadora de fosfatos (PBS). Una vez obtenido el botón celular, se inició la extracción de ARN total por medio del RNA easymini kit (Quiagen). Para verificar la cantidad y la calidad del ARN, se utilizó un chip y el bioanalizador 2100 (Agilent). Se realizó la retrotranscripción reversa para la obtención de ADNc´s. Se utilizaron 2µL de ADNc para la amplificación de los genes PCA3 y PSA (APE) utilizando sondas Taqman (Applied Biosystems). El score de PCA3 fue calculado con la expresión relativa de ARNm PCA3/ARNm APE usando un algoritmo específico para la prueba. El rendimiento del PCA3 fue evaluado en términos de sensibilidad y especificidad al comparar los resultados de este con los resultados de la biopsia. La habilidad del score de PCA3 para predecir el resultado de la biopsia fue evaluada y comparada con el APE total sérico, APE en zona gris, %flAPE.
¿RESULTADOS
Se informan los resultados iniciales del periodo comprendido entre abril de 2008 y agosto de 2009. De 78 pacientes programados a BxTRUS con APE sérico mayor a 4 ng/mL y/o tacto rectal anormal. Se excluyeron ocho pacientes en los que el rendimiento de ARNm obtenido en la orina no fue el adecuado al no amplificar para PCA3, encontrando en todos, el antecedente de RTUP; que consideramos como factor que impide una celularidad adecuada en las muestras de orina. De los 70 pacientes incluidos en el estudio el promedio de edad es de 65 años (rango 48 a 87 años), el APEt promedio de 48 ng/mL (rango: 0.9 ng/mL a 1160 ng/mL). Se procedió a una primera serie de biopsias de 57 pacientes; once a biopsias de repetición, y dos a una tercera serie. De los 70 pacientes, 18 (25%) resultaron con biopsias positivas para cáncer, dos con PCA3 indeterminados o negativos. Sólo dos pacientes fueron positivos en biopsias de repetición. El grado de Gleason 3+3 se identificó en ocho pacientes (45%), 4+3 en uno (5.5%), 4+4 en seis (33%), 5+4 en uno (5.5%), 5+5 en dos (11%). El grado de Gleason no se correlacionó con el score de PCA3. Para evaluar la capacidad de la prueba para predecir el resultado de la biopsia, se llevo a cabo el análisis de la curva ROC usando el resultado de la biopsia como método de referencia.
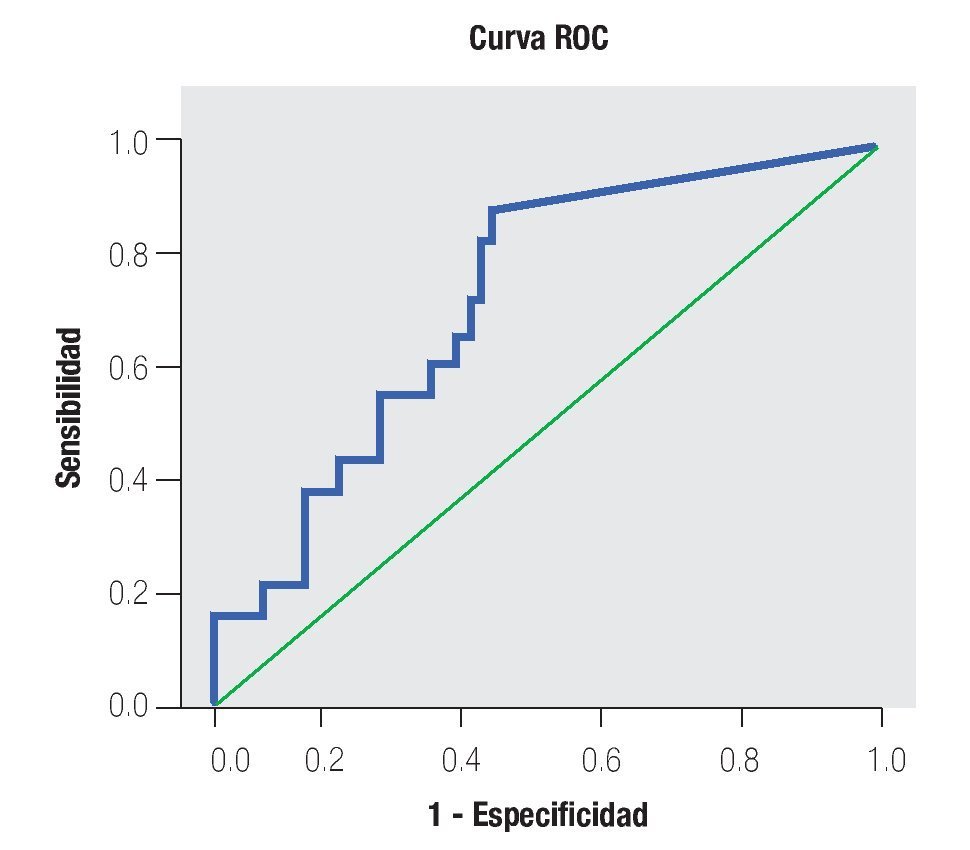
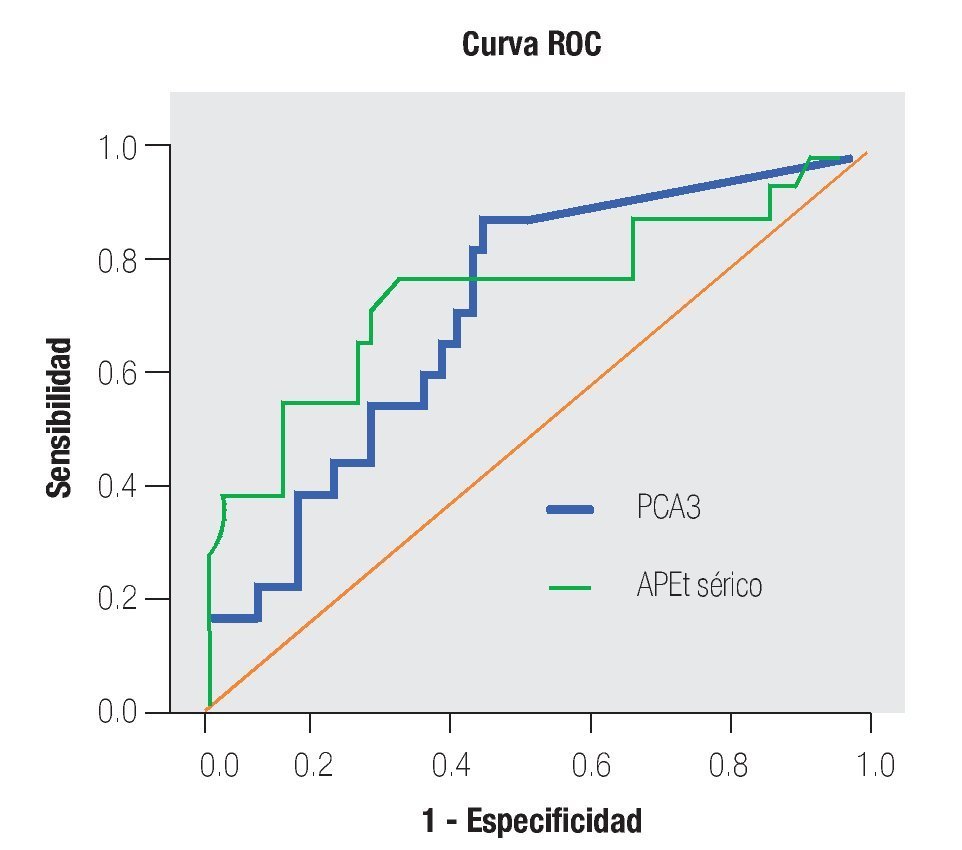
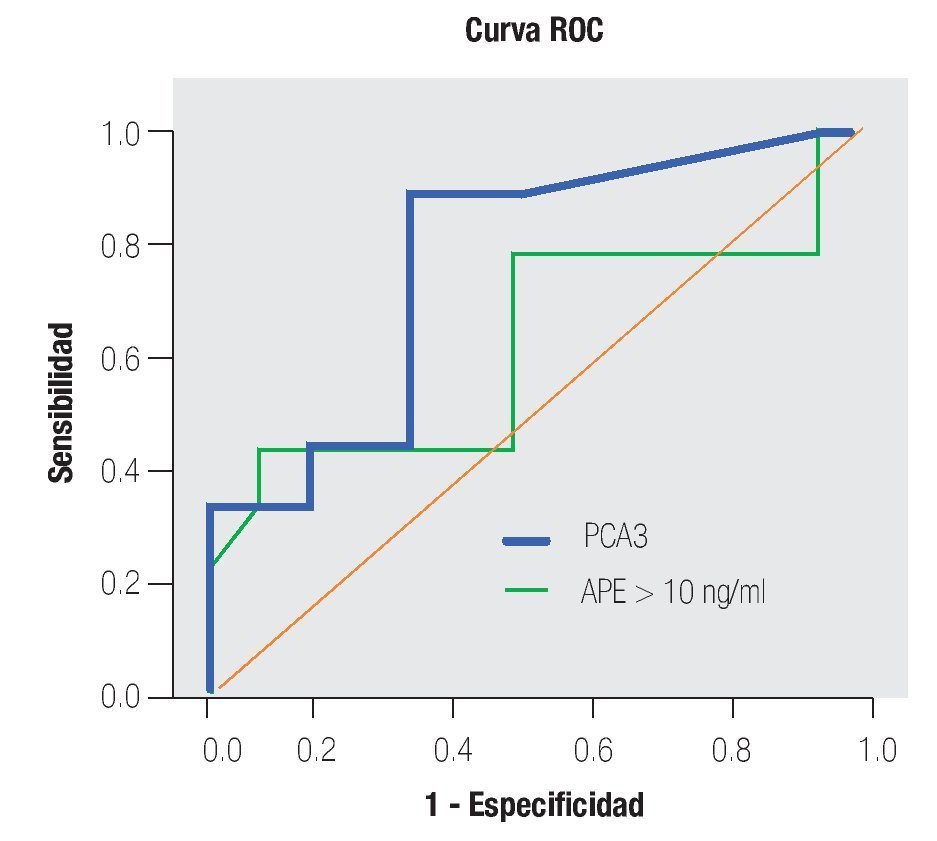
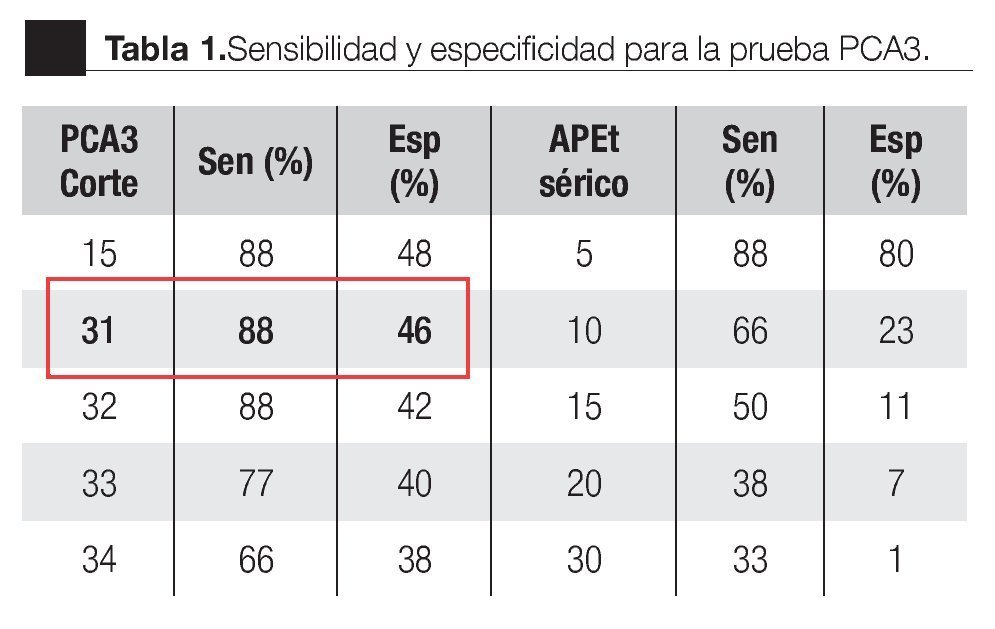
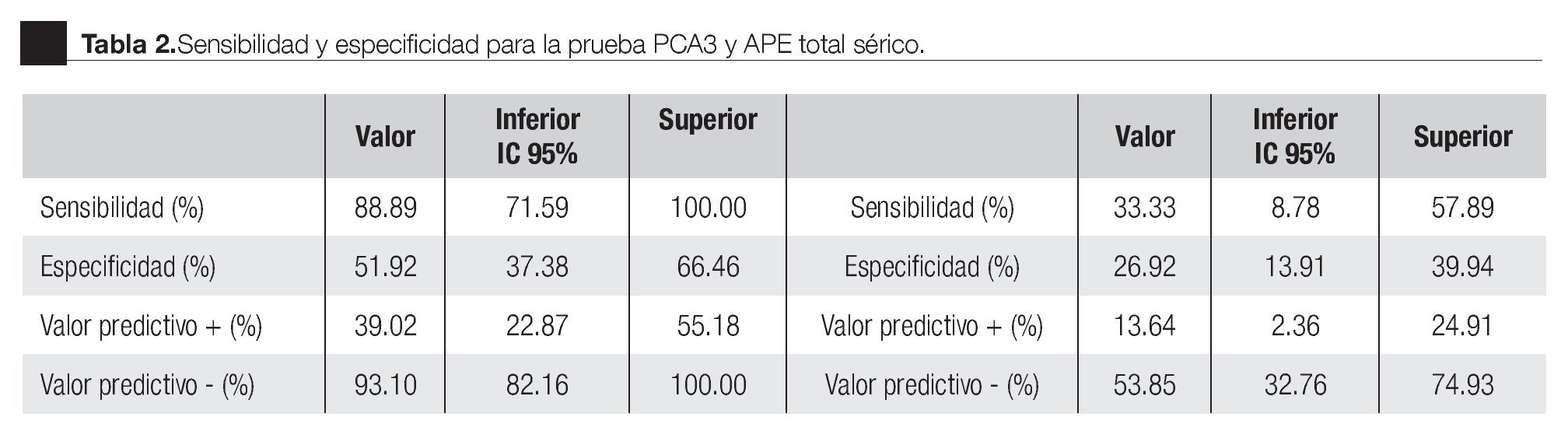
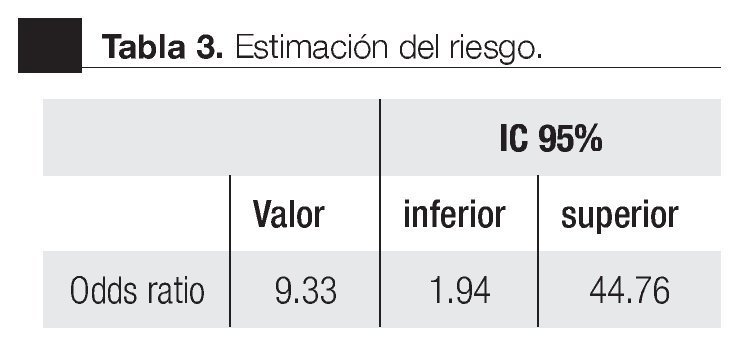
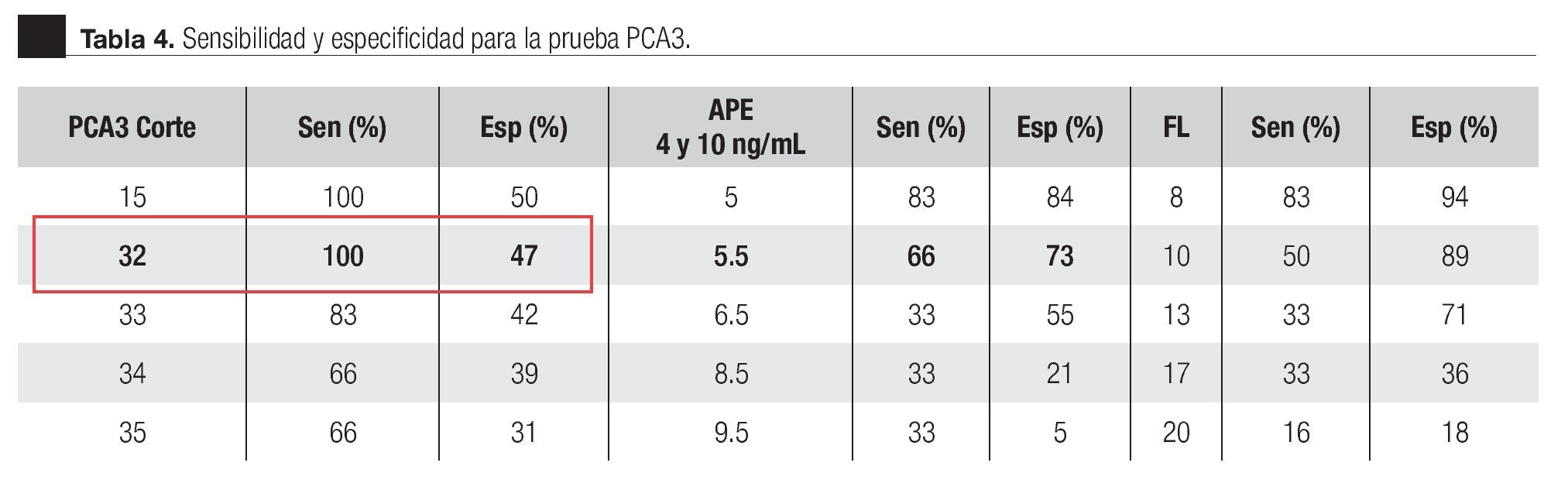
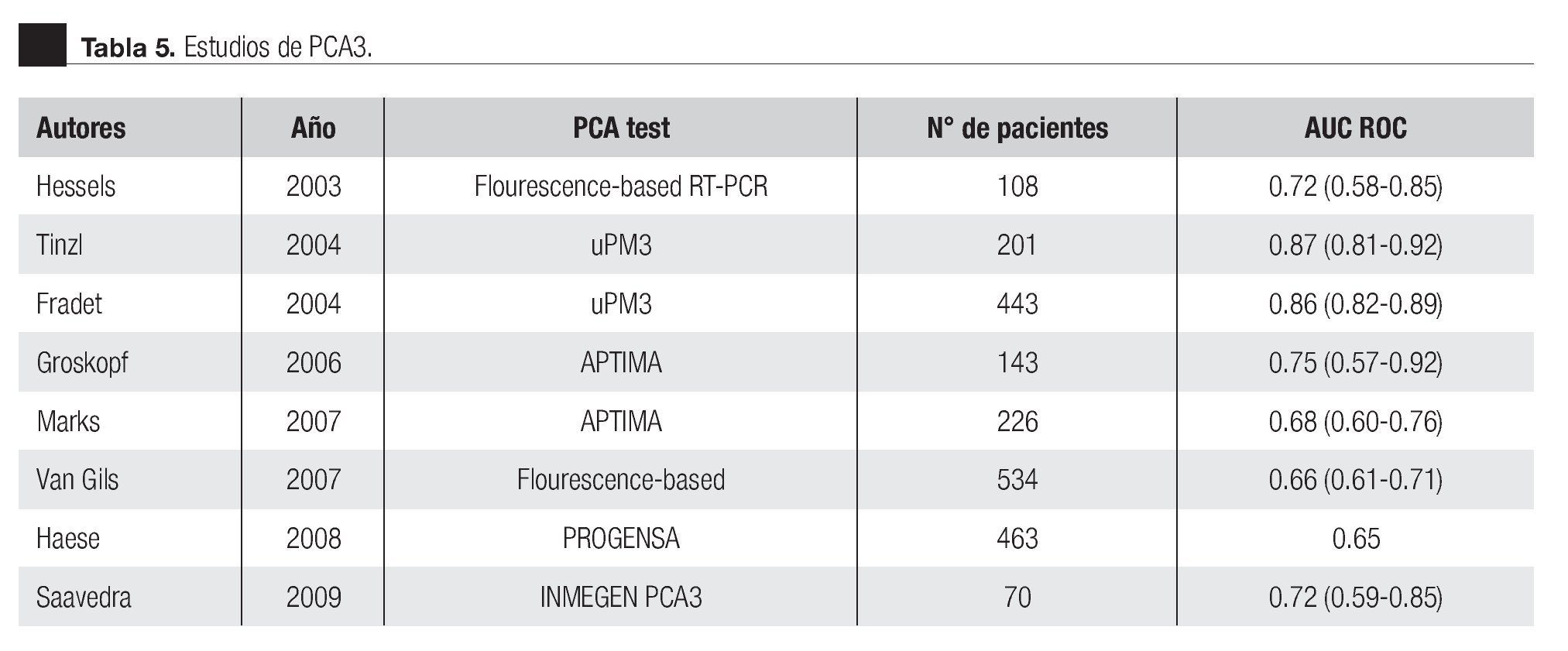
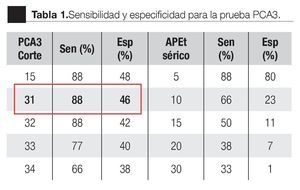
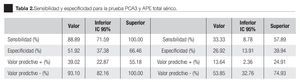
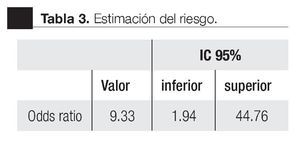
La AUC en la curva ROC para PCA3 fue 0.72. (IC 95% 0.59 a 0.85) con valor de p = 0.005 (Imagen 1). El APE total sérico mostró una AUC de 0.69 (IC 95% 0.52 a 0.86) (Imagen 2), indicando consecuentemente que el nivel de APE sérico tiene un valor menor para el diagnóstico en esta población. La curva ROC fue usada para determinar la sensibilidad y especificidad de la prueba para el PCA3 con diferentes puntos de corte. Usando como corte 31(Tabla 1), la prueba mostró una sensibilidad de 83% y especificidad de 44%. El valor predictivo positivo para PCA3 es de 39%, el valor predictivo negativo es de 93%. (Tabla 2), con un Odds ratio de 9.3 (Tabla 3). El APEt sérico mostró una sensibilidad de 33%, especificidad de 26%, valor predictivo positivo de 13% y un valor predictivo negativo de 53% (Tabla 3).
Imagen 1.Análisis curva ROC usando el score de PCA3 como indicador diagnóstico y biopsia prostática como método de referencia.
Imagen 2. Análisis curva ROC usando score de PCA3 y APE sérico como indicadores diagnósticos y la biopsia como método de referencia.
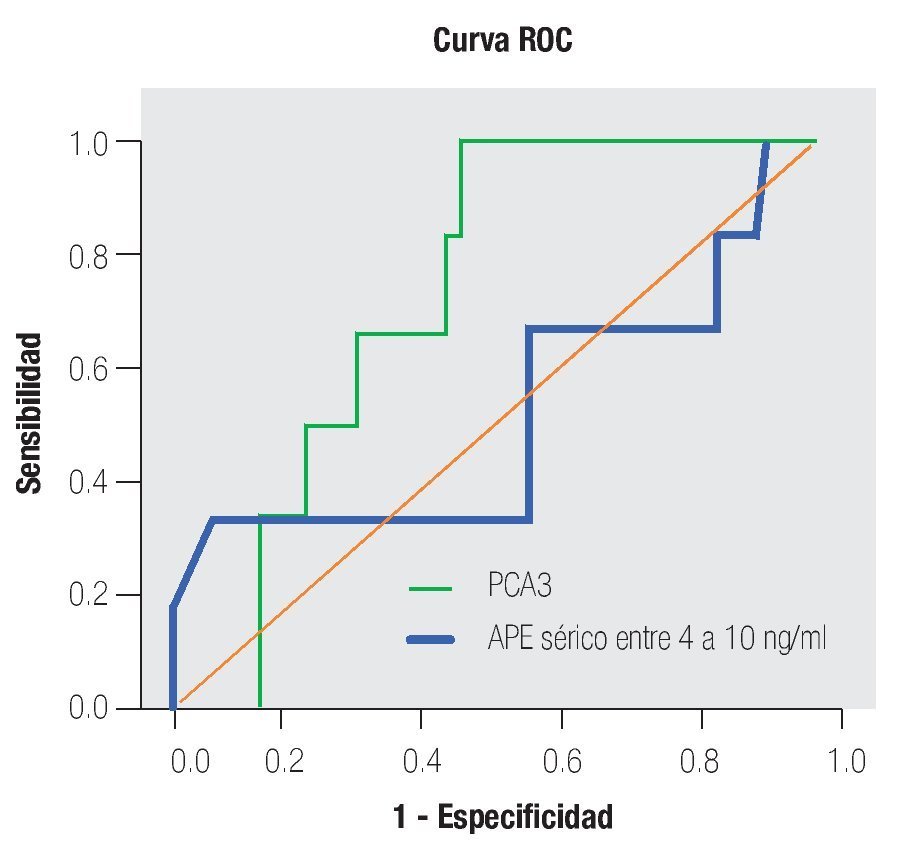
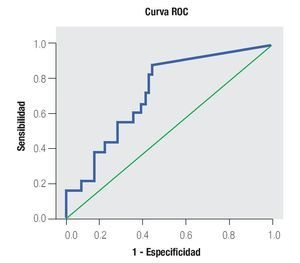
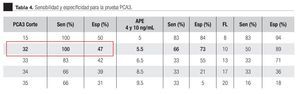
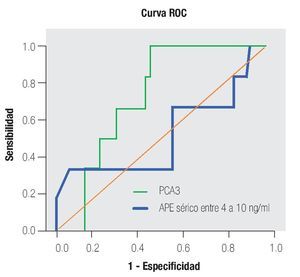
De los 18 pacientes con biopsias positivas, seis (33%) se encontraron con APE en zona gris. El promedio de edad fue de 66 años (rango 51 a 81), el APE promedio fue 7.08 ng/mL (rango 5 ng/mL a 9.8 ng/mL), la %flAPE promedio fue 13% (rango 7% a 21%). En los seis pacientes, mencionados con el APE en zona gris con biopsia positiva, el PCA3 amplificó y con un punto de corte de 32 mostró sensibilidad de 100% y especificidad de 47% con una AUC 0.72 (IC 95% 0.57-0.88) p = 0.075.
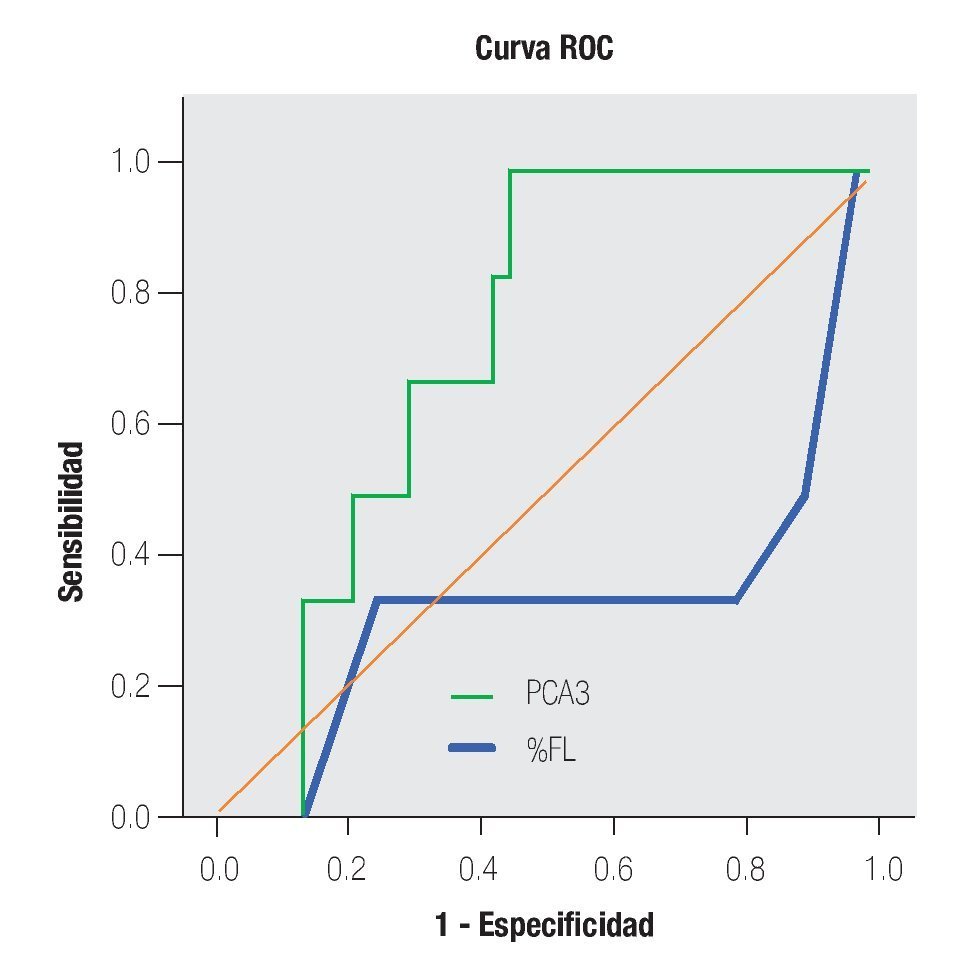
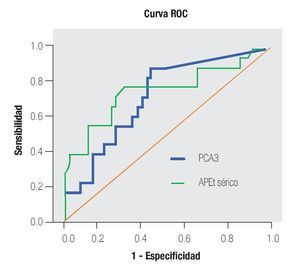
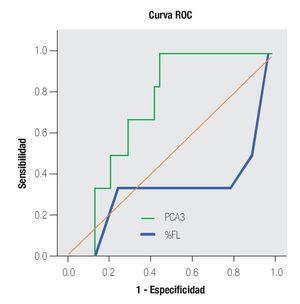
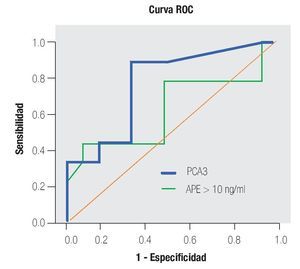
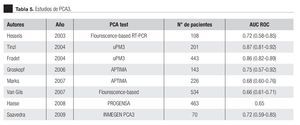
En la Tabla 4 y las Imágenes 3, 4 y 5, se muestra la comparación de la sensibilidad y especificidad del PCA3 con el APE en zona gris y la fracción libre a diferentes puntos de corte. En la Tabla 5 se muestran algunos estudios comparativos relacionados a la determinación del PCA3 y sus resultados en curvas ROC.
Imagen 3. Análisis curva ROC usando el score PCA3 y APE en zona gris como indicador diagnóstico y la biopsia prostática como método de referencia.
Imagen 4.Análisis de curva ROC, usando el score PCA3 o % FL del APE en zona gris como indicador diagnóstico y la biopsia prostática como método de referencia.
Imagen 5.Análisis de curva ROC usando PCA3 y APE mayor de 10 ng/mL como indicador diagnóstico y la biopsia prostática como método de referencia.
¿ DISCUSIÓN
Bussemaker en 1999, comparó la ex presión del gen PCA3 en tejidos prostáticos con y sin neoplasia.9 En 2002, De Kok desarrolló un método para cuantificar este gen y encontró que la expresión es muy baja en tejido sano, en comparación con el maligno.12 En 2003, Hessels sugirió la utilidad clínica de este marcador en muestras de orina.10 En nuestro trabajo, la sobreexpresión del gen PCA3 en orina fue detectable, obteniendo un rendimiento de ARNm adecuado para la amplificación. Se logró desarrollar un método para la cuantificación absoluta del número de copias del ARNm del gen PCA3; en algunos pacientes la cantidad de ciclos en la amplificación nos proporcionaron resultados diferentes a las pruebas estandarizadas (APTIMA). Al no obtener la amplificación dentro de los rangos esperados para el experimento PCR en tiempo real con el equipo ABI 7900HT, nos sugiere que en las muestras de orina la cantidad de células obtenidas no es la adecuada. El antecedente de RTUP podría ser un factor a estudiar como causante de muestras con baja o nula celularidad. Cabe mencionar que de los ocho pacientes excluidos, cinco tuvieron biopsias positivas y tres negativas; en todos, el PCA3 no fue detectable, cinco de ellos cuentan con dos eventos de resección prostática en diferentes periodos de tiempo, el último al menos de un año y tres con RTUP sólo en una ocasión; el común denominador es que correspondieron histopatológicamente a tejido benigno. Ante la elevación del APE sérico estos mismos pacientes se llevaron a re-biopsias. De los cinco positivos a CaP, cuatro fueron sometidos a prostatectomía radical y uno se encuentra en manejo con bloqueo androgénico máximo. De tal forma que los cambios histológicos ocasionados por la RTUP en la uretra prostática son motivo actualmente de estudio para descartar o confirmar la consecuente ausencia de exfoliación celular que condicione una baja o nula celularidad en la muestra de orina y con ello la falta en rendimiento del material genético. Sin embargo, no olvidar que, al no detectarse ni amplificarse el ARNm PCA3, la posibilidad de tener células de adenocarcinoma es remota, aproximadamente menos 10%.9-15 Extrañamente, sólo dos pacientes con biopsia positiva sin antecedentes de manipulación uretral o resección prostática no amplificaron para PCA3; estamos aún analizando esta situación, para ajustar posibles fallas o variables en la metodología de la En los pacientes con una biopsia positiva, el análisis de la curva ROC para PCA3 como indicador diagnóstico usando la biopsia como método de referencia , mostró una AUC de 0.72 (IC 0.59 - 0.85). Tomando como punto de corte 31 encontramos una sensibilidad de 88% y especificidad de 44% para detección de CaP en comparación con el APE, que mostró una baja sensibilidad de 33%. Groskopf encontró un AUC de 0.746; sensibilidad de 69% y especificidad del 79%; y con una especificidad para el APE sérico de 28%.13 En la Tabla 5 se muestran los resultados de diversos estudios realizados para la prueba PCA3, logrando en nuestro estudio valores similares a los descritos previamente.
En los pacientes con PCA3 negativo o indeterminado con biopsia negativa (n = 28, 54%); el reporte histopatológico en la mayoría correspondió a inflamación crónica, atrofia simple o parcial. Bassett16 informó que la inflamación crónica en la biopsia no aumenta riesgo de cáncer en una muestra posterior; la misma observación la señalan otros autores.17-19 Se ha estudiado la atrofia glandular y el desarrollo de CaP sin que se encuentre aún resuelta esta asociación.20 Recientemente se publicó un estudio para la predicción del resultado de la biopsia por medio de nomogramas, incorporando la prueba de PCA3 en orina. El análisis univariado y multivariado determinó al PCA3 como factor predictor independiente para riesgo de CaP con significancia estadística (p < 0.001) superando a los otros factores analizados (17). De tal manera que el seguimiento en los pacientes con PCA3 negativo y biopsia negativa la posibilidad o necesidad de una biopsia subsecuente podría ser nula. Por consecuencia en los pacientes PCA3 positivo con biopsia negativa es muy importante el seguimiento estrecho y a largo plazo, considerando a este grupo de alto riesgo para CaP con la necesidad de una biopsia de repetición. Una vez obtenidos estos resultados podremos evaluar y establecer la utilidad real de la prueba PCA3 desarrollada en el INMEGEN.
Por el momento, consideramos que el prototipo de prueba para INMENGEN PCA3 es adecuado con la capacidad para amplificar y cuantificar el ARNm PCA3 en muestra de orina en pacientes sometidos a biopsia prostática. Es indispensable un mayor número de pacientes para validar absolutamente esta prueba y con un seguimiento a largo tiempo en aquellos pacientes que amplificaron para PCA3 con biopsias negativas. Hasta este momento los resultados en el desarrollo del PCA3 demuestran ser una prueba viable y que pueda ser considerada como apoyo en la detección de CaP en pacientes mexicanos.21
¿ CONCLUSIONES
La tendencia del estudio nos muestra que la sobreexpresión del gen PCA3 en orina es detectable. La prueba para ARNm PCA3 mostró buenos resultados clínicos y una especificidad muy superior a la del APE. Hasta este momento no existe literatura latinoamericana con uso de PCA3 en orina como ayuda en la detección de cáncer de próstata. Con el desarrollo de esta prueba en orina de bajo costo, el ensayo PCA3 combina un procesamiento de la muestra sencillo, con pruebas precisas e instrumentos actuales con obtención de resultados en corto tiempo, que podrían añadir especificidad a los algoritmos actuales para el diagnóstico del CaP. Es necesario aumentar el número pacientes sometidos a la prueba con seguimiento a largo plazo para considerar su utilidad y aplicación como marcador tumoral en la población mexicana.
Correspondencia: Dr. Dorian V Saavedra Briones.
Calzada de Tlalpan 4800. Colonia Sección XVI; 14000. Delegación Tlalpan.
Teléfono: 4000 3044.
Correo electrónico:valfre2000@yahoo.com.mx