El cáncer de testículo representa el 1% de todas las neoplasias en varones; sin embargo, es la tumoración maligna más común en varones de 15 a 45 años.1 Esta anomalía corresponde a 1% y 1.5% de las neoplasias en el varón y 5% de los tumores urológicos. En México, el Registro Histopatológico de Neoplasias Malignas del año 2000 consignó 917 casos, lo cual equivale a 1.9 casos por región/habitante y a 1% de todos los cánceres reportados. En el grupo de edad de 15 a 45 años, es la primera causa de cáncer con 700 casos, es decir, 2.9 casos por región/habitante por 100,000.2-4 En 10 años (1984-1994), el registro hospitalario del Instituto Nacional de Cancerología identificó 748 casos, lo cual la convierte en la neoplasia genital en varones más atendida.5
El estadio clínico representa la piedra angular para determinar el tratamiento del cáncer de testículo. La clasificación actual se basa en el TNM 2002 de la UICC (International Union Against Cancer)6 y, de manera adicional, se clasifica de acuerdo con el IGCCCG (International Germ Cell Cancer Collaborative Group). Con este sistema se establece el estadio clínico y el pronóstico, ya que utiliza la estirpe histológica, localización del tumor primario, localización de las metástasis y marcadores tumorales.7 De acuerdo con el Registro Europeo de Cáncer, hasta 90% de los pacientes se presenta en estadios tempranos (TNM, I - IIB). La mayoría de los individuos con cáncer testicular (61 - 78%) se diagnostica en estadio clínico I confinado al testículo, con normalización de los marcadores luego de la orquiectomía.8,9
De los sujetos con estadio clínico I se espera la remisión en el 100% de los casos. 10,11 Los tumores germinales no seminomatosos (NSGST) se pueden dividir en mixtos (con componente seminomatoso), carcinoembrionarios (puro en 3% a 4% y presente en 40% de los NSGST), teratomas (5% a 10%), coriocarcinomas (1%) y mixtos (60%). 12,13 La vigilancia luego de la orquiectomía en pacientes con estadio I con NSGST revela una tasa de recurrencia de 28% con una media de tiempo hasta la recurrencia de cuatro a 13 meses. Alrededor del 60% de las recurrencias se encuentra en el retroperitoneo, 25% en pulmones y el 10% muestra tan sólo marcadores elevados. 14 El objetivo principal en el tratamiento adyuvante de los pacientes en estadio I de los NSGST es adaptar el tratamiento al 28% de los individuos que tienen enfermedad metastásica oculta. 14 La vigilancia sin valoración de los factores de riesgo acaba en el tratamiento de las recurrencias en alrededor de un tercio de los enfermos con múltiples ciclos de quimioterapia, así como en la resección de masas residuales. La quimioterapia adyuvante en los NSGST estadio I, sin valoración de los factores de riesgo, representa un sobretratamiento en 70% de los pacientes. De ahí la importancia de valorar los factores de riesgo para identificar a las personas con riesgo elevado de enfermedad metastásica oculta. 14 El Consejo de investigación médica ha realizado estudios para identificar los factores de riesgo de recurrencia en los NSGST estadio I; se han demostrado cuatro factores pronósticos de recurrencia: invasión vascular, invasión linfática, presencia de carcinoma embrionario y ausencia de tumor del saco de Yolk. Estudios prospectivos basados en estos criterios revelan que la presencia de al menos tres de estos cuatro factores es indicativa de recurrencia en un 48% de los casos. 14,15La invasión vascular fue el hallazgo predominante y de mayor importancia. En estudios multivariados se reconocieron tres factores: invasión vascular, tasa de proliferación mediante inmunotinción con MIB-I (> 70% de la células tumorales) y porcentaje de carcinoma embrionario (> 50% como componente del tumor primario). La combinación de estos tres factores fue predictiva de metástasis ocultas en 64% de los casos. En contraste, los pacientes sin invasión vascular y una tasa baja de proliferación con MIB (< 70%) sólo tienen 13% de probabilidades de desarrollar metástasis. En concordancia con estas combinaciones pronósticas, se han adaptado medidas terapéuticas de acuerdo con el grupo de riesgo y se han notificado tasas de recurrencias en grupos de alto riesgo tratados con quimioterapia del 0%. Los estudios realizados en el M.D. Anderson Cancer Center y en Toulouse, concluyeron que para definir un grupo de alto riesgo debería existir al menos una combinación de la invasión vascular con carcinoma embrionario.16-25
La tasa de recurrencia en pacientes en observación con invasión linfática/ vascular es del 48% y sin invasión linfática/vascular del 14%-22 %; estos son los factores pronósticos más importantes. La tasa de proliferación y el porcentaje de carcinoma embrionario también son factores pronósticos, pero no contribuyen en forma independiente, a menos que se agreguen a la invasión linfática/vascular.26
El MIB-I de inmunohistoquímica fue un factor predictivo promisorio. El carcinoma embrionario en el tumor primario y los estadios patológicos altos tuvieron efectos intermedios. Hasta ahora, los modelos han incluido la invasión vascular y el carcinoma embrionario y uno o dos factores más débiles. Ninguna de las publicaciones de los tratamientos adaptados al riesgo ha valorado el MIB-I.27
En suma, se han identificado los factores de riesgo para definir a los grupos de bajo y alto riesgo con una tasa de recurrencia de 13% y 64%, respectivamente. Estos factores han llevado a idear esquemas terapéuticos de acuerdo con el riesgo establecido: vigilancia para los pacientes de bajo riesgo y quimioterapia para los sujetos de alto riesgo.
OBJETIVO
Comparar la evolución de los pacientes con tumores testiculares no seminomatosos en estadio I tratados con quimioterapia o vigilancia.
MATERIAL Y MÉTODOS
Se realizó un estudio transversal analítico. Se revisaron los expedientes de los pacientes con diagnóstico de neoplasia testicular tratados en la institución de los autores (Hospital Dr. Manuel Gea González) de enero de 1989 a octubre de 2008. Se incluyó a los pacientes con resultado histopatológico corroborado de tumor germinal no seminomatoso estadio I según el TNM 2002, con expediente y seguimiento completos, y se excluyó a los individuos con otras neoplasias, así como a los enfermos con expediente y seguimiento incompletos. El estadio se determinó en la institución con base en los hallazgos histopatológicos, radiografía de tórax, marcadores tumorales posorquiectomía y tomografía abdominopélvica.
Todos los pacientes analizados en este estudio se sometieron a orquiectomía. Los sujetos con indicación de quimioterapia recibieron 2 ciclos de BEP (bleomicina, etopósido y platino) por parte del servicio de oncología médica. El seguimiento y la evolución se efectuaron en su totalidad en el servicio del hospital. Las revisiones regulares consistieron en exploración física, radiografía de tórax y marcadores tumorales. Durante el primer año se revisó a los pacientes cada mes con TAC trimestral. El segundo año tuvieron revisión bimensual y TAC cada cuatro meses. El tercer año se atendieron con revisión trimestral y TAC semestral. El cuarto y quinto años tuvieron revisión y TAC semestrales y los años subsecuentes revisión y TAC anuales.
Se analizaron los resultados de las siguientes variables: edad, testículo afectado, estadio TNM, invasión linfovascular, porcentaje de carcinoma embrionario, presencia de senos endodérmicos, estirpe histológica, grupo pronóstico (IGCCCG), tratamiento y tiempo de seguimiento, que se correlacionaron con recurrencia y periodo libre de enfermedad.
El periodo libre de enfermedad se definió como el intervalo desde la fecha de la orquiectomía hasta la recurrencia (evento) documentada de la enfermedad.
Se realizó un análisis con estadística descriptiva, medidas de tendencia central y dispersión. El análisis del periodo libre de enfermedad se determinó con curvas de Kaplan-Meier y log rank. Para el análisis categórico de recurrencia se utilizó la X2 y el multivariado de Cox; se consideró significativa una p ± 0.05. La tasa de error tipo I se controló a 5%. Los cálculos estadísticos se realizaron mediante el paquete de software Stata/SE Ver 9.1 para Windows, Stata Corp LP.
RESULTADOS
Se identificó a 319 pacientes con diagnóstico de neoplasia testicular, de los cuales se incluyó en el estudio a 196 porque contaban con expediente y seguimiento completos. De ese total, 189 correspondían a tumores germinales y 104 (55%) se determinaron como no seminomatosos. De estos 104 pacientes, 50 (48%) se encontraban en estadio I. Por lo tanto, la muestra final se conformó con 50 pacientes: 19 (38%) con estadio Ia, 15 (30%) con estadio Ib y 16 (32%) con estadio Is. La media de edad al momento del diagnóstico fue de 25 años. Un total de 17 pacientes (34%) mostró afectación del testículo derecho, 32 (64%) del testículo izquierdo y 1 (2%) fue bilateral.
Todos los pacientes se clasificaron en el grupo pronóstico de bajo riesgo de la IGCCCG. En cuanto a los datos histológicos: 13 (26%) tenían un componente seminomatoso, 11 (22%) eran coriocarcinomas, 23 (46%) representaban carcinoma embrionario, 10 (20%) correspondían a senos endodérmicos y 33 (66%) a teratomas; de estos últimos, 19 (57%) eran maduros, 10 (30%) inmaduros y 4 (12%) mixtos; asimismo, 15 (30%) de los tumores tenían más de una estirpe histológica. Al valorar los factores de riesgo para recurrencia se encontró invasión vascular en 24 (48%), carcinoma embrionario > 50% en 10 (20%) y el factor protector de senos endodérmicos en 10 (20%). Respecto del tratamiento, 32% (16) recibió quimioterapia, mientras que el 68% (34) se mantuvo bajo vigilancia. Se identificó recurrencia en el 24% (12) de los pacientes, que se presentó en un tiempo medio de 13.5 meses. La mortalidad fue de 4% (dos pacientes).
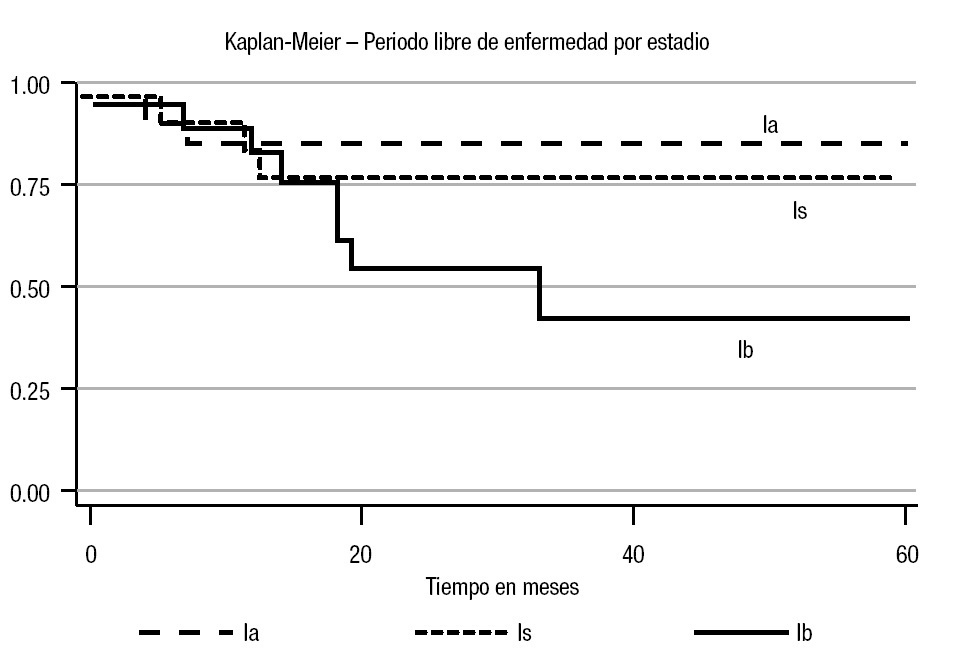
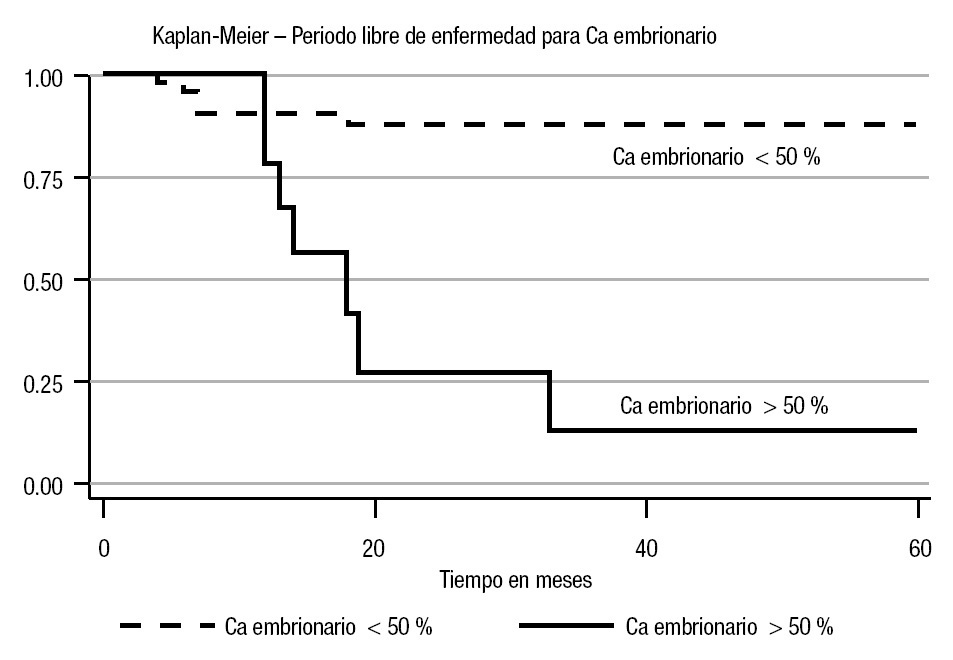
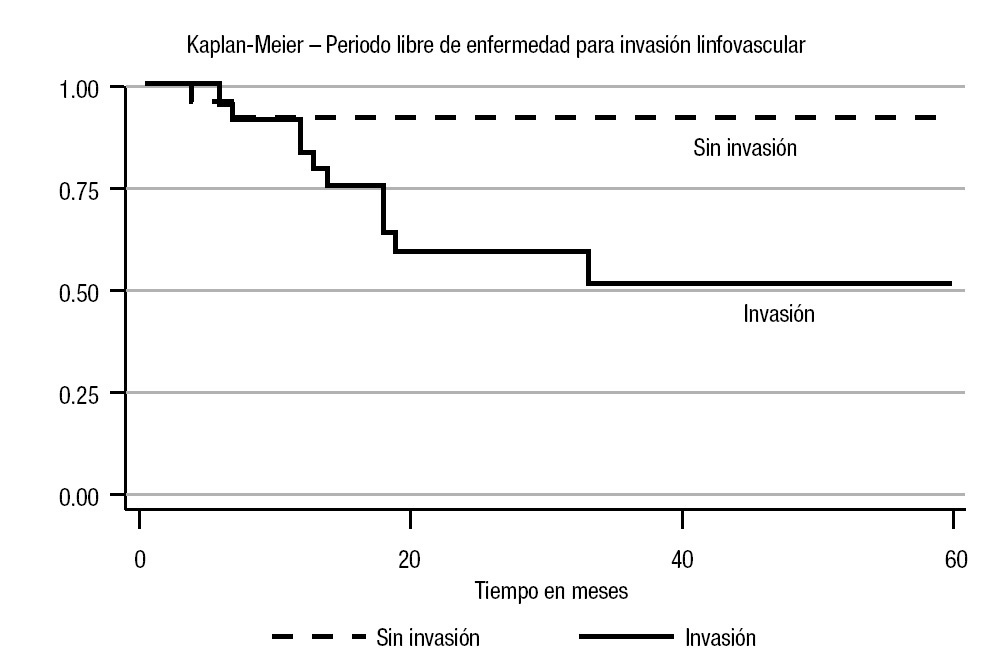
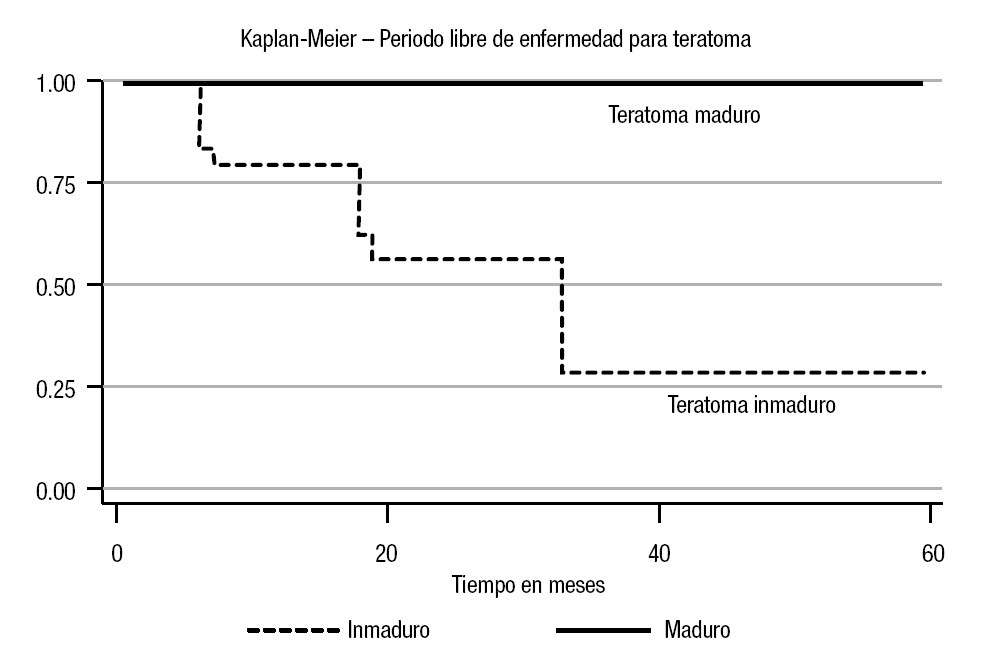
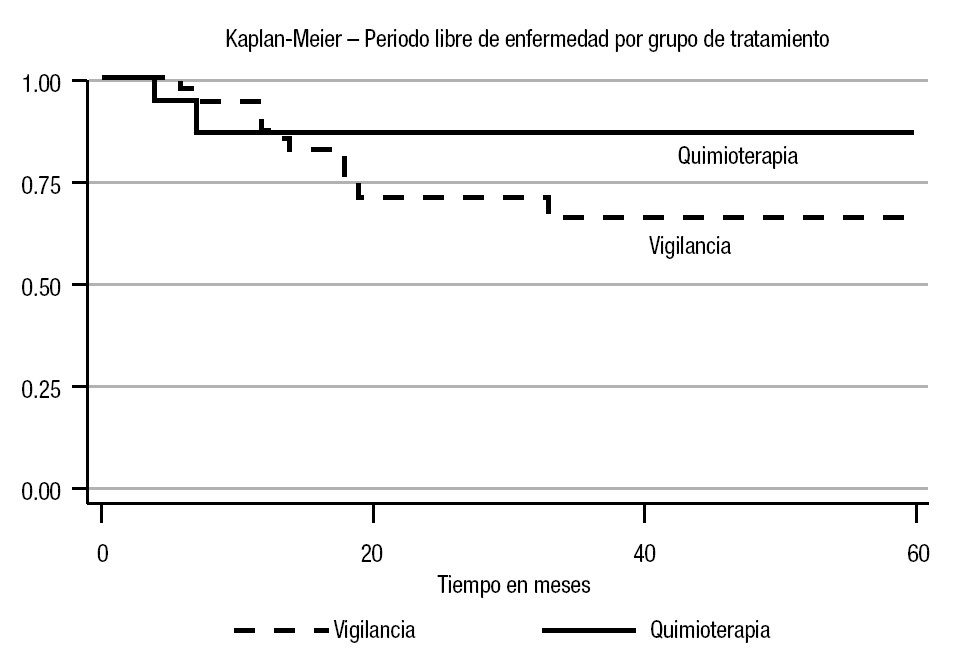
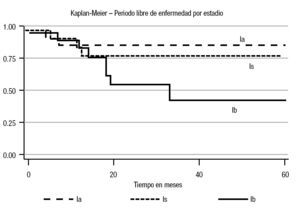
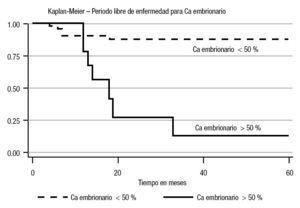
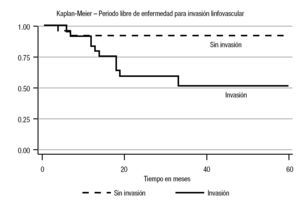
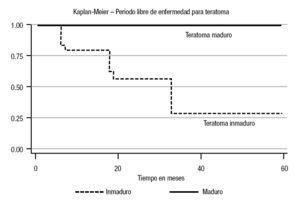
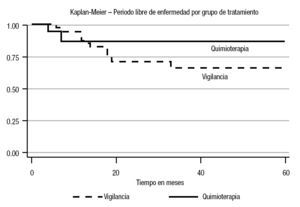
En el análisis estadístico se perfiló una tendencia en cuanto al periodo libre de enfermedad; la menor correspondió al estadio Ib (45%) a cinco años (p = 0.10) (Imagen 1). En cuanto a los factores de riesgo considerados, se observó recurrencia con carcinoembrionario > 50% del 60% (p = 0.001) con un periodo libre de enfermedad de 13% a cinco años (p = 0.0001). Para la invasión linfovascular, la recurrencia fue de 84% (p = 0.005), con un periodo libre de enfermedad de 51% a cinco años (p = 0.01). En cuanto a las estirpes histológicas, se advirtió una diferencia estadística en el caso del teratoma: 28% a cinco años (p = 0.04) para el inmaduro (Imágenes 2, 3 y 4). No hubo diferencia estadística para el periodo libre de enfermedad para senos endodérmicos, coriocarcinoma ni tumoraciones con o sin seminoma. Respecto del tratamiento, la recurrencia para los pacientes en vigilancia fue del 29.01%, en comparación con 12.5% del grupo sometido a quimioterapia (p = 0.17), con tendencia significativa en cuanto al periodo libre de enfermedad (65 vs 90% a cinco años; p = 0.29) (Imagen 5).
Imagen 1. Curva del periodo libre de enfermedad por estadio sin considerar el grupo de tratamiento.
Imagen 2.Curva del periodo libre de enfermedad con o sin carcinoma embrionario > o < 50%.
Imagen 3.Curva del periodo libre de enfermedad con o sin invasión vascular.
Imagen 4. Curva del periodo libre de enfermedad con teratoma maduro e inmaduro.
Imagen 5.Curva del periodo libre de enfermedad por grupo de tratamiento.
En el análisis multivariado de Cox se observó un riesgo relativo para recurrencia de los pacientes con invasión linfovascular de 1.7 (IC 95%, 0.86-20.0) (p = 0.76) y para carcinoembrionario > 50% de 1.7 (IC 95%, 0.9-3.8; p = 0.08).
DISCUSIÓN
El manejo de los tumores estadio I germinales no seminomatosos después de la orquiectomía radical puede consistir en vigilancia, quimioterapia o aun linfadenectomía. Dada la posibilidad hasta de 28% de recurrencia informada en las publicaciones internacionales14 y 24% en la institución de los autores, se han investigado factores de riesgo para recurrencia que modifiquen el tratamiento, de tal manera que los pacientes con alto riesgo se sometan a quimioterapia temprana. En este estudio se observó que el estadio con mayor recurrencia fue el Ib, puesto que muchos de éstos se vigilaron a pesar de que presentaban invasión linfovascular, no así el estadio Is que recibió quimioterapia. Se demostró así que los individuos sometidos a vigilancia tienen una tendencia estadística a recurrir (p = 0.17) con un periodo libre de enfermedad a cinco años de sólo 65%. Asimismo, se probó que los factores de riesgo como el carcinoembrionario > 50% y la invasión linfovascular fueron estadísticamente significativos para predecir recurrencia, juntos o como factores independientes. El otro factor que se comenta en la bibliografía, la tasa de proliferación, no se valoró por falta de inmunohistoquímica en la institución de los autores y porque no ha demostrado tener un peso importante como predictor. La ausencia de senos endodérmicos en esta institución no tuvo influencia en la predicción de recurrencia. El teratoma inmaduro, a pesar de que no se consideró un factor de riesgo para recurrencia, en este protocolo sí mostró una diferencia estadísticamente significativa en relación con las otras variantes.
CONCLUSIONES
No se recomienda la vigilancia en pacientes estadio I con carcinoembrionario > 50% y/o invasión linfovascular. De igual modo, se propone la linfadenectomía retroperitoneal en los sujetos con teratoma inmaduro. Es importante realizar estos mismos protocolos en diferentes centros a nivel nacional para establecer guías propias de manejo.
Correspondencia: Dr. Víctor Hernández Castellanos.
Hospital General Dr. Manuel Gea González, Secretaría de Salud. Calzada de
Tlalpan 4800. Col Sección XVI. Delegación Tlalpan C.P. 14000, México, D. F.
Teléfono: 40-00-30-44. Celular: 044-55-39-99-93-19.
Correo electrónico: vahcmed@yahoo.com