Se revisa el siguiente caso clínico de microdisección testicular bilateral según la técnica descrita por Schlegel y Li, debido a la importancia del método de obtención de espermatozoides para inyección intracitoplasmática de espermatozoides en pacientes con azoospermia no obstructiva, así como la controversia sobre los factores pronóstico de éxito de la misma. Aproximadamente 2 tercios de la infertilidad masculina corresponde a pacientes con azoospermia no obstructiva, y con el avance en las técnicas de reproducción asistida como la fertilización «in vitro» e inyección intracitoplasmática de espermatozoides, la vía de obtención de espermatozoides ha constituido el mayor reto para los urólogos. Así pues, la técnica micro-dissection testicular sperm extraction (m-TESE) se considera una opción terapéutica en casos con antecedente de intentos fallidos con otras técnicas, como el que se describe a continuación con resultado exitoso, aislándose finalmente 9 espermatozoides para posterior inyección intracitoplasmática de espermatozoides, logrando embarazo a término y la obtención de producto único vivo.
The following clinical case of bilateral testicular microdissection, according to the technique described by Schlegel and Li, was reviewed, given the importance of this sperm retrieval method for intracytoplasmic sperm injection in patients with nonobstructive azoospermia, as well as the controversy surrounding its outcome factors. Approximately two-thirds of male infertility corresponds to patients with nonobstructive azoospermia, and with the advances made in the assisted reproduction techniques, such as “in vitro” fertilization and intracytoplasmic sperm injection, sperm retrieval techniques have become one of the greatest challenges for urologists. The micro-dissection testicular sperm extraction is considered a therapeutic option in cases that have had a history of failed attempts with other techniques. Our case had a successful outcome: 9 spermatozoids were isolated for later intracytoplasmic sperm injection, and a full-term pregnancy was achieved, resulting in the birth of a healthy infant.
La azoospermia constituye uno de los principales problemas relacionados con infertilidad. Aproximadamente el 10% de las infertilidades de factor masculino se deben a azoospermia y casi 2 tercios de estos pacientes presentan azoospermia no obstructiva. La distinción entre azoospermia obstructiva y no obstructiva se basa en parámetros clínicos, hormonales, ultrasonográficos, histológicos y genéticos. Un examen preoperatorio minucioso por parte del urólogo no es beneficioso únicamente para el paciente y su pareja, sino también para el mismo especialista quien deberá determinar el tipo de procedimiento terapéutico a emplear y la programación del mismo1.
En diferentes estudios se ha intentado demostrar la relación que guardan los niveles de hormona folículo estimulante (FSH) inversamente proporcional con la probabilidad de encontrar espermatozoides viables, sin embargo, los niveles de FSH no han resultado ser un parámetro confiable determinante del éxito de la obtención de espermatozoides en la biopsia testicular2,3.
La FSH puede predecir la presencia de espermatozoides en una biopsia al azar convencional (método de extracción testicular de espermatozoides; TESE, del inglés testicular sperm extraction)4,5. Sin embargo, la micro-TESE está basada en el principio de identificar el patrón más avanzado de espermatogénesis en el testículo, no necesariamente el predominante, al contrario de la FSH que refleja el patrón predominante, y no puede mostrar áreas aisladas de espermatogénesis dentro del testículo; por lo que ha demostrado ser más exitosa para la obtención de espermatozoides que una o múltiples biopsias al azar e independiente de los niveles de FSH3,4,6,7.
Anteriormente, el abordaje y manejo de la azoospermia no obstructiva se llevaba a cabo mediante valoración hormonal y genética. Sin embargo, en la medida que endocrinológicamente no era posible predecir la viabilidad de las muestras de esperma obtenidas, se propuso además la realización de biopsia testicular aislada con el fin de tener un diagnóstico histopatológico antes de obtener muestra alguna; sin embargo, la Asociación Europea de Urología propuso la biopsia testicular no solo como método diagnóstico sino también como la posibilidad de obtener espermatozoides4.
En la actualidad, la técnica de fertilización «in vitro» y la inyección intracitoplasmática de espermatozoide han revolucionado el tratamiento de la infertilidad, por lo que la vía de obtención de espermatozoides ha constituido el mayor reto3,8.
El método de TESE se considera un procedimiento a ciegas, ya que no es posible observar directamente las áreas de espermatogénesis, sino hasta que el tejido es removido del testículo; por eso se prefiere utilizar la técnica de microdisección (m-TESE), desarrollada por Schlegel y Li.6. Dicha técnica consiste en realizar una incisión en plano ecuatorial inicial en el testículo, la cual permite la búsqueda de túbulos seminíferos largos y opacos, que9 serán aquellos donde se encuentre mayor cantidad de espermatozoides y sitios de espermatogénesis. Siguiendo la técnica, si no es posible encontrar espermatozoides a través de esta incisión, los polos testiculares son disecados extensamente, la túnica albugínea es incidida ecuatorialmente aproximadamente 270 grados de la circunferencia testicular preservando los vasos por debajo de la túnica. La exploración incluye microdisección profunda en el parénquima testicular siguiendo los túbulos seminíferos y vasos sanguíneos como planos paralelos hasta lograr identificar espermatozoides. De ser necesario, se repite dicho procedimiento para el testículo contralateral6,10.
Se ha propuesto que la técnica de m-TESE sea considerada el procedimiento gold estándar para obtención de espermatozoides en azoospermia no obstructiva aun en casos con antecedente de intentos fallidos con otras técnicas de obtención de esperma, ya que, además, ha demostrado tener menos complicaciones posquirúrgicas y secuelas por biopsias múltiples, debido a una pérdida significativa de tejido testicular y disminución del flujo sanguíneo4,9.
Descripción del casoPaciente masculino de 35 años de edad acude a consulta de primera vez por intento fallido para tener familia durante más de un año, con 2 espermatobioscopias directas que demuestran azoopsermia. Además muestra niveles de FSH de 22ng/ml.
Se realiza exploración física completa: a la inspección observamos a un paciente masculino de edad aparentemente similar a la cronológica, caracteres sexuales secundarios presentes, con testículos atróficos. Se solicita cariotipo, descartando cromosomopatía (específicamente síndrome de Klinefelter y deleción de brazo corto de cromosoma Y). Se descartaron además, alteraciones hormonales, anatómicas como varicocele o algún otro factor que pudiese ser asociado a azoospermia (toxicomanías, medicamentos gonadotóxicos, etc.). Se repite espermatobioscopia directa, y siguiendo las guías de la American Urology Association se cuenta al final con 4 espermatobioscopias directas, todas con reporte de azoospermia por lo que se decide programación para m-TESE para inyección intracitoplasmática de espermatozoides en la Clínica de Fertilización Asistida del Centro Médico ABC de Santa Fe.
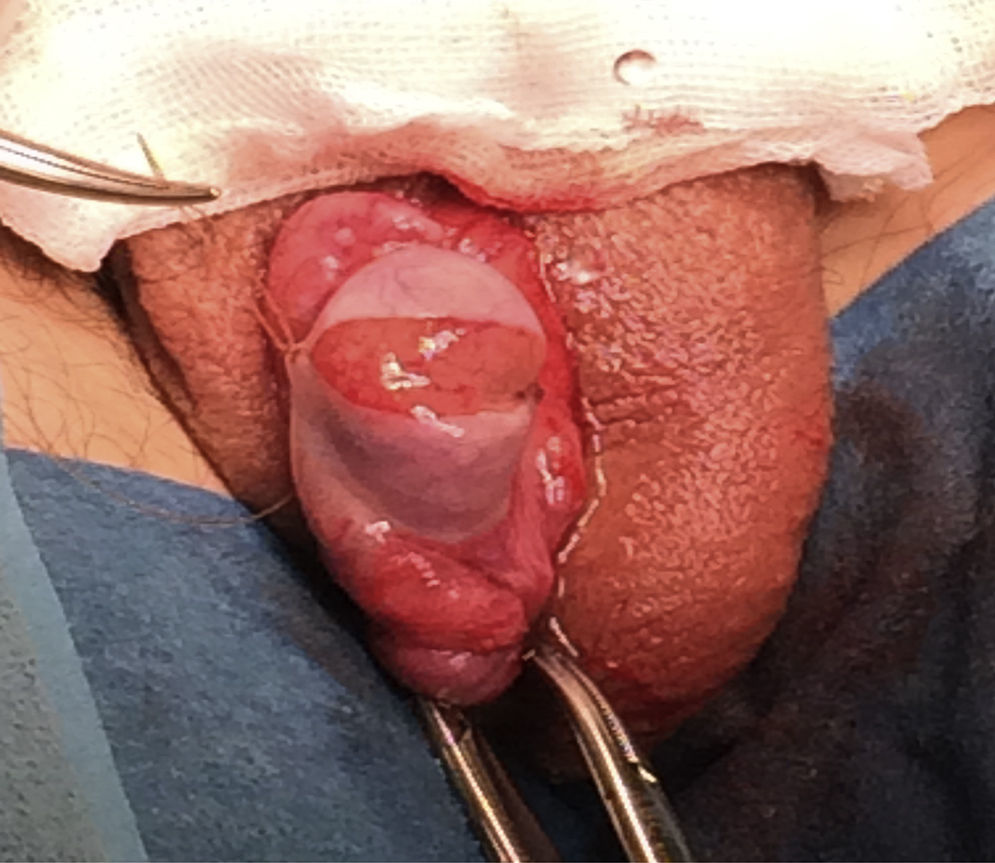
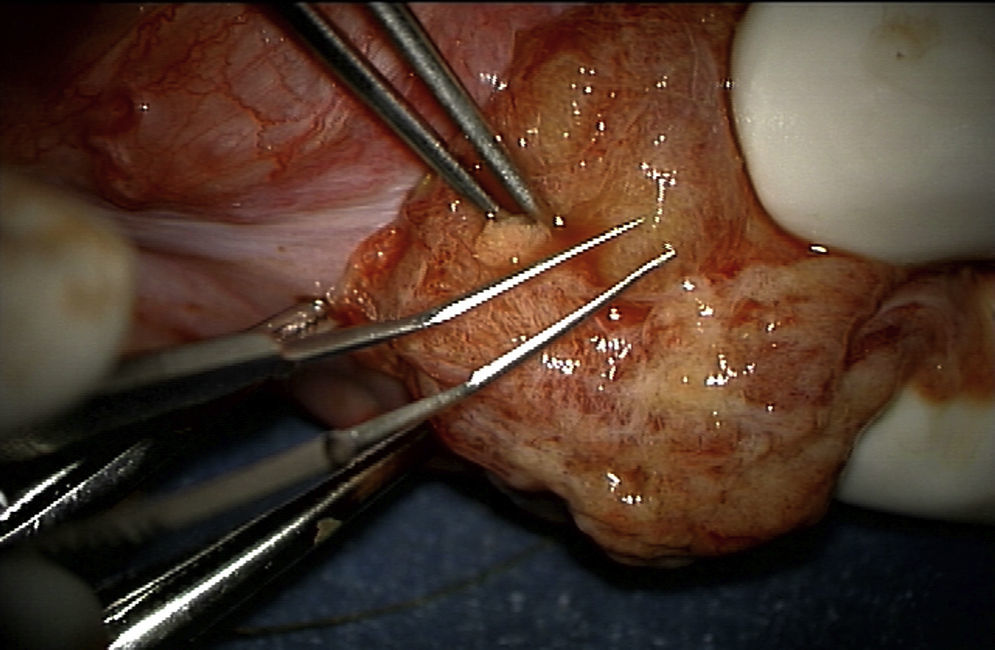
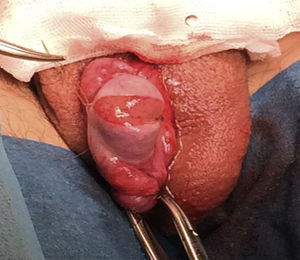
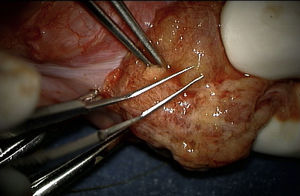
Técnica de microdisecciónPrevia asepsia y antisepsia regional con el paciente bajo sedación, se realizó una incisión de la túnica albugínea en el plano ecuatorial, realizando disección del parénquima testicular (fig. 1). Se colocó microscopio, logrando identificar los túbulos seminíferos. Siguiendo la técnica, al no encontrar inicialmente espermatozoides, fue necesario disecar extensamente los polos testiculares, la túnica albugínea fue incidida ecuatorialmente aproximadamente 270 grados de la circunferencia testicular preservando los vasos por debajo de la túnica. La exploración incluyó microdisección profunda en el parénquima testicular (fig. 2), y en este caso fue necesario realizar dicho procedimiento para el testículo contra lateral. Finalmente, se tomaron 6 biopsias de testículo derecho y 5 de testículo izquierdo, logrando identificar 8 espermatozoides. (Procedimiento transoperatorio en donde se interactúa con embriólogos de La Clínica de Fertilización Asistida en el Centro Médico ABC-Santa Fe).
Una vez identificados los espermas, se procedió a lavarlos y centrifugarlos con medio G-MOPS PLUS durante 10min a 1,600rpm. Poco después se incuban en un medio ambiente con CO2 al 5%, oxígeno al 21% y nitrógeno al 74%, y a 37¿C durante 18h (durante la noche previa a la captura de ovocitos). Posteriormente se realiza inyección intracitoplasmática de 8 espermas en 8 óvulos maduros. Se cultivan con la técnica convencional durante 72h. A las primeras 24h se observó que solo ocurrió la fertilización (2 PN) en 2 de los 8 óvulos inyectados. Hacia el tercer día (72h) se desarrollaron 2 embriones, uno de 9 y uno de 12 células, con un 5% y un 10% de fragmentación respectivamente. Se decide realizar la transferencia de embriones la tarde del tercer día de evolución, la cual se llevó a cabo sin complicaciones. A los 14 días de la aspiración folicular se cuantifica la presencia de la hormona gonadotropina coriónica en suero, la cual fue de 142mUI/ml. Catorce días después se demuestra la presencia de un saco intrauterino, con presencia de embrión único y latido cardiaco presente. Se vigiló la evolución de un embarazo sano, normal y sin complicaciones, dando como resultado el nacimiento de un producto único vivo del sexo masculino a las 38.5 semanas de gestación, con un peso de 2,960g, talla 49cm y APGAR 9/9.
DiscusiónSi bien se trata de la revisión de un caso clínico, los resultados que se han venido observando desde 1998 desde la descripción de la técnica de micro-TESE y en los estudios posteriores reportados han sido favorables, pareciendo suficientes para considerar a la m-TESE no solo como método diagnóstico, sino terapéutico para casos de infertilidad masculina por azoospermia no obstructiva, independientemente de los niveles de FSH, ya que dicha relación en estudios previos y aun durante este caso clínico en particular, no ha logrado ser concluyente para determinar el éxito de la micro-TESE, por lo que los niveles de FSH continuarán generando controversia; sin embargo, el factor que parece ser determinante es el método de obtención de espermatozoides mediante la técnica descrita por Schlegel et al., ya que permite una observación directa al microscopio de las zonas de espermatogénesis, independiente de la FSH.
La casuística no nos permite ser más concluyentes para mostrarlo como método de elección en el tratamiento de la misma, sin embrago, aun en un caso clínico aislado, se logra demostrar la importancia de la búsqueda exhaustiva de espermatozoides bajo observación directa al microscopio y el beneficio para la pareja.
En casos extremos como el expuesto en este artículo, consideramos que el mejor momento para realizarlo es durante el ciclo de estimulación ovárica de la pareja (procedimiento diagnóstico y terapéutico). De lo contrario, corremos 2 riesgos importantes:
1. Que los espermatozoides aislados no resistan la criopreservación o vitrificación para el día que deban ser usados.
2. La realización de microdisección testicular en un segundo tiempo quirúrgico fallida, debido a ausencia de células germinales por manipulación previa, considerando que estos pacientes por lo general tienen volúmenes testiculares muy disminuidos.
Se debe informar adecuadamente al paciente respecto a los riesgos y beneficios además de informarle de un panorama real de éxito de este procedimiento. Dentro de los principales riesgos está la posibilidad de insuficiencia testicular que haga necesario un reemplazo hormonal después del procedimiento hasta la atrofia completa del testículo manipulado.
Sin duda la m-TESE parece ser un método efectivo para la obtención de espermatozoides y ofrecer así mayor probabilidad de éxito y posibilidad real de paternidad que difícilmente se conseguía con los métodos previos en pacientes con intentos fallidos previos.
Destacamos las limitaciones de la revisión de un caso clínico aislado, dadas la casuística y la experiencia del manejo de infertilidad masculina, por lo que crece el interés en el estudio del método diagnóstico y terapéutico ideal según las características de cada paciente.
FinanciaciónLos autores no recibieron ningún patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.