La fístula arteriovenosa posnefrectomía es poco frecuente a pesar del número de nefrectomías que se realizan en el mundo, y ocurren más a menudo en el lado derecho, como el caso que presentamos.
Presentación del casoMujer de 66 años de edad. En enero 2005 se realizó nefrectomía radical derecha. En mayo 2015 se presenta a la consulta de cardiología en anasarca y con un soplo abdominal, se realiza tomografía de abdomen, se diagnostica fístula de arteria renal derecha a cava. Hemodinamista descarta tratamiento endovascular, es enviada a nuestro servicio de urología.
Por laparoscopia, en decúbito lateral derecho se extraen 2l de ascitis y se diseca el nacimiento de la «arteria renal derecha» y se aplican 2 grapas de Hem-o-lok de 10mm. El primer día de postoperatorio: mínimo dolor abdominal, toleró vía oral, canalizó gases y signos vitales normales, sin embargo, se sigue escuchando soplo abdominal (30h de postoperatorio); se hace tomografía de abdomen. La fístula arteriovenosa sin cambio y doble grapa Hem-o-lok en la arteria mesentérica superior, pero con flujo a pesar de las 2 grapas (obstrucción parcial). Hicimos laparoscopia de urgencia, se retiran grapas de la arteria mesentérica superior, se localiza la arteria renal derecha, doble grapa Hem-o-lok, desaparece el soplo. Postoperatorio excelente. Tomografía de control, sin fístula arteriovenosa y arteria mesentérica superior normal sin grapas.
ConclusionesCaso complejo, poco común, que se resolvió con técnica laparoscópica. Quizá una placa de ateroma evitó la obstrucción completa de la arteria mesentérica superior. La posición del paciente fue un factor importante para encontrar la arteria renal derecha.
Post-nephrectomy arteriovenous fistula is rare in relation to the number of nephrectomies performed worldwide and they are more frequent on the right side, as was true for the case presented herein.
Case reportA 66-year-old woman underwent right radical nephrectomy in January 2005. In May 2015 she came to a cardiology consultation presenting with anasarca and an abdominal murmur. An abdominal tomography scan was done and an arteriovenous fistula involving the right renal artery and the vena cava was diagnosed. The hemodynamics specialist ruled out endovascular treatment and the patient was referred to our urology service.
Through laparoscopy performed with the patient in the right lateral decubitus position, 2L of ascites were extracted and the origin of the right renal artery was dissected. Two 10mm Hem-o-Lok staples were applied. On the first postoperative day the patient had minimal abdominal pain, tolerated a liquid diet, passed gases, and had normal vital signs, but the abdominal murmur continued to be heard. At 30h after the procedure, an abdominal tomography scan was carried out that revealed no change in the arteriovenous fistula. The double Hem-o-Lok staples were observed in the superior mesenteric artery, but there was flow despite the 2 staples (partial obstruction). Emergency laparoscopy was performed, removing the staples from the superior mesenteric artery. The right renal artery was located and 2 Hem-o-Lok staples were placed. The murmur ceased. The patient had excellent postoperative progression. The control tomography scan showed there was no arteriovenous fistula and the superior mesenteric artery was normal with no staples.
ConclusionsThis was an unusual and complex case that was resolved through laparoscopy. Perhaps an atheroma prevented complete superior mesenteric artery obstruction. The position of the patient was an important factor in locating the right renal artery.
Las fístulas arteriovenosas (FAV) renales constituyen una dolencia poco frecuente en la práctica urológica habitual. El primer caso fue descrito por Varela en 1923 en un varón de 28 años con insuficiencia cardíaca e hipertensión. Desde entonces, más de 350 casos han sido publicados en la literatura mundial, observándose un aumento de la incidencia de esta dolencia en las últimas décadas, en relación fundamentalmente con 2 factores: el aumento del abordaje renal percutáneo con fines terapéuticos o diagnósticos. Sin embargo, la exacta incidencia de esta dolencia no puede precisarse, pues la mayoría, por su nula repercusión clínica, suele pasar desapercibida. Existen 3 tipos de FAV renales: las congénitas, las idiopáticas y las adquiridas. Las más frecuentes son las adquiridas, que constituyen el 75% de las FAV. Dentro de ellas, las más comunes son las secundarias a la biopsia percutánea renal, las producidas por traumatismo (ya sea penetrante o contuso) y las secundarias a cirugía percutánea renal, siendo una rareza las fístulas que aparecen después de una nefrectomía1-5. Presentamos un caso de una paciente diagnosticada, 10 años después de una nefrectomía radical derecha, que desarrolló una fístula entre arteria renal derecha y vena cava inferior.
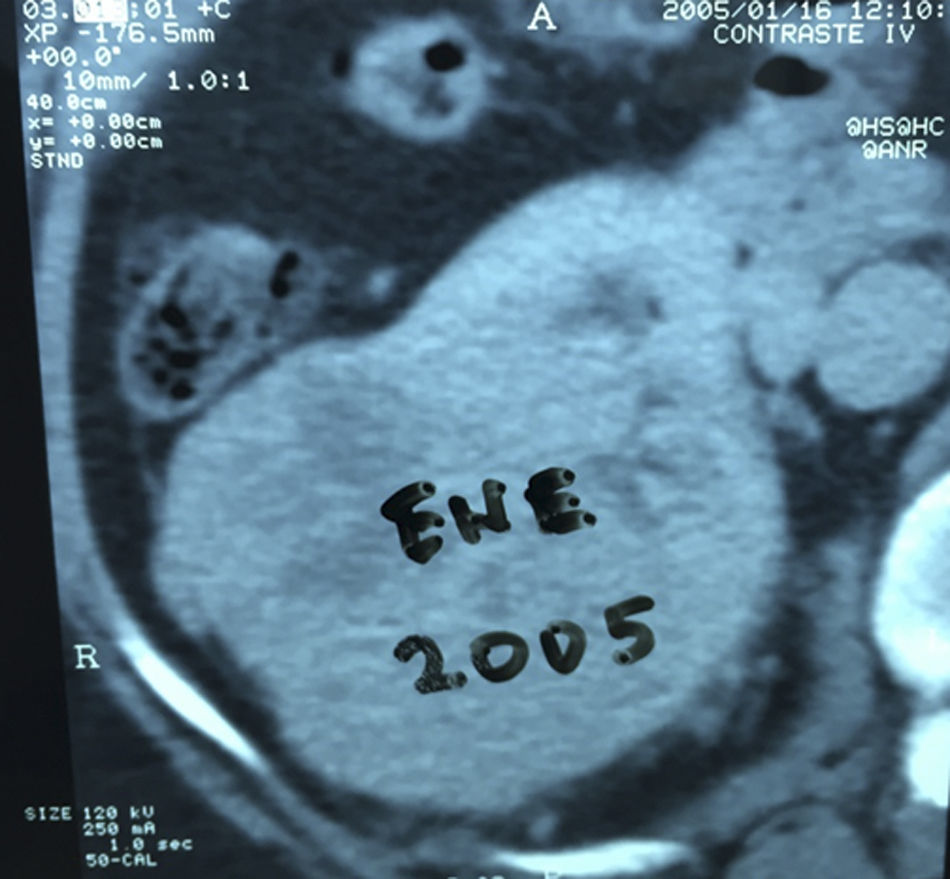
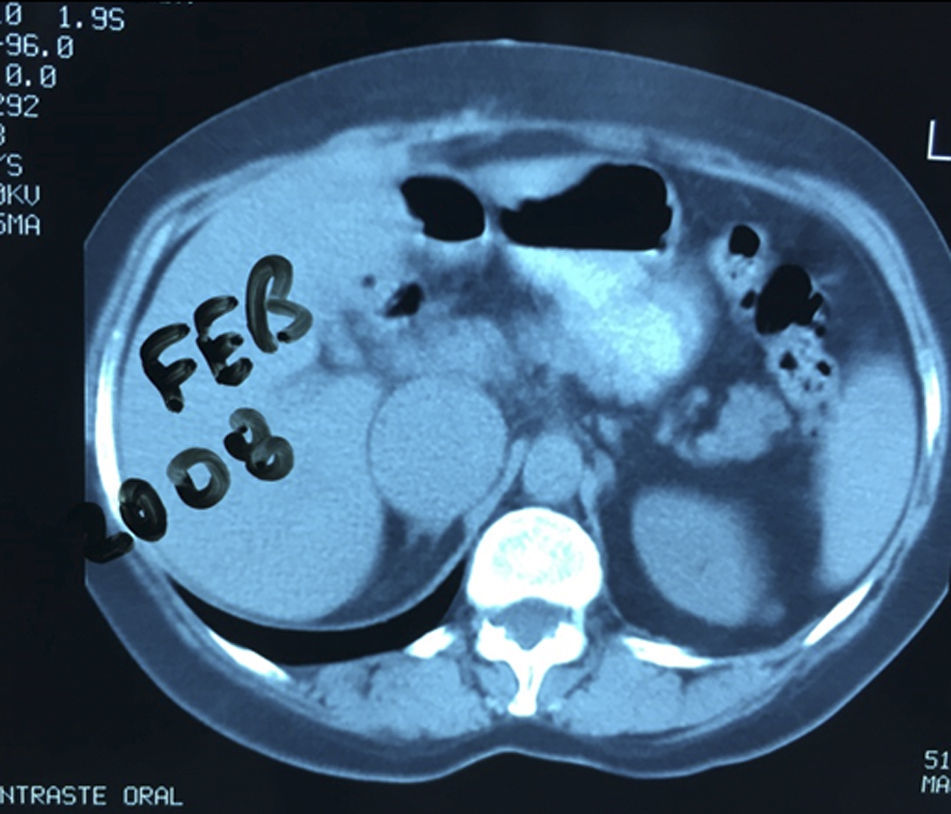
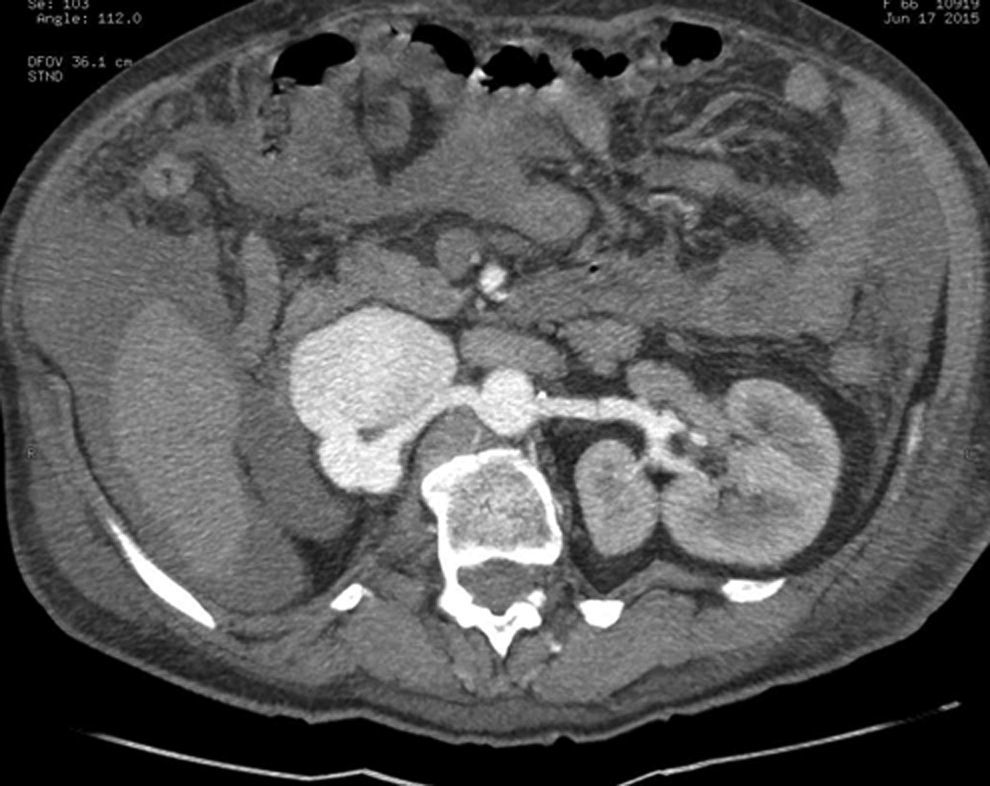
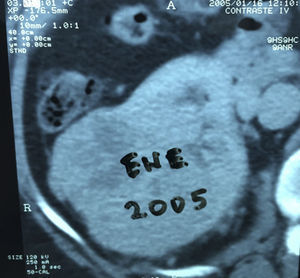
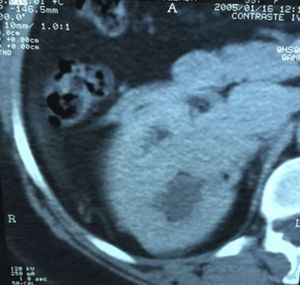
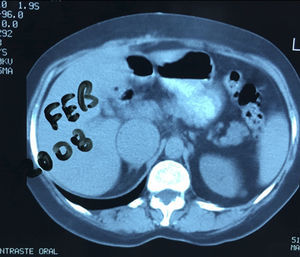
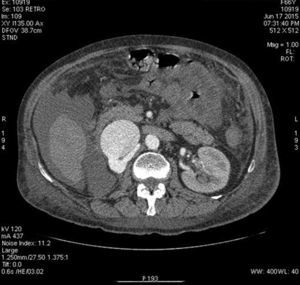
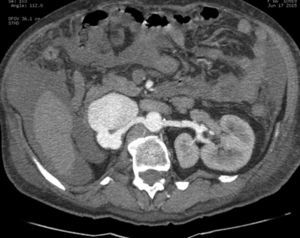
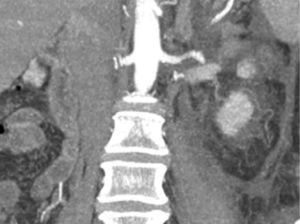
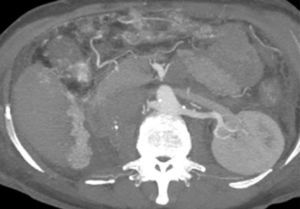
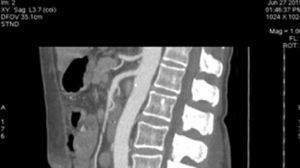
Presentación del casoPaciente femenino de 66 años de edad, en enero del 2005 se realiza nefrectomía radical derecha abierta por un adenocarcinoma renal de células claras con trombo tumoral (figs. 1 y 2), sin embargo no se realiza trombectomía tumoral de vena cava hasta abril del 2007. Su postoperatorio fue complicado por el sangrado abundante que tuvo, al final se recuperó; en su seguimiento oncológico solo se observaba gran dilatación de la vena cava pero sin ningún indicio de actividad tumoral (figs. 3 y 4). En 2010 es vista por cardiología por datos de insuficiencia cardíaca congestiva, se manejó como tal durante este tiempo, sin embargo su actividad física cada vez iba decayendo; en marzo del 2015 visita a un cardiólogo hemodinamista; al estudiar a la paciente le encuentra un soplo abdominal; dentro de los estudios que le hace, un ecocardiograma reporta ventrículo izquierdo normal, resistencias pulmonares aumentadas, lo que lo hace dudar del diagnóstico cardiológico emitido con anterioridad; con la sospecha de una FAV le practica una arteriografía aórtica corroborando el diagnóstico de FAV, sin embargo al ver el tamaño y el flujo tan alto a la cava no se atreve a aplicar el embolizante para tapar la FAV (por miedo a que emigre el agente embolizante); para completar su estudio, le actualiza una angiotomografía abdominal, encontrando una vena cava muy dilatada, debido a una fístula de arteria renal derecha (ARD) a vena cava, con ascitis importante (figs. 5 y 6); en este momento la paciente se encuentra en anasarca, dificultad respiratoria con imposibilidad para la deambulación, se le da tratamiento médico, el cardiólogo presenta el caso para ver si podríamos resolver el caso por laparoscopia. Se revisó el caso y decidimos abordarlo con la técnica laparoscópica por el lado izquierdo del abdomen, para disecar la aorta y el nacimiento de la ARD a la que se le pondrían 2 grapas Hem-o-lok de 10mm y así cerrar la FAV y de esta forma evitamos el lado derecho que ya tiene 2 cirugías previas, además de una cava muy dilatada y el seudoaneurisma que se forma entre el muñón de la ARD y la cava, ya que si se llegan a lesionar estas estructuras se presentaría un sangrado profuso de difícil control con resultados potencialmente catastróficos.
Técnica quirúrgicaEn decúbito lateral derecho casi en 80 grados se colocan 4 trocares 2 de 5mm y 2 de 10-12mm en hemiabdomen izquierdo, se abre la corredera parietocólica izquierda para tener acceso al retroperitoneo, se diseca el uréter izquierdo junto con la vena ovárica izquierda, se continúa su disección hacia su porción cefálica hasta llegar al hilio renal izquierdo, engrapa la vena lumbar con Hem-o-lok de 5mm para liberar la vena renal izquierda y poder disecar la aorta y el nacimiento de la arteria renal izquierda; levantando la vena renal izquierda por su cara inferior intentamos encontrar la ARD, no se logra, entonces se diseca y se engrapa la vena suprarrenal izquierda con Hem-o-lok de 5mm, ahora se desplaza la vena renal izquierda caudalmente, se identifica la ARD, se aplica grapa Hem-o-lok de 10mm en su nacimiento de la aorta, para descartar que sea la arteria mesentérica superior (AMS); se observa el intestino delgado por un lapso no menor a 10min, al no haber ningún dato de isquemia intestinal se coloca una segunda grapa, se vuelve a chequear el intestino delgado y se corrobora que no hay isquemia intestinal, se deja un drenaje cerrado en cavidad abdominal, se cierran los puertos de 10-12mm con aguja de Carter Tomason con Vicril del 0 y luego la piel con nailon 3 ceros. Sin complicaciones.
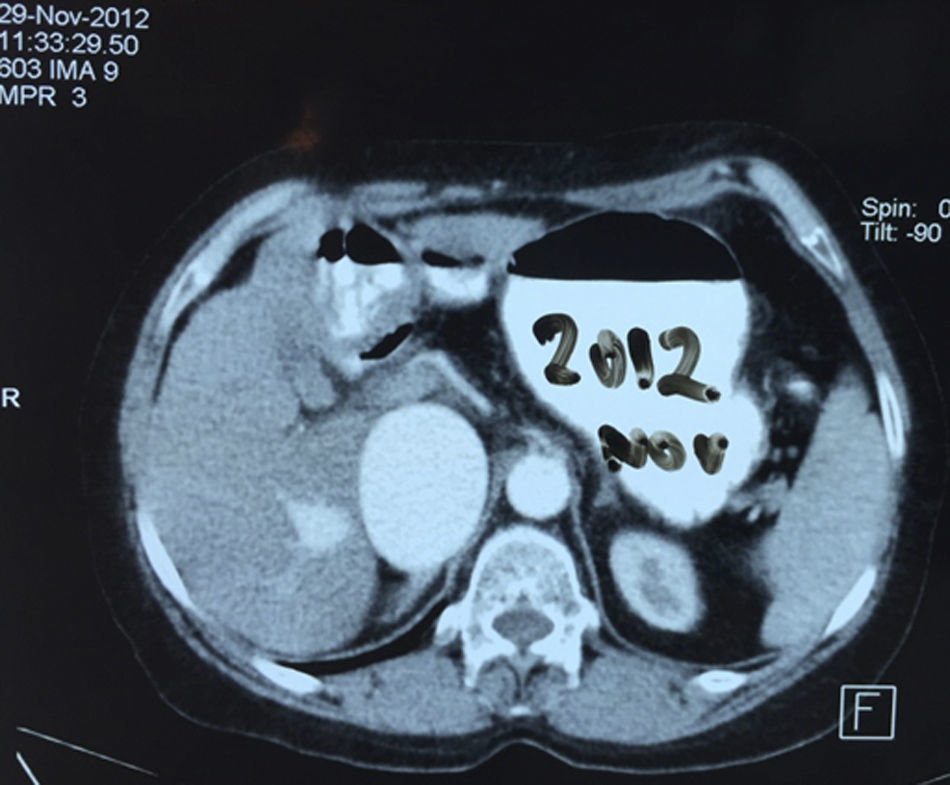
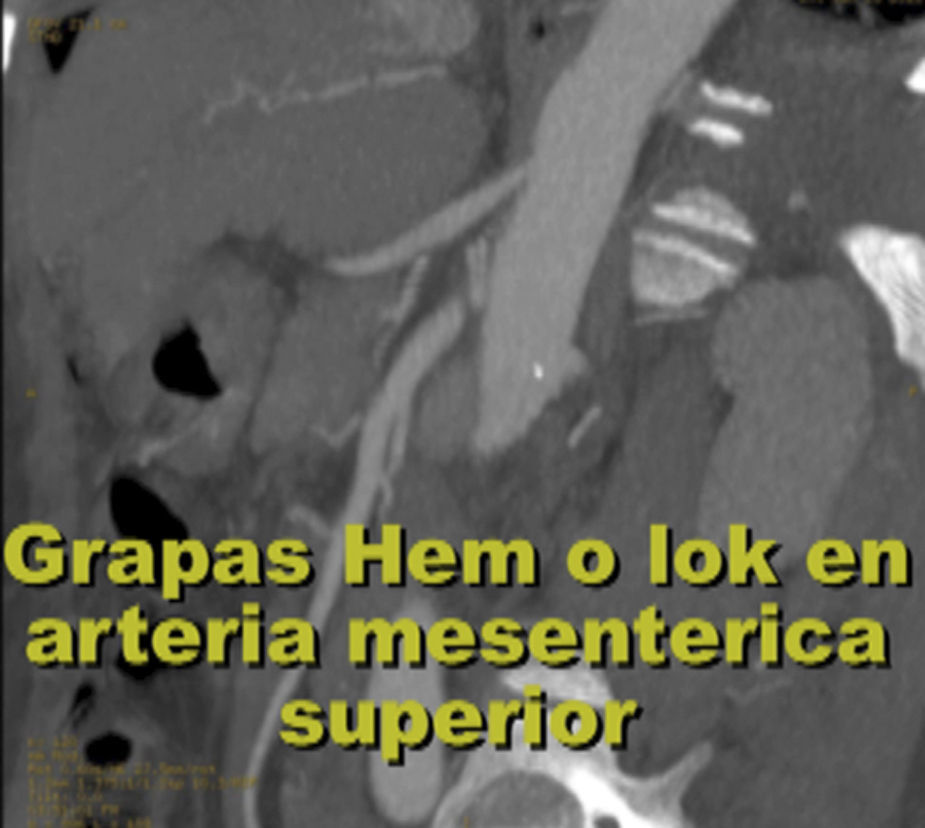
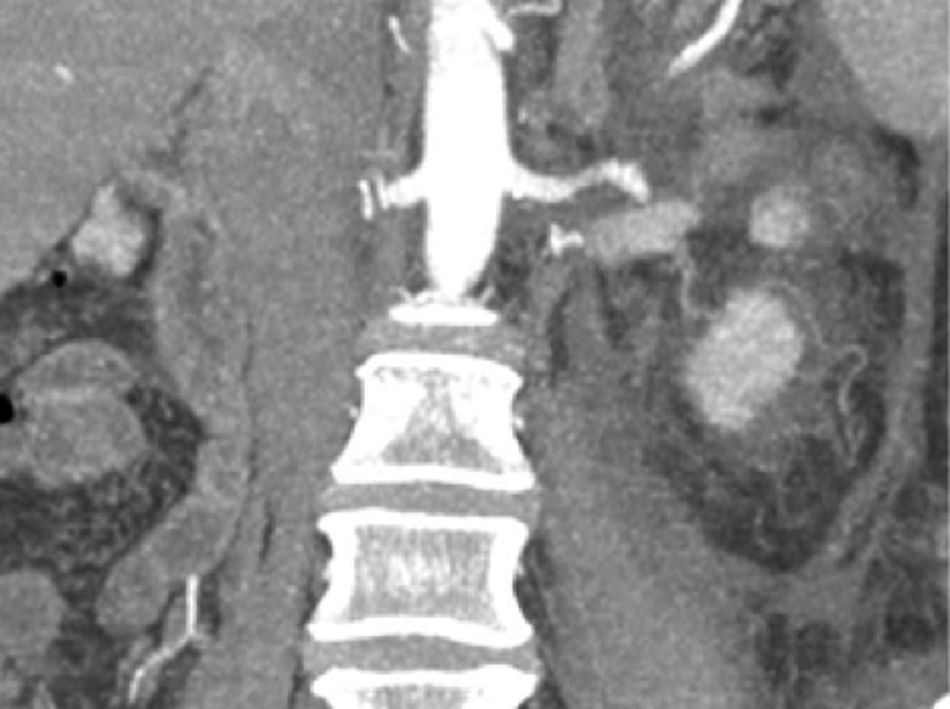
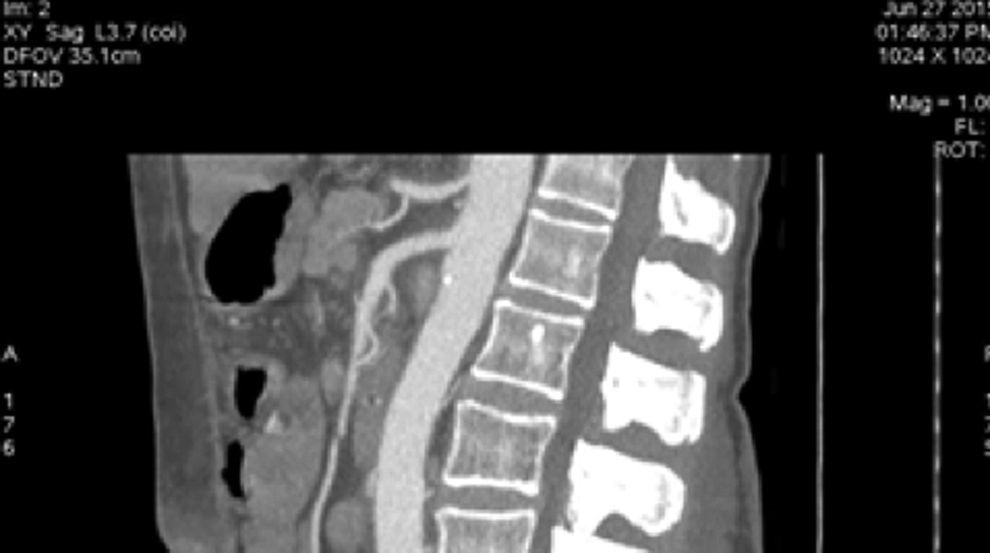
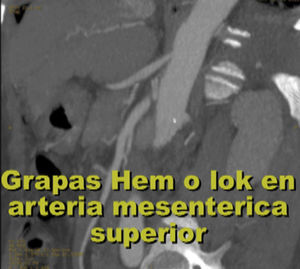
EvoluciónEl primer día de postoperatorio, el drenaje abdominal había sido aproximadamente de 600ml en 24h, toleró la vía oral, canalizó gases, deambuló sin asistencia, con peristalsis intestinal presente, dolor abdominal leve y tolerable, refiriendo que se sentía mejor que antes de la cirugía, sin embargo se seguía escuchando el mismo soplo abdominal, por lo que inmediatamente se pide una nueva angiotomografía abdominal. A las 30h de postoperatorio el estudio muestra la FAV sin cambio alguno y se observa la AMS con medio de contraste normal, pero en su nacimiento de la aorta 2 grapas Hem-o-lok causando una obstrucción parcial (figs. 7 y 8), por lo que es llevada inmediatamente a quirófano para exploración laparoscópica. Se colocó a la paciente en decúbito lateral derecho (pero ahora a 40 grados aproximadamente). El acceso laparoscópico se llevó a cabo en poco tiempo, porque ya todo se encontraba disecado, localizamos las grapas de la AMS, la primer grapa se cortó con dificultad con una tijera laparoscópica convencional (no contamos con bisturí armónico). La segunda grapa la cortamos fácilmente con una tijera laparoscópica de punta de perico, luego continuamos con la búsqueda de la ARD, por debajo de la vena renal izquierda, a la misma altura de la arteria renal izquierda encontramos sin dificultad la ARD (con la ayuda de la nueva posición que se le dio a la paciente).
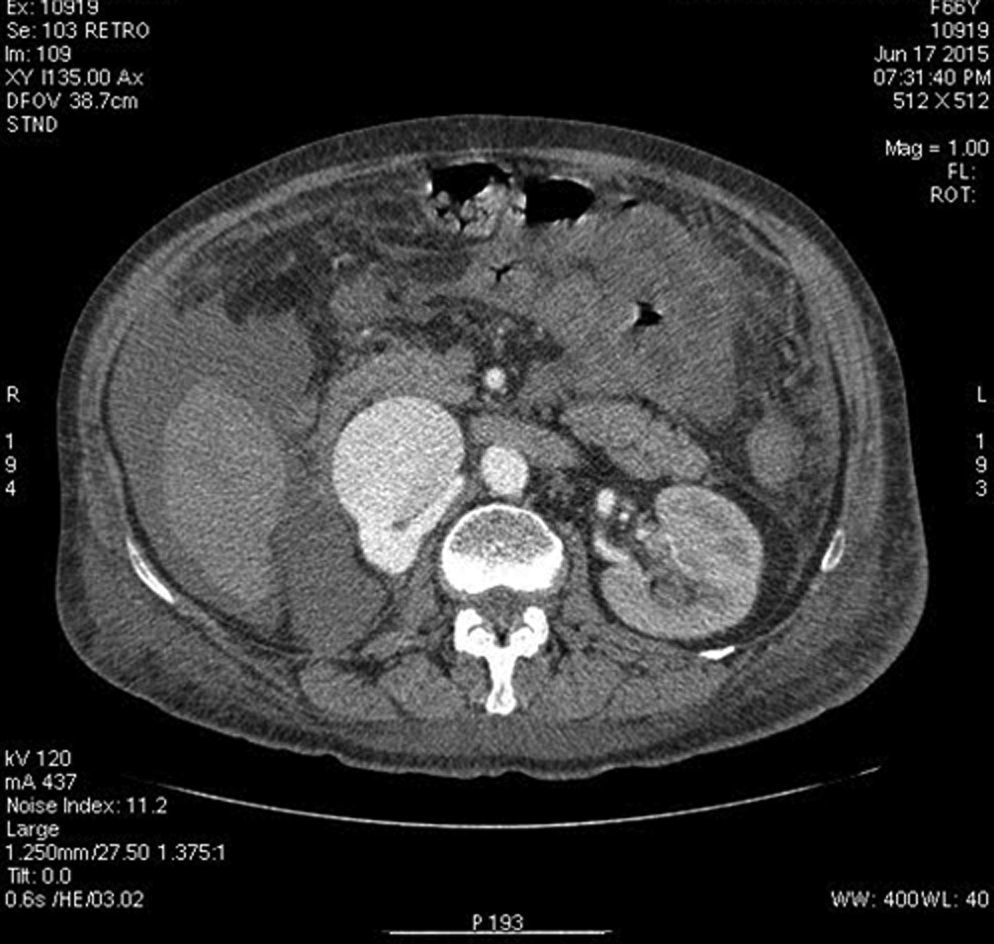
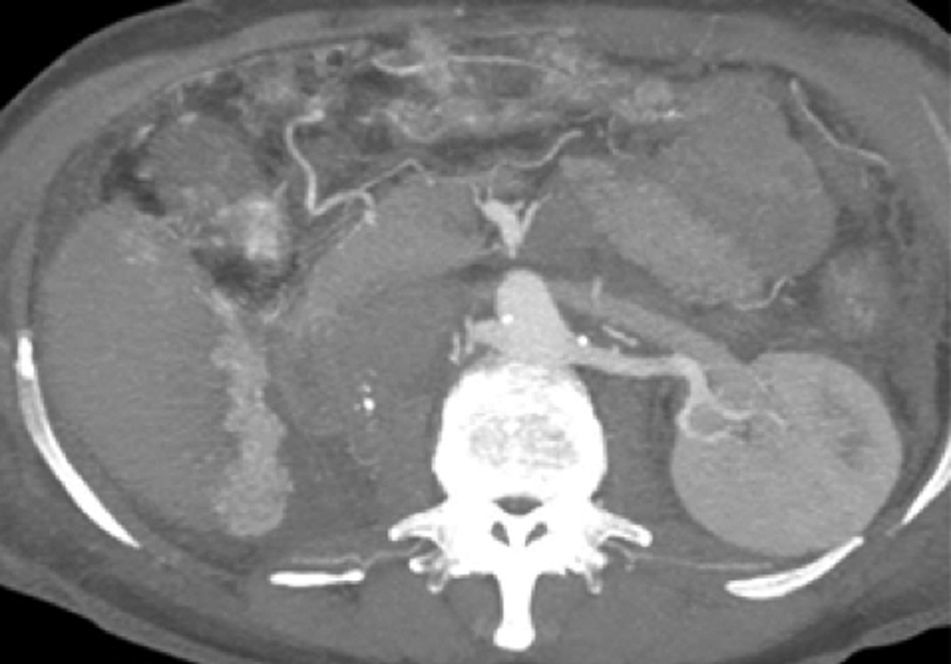
Se colocó un estetoscopio en la espalda a nivel de L-2 aproximadamente, el anestesiólogo podía escuchar el soplo producido por la FAV y monitorizar así sí había algún cambio al momento de colocar la grapa Hem-o-lok de 10mm en el nacimiento de la ARD; al hacerlo, de inmediato cesó el soplo. Se puso una segunda grapa en el nacimiento de la ARD. Se coloca nuevamente drenaje cerrado abdominal y se cierran los puertos como se describió anteriormente. Al día siguiente se realiza nueva tomografía axial computarizada de abdomen, corroborando la ausencia de FAV y una AMS normal (sin grapas) (figs. 9, 10 y 11), su evolución postoperatoria fue aún mejor, con drenaje abdominal muy escaso (menor a 50ml en 24h), se dio de alta a las 48h, tolerando vía oral, canalizando gases, sin ningún drenaje, signos vitales estables, caminando sin ningún tipo de ayuda, sin edema y con una saturación de O2 normal con aire ambiente. A los 2 meses de operada la paciente relata que su actividad física ha aumentado sustancialmente, el cardiólogo le practicó un ecocardiograma donde corroboró la disminución importante de las resistencias pulmonares y la disminución del volumen del ventrículo derecho; ya no está tomando ningún medicamento.
ConclusionesLa FAV posnefrectomía es una complicación muy poco frecuente, en la literatura existen menos de 100 casos reportados6. En un 70% de los casos se describen en el lado derecho, pues los vasos son más cortos en este lado y ello supone mayor dificultad en el momento de disecar los distintos componentes del pedículo para ligarlos por separado1,3,4.
Nuestro caso tiene varios puntos que analizar; primero, se hace solo nefrectomía radical por un cáncer renal con trombo tumoral, 2 años y 3 meses después se realiza trombectomía tumoral, con un seguimiento de más de 10 años sin evidencia de actividad tumoral; segundo, el tiempo de diagnóstico fue de 10 años; tercero, tratamiento para su solución; cuarto, el incidente quirúrgico de la obstrucción parcial de la AMS, la reintervención laparoscópica para resolver el incidente y la FAV.
1.o. De acuerdo a la literatura el adenocarcinoma renal de células claras en etapa clínica T3b, N0, M0, tiene una supervivencia del 30-50% a 5 años, sin embargo no se encontró nada si la trombectomía tumoral se retrasaba como en este caso más de 2 años sin tener repercusión oncológica.
2.o. La comunicación del sistema arteriovenoso a nivel de la fístula produce un cortocircuito izquierda-derecha, con el consiguiente aumento del gasto cardíaco. Todo ello afecta a ambas cavidades ventriculares, con aparición de cardiomegalia y, a la larga, insuficiencia cardíaca congestiva2,3. La mayoría se diagnostican de forma tardía, muchos años después de la cirugía1,4. El tiempo medio desde la cirugía al diagnóstico se estima que es de 15 años1,3,5. Las manifestaciones clínicas varían en función del tiempo entre la nefrectomía y el diagnóstico2,4. A pesar de que la presencia de un soplo continuo a nivel del flanco o del abdomen es diagnóstica, a menudo se sospechan ante un cuadro de hipertensión refractaria al tratamiento o por clínica de insuficiencia cardíaca congestiva, que es la complicación más importante de esta entidad y que suele aparecer en etapas tardías, como fue en nuestro caso, más el antecedente de nefrectomía, debería alertarnos de la posibilidad de este diagnóstico2,7. El diagnóstico de sospecha es básicamente clínico, exploraciones como la ecografía doppler, la tomografía axial computarizada, y sobre todo, la tomografía tridimensional, nos ayudan a confirmar el diagnóstico de sospecha y ver la morfología de la fístula para decidir la mejor opción terapéutica4,7,8.
3.o. Todas las fístulas, y más aún las de gran calibre, deberían tratarse ante el riesgo de aparición de fallo cardíaco o, en menos ocasiones, de rotura espontánea del aneurisma4,9. El tratamiento de elección depende del tamaño y de la etiología de la fístula. La exéresis completa de la fístula, la ligadura simple de la vena y arteria o la embolización percutánea, son medidas terapéuticas que han demostrado ser eficaces para el tratamiento de esta dolencia4,9. En fístulas sintomáticas y de pequeño tamaño, la embolización percutánea es el tratamiento de elección, reservando la cirugía de exéresis para las FAV de gran tamaño no resueltas con embolización y la ligadura simple para los casos de fístula de gran tamaño en que la exéresis es dificultosa debido a la inflamación de alrededor4. La embolización percutánea, aunque mucho más ventajosa respecto a la cirugía abierta, no está libre de riesgos. Se han descrito casos de migración de los agentes embolizantes hacia el sistema circulatorio pulmonar (sobre todo en fístulas de gran tamaño), casos de isquemia intestinal o renal contralateral y casos de recidiva de la fístula. En la literatura se describen distintas técnicas de embolización percutánea, en las que se usan materiales diversos, con la intención de disminuir el riesgo de migración4,9,10. La cirugía de exéresis consiste en individualizar la lesión, con ligadura por separado de arteria y vena, previa resección del trayecto fistuloso. En los casos de exéresis dificultosa, la ligadura simple de los vasos puede dar buenos resultados, aunque el riesgo de recidiva es mayor4,11. Se buscó en la literatura (PubMed) si había algún caso como el que estamos presentando, resuelto por laparoscopia o laparoscopia asistida con robot y no se encontró; probablemente sea de los pocos casos de FAV posnefrectomía derecha resueltos con técnica laparoscópica.
4.o. Fue referida la paciente a nuestro equipo quirúrgico laparoscópico por la experiencia que tenemos sobre todo en el campo de la nefrectomía donante. Consideramos factible realizar el procedimiento por el lado izquierdo del abdomen, ya que el lado derecho tenía 2 procedimientos quirúrgicos previos donde quizá pudiésemos encontrar un campo quirúrgico con fibrosis y adherencias, así como la gran dilatación de la vena cava con mayor presión debido a la FAV, el aneurisma de la misma fístula, y si tuviésemos una lesión de estas estructuras el sangrado sería de difícil control y quizá con un final catastrófico.
Por esta razón decidimos abordar el caso por el lado izquierdo del abdomen y llevar a cabo uno de los principios básicos en la reparación de cualquier FAV, que es, primero tener control de la arteria que alimenta la FAV12. Colocamos al paciente en decúbito lateral derecho 80 grados de inclinación, no pudimos encontrar el nacimiento de la ARD por debajo de la vena renal izquierda, decidimos engrapar y cortar la vena suprarrenal izquierda para desplazar la vena hacia abajo y localizar la ARD.
Supuestamente la encontramos, observamos que la arteria salía lateral a la aorta (por la posición que tenía la paciente, que en ese momento no tomamos en cuenta), se colocó una grapa Hem-o-lok de 10mm en el nacimiento de la arteria, observamos el color del intestino delgado por lo menos por 10min, con el fin de descartar la posibilidad de haber engrapado la AMS; antes de colocar la segunda grapa y aún después de hacerlo nos quedamos observando la irrigación del intestino delgado durante varios minutos más antes de dar por terminado el procedimiento quirúrgico. La paciente nunca tuvo datos clínicos de abdomen agudo, solo la persistencia del soplo abdominal nos hizo reestudiar a la paciente y darnos cuenta que a pesar de tener doble grapa Hem-o-lok bien colocadas en la AMS seguía teniendo flujo. Aún no nos explicamos el porqué de esto, quizá una placa de ateroma evitó que se cerrara del todo la luz de la AMS evitando una isquemia intestinal severa. La reintervención fue realizada de manera urgente antes de que se presentara una trombosis mesentérica, ahora tratando de saber cuál fue el factor de no encontrar la ARD; concluimos que fue la posición de la paciente, por lo tanto en la reintervención colocamos a la paciente en decúbito lateral derecha, pero como a 40 grados de inclinación, no a 80 grados como en el procedimiento inicial. Esto permitió con cierta facilidad identificar la ARD por debajo de la vena renal izquierda, previamente se retiraron las grapas de AMS sin complicación alguna, la monitorización de la FAV durante el pinzamiento de la ARD la hicimos con un estetoscopio. Inicialmente habíamos pensado en monitorizar el soplo de la FAV por medio de un ultrasonido doppler color, pero no fue posible por la posición de la paciente, o usar un doppler fetal portátil, pero en ese momento y a esa hora el dispositivo no tenía batería. La reintervención se llevó a cabo en menos de una hora, ya que casi todo estaba disecado.
Cada vez las técnicas endoscópicas de mínima invasión pueden sustituir a las realizadas por cirugía abierta, con las ventajas de mejor visión, menor sangrado y pronta recuperación.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.