Los virus del papiloma humano (VPH) constituyen un grupo viral heterogéneo, cuyo genoma está constituido por ADN de doble cadena helicoidal con una cápside proteica. Existen más de 230 tipos de VPH (118 de ellos bien tipificados), más de 40 tipos anogenitales, de los cuales 15 son oncogénicos y, en humanos, constituyen unos de los grupos virales que con mayor frecuencia infecta el epitelio de piel y mucosas: conjuntivas, cavidad bucal, laringe y árbol bronquial entre otros. El papiloma escamoso de la mucosa oral, ocasionado por los genotipos 33 y 32, es la lesión papilar más frecuente y constituye el 2.5% de todas las lesiones de la cavidad oral, laringe, árbol bronquial, esófago, vejiga, ano y tracto genital. El objetivo del presente estudio es realizar una revisión de la literatura sobre la papilomatosis oral y reportar un caso.
Human papilloma viruses constitute a heterogeneous viral group; their genome is made up of a helicoidal doublestranded DNA molecule with a protein capsid. There are over 230 HPV types (118 of them well characterized; more than 40 are analgenital types, out of which 15 are oncogenic). In humans they represent one of the viral groups which more frequently infect epithelium of skin and mucosae, conjunctive tissue, oral cavity, larynx, and bronchial tree among others. Oral mucosa squamous papilloma, caused by genotypes 33 and 32, is the most frequently found papillary lesion and represents 2.5% of all lesions of the oral cavity, larynx, bronchial tree, esophagus, bladder anus and genital tract. The aim of the present study was to conduct a literature review on oral papillomatosis as well as to review a clinical case.
Los virus del papiloma humano (VPH) constituyen un grupo viral heterogéneo, cuyo genoma está constituido por ADN de doble cadena helicoidal con una cápside proteica. Se trata de epiteliotrópicos que infectan el estado basal del epitelio y, como resultado, mantienen la transcripción y replicación de su ADN a niveles basales, produciendo lesiones hiperplásicas papilomatosas y verrugosas en piel y mucosas.1
Existen más de 230 tipos de VPH (118 de ellos bien caracterizados) y más de 40 tipos anogenitales, de los cuales 15 son oncogénicos y en humanos constituyen unos de los grupos virales que con mayor frecuencia infectan el epitelio de piel y mucosas: conjuntivas, cavidad bucal (genotipos 33 y 32), laringe, árbol bronquial, esófago, vejiga, ano y tracto genital.2,3
En el caso del VPH lingual, existen dos grandes grupos de presentación clínica:
a) Lesiones benignas y b) lesiones premalignas o malignas. Entre las lesiones bucales benignas se encuentran el papiloma bucal, la verruga vulgar bucal, el condiloma acuminado bucal y la hiperplasia epitelial focal (enfermedad de Heck).4–6 En tanto las lesiones premalignas o malignas están representadas principalmente por leucoplasias y carcinoma escamocelular.7
El papiloma escamoso de la mucosa oral es la lesión papilar más frecuente y representa el 2.5% de todas las lesiones de la cavidad oral.6 Las lesiones clínicas del VPH se observan con mayor frecuencia en el labio superior, labio inferior, frenillo lingual, dorso de la lengua y comisuras.8
La morfología más comúnmente observada es la de colifl or, aunque también pueden apreciarse otras formas como verrugas vulgares, además de hiperqueratosis o incluso una superficie no queratinizada, con cambios de coloración superficial (normalmente violácea).9 De acuerdo con las referencias bibliográficas, la mayoría de las veces, se transmite por una práctica sexual orogenital.10
El objetivo del presente estudio es realizar una revisión de la literatura en torno a la papilomatosis oral y reportar un caso.
HISTOLOGÍA DE LA LENGUALas células de la lengua tienen una disposición estructural poliestratificada. Estas células se encuentran asentadas sobre un estrato corneo (superficial), estrato granuloso, estrato espinoso y estrato basal (el más profundo). El núcleo de estas células cambia de tamaño de acuerdo con su madurez y especialización.11
GENOMA DEL VIRUS DE PAPILOMALas partículas virales están compuestas por una cápside protéica conformada en un 95% por la proteína L1 y en un 5% por la proteína L2. Dichas proteínas se ensamblan para formar capsómeros icosaédricos. En el interior de la cápside, se encuentra un DNA circular de doble cadena de aproximadamente 8,000 pares de bases, constituido por ocho genes y una región regulatoria no codificante, la cual contiene sitios de unión para factores protéicos y hormonales del hospedero necesarios para que el virus pueda completar su ciclo de replicación.12
El genoma del VPH es similar y está conformado por dos tipos de genes, aquellos codificados en las etapas tempranas de la infección, mejor conocidos como genes E (del inglés early = temprano), y aquellos codificados durante las etapas tardías del ciclo de replicación, conocidos como L (del inglés late = tardío). Se conocen seis genes tempranos: E1, E2, E4, E5, E6 y E7 (si bien se considera que E4 es en realidad un gen tardío), y dos tardíos: L1 y L2. Los genes tempranos codifican proteínas involucradas en la replicación y regulación viral, así como en su capacidad carcinogénica. Por su parte, los genes tardíos codifican las proteínas estructurales que conforman la cápside viral.12,13
CICLO DE VIDA DEL VPHEl VPH penetra al huésped por una pequeña abrasión en el epitelio íntegro de la lengua.13 A continuación, inicia su ciclo productivo infectando a las células poco diferenciadas de las capas basales del epitelio, donde comienza la transcripción de sus genes.12
Cuando las células infectadas se diferencian y migran desde la capa basal hacia el estrato espinoso del epitelio (permisibidad inmunológica), la replicación viral se estimula, produciendo la acumulación de viriones dentro del núcleo y el ensamble de la cápside en el citoplasma. Existen por lo menos dos ciclos para la replicación viral: a) la infección lítica y b) la infección lisogénica.
En la infección lítica, el virus llega a las células parabasales con capacidad de replicación, se introduce en el citoplasma y posteriormente en el núcleo. Una vez dentro del núcleo, se replica en la zona episomal, sin integrarse al genoma celular, produciéndose un número aproximado de 20 copias virales. En esta fase, las copias virales completan su estructura al ensamblarse la cápside. Estas partículas virales completas causan la muerte de la célula y quedan libres cerca de la superficie de los epitelios.
En la infección lisogénica, el genoma celular se ve directamente afectado, es el caso de los VPH de alto riesgo (16 y 18). Después de alcanzar al núcleo celular el virus se integra al genoma de la célula huésped, principalmente los segmentos E6 y E7. La replicación de los virus en este caso entra en un periodo de latencia hasta que la célula huésped replica su propio ADN y el de los virus integrados. Los segmentos de ADN viral son transcripcionalmente activos después de la división celular, lo que garantiza su propagación.13 A diferencia de la infección lítica, este tipo de infección se observa en células con crecimiento maligno.
La expresión de los genes de los diferentes tipos de VPH se regula de manera estricta y específica mediante factores de transcripción como el AP1, el factor específico de queratinocitos, NF1/CTF, CEFI, CEFII y TEFI y algunos factores de origen hormonal.
En ambos tipos de infección las proteínas E1 y E2 inician su expresión en dirección ascendente (suprarregulación), activándo la transcripción del ADN y la expresión controlada en las células basales.12
Los genes E6 y E7 del VPH están directamente relacionados con la transformación maligna de las células por medio de las oncoproteínas E6 y E7, las cuales tienen la capacidad de formar complejos con los productos de genes celulares que regulan el ciclo celular, entre los que se encuentran p53 y Rb. La oncoproteína E6 crea un complejo con la proteína p53, en tanto E7 crea un complejo con la proteína Rb.
La proteína Rb regula el paso de G1 a S. La oncoproteína E7 secuestra a Rb evitando que ésta pueda regular las proteínas de proliferación celular lo que hace que el ciclo celular permanezca en fase de síntesis.13 Estos dos eventos, la integración de los genes virales al genoma celular y el bloqueo de las funciones normales de los genes supresores del tumor p53 y Rb, se asocian a la transformación celular de las células infectadas con virus de alto potencial oncogénico (16 y 18). Los cambios progresivos que experimentan los queratinocitos modifi can el microambiente y alteran el equilibrio del epitelio mediante estímulos de proliferación celular guiada por la secreción de los factores de crecimiento epidermal alfa y beta.
Las proteínas E2, E3, E4, E5, E6 y E7, por su parte, inducen la pérdida de control proteico génico (ADN episómico en el núcleo celular), mientras que E6 y E7 replican el ADN viral.
L1 y L2 ensamblan al virus y se posicionan en las células escamosas maduras para posteriormente descamarse (más de 1,000 copias por célula).
En el caso de lesiones benignas, como el papiloma lingual, la proliferación de partículas del ADN episomal promueve un crecimiento anormal del epitelio aumentando los errores génicos de las células (gastogénesis).
E6 y E7 promueven la proliferación e inmortalización del virus. Cuando el virus tiene potencial oncogénico provoca la malignización; cuando no lo tiene, se desarrolla una lesión benigna que puede autolimitarse en un periodo de dos años. Este mecanismo está inducido principalmente por la pérdida de telómeros del ADN, lo cual inhibe la apoptosis, aumenta el número de células infectadas y disminuye la acetilación y fosforilación de p 53 y Rb. Además, se promueve la expresión de factores angiogénicos como el factor de crecimiento vascular que desorganiza al citoesqueleto celular y a la matriz extracelular, afectado los factores de regulación que intervienen en la salud de estas estructuras.12
La infección por VPH produce cambios importantes en la morfología celular, por ejemplo, se observa la formación de vacuolas perinucleares, núcleos agrandados, irregulares e hipercromáticos, además de binucleaciones. Las células que han sufrido esta serie de cambios se conocen como koilocitos y son consideradas como la «huella digital» del virus. La manifestación morfológica más común de la infección por VPH es el condiloma (condyloma acuminatum).14
PRESENTACIÓN DEL CASOMFA, femenino de 21 años de edad, soltera, dedicada al hogar, originaria y residente del Estado de México, grupo y Rh O positivo.
Como parte de sus antecedentes familiares, su padre fue portador de esclerosis múltiple y su hermana presenta artritis reumatoide.
Niega toxicomanías. Padeció fibroadenoma mamario múltiple juvenil en la mama izquierda, para el cual recibió tratamiento quirúrgico.
Inicia su menarca a los 15 años de edad con un ritmo menstrual de 28 × 3 y la vida sexual activa a los 17 años de edad. Reporta una pareja sexualmente activa, niega sexo orogenital, GI, PI, obtiene producto único, vivo, de 3.1kg.
Hace un año se practicó estudio citológico y colposcópico de tracto genital inferior, además de revisión mamaria. Los resultados fueron negativos para cáncer y VPH. El método de planificación familiar que utiliza es el dispositivo intrauterino.
Acude a consulta de primera vez el mes de abril de 2014, manifestando glosodinia ventral de 3 meses de evolución. Posteriormente, presenta sensación de cuerpo extraño y abultamiento del tejido con un crecimiento progresivo centrifugo hasta formar una tumoración lentijiforme, sangrante al contacto con el paladar duro y en la masticación. Acude a facultativo indicando manejo sistémico no especificado sin obtener buena respuesta.
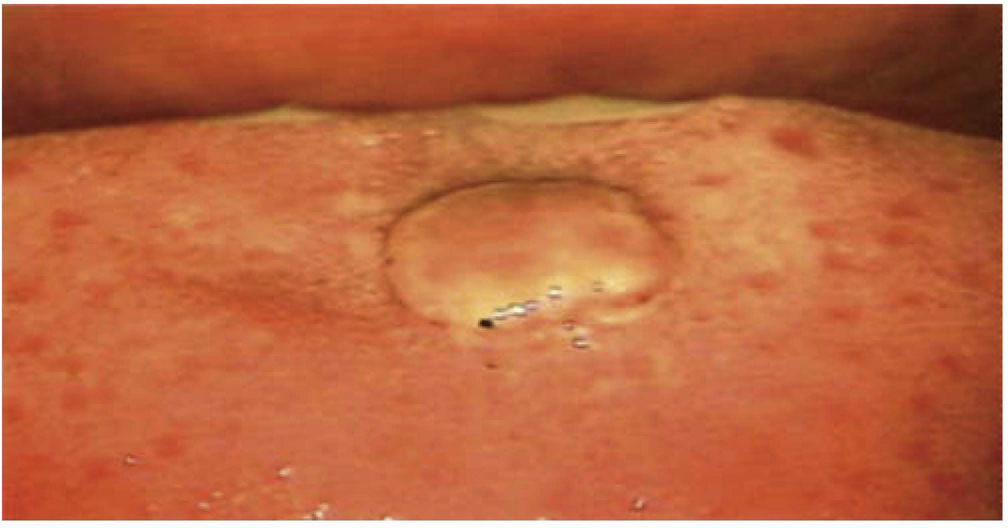
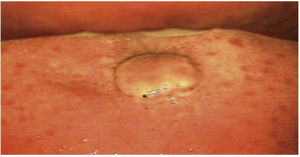
En la inspección de la cavidad oral mediante colposcopia con aumento de 0.66x (colposcopio Hinselmann, 2014 México), se observa una lesión de 1cm de diámetro, rosa, circular, de bordes mellados, sin pedículo y avascular (Figura 1). Al momento de concluir el estudio, informamos a la paciente el diagnóstico y tratamiento a efectuar.
TRATAMIENTOBajo anestesia local con xilocaína al 2% con epinefrina, se procede a infiltrar (aguja calibre 30 G) la base de la lesión (1mL). Se pinza la superficie de la lesión y se realiza disección cortante en cuña de la misma. Tras verificar hemostasia, se afrontan los bordes (dermalon 000) en un plano con punto invertido. La pieza se fija en formol al 10% en 5mL y se envía a patología.
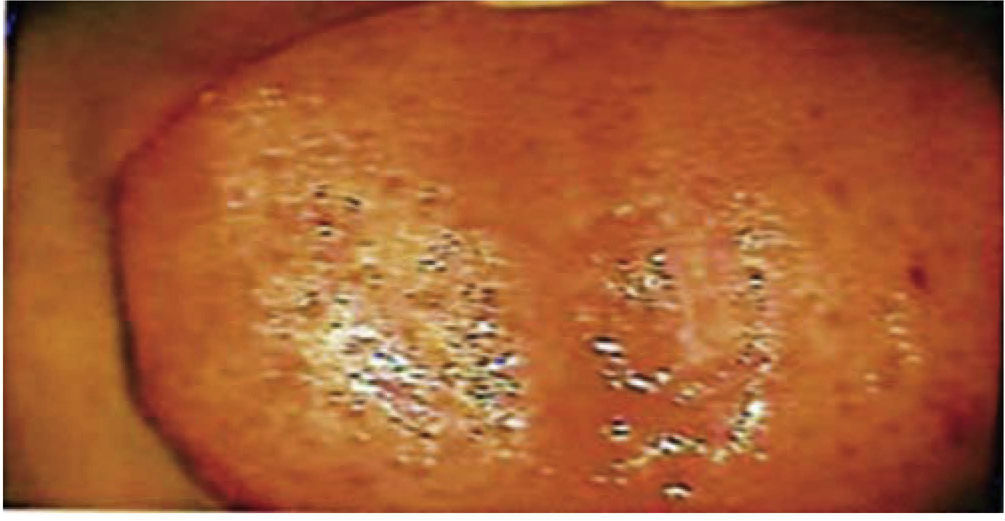
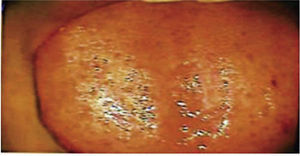
Quince días después, se retiran los puntos quedando la zona quirúrgica sana (Figura 2).
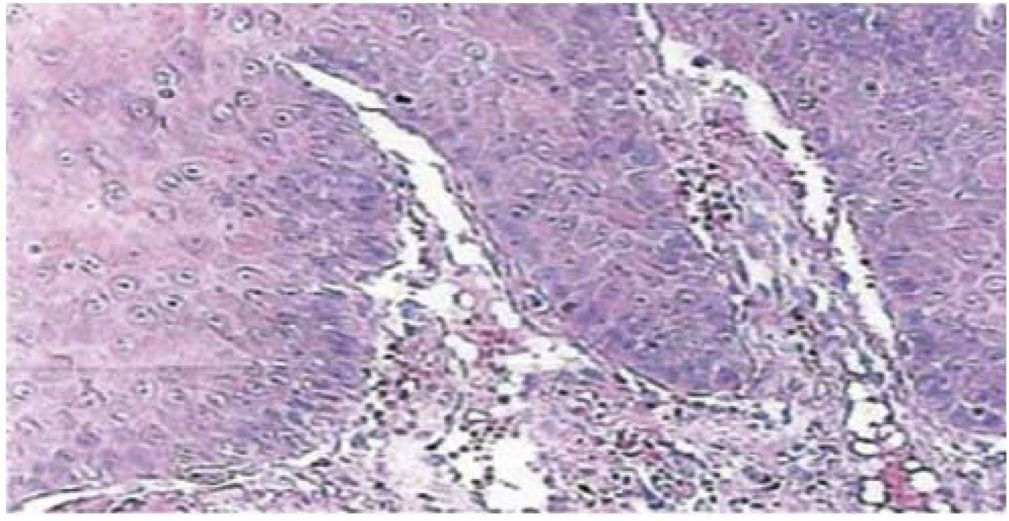
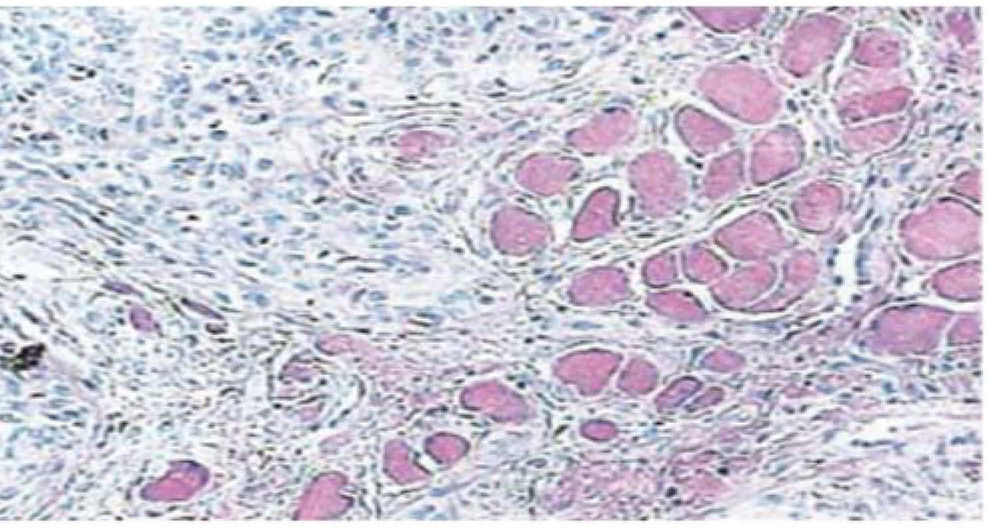
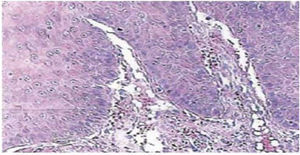
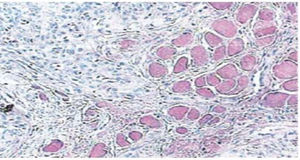
El reporte histopatológico informa la presencia de tejido con dimensiones de 0.6 × 0.5cm, forma irregular, color café oscuro y consistencia suave. Microscópicamente, se observa un epitelio poliestraficado córneo, acantosis e hiperqueratosis. En su seno se encuentran focos de cornificación intraepitelial de diferentes tamaños. Las células epiteliales son, en general, de menor tamaño que las del estrato espinoso normal (Figuras 3 y 4). El diagnóstico final indicó un papiloma escamoso de lengua. La genotipificación viral mediante reacción en cadena de la polimerasa (PCR) en tiempo real reportó la presencia de un genotipo 58 (virus de alto riesgo).
El VPH es un virus DNA que pertenece a la familia papovaviridae, del género papilomavirus. Se han descrito más de 230 genotipos. Su periodo de incubación oscila entre tres semanas y ocho meses, con un promedio de tres meses. De los 230 genotipos de papilomavirus, 16 son los que se relacionan con mayor frecuencia a lesiones bucales (1, 2, 3, 4, 6, 7, 10, 11, 13, 16, 18, 31, 32, 33, 35 y 57).
Existen dos grandes grupos de presentación clínica de VPH: a) lesiones benignas y b) lesiones premalignas o malignas. Las lesiones bucales benignas incluyen el papiloma bucal, la verruga vulgar bucal, el condiloma acuminado bucal y la hiperplasia epitelial focal (enfermedad de Heck). Las lesiones premalignas o malignas están representadas principalmente por la leucoplasia y el carcinoma escamocelular, asociados a los genotipos 16 y 18. La vía de trasmisión del VPH la constituyen las prácticas orogenitales.
Para su diagnóstico existen varias técnicas entre las que se encuentran la citología convencional, la citología en base líquida, la histología, la colposcopia y técnicas de biología molecular como la hibridación in situ y la reacción en cadena de la polimerasa (PCR).15,16 En el caso clínico expuesto se tomó la decisión de realizar la genotipificación del virus por PCR, mediante la cual se determinó la existencia de un genotipo 58. Este dato no ha sido documentado en la clasificación reportada en la literatura.
El tratamiento se individualiza en cada caso. Pueden emplearse técnicas destructivas como la crioterapia o la electrocirugía, inmunomoduladores (imiquimod al 0.5%), o un antimetabolito que interfiera con la síntesis del DNA y el RNA (ácido ribonucleico) por inhibición de la timidilato sintetasa (5-flurouracilo).17,18
En el caso expuesto optamos por la cirugía con bisturí en frío con base en el lugar de presentación de la lesión y la posibilidad de no dejar secuelas.
CONCLUSIÓNLa mucosa bucal expuesta a microtraumas, microorganismos, factores químicos y físicos, pueden actuar sinérgicamente con los VPH para ocasionar el desarrollo de lesiones benignas o carcinomas.
El VPH juega un papel importante en el desarrollo del carcinoma de células escamosas en los tractos anal, genital, bucal, epidermodisplasia verruciforme y en laringe.
En las lesiones benignas, los genotipos 33 y 32 son los más frecuentes; sin embargo, en nuestro caso el genotipo 58 fue el que reportó el resultado de biología molecular.
En la literatura mundial no se ha reportado la genotipificación 58 en este tipo de lesiones que clínicamente aparentan un comportamiento benigno.
El diagnóstico y manejo interdisciplinario entre odontólogos, oncólogos y ginecólogos debidamente capacitados en el estudio de estas lesiones bajo visión colposcópica es de suma importancia para abordar esta patología.
El tratamiento mediante intervención quirúrgica, procurando dejar bordes libres de lesión con bisturí en frío, es una solución adecuada para erradicar este tipo de lesiones sin secuelas, sobre todo en tumores que aparentan ser benignos clínicamente, pero que genotípicamente tendrán un comportamiento maligno a mediano y largo plazo.
Consideramos que el presente reporte de caso resulta de interés, ya que en la bibliografía mexicana existen pocos reportes relacionados con esta patología.
Este artículo puede ser consultado en versión completa en http://www.medigraphic.com/facultadodontologiaunam
Maestro en Ciencias. Especialista en Ginecología y Obstetricia. Recertificado por el Consejo Mexicano de Ginecología y Obstetricia. Profesor del Diplomado en Patología del Tracto Genital y Complejo AnoPerineal (UNAM) (CONADICO). Director Médico del Hospital Centro Quirúrgico Satélite