Determinar a ocorrência de síndrome metabólica (SM) e do fenótipo cintura hipertrigliceridêmica (CH) em amostra de adolescentes e estabelecer qual indicador antropométrico melhor identifica SM e CH, de acordo com gênero e fase da adolescência.
MétodosEstudo transversal com 800 adolescentes (414 meninas) de 10‐19 anos. Indicadores antropométricos (índice de massa corporal, perímetro da cintura, relação cintura/estatura, relação cintura/quadril e relação pregas cutâneas centrais/periféricas) foram determinados por protocolos padronizados. Para diagnóstico da SM, foi usada a proposta de Ferranti et al. (2004). A CH foi definida pela presença simultânea de perímetro da cintura aumentado (>75 percentil por idade e sexo) e triglicerídeos elevados (>100mg/dL). O desempenho dos indicadores antropométricos foi avaliado por meio da curva Receiver Operating Characteristic.
ResultadosA prevalência de SM foi idêntica à de CH (6,4%), sem diferenças entre os gêneros e entre as fases da adolescência. O perímetro da cintura apresentou maior área abaixo da curva no diagnóstico da SM, exceto para meninos entre 17‐19 anos, para os quais a relação cintura/estatura exibiu melhor desempenho. No diagnóstico da CH, a cintura isolada apresentou maior área abaixo da curva, exceto para os meninos nas fases inicial e final da adolescência, nos quais a relação cintura/estatura obteve maior área. A relação entre as pregas cutâneas apresentou pior desempenho para identificar SM e CH.
ConclusõesO perímetro da cintura e a relação cintura/estatura mostraram o melhor desempenho para identificar SM e CH em ambos os sexos e nas três fases da adolescência.
To determine the prevalence of metabolic syndrome (MS) and the hypertriglyceridemic waist phenotype (HW) in a representative adolescent sample; as well as to establish which anthropometric indicator better identifies MS and HW, according to gender and adolescent age.
MethodsThis cross sectional study had the participation of 800 adolescents (414 girls) from 10‐19 years old. Anthropometric indicators (body mass index, waist perimeter, waist/stature ratio, waist/hip ratio, and central/peripheral skinfolds) were determined by standard protocols. For diagnosis of MS, the criteria proposed by de Ferranti et al. (2004) were used. HW was defined by the simultaneous presence of increased waist perimeter (>75th percentile for age and sex) and high triglycerides (>100mg/dL). The ability of anthropometric indicators was evaluated by Receiver Operating Characteristic curve.
ResultsThe prevalence of MS was identical to HW (6.4%), without differences between genders and the adolescence phases. The waist perimeter showed higher area under the curve for the diagnosis of MS, except for boys with 17‐19 years old, for whom the waist/stature ratio exhibited better performance. For diagnosing HW, waist perimeter also showed higher area under the curve, except for boys in initial and final phases, in which the waist/stature ratio obtained larger area under the curve. The central/peripheral skinfolds had the lowest area under the curve for the presence of both MS and HW phenotype.
ConclusionsThe waist perimeter and the waist/stature showed a better performance to identify MS and HW in both genders and in all three phases of adolescence.
As doenças crônicas não transmissíveis são consideradas a principal causa de mortalidade nos países desenvolvidos e em desenvolvimento1 e estão aumentando rapidamente, em especial nos países em desenvolvimento.2 No Brasil, essas doenças correspondem a cerca de 70% da mortalidade.3
A síndrome metabólica (SM) é definida como um conjunto de alterações que incluem obesidade central, dislipidemia, hiperglicemia, resistência à insulina e hipertensão arterial.4 O fenótipo cintura hipertrigliceridêmica (CH), um dos componentes da SM, é identificado pela presença simultânea de perímetro da cintura e concentrações de triglicerídeos elevados.5 Ambos os fenótipos são importantes preditores das doenças cardiovasculares,2 contudo a CH é considerada um método mais simples para triagem de indivíduos com risco cardiometabólico aumentado.6
A prevalência de SM e CH vem sendo amplamente investigada em adultos,4,5,7–10 mas estudos com crianças e adolescentes são limitados.6,11,12 Pesquisas conduzidas no Irã com crianças e adolescentes de 6‐18 anos relataram prevalência de 14% e 8,52% de SM e CH, respectivamente.6,13 Esmaillzadeh et al.11 observaram prevalência de SM de 10,1% em adolescentes de 10‐19 anos (10,3% nos meninos e 9,9% nas meninas) e 6,5% de CH (7,3% nos meninos e 5,6% nas meninas). Recentemente, encontrou‐se prevalência de CH de 7,2% em adolescentes de 11‐17 anos da cidade de Salvador (BA).12
Diante da escassez de dados sobre o fenótipo CH na população adolescente e das evidências de que a prevalência de SM em pediatria vem aumentando,2 com tendência a persistir na vida adulta,14 torna‐se necessário estabelecer qual o melhor indicador de distribuição da gordura corporal que permite identificar precocemente adolescentes em risco para estabelecer intervenções e melhorar a saúde cardiovascular futura.15 Diante do exposto, o objetivo deste estudo foi determinar a prevalência de SM e do fenótipo CH em uma amostra representativa de adolescentes, bem como estabelecer qual indicador antropométrico melhor identifica a SM e o fenótipo CH, de acordo com gênero e fase da adolescência.
MétodoEstudo transversal, que compõe uma investigação mais ampla feita com adolescentes de 10‐19 anos de ambos os sexos da população rural e urbana de escolas públicas e privadas (do 5° ano do ensino fundamental ao 3° ano do médio) do município de Viçosa (MG). O tamanho amostral foi calculado com o programa Epi Info, versão 6,04. Considerando‐se a população na faixa etária de 10‐19 anos e 11 meses residente no município no último censo, um total de 11.898,16 a prevalência esperada de 50%, visto que o estudo considera como desfecho múltiplos fatores de risco cardiovasculares, 5% de variabilidade aceitável, 99% de nível de confiança e acréscimo de 20% para controle de possíveis fatores de confusão, o cálculo amostral resultou em 796 adolescentes. O valor de 50% para a prevalência foi escolhido, pois, quando esse dado não é conhecido, o método mais conservador e que potencializa o tamanho da amostra é adotar a estimativa de 50%.
Os critérios de inclusão foram: não fazer uso regular de medicamentos que alterassem a glicemia, a insulinemia, o metabolismo lipídico e/ou os níveis pressóricos; não participar de programa de redução e controle de peso; não fazer uso regular de diuréticos/laxantes e não estar grávida ou já ter engravidado. Os adolescentes que atendiam aos critérios de inclusão e que fizeram parte do estudo foram subdivididos por sexo e agrupados por intervalos etários (10‐13 anos: fase inicial; 14‐16 anos: fase intermediária; 17‐19 anos: fase final).17
Os alunos foram selecionados entre aqueles que assinaram o termo de consentimento livre e esclarecido, por meio de sorteio aleatório simples, que respeitou a proporção de alunos de cada idade, em cada escola. Quando um participante recusou‐se a participar em qualquer uma das fases de estudo ou desistiu, outro estudante foi selecionado para substituí‐lo. Todos os participantes e seus pais/ responsáveis, no caso de voluntários menores de 18 anos, assinaram o termo de consentimento livre e esclarecido, de acordo com a Declaração de Helsinque e com as normas da Resolução n° 466/2012 do Conselho Nacional de Saúde. O estudo foi aprovado pelo Comitê de Ética em Pesquisas com Seres Humanos da Universidade Federal de Viçosa (Of. Ref. n° 0140/2010).
A coleta de dados ocorreu entre 7h e 9h30 na Divisão de Saúde da Universidade Federal de Viçosa, por profissionais qualificados e previamente treinados.
O peso e altura foram aferidos mediante técnicas internacionais padronizadas com os adolescentes descalços e usando roupas leves18 em balança digital eletrônica (LC 200PP, Marte®, São Paulo, Brasil) e estadiômetro portátil (Alturexata®, Belo Horizonte, Brasil). O índice de massa corporal foi calculado por meio da razão entre o peso corporal (kg) e o quadrado da estatura (m2).
O perímetro da cintura foi aferido no ponto médio entre a margem inferior da última costela e a crista ilíaca, no plano horizontal e no fim de uma expiração normal. O perímetro do quadril foi verificado na região glútea sobre roupas leves, sendo circundado o maior perímetro horizontal entre a cintura e os joelhos.18 Todas as aferições foram feitas em duplicata por um único avaliador treinado, aceitaram‐se variações de 0,5 cm e foi calculada a média entre os valores, com uma fita métrica com extensão de 2 metros, flexível e inelástica (Cardiomed®, São Luiz, MA, Brasil). A seguir, calculou‐se a relação cintura estatura e a relação cintura quadril pela divisão do perímetro da cintura (cm) pela estatura (cm) e pelo perímetro do quadril (cm), respectivamente.
As pregas cutâneas, subescapular, suprailíaca, tricipital e bicipital foram verificadas no lado direito do corpo e todas as medidas foram tomadas três vezes de forma não consecutiva (usou‐se a média) por um único avaliador treinado com o equipamento Lange Skinfold Caliper (Cambridge Scientific, Cambridge, MA, EUA).18 Considerou‐se prega cutânea periférica a soma das pregas tricipital e bicipital e como central ou troncular o somatório da subescapular e suprailíaca, a partir das quais se calculou a relação prega cutânea central ou troncular/prega cutânea periférica.19
As amostras de sangue foram coletadas, após jejum de 12 horas, em veia antecubital e o soro foi separado por centrifugação a 2.225×g por 15 minutos, à temperatura ambiente (2‐3 Sigma, Sigma Laborzentrifuzen, Osterodeam Harz, Germany). A glicemia foi medida pelo método glicose oxidase com o equipamento Cobas Mira Plus (Roche Diagnostics, GmbH, Montclair, NJ, USA). As concentrações de HDL e triglicerídeos foram dosadas pelo método colorimétrico enzimático, com automação pelo equipamento Cobas Mira Plus (Roche Diagnostics, GmbH, Montclair, NJ, USA) (Roche Corp.).
A pressão arterial sistólica e diastólica foi aferida após repouso mínimo de 15 minutos, com monitor de pressão sanguínea de insuflação automática (Omron® Model HEM‐741 CINT, Quioto, KYT, Japão) e manguito de tamanho adequado ao perímetro do braço. A medida foi repetida duas vezes no braço com maior valor de pressão, com intervalo de 1 minuto entre elas, e foi usada a média das duas últimas medidas.20
Para o diagnóstico da SM empregou‐se a definição proposta por de Ferranti et al.,14 a qual se baseia na presença de três dos seguintes critérios: perímetro da cintura >75 percentil segundo sexo e idade da própria população; HDL<50mg/dL (exceto para meninos de 15‐19 anos, nos quais se usou <45mg/dL); triglicerídeos ≥100mg/dL; pressão arterial sistólica e ou diastólica >90 percentil por sexo, idade e altura; e glicemia de jejum ≥100mg/dL. Deve‐se notar que o critério de Ferranti et al. propõe glicemia ≥110, mas se optou por usar a recomendação mais recente da American Diabetes Association.21
O fenótipo CH foi definido com o uso dos pontos de corte para definição da SM. A presença simultânea do perímetro da cintura aumentado (≥75 percentil por idade e sexo da própria população estudada) e de concentrações séricas elevadas de triglicerídeos (≥100mg/dL) foi considerada CH.22
O banco de dados foi elaborado com dupla digitação no Microsoft Office Excel 2007 e para as análises estatísticas foram usados os programas SPSS for Windows, versão 17.0, e MedCalc versão 9.3. O teste de Kolmogorov‐Smirnov, métodos gráficos e o coeficiente de assimetria (Skewness > 1; assimétrico) foram usados para avaliar as variáveis quanto à normalidade. As variáveis antropométricas, clínicas e metabólicas foram comparadas entre as fases por Anova seguida do post hoc de Tukey ou pelo teste de Kruskall‐Wallis seguido por Mann‐Whitney com correção de Bonferroni para variáveis com distribuição paramétrica e não paramétrica, respectivamente. Para as comparações entre os sexos usou‐se o teste t de Student ou o de Mann‐Whitney para variáveis com distribuição paramétrica e não paramétrica, respectivamente. A ocorrência da SM e CH, bem como de seus componentes individuais, foi comparada entre as fases e entre os sexos por meio do teste do qui‐ quadrado de Pearson. Adicionalmente, foram elaboradas curvas receiver operator characteristic e calculou‐se a área abaixo da curva, a fim de identificar o melhor indicador antropométrico associado à SM e ao fenótipo CH.
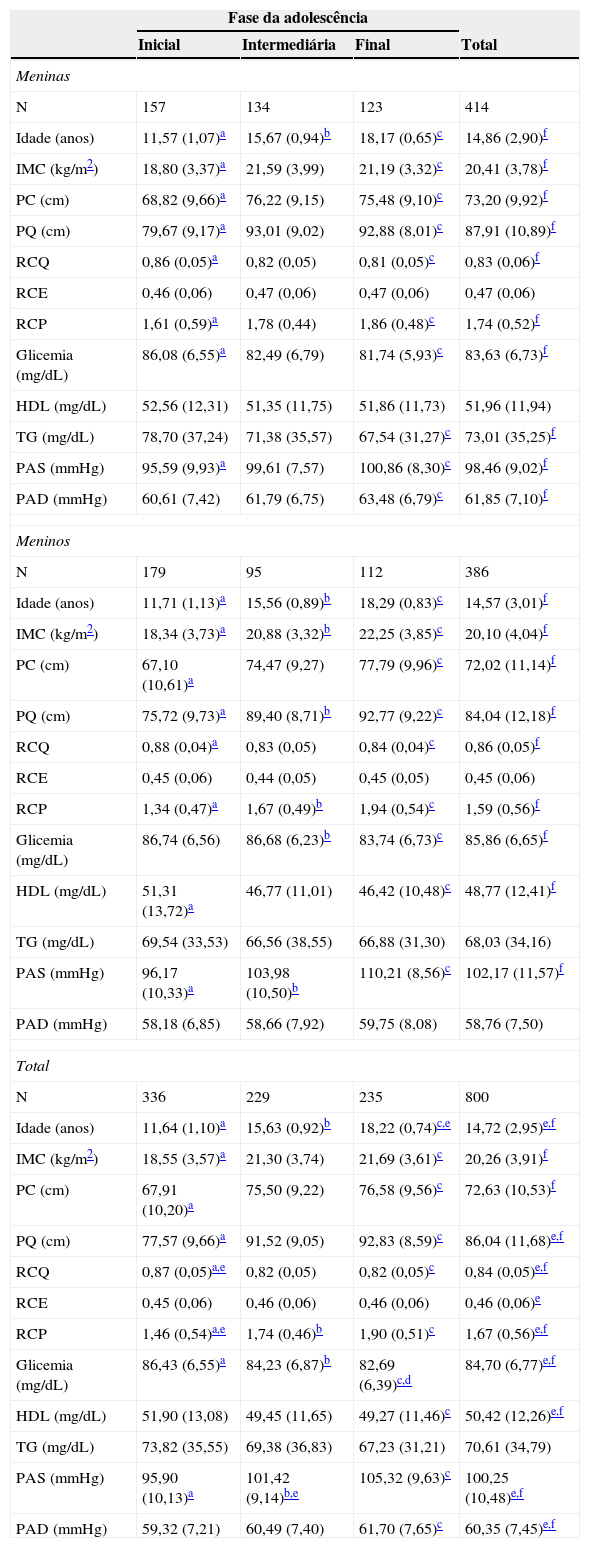
ResultadosForam contatados, em 2010, todos os adolescentes estudantes das escolas públicas e particulares, tanto da zona urbana quanto na rural, de Viçosa (MG). Em 2010, o município tinha 27 escolas e todas participaram do estudo. Todos os adolescentes que aceitaram participar e entregaram o termo de consentimento livre e esclarecido foram incluídos no presente estudo: 828. Desses, 28 foram excluídos pelos seguintes motivos: uso de medicamento anticonvulsivante (um); história de hipotireoidismo (um); jejum inadequado (dois); impossibilidade técnica na coleta de sangue (um); uso de antidepressivo (fluoxetina) (nove); história de mielomenigoncele (um); presença de câncer no nariz (um); uso de hormônio do crescimento (um); alterações hormonais (três); uso de suplementos e/ou vitaminas (cinco); gravidez anterior (dois); pé inchado e com gesso (um). Assim, os adolescentes estudados incluíram 414 meninas e 383 meninos com idade média de 14,72 (DP=2,95). As características antropométricas, clínicas e metabólicas são apresentadas na tabela 1.
Características dos adolescentes de acordo com gênero e fase de idade
| Fase da adolescência | ||||
|---|---|---|---|---|
| Inicial | Intermediária | Final | Total | |
| Meninas | ||||
| N | 157 | 134 | 123 | 414 |
| Idade (anos) | 11,57 (1,07)a | 15,67 (0,94)b | 18,17 (0,65)c | 14,86 (2,90)f |
| IMC (kg/m2) | 18,80 (3,37)a | 21,59 (3,99) | 21,19 (3,32)c | 20,41 (3,78)f |
| PC (cm) | 68,82 (9,66)a | 76,22 (9,15) | 75,48 (9,10)c | 73,20 (9,92)f |
| PQ (cm) | 79,67 (9,17)a | 93,01 (9,02) | 92,88 (8,01)c | 87,91 (10,89)f |
| RCQ | 0,86 (0,05)a | 0,82 (0,05) | 0,81 (0,05)c | 0,83 (0,06)f |
| RCE | 0,46 (0,06) | 0,47 (0,06) | 0,47 (0,06) | 0,47 (0,06) |
| RCP | 1,61 (0,59)a | 1,78 (0,44) | 1,86 (0,48)c | 1,74 (0,52)f |
| Glicemia (mg/dL) | 86,08 (6,55)a | 82,49 (6,79) | 81,74 (5,93)c | 83,63 (6,73)f |
| HDL (mg/dL) | 52,56 (12,31) | 51,35 (11,75) | 51,86 (11,73) | 51,96 (11,94) |
| TG (mg/dL) | 78,70 (37,24) | 71,38 (35,57) | 67,54 (31,27)c | 73,01 (35,25)f |
| PAS (mmHg) | 95,59 (9,93)a | 99,61 (7,57) | 100,86 (8,30)c | 98,46 (9,02)f |
| PAD (mmHg) | 60,61 (7,42) | 61,79 (6,75) | 63,48 (6,79)c | 61,85 (7,10)f |
| Meninos | ||||
| N | 179 | 95 | 112 | 386 |
| Idade (anos) | 11,71 (1,13)a | 15,56 (0,89)b | 18,29 (0,83)c | 14,57 (3,01)f |
| IMC (kg/m2) | 18,34 (3,73)a | 20,88 (3,32)b | 22,25 (3,85)c | 20,10 (4,04)f |
| PC (cm) | 67,10 (10,61)a | 74,47 (9,27) | 77,79 (9,96)c | 72,02 (11,14)f |
| PQ (cm) | 75,72 (9,73)a | 89,40 (8,71)b | 92,77 (9,22)c | 84,04 (12,18)f |
| RCQ | 0,88 (0,04)a | 0,83 (0,05) | 0,84 (0,04)c | 0,86 (0,05)f |
| RCE | 0,45 (0,06) | 0,44 (0,05) | 0,45 (0,05) | 0,45 (0,06) |
| RCP | 1,34 (0,47)a | 1,67 (0,49)b | 1,94 (0,54)c | 1,59 (0,56)f |
| Glicemia (mg/dL) | 86,74 (6,56) | 86,68 (6,23)b | 83,74 (6,73)c | 85,86 (6,65)f |
| HDL (mg/dL) | 51,31 (13,72)a | 46,77 (11,01) | 46,42 (10,48)c | 48,77 (12,41)f |
| TG (mg/dL) | 69,54 (33,53) | 66,56 (38,55) | 66,88 (31,30) | 68,03 (34,16) |
| PAS (mmHg) | 96,17 (10,33)a | 103,98 (10,50)b | 110,21 (8,56)c | 102,17 (11,57)f |
| PAD (mmHg) | 58,18 (6,85) | 58,66 (7,92) | 59,75 (8,08) | 58,76 (7,50) |
| Total | ||||
| N | 336 | 229 | 235 | 800 |
| Idade (anos) | 11,64 (1,10)a | 15,63 (0,92)b | 18,22 (0,74)c,e | 14,72 (2,95)e,f |
| IMC (kg/m2) | 18,55 (3,57)a | 21,30 (3,74) | 21,69 (3,61)c | 20,26 (3,91)f |
| PC (cm) | 67,91 (10,20)a | 75,50 (9,22) | 76,58 (9,56)c | 72,63 (10,53)f |
| PQ (cm) | 77,57 (9,66)a | 91,52 (9,05) | 92,83 (8,59)c | 86,04 (11,68)e,f |
| RCQ | 0,87 (0,05)a,e | 0,82 (0,05) | 0,82 (0,05)c | 0,84 (0,05)e,f |
| RCE | 0,45 (0,06) | 0,46 (0,06) | 0,46 (0,06) | 0,46 (0,06)e |
| RCP | 1,46 (0,54)a,e | 1,74 (0,46)b | 1,90 (0,51)c | 1,67 (0,56)e,f |
| Glicemia (mg/dL) | 86,43 (6,55)a | 84,23 (6,87)b | 82,69 (6,39)c,d | 84,70 (6,77)e,f |
| HDL (mg/dL) | 51,90 (13,08) | 49,45 (11,65) | 49,27 (11,46)c | 50,42 (12,26)e,f |
| TG (mg/dL) | 73,82 (35,55) | 69,38 (36,83) | 67,23 (31,21) | 70,61 (34,79) |
| PAS (mmHg) | 95,90 (10,13)a | 101,42 (9,14)b,e | 105,32 (9,63)c | 100,25 (10,48)e,f |
| PAD (mmHg) | 59,32 (7,21) | 60,49 (7,40) | 61,70 (7,65)c | 60,35 (7,45)e,f |
IMC, índice de massa corporal; PC, perímetro da cintura; PQ, perímetro do quadril; RCQ, relação cintura quadril; RCE, relação cintura estatura; RCP, relação pregas centrais/periféricas; HDL, lipoproteína de alta densidade; TG, triglicerídeos; PAS, pressão arterial sistólica; PAD, pressão arterial diastólica.
Dados apresentados em média (desvio padrão).
As meninas tiveram maiores valores de perímetro do quadril, relação cintura/estatura, relação pregas cutâneas centrais/periféricas, HDL e pressão arterial diastólica comparadas com os meninos. Esses apresentaram maiores valores de glicemia e pressão arterial sistólica. Os parâmetros índice de massa corporal, perímetro da cintura, triglicerídeos e idade não diferiram entre os sexos. Algumas variáveis não se modificaram com a idade, sendo relação cintura/estatura e HDL nas meninas e relação cintura/estatura, triglicerídeos e pressão arterial diastólica nos meninos. Comparando as fases da adolescência, observa‐se que no sexo feminino a intermediária e final não diferem entre si (fase inicial < fase intermediária = fase final), enquanto que de forma geral nos meninos os parâmetros diferem entre as fases (fase inicial < fase intermediária < fase final, exceto glicemia, que diminuiu da fase intermediária para a final).
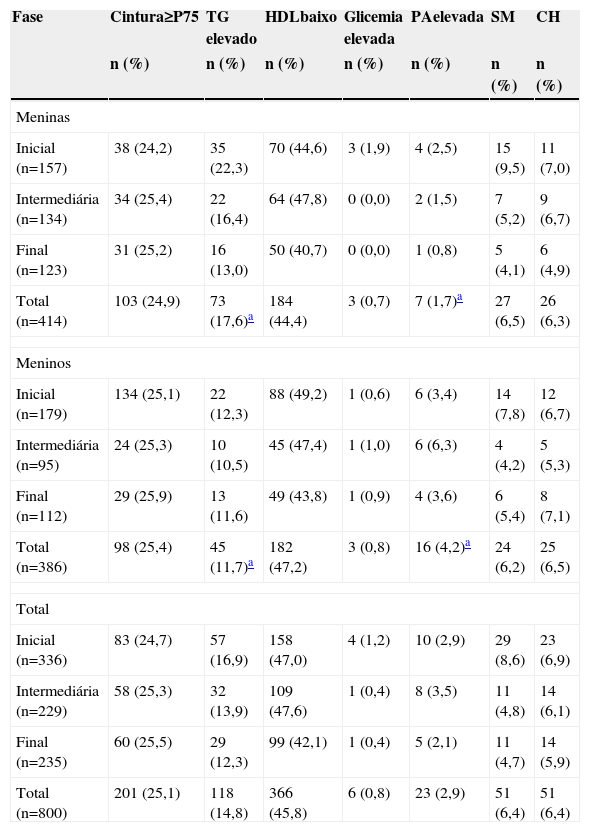
A tabela 2 indica a presença da SM, do fenótipo CH e dos seus componentes, de acordo com o gênero e a fase da adolescência. A prevalência de SM foi idêntica à de CH (6,4%), sem diferenças entre os gêneros e entre as fases da adolescência. Dentre os componentes da síndrome, o mais prevalente foi baixo HDL. Em relação ao fenótipo, a prevalência de obesidade abdominal foi superior à de hipertrigliceridemia. A prevalência de pressão arterial elevada foi maior nos meninos (p<0,01), enquanto que a hipertrigliceridemia foi mais prevalente nas meninas (p<0,01).
Prevalência de síndrome metabólica, cintura hipertrigliceridêmica e componentes individuais, de acordo com gênero e fase da adolescência
| Fase | Cintura≥P75 | TG elevado | HDLbaixo | Glicemia elevada | PAelevada | SM | CH |
|---|---|---|---|---|---|---|---|
| n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | n (%) | |
| Meninas | |||||||
| Inicial (n=157) | 38 (24,2) | 35 (22,3) | 70 (44,6) | 3 (1,9) | 4 (2,5) | 15 (9,5) | 11 (7,0) |
| Intermediária (n=134) | 34 (25,4) | 22 (16,4) | 64 (47,8) | 0 (0,0) | 2 (1,5) | 7 (5,2) | 9 (6,7) |
| Final (n=123) | 31 (25,2) | 16 (13,0) | 50 (40,7) | 0 (0,0) | 1 (0,8) | 5 (4,1) | 6 (4,9) |
| Total (n=414) | 103 (24,9) | 73 (17,6)a | 184 (44,4) | 3 (0,7) | 7 (1,7)a | 27 (6,5) | 26 (6,3) |
| Meninos | |||||||
| Inicial (n=179) | 134 (25,1) | 22 (12,3) | 88 (49,2) | 1 (0,6) | 6 (3,4) | 14 (7,8) | 12 (6,7) |
| Intermediária (n=95) | 24 (25,3) | 10 (10,5) | 45 (47,4) | 1 (1,0) | 6 (6,3) | 4 (4,2) | 5 (5,3) |
| Final (n=112) | 29 (25,9) | 13 (11,6) | 49 (43,8) | 1 (0,9) | 4 (3,6) | 6 (5,4) | 8 (7,1) |
| Total (n=386) | 98 (25,4) | 45 (11,7)a | 182 (47,2) | 3 (0,8) | 16 (4,2)a | 24 (6,2) | 25 (6,5) |
| Total | |||||||
| Inicial (n=336) | 83 (24,7) | 57 (16,9) | 158 (47,0) | 4 (1,2) | 10 (2,9) | 29 (8,6) | 23 (6,9) |
| Intermediária (n=229) | 58 (25,3) | 32 (13,9) | 109 (47,6) | 1 (0,4) | 8 (3,5) | 11 (4,8) | 14 (6,1) |
| Final (n=235) | 60 (25,5) | 29 (12,3) | 99 (42,1) | 1 (0,4) | 5 (2,1) | 11 (4,7) | 14 (5,9) |
| Total (n=800) | 201 (25,1) | 118 (14,8) | 366 (45,8) | 6 (0,8) | 23 (2,9) | 51 (6,4) | 51 (6,4) |
SM, síndrome metabólica; CH, cintura hipertrigliceridêmica; P, percentil; TG, triglicerídeos; HDL, lipoproteína de alta densidade; PA, pressão arterial.
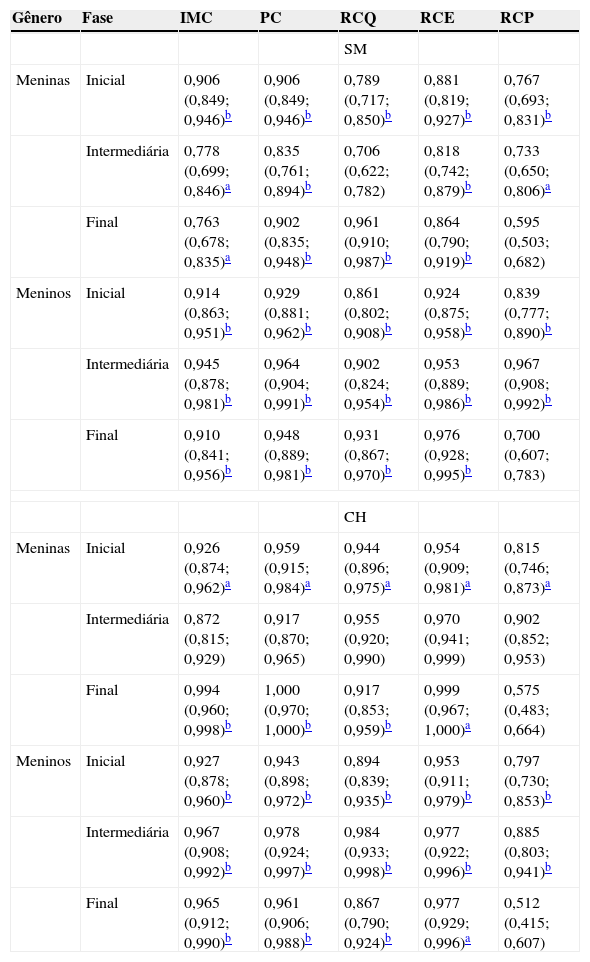
Quando se avaliou qual indicador antropométrico exibiu melhor desempenho na predição da SM e CH, o perímetro da cintura apresentou os maiores valores absolutos de área abaixo da curva em todas as análises, exceto para meninos nas fases inicial e final no diagnóstico da CH e para meninos na fase final no diagnóstico da SM nos quais a relação cintura/estatura apresentou maior valor absoluto de área abaixo da curva. Por sua vez, a relação pregas cutâneas centrais/periféricas obteve as menores áreas abaixo da curva para a presença tanto de SM quanto da CH (tabela 3). As áreas abaixo das curvas foram calculadas mediante as curvas receiver operator characteristic (figs. 1 e 2).
Áreas abaixo da curva (95% IC) dos indicadores antropométricos como preditores da síndrome metabólica e do fenótipo cintura hipertrigliceridêmica
| Gênero | Fase | IMC | PC | RCQ | RCE | RCP |
|---|---|---|---|---|---|---|
| SM | ||||||
| Meninas | Inicial | 0,906 (0,849; 0,946)b | 0,906 (0,849; 0,946)b | 0,789 (0,717; 0,850)b | 0,881 (0,819; 0,927)b | 0,767 (0,693; 0,831)b |
| Intermediária | 0,778 (0,699; 0,846)a | 0,835 (0,761; 0,894)b | 0,706 (0,622; 0,782) | 0,818 (0,742; 0,879)b | 0,733 (0,650; 0,806)a | |
| Final | 0,763 (0,678; 0,835)a | 0,902 (0,835; 0,948)b | 0,961 (0,910; 0,987)b | 0,864 (0,790; 0,919)b | 0,595 (0,503; 0,682) | |
| Meninos | Inicial | 0,914 (0,863; 0,951)b | 0,929 (0,881; 0,962)b | 0,861 (0,802; 0,908)b | 0,924 (0,875; 0,958)b | 0,839 (0,777; 0,890)b |
| Intermediária | 0,945 (0,878; 0,981)b | 0,964 (0,904; 0,991)b | 0,902 (0,824; 0,954)b | 0,953 (0,889; 0,986)b | 0,967 (0,908; 0,992)b | |
| Final | 0,910 (0,841; 0,956)b | 0,948 (0,889; 0,981)b | 0,931 (0,867; 0,970)b | 0,976 (0,928; 0,995)b | 0,700 (0,607; 0,783) | |
| CH | ||||||
| Meninas | Inicial | 0,926 (0,874; 0,962)a | 0,959 (0,915; 0,984)a | 0,944 (0,896; 0,975)a | 0,954 (0,909; 0,981)a | 0,815 (0,746; 0,873)a |
| Intermediária | 0,872 (0,815; 0,929) | 0,917 (0,870; 0,965) | 0,955 (0,920; 0,990) | 0,970 (0,941; 0,999) | 0,902 (0,852; 0,953) | |
| Final | 0,994 (0,960; 0,998)b | 1,000 (0,970; 1,000)b | 0,917 (0,853; 0,959)b | 0,999 (0,967; 1,000)a | 0,575 (0,483; 0,664) | |
| Meninos | Inicial | 0,927 (0,878; 0,960)b | 0,943 (0,898; 0,972)b | 0,894 (0,839; 0,935)b | 0,953 (0,911; 0,979)b | 0,797 (0,730; 0,853)b |
| Intermediária | 0,967 (0,908; 0,992)b | 0,978 (0,924; 0,997)b | 0,984 (0,933; 0,998)b | 0,977 (0,922; 0,996)b | 0,885 (0,803; 0,941)b | |
| Final | 0,965 (0,912; 0,990)b | 0,961 (0,906; 0,988)b | 0,867 (0,790; 0,924)b | 0,977 (0,929; 0,996)a | 0,512 (0,415; 0,607) | |
IC, intervalo de confiança; SM, síndrome metabólica; CH, cintura hipertrigliceridêmica; IMC, índice de massa corporal; PC, perímetro da cintura; RCQ, relação cintura quadril; RCE, relação cintura estatura; RCP, relação pregas centrais/periféricas.
Curvas receiver operator characteristic (ROC) para a síndrome metabólica de acordo com gênero e fase da adolescência. IMC, índice de massa corporal (kg/m2); PC, perímetro da cintura (cm); RCQ, relação cintura quadril; RCE, relação cintura estatura; RCP, relação pregas centrais/periféricas.
Curvas receiver operator characteristic (ROC) para o fenótipo cintura hipertrigliceridêmica de acordo com gênero e fase da adolescência. IMC, índice de massa corporal (kg/m2); PC, perímetro da cintura (cm); RCQ, relação cintura/quadril; RCE, relação cintura/estatura; RCP, relação pregas centrais/periféricas.
Foi identificada prevalência de 6,4% para SM e fenótipo CH, sem diferenças entre os gêneros e as fases da adolescência.
A SM é um problema de saúde no grupo pediátrico nos países desenvolvidos e especialmente naqueles em desenvolvimento,2 contudo ainda não existe um critério formal e unificado para o seu diagnóstico em crianças e adolescentes e observa‐se o emprego de diversos critérios para essa definição em diferentes populações, o que dificulta a comparação das prevalências.13 A prevalência da SM nos Estados Unidos, pelo mesmo critério usado no presente estudo, foi estimada em 12,9% nos mexicano‐americanos, 10,9% entre não hispânicos brancos e 2,5% nos não hispânicos negros.14 Kelishadi et al.13 observaram prevalência de 14% (13% nas meninas e 14% nos meninos) de SM por critério análogo ao do presente estudo. No Brasil, estudo feito com crianças e adolescentes em Salvador (BA) observou prevalência de 6,6% (8,5% nas meninas e 4,7% nos meninos).23
A prevalência do fenótipo CH neste estudo (6,4%) foi idêntica àquela observada em estudo feito com adolescentes de 10‐19 anos em Teerã (Irã) (6,4%)11 e semelhante àquela identificada em crianças e adolescentes de 6‐18 anos do Irã (8,5%),6 em adolescentes de 10‐19 anos do Reino Unido (7,3%)22 e em adolescentes de 11‐17 anos em Salvador (BA) (7,2%).12 Contudo, em um estudo feito na Inglaterra24 com crianças e adolescentes obesos de 8‐18 anos, foi encontrada prevalência de 40% do fenótipo CH.22 As diferenças nas prevalências de SM e do fenótipo CH podem ser atribuídas às variações nos pontos de corte usados para classificar obesidade central, hipertrigliceridemia e outros componentes da síndrome entre os diferentes estudos e suas diferenças no estado nutricional, maturação sexual, etnia e hábitos de vida entre as regiões.12,25
Dentre os componentes da SM, as baixas concentrações de HDL foram o mais prevalente, o que pode ser explicado pelo processo de transição nutricional vivenciado no Brasil, onde o consumo alimentar tem sido principalmente constituído de alimentos de alto teor energético, e entre os adolescentes destaca‐se a frequência elevada de consumo de biscoitos recheados, linguiça, salsicha, mortadela, sanduíches e salgados. A prevalência de inadequação do consumo de gordura saturada foi superior a 80% e o consumo de biscoitos recheados que contêm gorduras hidrogenadas e ácidos graxos trans foi quatro vezes maior nesse grupo comparado com o dos adultos.26 A baixa prática de atividade física comumente observada nesse grupo etário é outro fator que possivelmente está contribuindo para a alta prevalência encontrada de baixas concentrações de HDL.27
Nesse sentido, embora a experiência de uso do fenótipo CH como uma ferramenta de diagnóstico de risco cardiometabólico em adolescentes ainda seja limitada, está documentado que, em adultos, esse fenótipo é capaz de identificar indivíduos com a tríade aterogênica, que compreende concentrações aumentadas de LDL pequenas e densas, apolipoproteína B e hiperinsulinemia e que têm alto risco para doenças cardiovasculares.5 Em estudo longitudinal com adultos do Teerã (n=6.834), observou‐se que o fenótipo CH aumentou o risco de incidência de doenças cardiovasculares.9 Os resultados desse estudo sugerem que essas duas medidas, PC e triglicerídeos, podem ser usadas em substituição aos indicadores de mais alto custo, para identificar adolescentes em risco de desordens metabólicas.
O segundo objetivo deste estudo foi verificar qual indicador antropométrico apresenta o melhor desempenho para identificar a ocorrência de SM e do fenótipo CH. As análises receiver operator characteristic indicaram que o perímetro da cintura e a relação cintura/estatura apresentaram maiores área abaixo da curva, tanto para identificar SM quanto CH. Estudos têm demonstrado que o perímetro da cintura em adolescentes constitui um bom indicador do conteúdo de gordura abdominal visceral28 e de fatores de risco cardiovasculares13,29,30 e pode ser um instrumento simples para identificar SM.13,23,25 Em um estudo feito com crianças e adolescentes (8‐18 anos), a relação cintura/estatura revelou‐se levemente melhor preditora da SM (área abaixo da curva = 0,83 [0,78‐0,89]), do que o perímetro da cintura (área abaixo da curva = 0,79 [0,73‐0,85]) e o índice de massa corporal (área abaixo da curva = 0,79 [0,72‐0,85]).23 Uma das vantagens da relação cintura/estatura é a possibilidade do uso do ponto de corte ≥ 0,5, aplicável a ambos os sexos e a todas as idades para identificar crianças e adolescentes em risco cardiovascular. 15 O índice de massa corporal, um indicador amplamente usado na rotina clínica pediátrica para a avaliação do estado nutricional, apresentou desempenho inferior ao perímetro da cintura e relação cintura/estatura, o que está de acordo com estudos prévios que apontaram a superioridade do perímetro da cintura isolado ou ajustado pela estatura.13,25,28 Além disso, o perímetro da cintura é menos afetado do que o índice de massa corporal pelo gênero, etnia e adiposidade total.28
O índice de menor desempenho foi a relação pregas cutâneas centrais/periféricas, o que pode ser explicado pelas pregas cutâneas estimarem a gordura subcutânea, e não a visceral, e essa última é a que está associada ao maior risco.31 Além disso, tem sido questionada a validade dos indicadores que se baseiam na relação entre medidas comparada às medidas isoladas para predizer risco cardiovascular.32
Esse estudo apresenta algumas limitações: a natureza transversal, que não permite avaliar os efeitos precisos do crescimento na medida de cintura, e a etnia, que constitui um dos fatores que interferem na distribuição de gordura corporal. Contudo, seus efeitos não foram avaliados, pois a classificação poderia ser imprecisa, devido à grande multietnicidade da população brasileira. Outro ponto limitante é que não foi possível avaliar o estágio de maturação sexual dos participantes e a puberdade interfere na distribuição da gordura corporal. Entretanto, buscou‐se controlar esses efeitos pelo emprego de pontos de corte de perímetro da cintura específicos por idade e sexo. Finalmente, características do estilo de vida (hábitos alimentares e de atividade física) poderiam afetar a relação entre a ocorrência de obesidade e outras desordens metabólicas associadas, de modo que devem ser incluídos em estudos futuros.
Pode‐se concluir que, de acordo com os resultados do presente estudo, o fenótipo CH constitui uma ferramenta simples para a substituição da SM na triagem de indivíduos em risco cardiometabólico. Em relação à capacidade dos indicadores antropométricos, o perímetro da cintura e a relação cintura/estatura apresentaram melhor desempenho para identificar SM e CH, dois fenótipos importantes de risco cardiometabólico, em ambos os sexos e em todas as fases da adolescência, o que enfatiza a importância de se incorporar a aferição destas medidas na rotina clínica pediátrica.
Essas observações levam à demanda de uma curva de referência nacional de perímetro da cintura para adolescentes, a qual poderia ser usada, tanto no âmbito clínico quanto na vigilância populacional, para identificar jovens assintomáticos mas com alto risco e que poderiam se beneficiar de uma intervenção precoce. Acredita‐se que tais avanços trariam um impacto na prevenção primária em saúde pública.
FinanciamentoConselho Nacional de Desenvolvimento Científico e Tecnológico (485986/2011‐6) e Fundação de Amparo à Pesquisa do Estado de Minas Gerais (APQ‐00872‐12).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.