Os prolactinomas gigantes são tumores raros, mais frequentes em homens, cujos critérios de diagnóstico incluem adenoma hipofisário com maior eixo igual ou superior a 4cm e extensão extrasselar, valor sérico de prolactina ≥1.000ng/mL e exclusão de secreção concomitante de hormona de crescimento (HC) ou corticotrofina (ACTH).
São descritos 3 casos de prolactinoma gigante, todos em doentes do sexo masculino com idades ao diagnóstico de 20, 41 e 75 anos.
O sintoma de apresentação foi cefaleia em 2 casos (uma associada a perda de visão do OE) e o terceiro caso foi um diagnóstico incidental. O doseamento de prolactina era superior a 4.700ng/mL em todos os casos, associado a um hipogonadismo hipogonadotrófico. O tamanho médio (maior eixo) da lesão inicial foi de 4,9cm (4‐6cm), sendo 2 dos casos submetidos a ressecção transesfenoidal ao diagnóstico. Dois doentes estão sob tratamento médico com bromocriptina e um medicado com cabergolina.
A bibliografia atual defende a opção inicial pelo tratamento médico com cabergolina, permanecendo a indicação cirúrgica para os casos resistentes, com sintomas compressivos graves ou doentes intolerantes aos agonistas dopaminérgicos.
Giant prolactinomas are rare tumors, more frequent in men and whose diagnostic criteria include pituitary adenomas with a diameter of 4cm or more, extrasellar extension, a serum prolactin ≥1,000ng/mL, and no concomitant growth hormone (GH) or corticotropin (ACTH) secretion.
We report on three cases of giant prolactinoma, all in male patients with an age at diagnosis of 20, 41 and 75 years.
The presenting symptom was headache in 2 cases (1 associated with vision loss of left eye) the third case was an incidental diagnosis. The prolactin assay was greater than 4700ng/ml in all cases associated with hypogonadotrophic hypogonadism. The average size (major axis) of the initial lesion was 4.9cm (4‐6cm), 2 cases underwent trans‐sphenoidal resection at diagnosis. Two patients are under medical treatment with bromocriptine and one was medicated with cabergoline.
The current literature supports the initial option for medical treatment with cabergoline, with surgical indication reserved for cases resistant to medical therapy, patients with severe compressive symptoms or intolerant to dopamine agonists.
Os prolactinomas são os tumores da hipófise mais frequentes, com uma prevalência de 3,5‐5 por 10.000 habitantes nos estudos epidemiológicos mais recentes1–4.
Os prolactinomas gigantes são raros, com uma frequência estimada em estudos retrospetivos de 0,5‐4,4% entre os tumores da hipófise5,6.
Embora a primeira série que relata prolactinomas gigantes seja de 1940, múltiplas definições e critérios de diagnóstico foram propostos. Em 2014, Maiter e Delgrange propuseram a seguinte definição de prolactinoma gigante1:
- i)
adenoma hipofisário com maior eixo de 4cm ou superior e extensão extrasselar;
- ii)
doseamento de prolactina ≥1.000ng/mL, com métodos modernos e estandardizados;
- iii)
exclusão de secreção concomitante de hormona de crescimento (HC) ou corticotrofina (ACTH).
Na maioria dos doentes existe uma associação entre os níveis de prolactina e o tamanho do tumor; contudo, esta associação nem sempre se verifica e pode ser causada pela composição predominantemente cística do prolactinoma com poucos lactotrofos viáveis ou pelo efeito de hook, que ocorre em cerca de 20% dos prolactinomas gigantes7. Este artefacto laboratorial ocorre quando os níveis elevados de prolactina interferem com a formação do complexo anticorpo‐antigénio‐anticorpo, o que determina um valor falsamente reduzido de prolactina7,8. Em caso de dúvida, o doseamento de prolactina deve ser repetido numa diluição de 1:100 de forma a evitar o efeito de hook7.
Descrição dos casosCaso 1Homem de 33 anos, com diagnóstico de prolactinoma gigante em 2001, após cefaleias persistentes. Na altura, com doseamento de prolactina superior a 4.700ng/mL e maior eixo da lesão com cerca de 6cm. Observado por neurocirurgia e submetido, nesse ano, a exérese transesfenoidal que foi incompleta e posteriormente medicado com bromocriptina 5mg/dia até 2009, quando teve alta da consulta de neurocirurgia de outra instituição hospitalar.
Enviado à consulta de endocrinologia pelo médico de família em 2011, por cefaleias persistentes e prolactina de 676ng/mL. Negava alterações visuais ou disfunção sexual, apresentava obesidade grau 3 e aspeto hipogonádico ao exame objetivo.
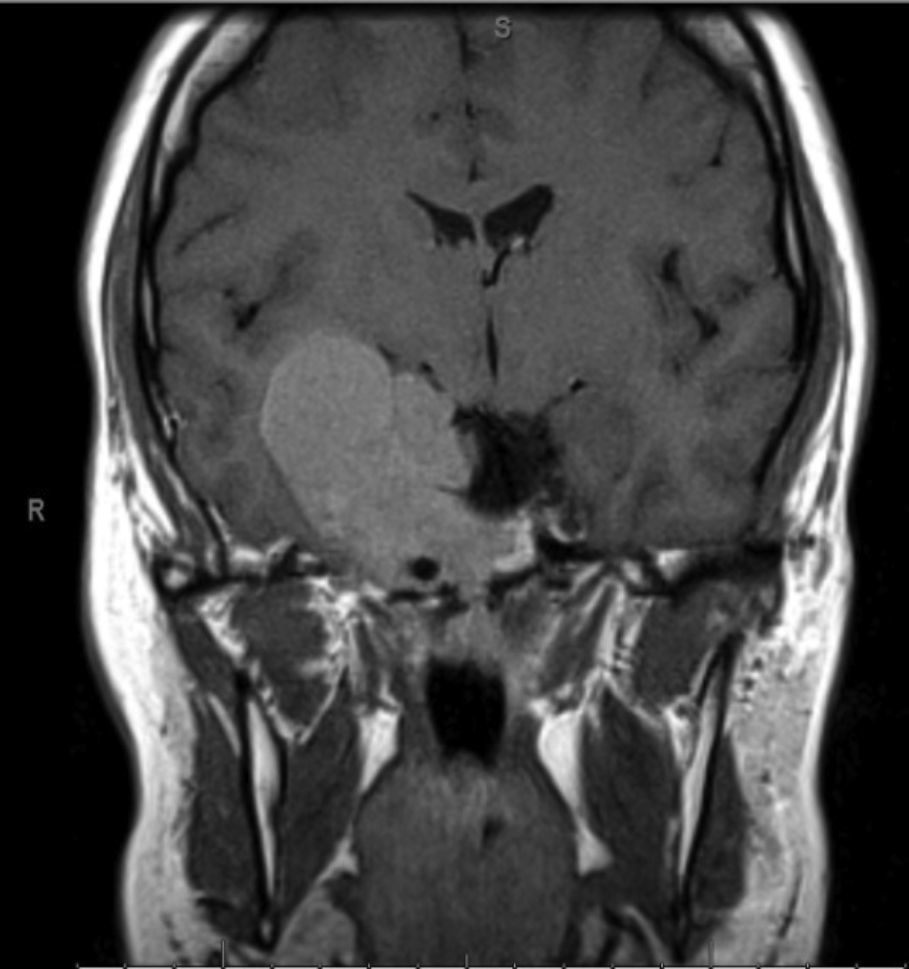
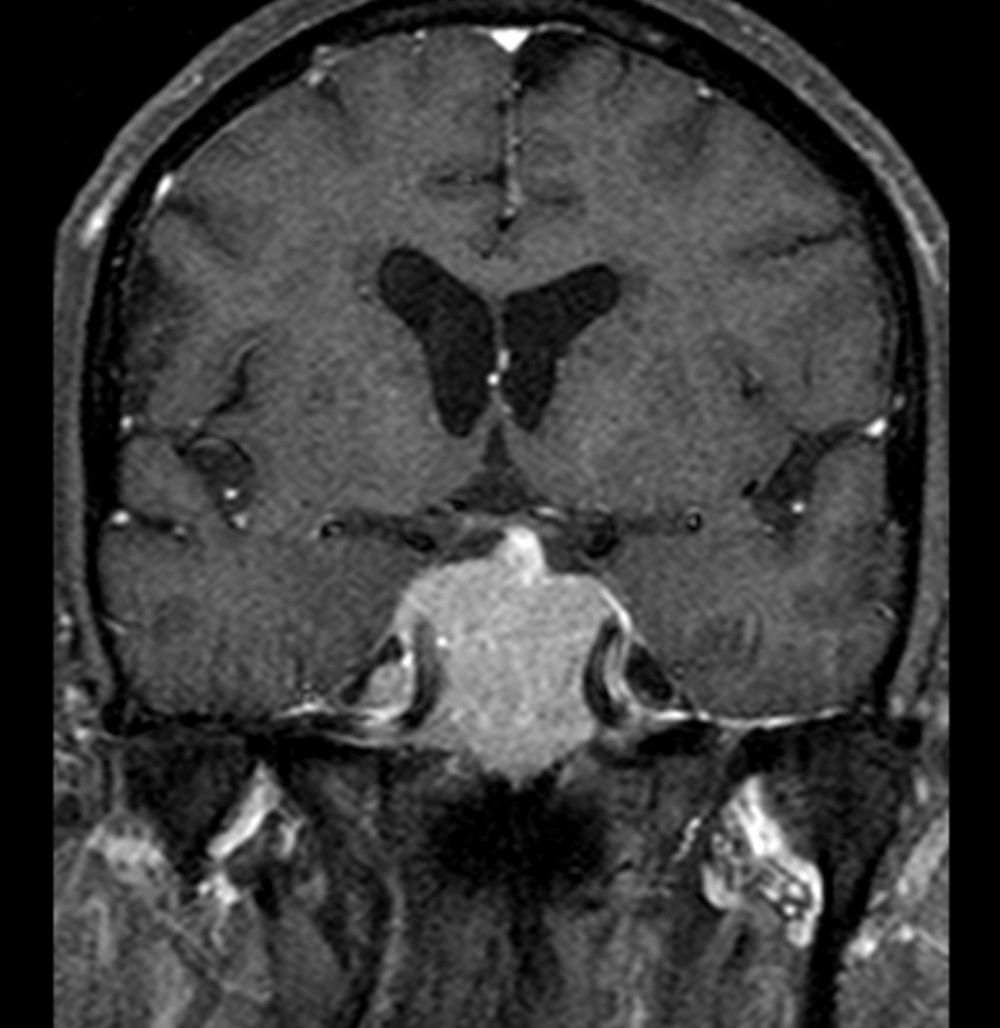
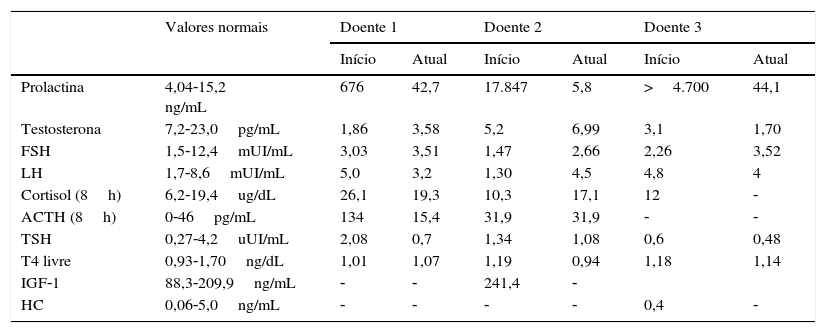
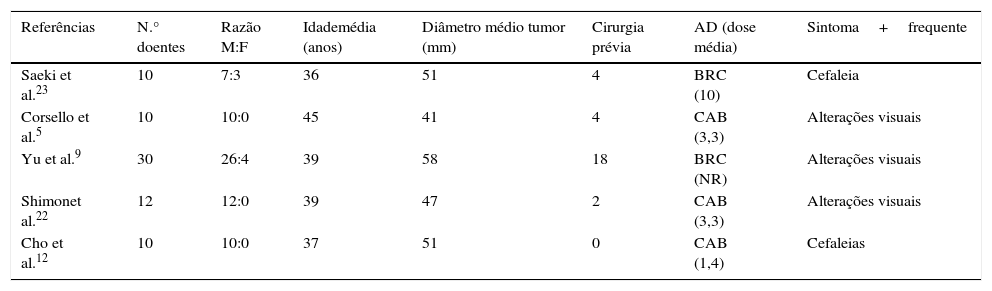
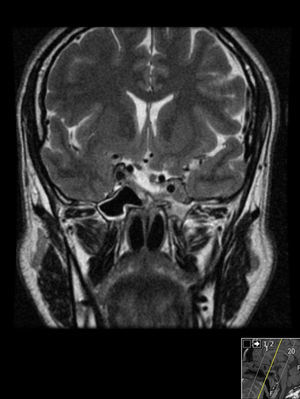
Foi feita reavaliação imagiológica com ressonância magnética (RMN) cerebral, que revelou volumosa lesão expansiva centrada na região parasselar direita com cerca de 6cm de maior diâmetro com invasão do seio cavernoso (fig. 1). Analiticamente com hipogonadismo hipogonadotrófico e suspeita de hipercortisolismo (tabela 1), que foi excluído por prova de frenação com baixa dose de dexametasona. Campos visuais de Goldmann e Humphrey sem perda campimétrica significativa.
Avaliação hormonal
| Valores normais | Doente 1 | Doente 2 | Doente 3 | ||||
|---|---|---|---|---|---|---|---|
| Início | Atual | Início | Atual | Início | Atual | ||
| Prolactina | 4,04‐15,2 ng/mL | 676 | 42,7 | 17.847 | 5,8 | >4.700 | 44,1 |
| Testosterona | 7,2‐23,0pg/mL | 1,86 | 3,58 | 5,2 | 6,99 | 3,1 | 1,70 |
| FSH | 1,5‐12,4mUI/mL | 3,03 | 3,51 | 1,47 | 2,66 | 2,26 | 3,52 |
| LH | 1,7‐8,6mUI/mL | 5,0 | 3,2 | 1,30 | 4,5 | 4,8 | 4 |
| Cortisol (8h) | 6,2‐19,4ug/dL | 26,1 | 19,3 | 10,3 | 17,1 | 12 | ‐ |
| ACTH (8h) | 0‐46pg/mL | 134 | 15,4 | 31,9 | 31,9 | ‐ | ‐ |
| TSH | 0,27‐4,2uUI/mL | 2,08 | 0,7 | 1,34 | 1,08 | 0,6 | 0,48 |
| T4 livre | 0,93‐1,70ng/dL | 1,01 | 1,07 | 1,19 | 0,94 | 1,18 | 1,14 |
| IGF‐1 | 88,3‐209,9ng/mL | ‐ | ‐ | 241,4 | ‐ | ||
| HC | 0,06‐5,0ng/mL | ‐ | ‐ | ‐ | ‐ | 0,4 | ‐ |
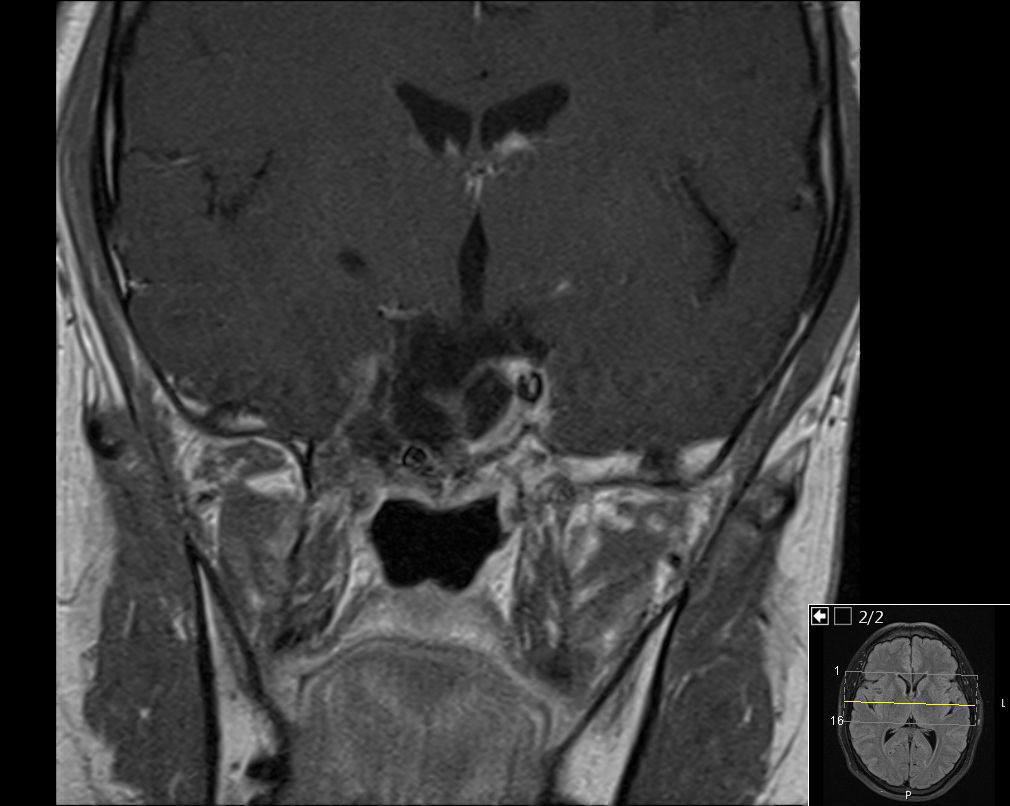
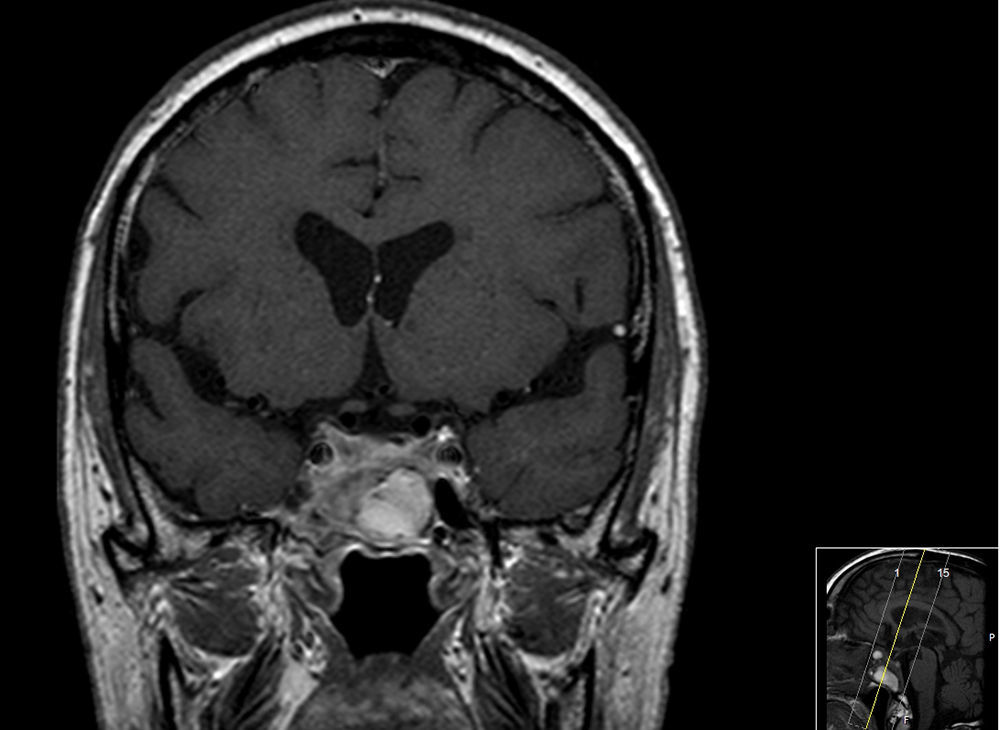
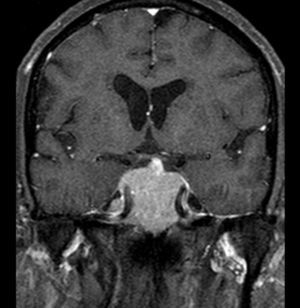
Reiniciou tratamento médico com bromocriptina com aumento progressivo da dose até 25mg/dia. Verificou‐se resposta parcial do tumor com diminuição acentuada do seu volume (fig. 2) após 23 meses de tratamento. Houve normalização da hiperprolactinemia (21,8ng/mL) e dos níveis de testosterona.
Involução das dimensões lesionais face à figura 1.
Na reavaliação de janeiro de 2015 deteta‐se novo agravamento imagiológico, descrito como ligeiro aumento do componente direito da lesão, mas bom controlo bioquímico. Foi aumentada dose de bromocriptina para 15mg/bid.
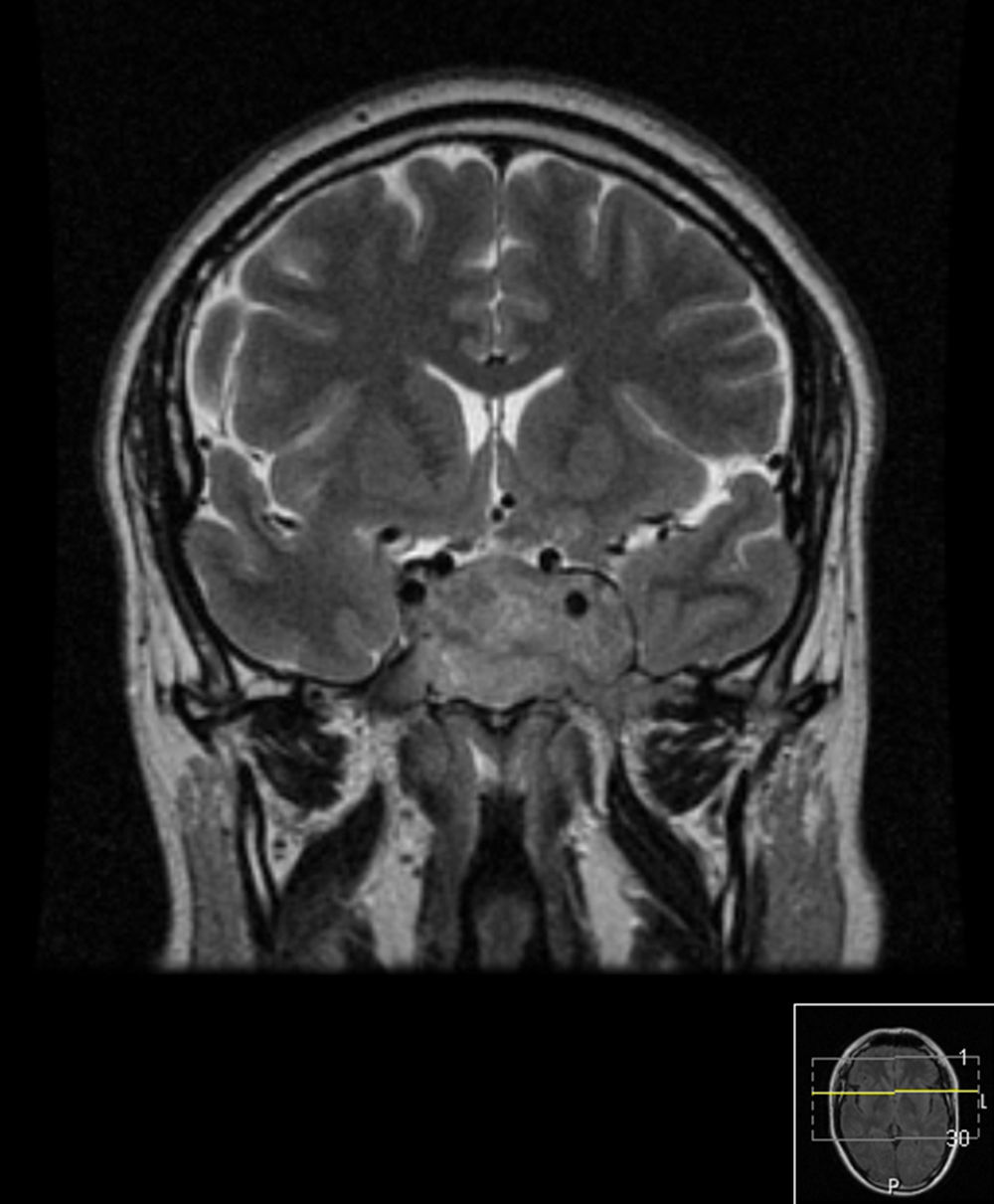
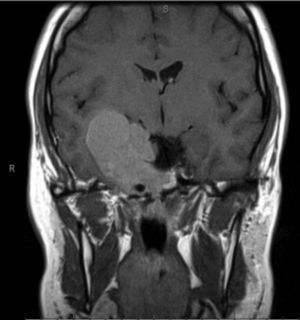
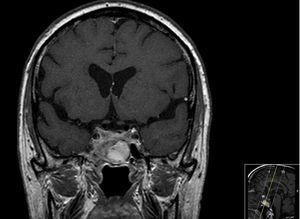
Caso 2Homem de 42 anos que, em outubro de 2013, recorreu ao serviço de urgência por perda progressiva da visão do olho esquerdo associada a cefaleias holocraneanas. Realizada TAC cerebral e posteriormente RMN cerebral que confirmou volumosa lesão expansiva extra‐axial de 4,8cm de maior eixo, com ponto de partida selar e invasão das câmaras esfenoidais e dos seios cavernosos, principalmente o esquerdo (fig. 3). O nível de prolactina era de 17.847ng/mL e não tinha alteração dos outros eixos hipofisários, exceto hipogonadismo hipogonadotrófico (tabela 1). Apresentava campos visuais de Humphrey com pontos de hipossensibilidade ínferotemporais do olho esquerdo. Foi submetido a exérese transesfenoidal da lesão em novembro de 2013, com exame anatomopatológico e imuno‐histoquímico compatível com prolactinoma. Posteriormente, foi enviado para a consulta de endocrinologia. Medicado inicialmente com cabergolina 0,25mg 2 vezes por semana, mas por intolerância (náuseas e tonturas) foi alterada terapêutica para bromocriptina 10mg/dia.
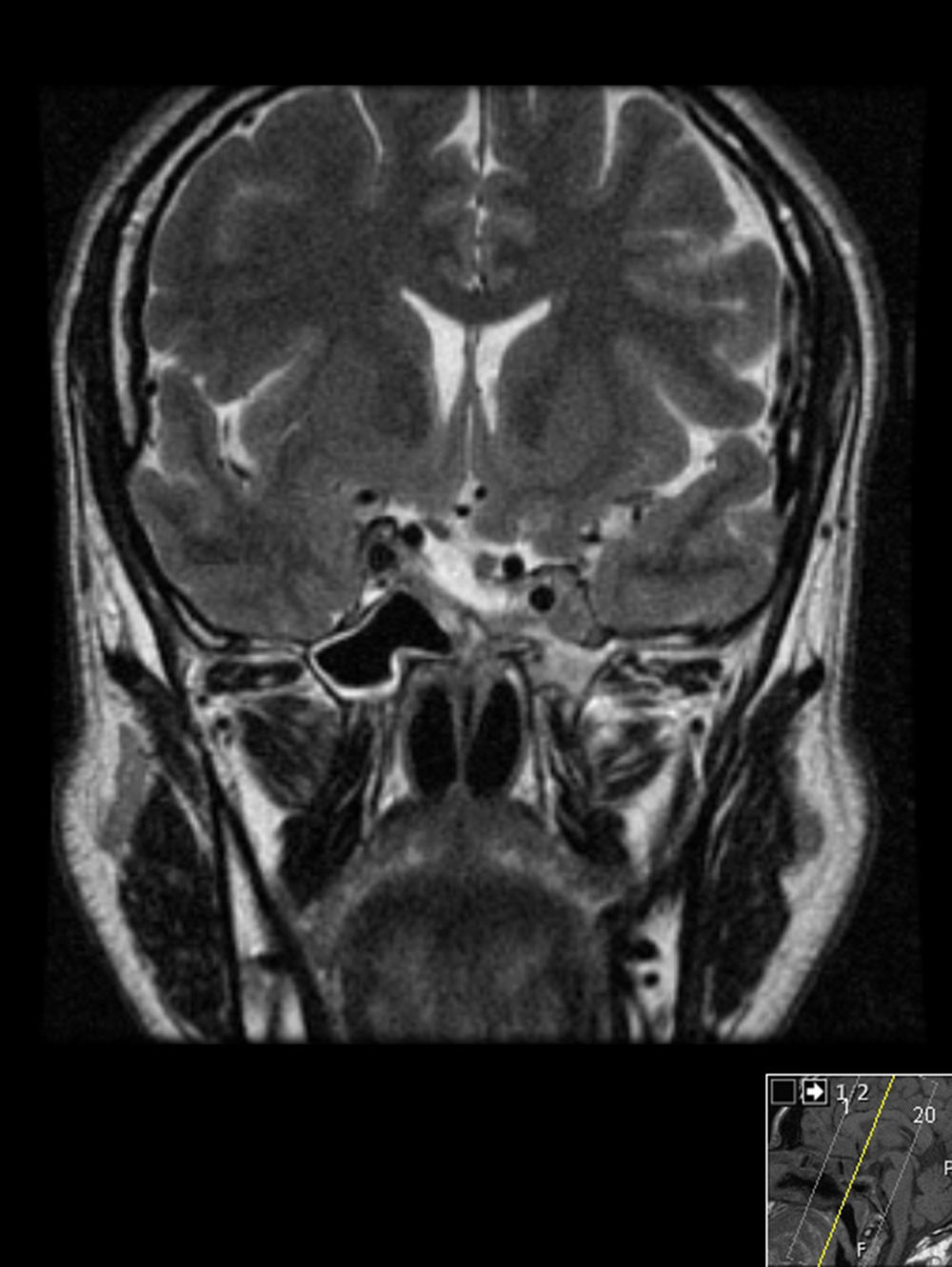
Última RMN cerebral de janeiro de 2015 com redução marcada das dimensões da lesão, persistindo um componente lesional com cerca de 1cm que envolve o seio cavernoso esquerdo (tabela 1). Prolactina de janeiro de 2015 igual a 5,8ng/mL e testosterona normal (fig. 4).
Redução marcada das dimensões da lesão neoformativa observada na figura 3.
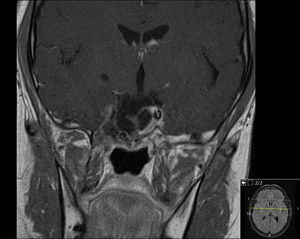
Homem de 76 anos com diagnóstico incidental de adenoma gigante em março de 2014, após realização de imagem cerebral por queda e traumatismo de crânio. Negava cefaleias, alterações da visão, ginecomastia, galactorreia e disfunção sexual. A lesão localizada na sela turca e com extensão ao corpo do esfenoide apresentava 4cm de maior eixo e invasão de ambos os seios cavernosos (fig. 5); contudo, a imagem descrita na RMN colocava a hipótese de diagnóstico diferencial entre macroadenoma hipofisário invasivo (hipótese mais provável), tumor de células gigantes, metástase ou um meningioma (embora menos prováveis).
Foi doseada prolactina com valor superior a 4.700ng/mL e testosterona diminuída, sem outras alterações analíticas (tabela 1). Avaliação dos campos visuais sem alterações.
Em maio de 2014, realizada biópsia do seio esfenoidal, orientada por neuronavegação. O estudo imuno‐histoquímico foi positivo para prolactina e negativo para ACTH, FSH, GH e TSH.
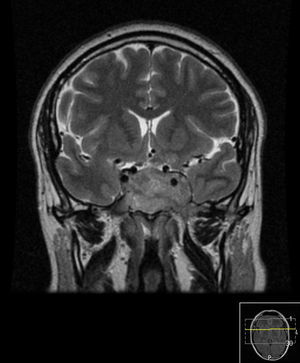
Foi medicado com cabergolina 2mg/semana. Dez meses após início do tratamento, a prolactina tinha um valor sérico de 1.098ng/mL. Proposto aumento da dose do agonista dopaminérgico (AD), que o doente recusou por motivos económicos, no entanto, 14 meses após o início do tratamento apresentava doseamento de prolactina de 44,1ng/mL. Realizou reavaliação imagiológica nessa altura, que revelou persistência da lesão já descrita, com dimensões sobreponíveis mas com hipersinal espontâneo em T1, que pode corresponder a eventual foco hemorrágico (fig. 6).
ComentárioAssim como nos casos clínicos descritos, a maioria das séries referidas na literatura (tabela 2) relata os prolactinomas gigantes como sendo mais prevalentes em homens com idade média ao diagnóstico de 40 anos e com uma razão homens/mulheres de 9:11,9. Os sintomas mais frequente são resultado do efeito de massa e/ou hiperprolactinemia com cefaleias, alterações visuais, oftalmoplegia por compressão do quiasma ótico ou nervos oculomotores, disfunção sexual, ginecomastia, amenorreia e hipogonadismo hipogonadotrófico1,7.
Características dos doentes em séries publicadas
| Referências | N.° doentes | Razão M:F | Idademédia (anos) | Diâmetro médio tumor (mm) | Cirurgia prévia | AD (dose média) | Sintoma+frequente |
|---|---|---|---|---|---|---|---|
| Saeki et al.23 | 10 | 7:3 | 36 | 51 | 4 | BRC (10) | Cefaleia |
| Corsello et al.5 | 10 | 10:0 | 45 | 41 | 4 | CAB (3,3) | Alterações visuais |
| Yu et al.9 | 30 | 26:4 | 39 | 58 | 18 | BRC (NR) | Alterações visuais |
| Shimonet al.22 | 12 | 12:0 | 39 | 47 | 2 | CAB (3,3) | Alterações visuais |
| Cho et al.12 | 10 | 10:0 | 37 | 51 | 0 | CAB (1,4) | Cefaleias |
BRC: bromocriptina mg/dia; CAB: cabergolina mg/semana; F: feminino; M: masculino; NR: não relatado.
O mecanismo responsável pelo hipogonadismo nos prolactinomas gigantes parece estar relacionado com a diminuição dos níveis séricos de LH e FSH consequentes à diminuição da secreção de GnRH secundária à hiperprolactinemia, da compressão da haste hipofisária e do efeito de massa pelo tumor10,11. Cerca de 50% dos doentes do sexo masculino com prolactinomas gigantes em tratamento com AD têm hipogonadismo persistente, que é tratado com testosterona12.
Os prolactinomas gigantes frequentemente invadem estruturas adjacentes à sela turca, nomeadamente a cisterna suprasselar, o seio esfenoide ou os seios cavernosos7. Raramente podem estender‐se ao lobo temporal, sendo responsáveis por crises convulsivas ou alterações da personalidade13, assim com invadir a base do crânio, a órbita ou a nasofaringe14,15.
Estes tumores são tipicamente invasivos, contudo, podem apresentar simultaneamente um comportamento agressivo definido pela resistência ao tratamento farmacológico e à recorrência após cirurgia16,17. Apenas os prolactinomas com metástases à distância são considerados carcinomas, sendo muito raros17. Nos prolactinomas invasivos foram investigados marcadores de proliferação, nomeadamente o índice Ki‐67, o índice mitótico e a mutação da proteína p53, de forma a identificar os tumores com potencial de crescimento, invasão e metastização e, dessa forma, decidir de forma precoce uma abordagem multidisciplinar18–20.
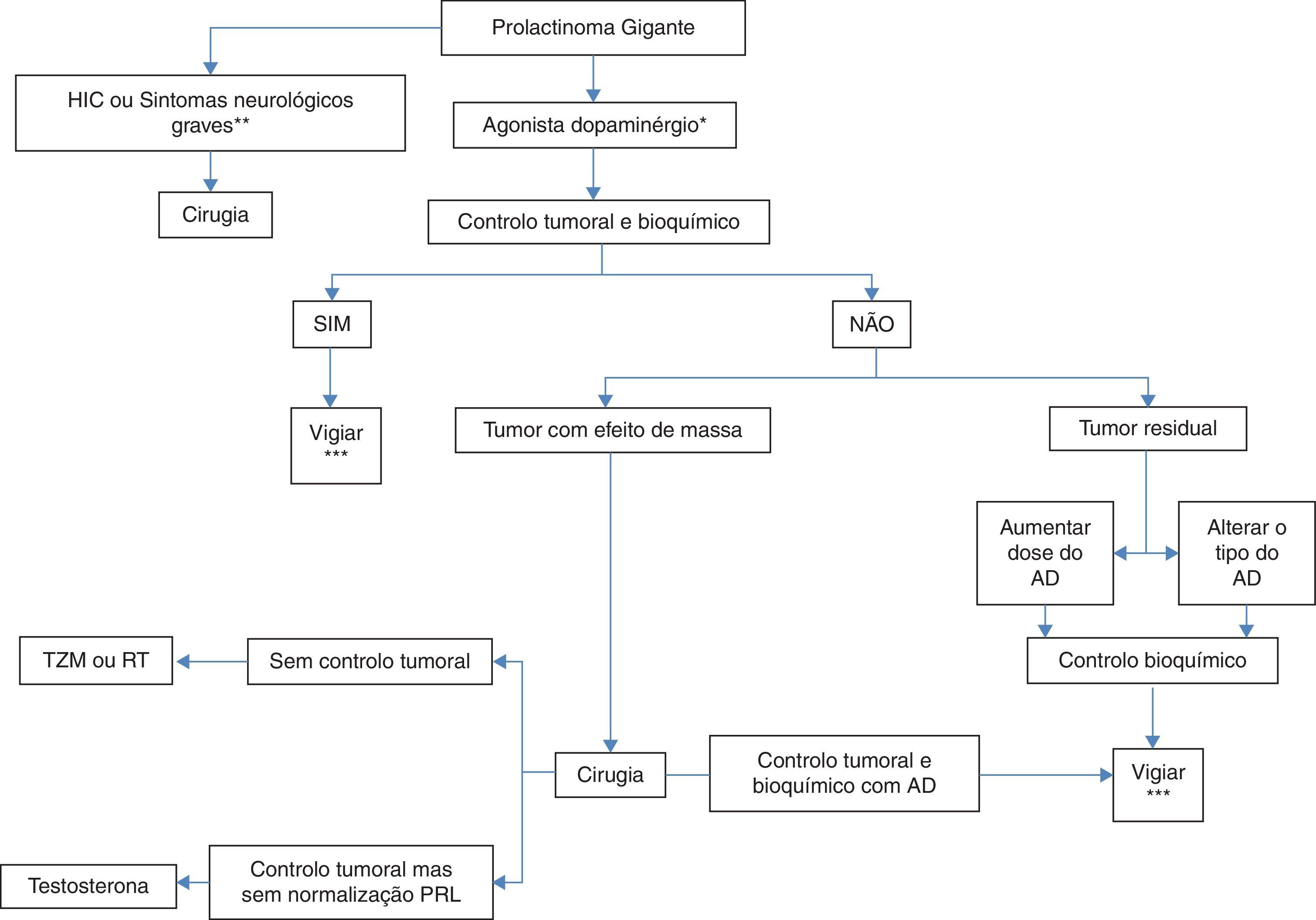
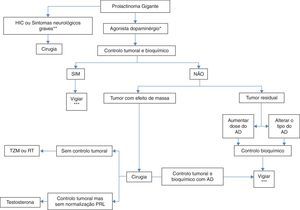
Diferentes abordagens de tratamento como os AD, a cirurgia ou a radioterapia podem ser necessários (fig. 7) para alcançar os alvos terapêuticos, nomeadamente a diminuição do volume tumoral, a normalização dos níveis de prolactina e a restituição do eugonadismo7.
Tratamento dos prolactinomas gigantes.
*Preferencialmente cabergolina.
**Apoplexia, alterações da visão recentes ou progressivas, alteração do nível de consciência.
*** Doseamento de PRL semestral, RMN cerebral e campos visuais anualmente. AD: agonistas dopaminérgico; HIC: hipertensão intracraniana; PRL: prolactina; RT: radioterapia;; TZM: temozolomida. Adaptado de: Moraes et al.7.
No passado, a cirurgia era a primeira opção para alívio rápido dos sintomas neurológicos, no entanto, devido às taxas de mortalidade e morbilidade, à persistência de lesão tumoral e à crescente demonstração da eficácia dos AD na redução do volume tumoral, a cirurgia foi perdendo o seu lugar de destaque no tratamento desta patologia1,21.
O uso dos AD cabergolina e bromocriptina está associado a uma redução do tumor, mesmo nos de grandes dimensões e nos que causam alterações visuais, hidrocefalia, exoftalmia ou sintomas neurológicos, sendo atualmente recomendados como a primeira linha no tratamento dos prolactinomas gigantes5,17,22. A melhoria dos campos visuais pode ocorrer em 1‐2 dias após a administração dos AD, com um tempo médio de 5 dias, e pode ser observado na ausência de uma resposta tumoral significativa23.
A cabergolina é o AD preferido devido à sua eficácia na redução das dimensões do tumor, na normalização dos níveis de prolactina e também devido à sua excelente tolerabilidade. A dose média varia entre 1,4‐4,5mg/semana em várias séries publicadas5,12,22,24,25 (tabela 2), no entanto, 2mg/semana é dose suficiente para controlo tumoral e bioquímico da maioria dos prolactinomas17. A eficácia da cabergolina na melhoria dos campos visuais, na melhoria da disfunção sexual e na reversão do hipogonadismo foi também demonstrada5,22. Ainda não existem estudos conclusivos sobre o resultado da cessação dos AD nos prolactinomas gigantes.
A eficácia da bromocriptina é variável nos diferentes estudos com uma dose média usada de 10‐40mg/dia. É menos utilizada devido à menor eficácia e à maior incidência de náuseas, vómitos e hipotensão postural7.
Alguns artigos referem que o uso de AD nas doses usadas para o tratamento da doença de Parkinson pode estar associado a doença valvular cardíaca severa, no entanto, as doses usadas no tratamento dos prolactinomas são menores, não se verificando esta associação em estudos recentes. Contudo, tratamentos de longa duração com AD podem estar associados a lesões subclínicas como calcificações na válvula aórtica ou regurgitação tricúspide leve a moderada26,27. Moraes et al. recomendam a realização de ecocardiograma previamente à introdução de cabergolina e nos 3‐6 meses após início do tratamento e, se for detetada doença valvular, o doente não deve ser tratado com cabergolina7.
A dose dos AD deve ser aumentada de acordo com a resposta e até à tolerância máxima do doente antes de ser proposta a cirurgia17. Os doentes que apresentam resistência à acção da bromocriptina podem subsequentemente responder à cabergolina28.
A remoção cirúrgica de um prolactinoma gigante é frequentemente parcial e a cura bioquímica é rara, devendo ser considerada como parte de uma abordagem multidisciplinar para os tumores resistentes aos AD ou para os doentes intolerantes a esses fármacos7,29. É tratamento de primeira linha para os doentes que apresentam sinais de hipertensão intracraniana ou apoplexia hipofisária com sintomas severos, como alterações visuais recentes ou progressivas ou deterioração do estado de consciência. A via transesfenoidal, usada frequentemente, pode permitir uma exérese eficaz dos componentes esfenoidal, selar e suprasselar com baixa taxa de complicações7.
A radioterapia fica reservada para os doentes em que, com os AD e com a cirurgia, não é alcançado o controlo da doença, permanecendo efeito de massa17. O efeito adverso mais comum deste tratamento é o hipopituitarismo e, em casos raros, a lesão de nervos cranianos ou o desenvolvimento de um tumor secundário30–32.
A temozolomida é um agente alquilante oral que inibe o crescimento de células tumorais e que demonstrou alguma eficácia nos carcinomas da hipófise e nos prolactinomas gigantes agressivos que permanecem descontrolados apesar de múltiplas modalidades de tratamento33–35. É habitualmente bem tolerada, as náuseas e a fadiga são frequentes, a leucopenia e trombocitopenia ocorrem em 4 e 17% dos doentes, respetivamente36.
Nos 3 casos apresentados os doentes negam ao diagnóstico sintomas de alterações endócrinas, provavelmente pela progressão lenta do tumor, o que poderá ter atrasado o diagnóstico, mas reconhecem a melhoria sintomática da astenia e da função sexual após resolução bioquímica da hiperprolactinemia e do hipogonadismo. Em nenhum dos doentes foi necessária medicação com testosterona e também não havia evidência de excesso ou défice de outras hormonas produzidas/libertadas pela hipófise.
Em 2 dos 3 casos apresentados o primeiro tratamento foi cirúrgico. O doente do primeiro caso foi submetido a ressecção transesfenoidal em 2001 pela extensão do tumor. No segundo doente a apresentação clínica com diminuição recente, mas progressiva da visão conduziu à decisão do neurocirurgião pelo tratamento cirúrgico, tendo sido posteriormente encaminhado para a consulta de endocrinologia para início do tratamento com AD.
Dois doentes estão medicados com bromocriptina: o doente do caso 2 por intolerância à cabergolina e o do caso 1 por razões económicas (a cabergolina é substancialmente mais cara), apesar do comportamento agressivo do tumor que recidivou em 2011 para as dimensões pré‐cirúrgicas.
As doses de bromocriptina usadas no caso 1 e 2 estão de acordo com o descrito na literatura, sendo que a dose máxima descrita usada é de 40mg/dia. Os 2mg semanais de cabergolina com que o doente 3 se encontra medicado também se encontram dentro dos valores descritos, sendo que o tempo médio até à resposta máxima é de 12‐24 meses. Contudo, apesar da boa resposta bioquímica com normalização dos níveis de prolactina, o prolactinoma apresenta as mesmas dimensões, pelo que será proposto novamente ao doente aumentar a dose de cabergolina.
Os prolactinomas gigantes apresentam um desafio diagnóstico e terapêutico, cujo diagnóstico é muitas vezes tardio. Na maioria dos casos os sintomas relacionados com alterações endócrinas não são valorizados e o tumor só é identificado após o aparecimento de sintomas neurológicos devido ao efeito de massa. Os AD são a primeira opção de tratamento e proporcionam uma diminuição marcada do tamanho tumoral, melhoria dos sintomas neurológicos e controlo dos níveis de prolactina.
O papel do endocrinologista é essencial na abordagem inicial destes doentes, devendo fazer parte da equipa multidisciplinar o neurocirurgião, o oftalmologista e, em casos mais específicos e raros, o radioterapeuta e o oncologista.
Conflito de interessesOs autores declaram não haver conflito de interesses.