Estudar a resposta do ligamento periodontal de ratazanas adultas à aplicação de forças durante a fase inicial de movimento dentário.
MétodosForam utilizadas 48 ratazanas Wistar machos, divididas em grupos de 12. O grupo controlo não foi submetido a manipulação. Os grupos teste foram submetidos a uma força de tração de 50g por períodos experimentais de 24, 48 e 72 horas. No final da experiência o periodonto foi analisado por imuno‐histoquímica para estudo da proliferação celular com coloração pelo antigénio nuclear de proliferação celular (PCNA).
ResultadosNão foram detetadas diferenças na proliferação celular entre os lados de tensão e pressão em todos os períodos experimentais. Células PCNA positivas foram visíveis às 24 horas, atingindo o máximo às 48 horas e posterior diminuição às 72 horas. As células marcadas foram visíveis em toda a extensão das áreas analisadas, mesmo nas regiões perivasculares, permitindo especular que ambos os fenótipos de fibroblastos proliferaram.
ConclusãoDe acordo com os dados obtidos, mesmo em ratazanas adultas, as células do ligamento periodontal respondem rapidamente à aplicação de forças aumentando a sua atividade proliferativa.
To assess the response of the periodontal ligament to a force applied in the initial phase of tooth movement.
Methods48 male Wistar rats, were used in the present study. The rats were divided into four groups: control group without treatment (n=12) and three treatment groups (n=12 per group) submitted to 50g forces for periods of 24, 48 and 72hours respectively. All the animals had free access to water and food. At the end of the experimental periods, the animals were given excess anesthetics and periodontium sections were analyzed by immunohistochemistry for proliferating cell nuclear antigen (PCNA).
ResultsProliferation was observed in the periodontium of all the animals submitted to treatment, as assessed by PCNA expression. PCNA expression levels also revealed similar proliferation levels in the tension and in the pressure sides. PCNA‐positive cells were detected at 24hours, augmented at 48hours and declined at 72hours indicating the rapid onset of the repair process following injury. The cells marked for PCNA were visible throughout the evaluated areas, including the perivascular regions, enlightening the involvement of fibroblasts in the repair process.
ConclusionThe results of the present study revealed that, even in adult animals, periodontal ligament cells respond quickly to the application of a force by increasing their proliferative activity in both the tension and pressure sides.
A procura de tratamento ortodôntico por parte de indivíduos adultos tem vindo a aumentar nas últimas décadas, pelo que nestes tem que se ter em consideração a idade, um importante fator clínico que afeta a velocidade e a quantidade de movimento dentário1.
O movimento gerado por uma força ortodôntica é produto da atividade celular que ocorre tanto a nível do compartimento ósseo, com reabsorção óssea do lado de pressão e aposição óssea do lado de tensão, como a nível do compartimento de tecido conjuntivo, com remodelação e reparação do ligamento periodontal (LP). Este apresenta uma elevada densidade celular que inclui osteoblastos, cementoblastos, células mesenquimatosas indiferenciadas e principalmente fibroblastos que apresentam 2 fenótipos diferentes: fibroblastos produtores de matriz extracelular (ME) e fibroblastos osteoblasto‐like com grande atividade de fosfatase alcalina2. Estes últimos são considerados células progenitoras dos osteoblastos e dos cementoblastos, são produtores de cemento radicular extrínseco3–5 e encontram‐se localizados nas regiões perivasculares e nos espaços medulares.
Com a idade, a maior parte dos tecidos colagénicos torna‐se metabolicamente inertes, apresentando o LP dos adultos menor densidade celular que o das crianças6,7. Também nos adultos se observa diminuição da atividade mitótica das células, menor produção dos componentes da matriz inorgânica e da quantidade relativa de colagénio solúvel. Em contraste, a desagregação e a inflamação do periodonto tendem a desenvolver‐se mais rapidamente8 e os fibroblastos adultos produzem, quando estimulados mecanicamente, mais prostaglandina E2 e interleucina‐1β do que as células mais jovens. Deste modo, especula‐se que o grau de destruição periodontal nos adultos estará relacionado, em parte, com respostas mais exacerbadas dos hospedeiros à tensão mecânica9.
A experimentação animal demonstrou que em ratos jovens o colagénio do LP apresenta uma alta taxa de regeneração, permitindo uma contínua remodelação10,11. Em animais mais velhos este período de tempo tende a duplicar12, havendo uma menor produção de colagénio. Já no movimento ortodôntico, muito embora a mobilização celular e a conversão das fibras de colagénio sejam consideravelmente mais lentas do que nos adolescentes13, continuam a ser mais elevadas do que noutros tecidos do organismo, não sendo fatores limitantes no tratamento ortodôntico. Mas se a fase inicial de movimento ortodôntico é mais rápida em ratos jovens, não existe diferença entre grupos etários no segundo período de movimento, indicando que a capacidade de regeneração óssea não está dependente da idade. Nos ratos adultos existe somente um atraso na resposta biológica inicial relacionada com a estrutura envelhecida do periodonto e com uma atividade diminuída a nível do compartimento ósseo1,14.
O movimento ortodôntico é um processo inflamatório iatrogénico que cria lesões das quais o organismo recupera com facilidade, se as forças aplicadas estiverem dentro dos limites terapêuticos. Mas se mesmo com a idade as lesões geradas a nível do periodonto ainda tendem a ser reparadas facilmente, a biomecânica ortodôntica nos adultos deveria apoiar‐se em forças intermitentes, permitindo, no período de repouso, a recuperação dos tecidos e a migração de novos elementos celulares para áreas de lesão ou isquemia, limitando as possíveis sequelas15.
A aplicação de forças ortodônticas induz alterações celulares a nível do periodonto, particularmente no lado de pressão, as quais, contudo, não são acompanhadas de perda de funcionalidade dos tecidos envolvidos. Este facto poderá indiciar que apesar de neste lado se observar sempre algum grau de hialinização16, ocorrerá simultaneamente proliferação das células tendo em vista a manutenção da funcionalidade tecidular mesmo em animais envelhecidos. No presente estudo, usou‐se como modelo experimental ratazanas Wistar adultas, a fim de provar que mesmo em adultos a proliferação celular é uma das consequências da aplicação de forças ortodônticas no período inicial do movimento dentário, permitindo a reparação dos tecidos.
Material e métodosNeste estudo foram utilizadas 48 ratazanas Wistar machos (Charles River, Barcelona, Espanha), com 24 semanas de idade e com peso inicial de 396,87±38,23g. Os animais, dado serem geneticamente semelhantes, foram divididos em grupos de 3 e alocados em gaiolas t4. Estas ratazanas são fáceis de manipular, um modelo animal já consistentemente validado, uniformes nas suas características anatomomorfológicas e cujos resultados expectáveis foram observados nos grupos estudados, facto pelo qual não houve necessidade de, nesta abordagem, duplicar a amostra, muito embora um estudo posterior tenha confirmado os resultados obtidos. Os animais foram divididos em 4 grupos de 12 ratos cada: grupo I de controlo sem manipulação, no grupo II o mecanismo de aplicação de força foi deixado por 24 horas, no grupo III foi deixado por 48 horas e no grupo IV foi deixado por 72 horas. Este trabalho foi aprovado pela DGAV (autorização 0421/000/000/2014) e os animais foram mantidos em condições laboratoriais normalizadas, de acordo com a legislação disposta no Decreto‐Lei n.° 113/2013 de 7 de agosto. Foram mantidos num ciclo de 12 horas luz/escuro, à temperatura constante de 22°C e com acesso a dieta sintética e água ad libitum.
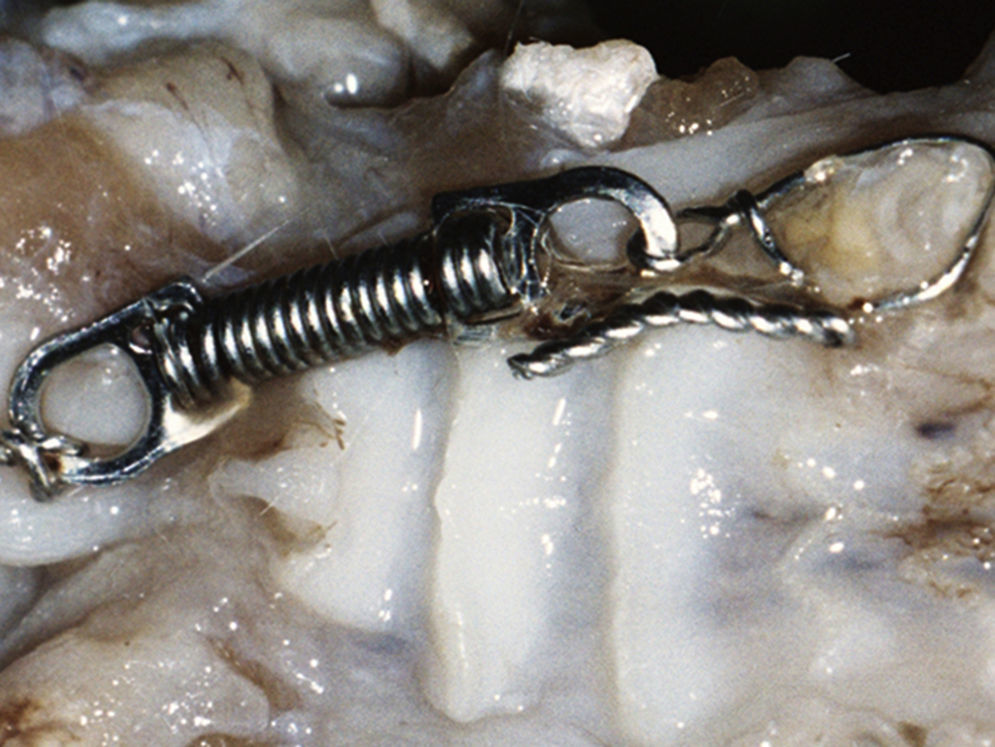
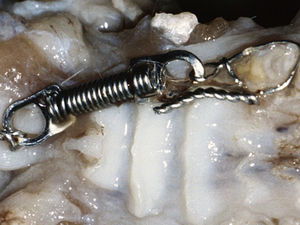
Os animais foram todos anestesiados por via intramuscular com 100mg/kg de cloridrato de ketamina (Ketalar®, Parke‐Davis Co., Barcelona, Espanha) e com 14mg/kg de xilazina (Rompun, Bayer Co., Amadora, Portugal). O mecanismo de aplicação de força constituído por uma mola em espiral fechada de níquel‐titânio estirada (Ni‐Ti extension spring, light force, 9mm, wire ø 0,010, coil ø 0,030, 704‐6.036, Ormco), foi colocado no quadrante maxilar direito, unindo o 1.° molar e os incisivos de todos os animais à exceção dos do grupo controlo. A força de tração de 50g17 garantiu a reprodutibilidade neste modelo, movimentando o 1.° molar em sentido mesial (fig. 1).
Todos os procedimentos cirúrgicos decorreram sem incidentes, tendo todos os animais sobrevivido. No fim do protocolo experimental, estes foram sacrificados com uma sobredosagem de cloridrato de ketamina e os maxilares imediatamente colhidos e fixados em formol neutro tamponado a 10%. Após descalcificação com EDTA (Sigma‐Aldrich, Madrid, Espanha) a 17%, as peças histológicas foram incluídas em parafina. As amostras foram orientadas de forma que se pudessem realizar cortes histológicos com 6μm de espessura, de sentido mésio‐distal e perpendiculares ao longo eixo do 1.° molar. Os cortes foram colhidos a nível do terço médio, região onde nos movimentos de tipping, o LP é sujeito a forças de pressão de menor intensidade.
Alguns dos cortes obtidos foram corados com hematoxilina‐eosina (HE) para observação geral das estruturas. Para a realização do estudo por imuno‐histoquímica, os cortes histológicos foram processados através do método da estreptavidina‐biotina, utilizando o anticorpo monoclonal endereçado ao antigénio nuclear da proliferação celular (PCNA) (PCNA‐Staining kit, Zymed, EUA). Como controlo negativo substituiu‐se o anticorpo primário por PBS, como controlo positivo externo foi utilizada uma secção de intestino delgado e como controlo positivo interno foi utilizado o epitélio oral do animal analisado, ambos marcados para PCNA.
O LP foi analisado por 3 patologistas diferentes a nível das raízes mesiais do 1.° molar, avaliando‐se o lado mesial onde foi exercida uma força de pressão e o lado distal onde foi exercida uma força de tensão, não se tendo verificado desacordo entre eles quanto aos resultados da avaliação.
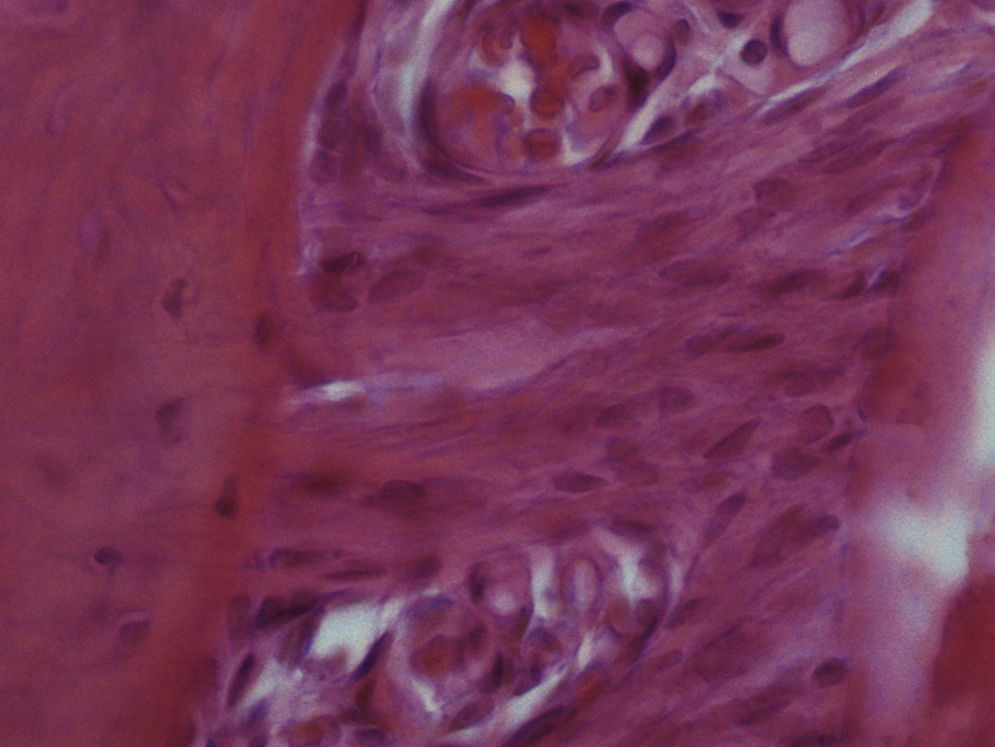
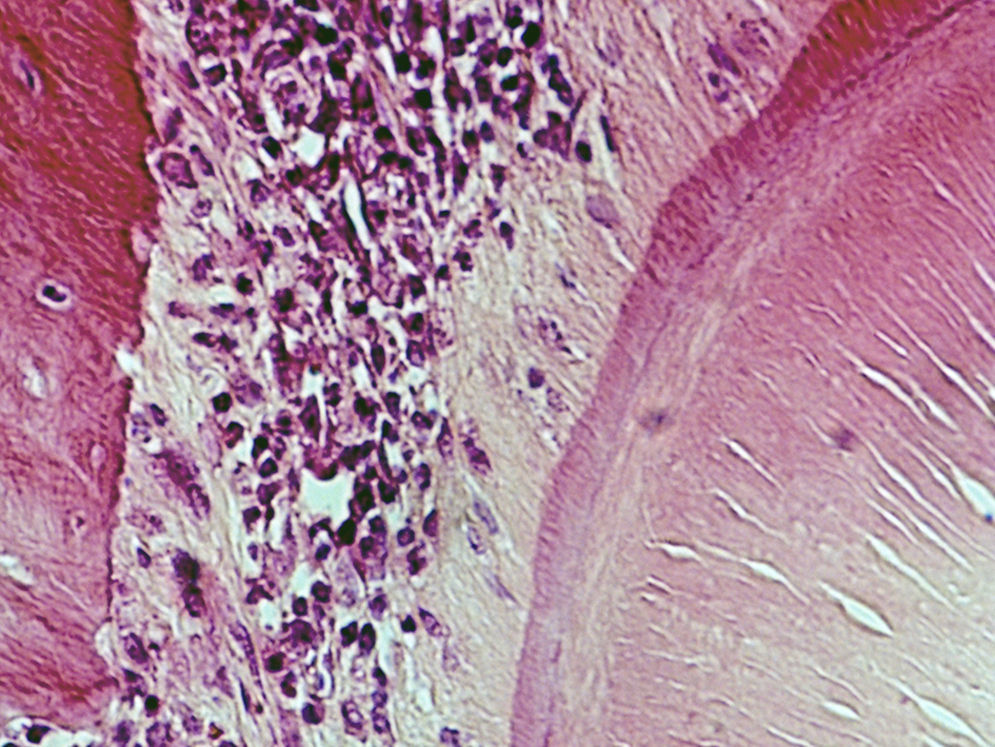
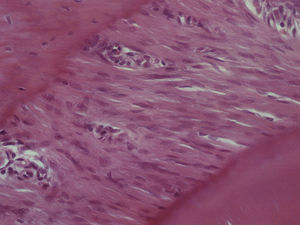
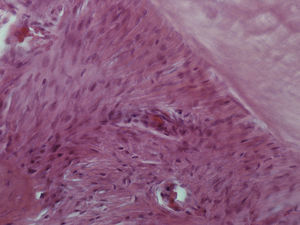
ResultadosHematoxilina‐eosinaGrupo I – o LP apresentou o aspeto característico de tecido conjuntivo laxo, moderadamente denso, sendo visível um grande número de células distribuídas uniformemente ao longo de todo o ligamento examinado, muito particularmente nas 2 regiões estudadas. Muitas das células presentes apresentavam um aspeto alongado e fusiforme. Foram visíveis vasos sanguíneos ao longo de todo o ligamento, mas principalmente junto à parede do osso alveolar. Não foi observada qualquer alteração quer da estrutura radicular quer dos tecidos periapicais (fig. 2).
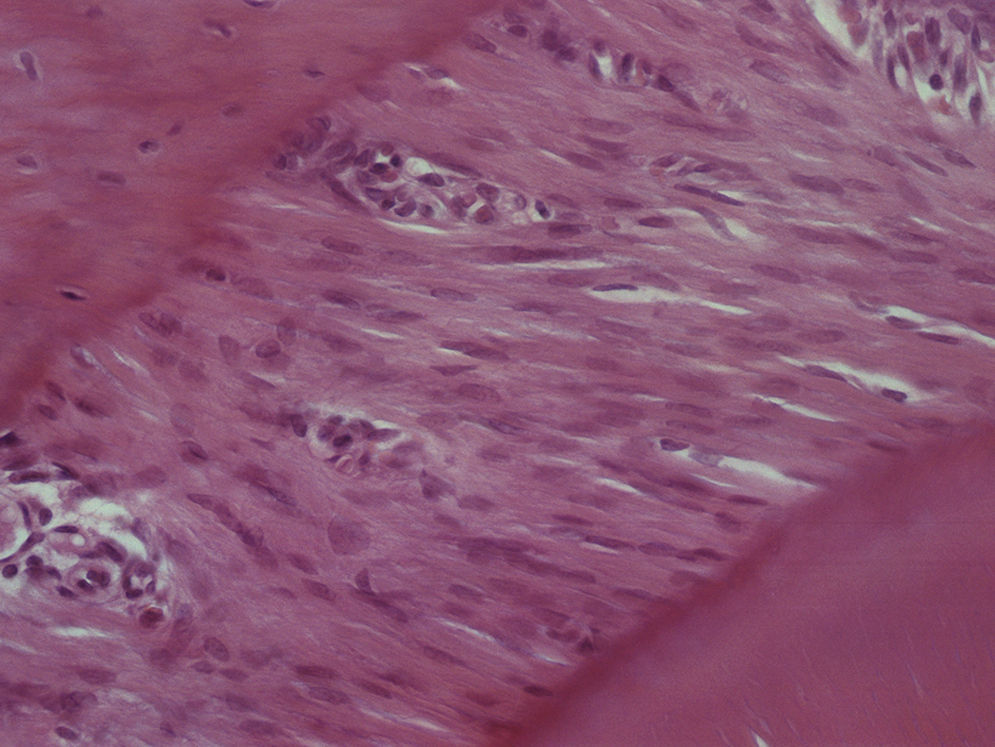
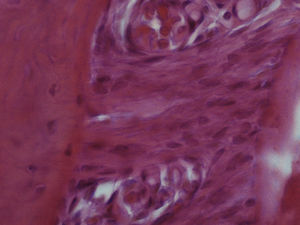
Grupo II – no lado de pressão foi evidente a perda celular com o LP a apresentar uma densidade celular menor que a do grupo de controlo. As células presentes, cuja morfologia era compatível com a de fibroblastos, apresentavam‐se mais alongadas e, em muitos casos, orientadas paralelamente ao vetor da força. A espessura do ligamento diminuiu. Junto à superfície radicular surgiram pequenas áreas acelulares de aspeto homogéneo, eosinófilo e vítreo compatíveis com áreas de hialinização. Foram visíveis áreas de reabsorção óssea indireta. Foi observada uma boa densidade celular no lado de tensão, sendo a espessura do ligamento maior do que no lado de pressão (fig. 3).
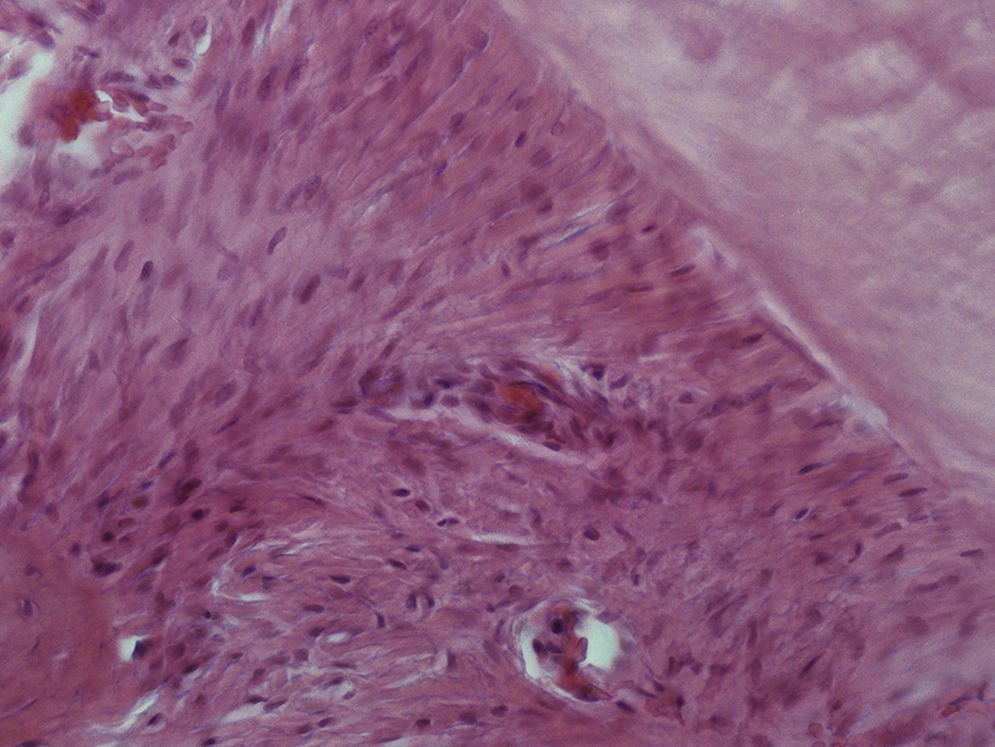
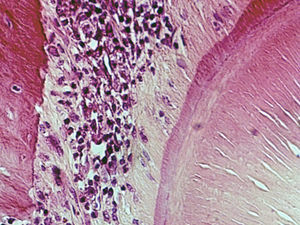
Grupo III – no lado de pressão surgiram algumas áreas com uma densidade celular menor do que a presente no grupo de controlo, mas com uma densidade celular maior do que a presente no grupo II. As células presentes continuaram a ter uma forma predominantemente alongada, muitas delas ainda com uma orientação paralela ao vetor de força. Foram observadas áreas com morfologia compatível com áreas de hialinização, mais extensas do que as presentes no grupo II, bem como áreas de reabsorção óssea indireta. A densidade celular permaneceu elevada no lado de tensão e superior à observada no lado de pressão (fig. 4).
Grupo IV – no lado de pressão, a densidade celular foi semelhante à detetada no grupo de controlo, sendo superior à observada nos grupos experimentais anteriores. Foram observadas tanto células de aspeto alongado como células de aspeto arredondado, em proporções variáveis ao longo do LP analisado. Já não foi aparente a orientação das células de acordo com o vetor de força, tal como visto nos grupos anteriores. As áreas de hialinização foram de menor dimensão, muito semelhantes às observadas no grupo II, tendo‐se detetado também infiltrado inflamatório com predomínio de células mononucleadas. No lado de tensão continuou a existir uma boa densidade celular sem que fossem observadas alterações histológicas significativas (fig. 5).
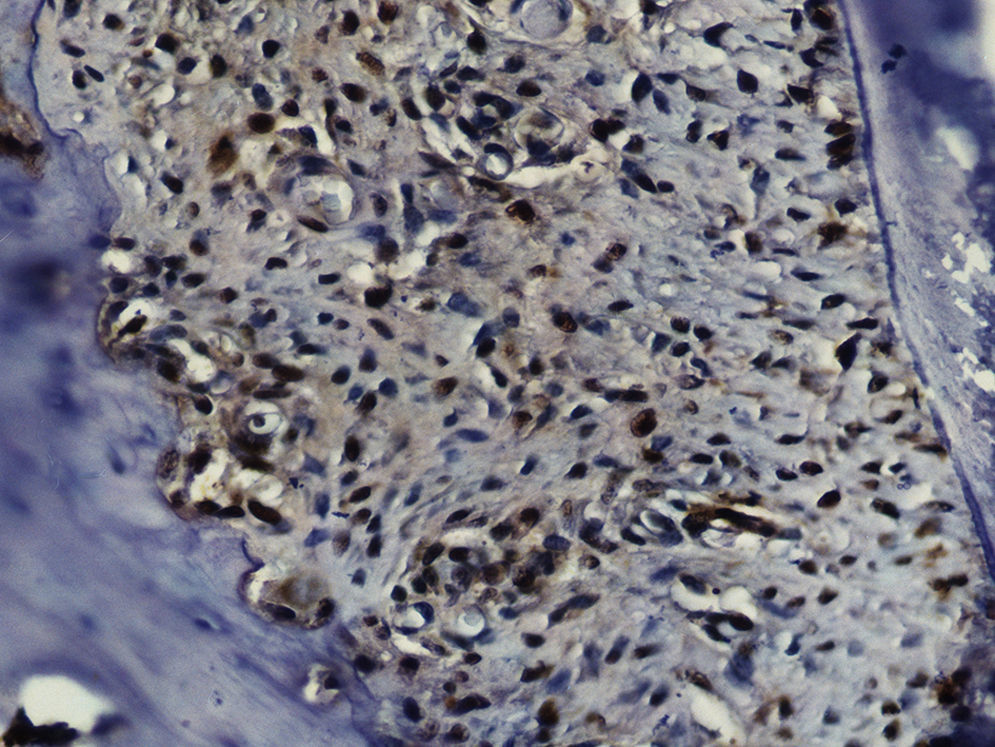
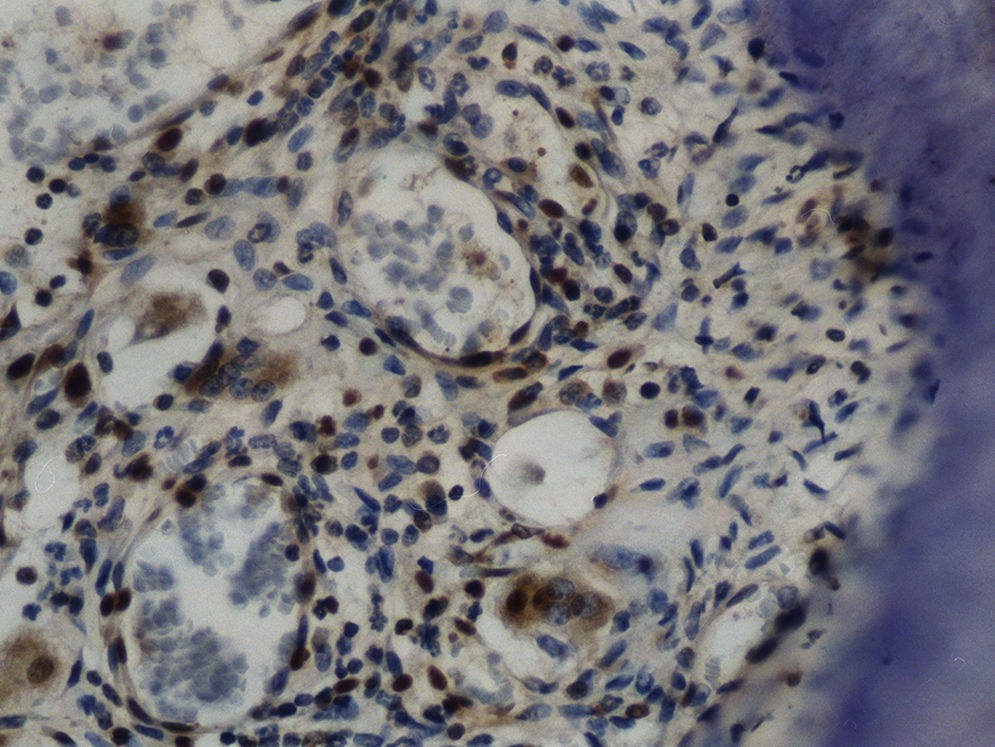
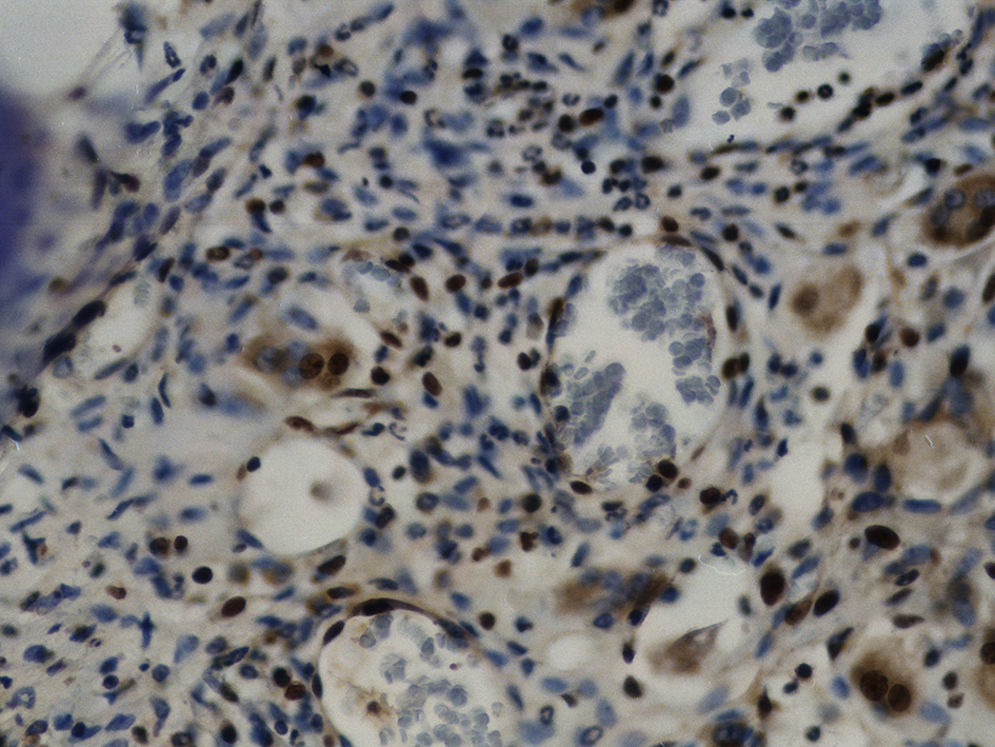
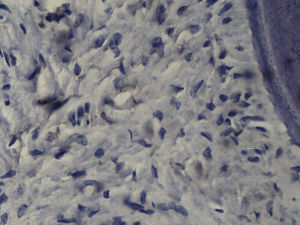
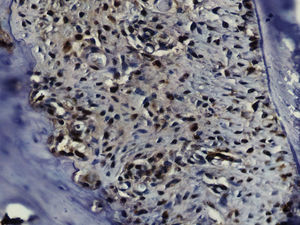
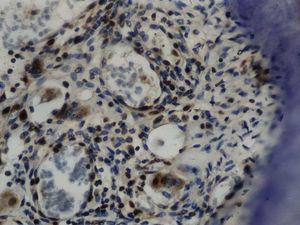
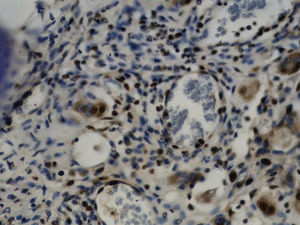
Imuno‐histoquímicaO grupo de controlo não mostrou expressão para PCNA, em contraste com os restantes grupos de teste (fig. 6). A marcação do grupo III (fig. 7) mostrou uma proliferação mais intensa do que a presente nas secções do grupo II (fig. 8), não havendo, contudo, em nenhum dos grupos, diferenças assinaláveis entre a marcação presente no lado de pressão e no lado de tensão. No grupo IV (fig. 9) a expressão do PCNA mostrou uma intensidade e distribuição semelhantes à presente no grupo II, não apresentando também diferenças entre os lados de pressão e tensão.
A regeneração dos tecidos conjuntivos envolve o controlo rigoroso da proliferação celular e dos processos de migração e morte celular18. Muito embora alguns estudos sobre o LP sujeito a forças mencionem a existência de proliferação dos fibroblastos19–21, vários outros consideram que o estímulo mecânico é apenas promotor de efeitos osteogénicos22–25 e que as células que proliferam em resposta à aplicação de forças pertenceriam somente ao compartimento com propriedades osteogénicas, excluindo os fibroblastos comuns produtores de ME. Os resultados contraditórios sobre a resposta das células do LP à aplicação de forças levaram à realização do presente trabalho usando ratazanas Wistar com 24 semanas dado que o LP destas consegue conservar as suas propriedades mecânicas até às 24 semanas de vida26, podendo‐se equiparar os animais a humanos com 18 anos de idade27. Esta opção deveu‐se ao facto de ¾ dos pacientes ortodônticos serem jovens adultos com idades inferiores a 27 anos28.
Os resultados obtidos mostraram que mesmo em animais adultos o LP responde rapidamente à aplicação de forças, aumentando a atividade proliferativa das células do compartimento de tecido conjuntivo, quer do lado do ligamento sujeito a pressão quer no lado sujeito a tensão.
A existência de células marcadas positivamente para PCNA em todas as áreas observadas, inclusive nas regiões perivasculares, permitiu constatar o envolvimento dos fibroblastos na regeneração dos tecidos periodontais. Apesar de não ter sido possível determinar o fenótipo dos fibroblastos, i. e., fibroblastos produtores de ME ou fibroblastos osteoblasto‐like envolvidos no processo, é possível que ambos os fenótipos tenham proliferado em resposta à agressão.
Em contraste com o observado nos fibroblastos do grupo de controlo que não expressam PCNA, a aplicação de força ortodôntica nos outros grupos atuou como estímulo mitogénico forçando os fibroblastos a iniciarem o ciclo celular. Apesar de se observar uma diminuição da densidade celular no lado de pressão, os resultados evidenciaram que mesmo nos animais adultos o tecido agredido iniciou a reparação 24 horas após a aplicação da força, dado que foram visíveis células marcadas para PCNA inclusivamente no lado de tensão. Nos 3 grupos teste o aumento da expressão do PCNA em ambos os lados do movimento, das 24 para as 48 horas e subsequente diminuição às 72 horas, indicia que o processo reparador é rápido e ocorre durante as primeiras 48 horas, apesar da densidade de fibroblastos presentes diminuir progressivamente com a idade29 e, após a aplicação de uma força, a desorganização inicial e a reorganização posterior associada à reparação, ocorrerem mais tarde e serem mais prolongadas30.
A discrepância dos resultados obtidos com os de estudos anteriores que mencionam a ocorrência de proliferação somente ao fim de 3 dias no lado de tensão22,31 poderá estar eventualmente relacionada com as diferentes intensidades e mecanismos de aplicação de forças e/ou o facto dos animais do presente estudo serem adultos. É portanto de salientar que os resultados do presente estudo demostraram que em animais adultos o LP responde rapidamente à aplicação de forças, aumentando a atividade proliferativa das células do compartimento de tecido conjuntivo, sendo evidente uma rápida resposta tanto no lado do ligamento sujeito a pressão como no lado sujeito a tensão.
ConclusãoMesmo em animais adultos, as células do LP respondem rapidamente à agressão, tanto no lado de pressão como no lado de tensão, levando células inicialmente quiescentes a iniciarem o ciclo celular, tornando‐se metabolicamente ativas, nomeadamente através da proliferação celular. Este facto é particularmente importante no lado de pressão no qual, devido à força aplicada, houve uma diminuição da densidade celular.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.