En los últimos años se ha producido un aumento exponencial en la prescripción de antipsicóticos de segunda generación (ASG) en niños y adolescentes para el tratamiento de trastornos psicóticos y otros trastornos mentales. Sin embargo, hay muy pocos estudios que comparen la tolerabilidad y la eficacia entre los distintos ASG en esta población. Este artículo revisa los datos actuales sobre las características diferenciales de eficacia y tolerabilidad de los ASG en población infanto-juvenil. Los datos muestran que los ASG no forman un grupo homogéneo, sino que cada fármaco de este grupo tiene un perfil característico, sobre todo con respecto a los efectos secundarios, especialmente las complicaciones metabólicas. En concreto, en las comparativas entre ASG, el tratamiento con olanzapina se relacionó con mayor aumento de peso y de colesterol, y el tratamiento con risperidona se asoció con mayor aumento de prolactina. Por ello, antes de prescribir un ASG resulta imprescindible tener en cuenta el perfil diferencial de estos fármacos.
Over the last few years, there has been a marked increase in the prescription of second-generation antipsychotics (SGA) for the treatment of psychotic disorders and other psychiatric conditions in children and adolescents. However, few reports compare the tolerability and efficacy of the different SGAs in this population. We review the literature on the differential characteristics of efficacy and tolerability of SGA in the pediatric population. Our results show that SGAs are not a homogeneous group, but that each drug has a distinct profile, particularly with respect to side effects, especially metabolic complications. Comparisons between SGAs have shown that treatment with olanzapine was associated with greater weight gain and increased cholesterol levels, and that treatment with risperidone was associated with a greater increase in prolactin levels. Therefore, the specific profile of an SGA should be taken into consideration when prescribing these drugs.
La prescripción de fármacos antipsicóticos de segunda generación (ASG) para el tratamiento de trastornos psicóticos y de otros trastornos mentales en niños y adolescentes se ha convertido en una práctica habitual en la clínica psiquiátrica1–3. Los estudios sobre la prevalencia del uso de estos fármacos en población infanto-juvenil muestran que, en los últimos años y en diferentes países de todo el mundo, se ha producido un aumento muy significativo de las prescripciones de ASG4, que se ha acompañado, en casi todo el mundo, de un descenso progresivo del uso de antipsicóticos clásicos o de primera generación (APG)5. En Estados Unidos, entre 1990 y 2000, las prescripciones de ASG aumentaron un 160%6, y en Reino Unido, entre los años 1994 y 2005, el uso de ASG aumentó en este grupo de edad casi 60 veces (0,01 usuarios por 1.000 pacientes-año en 1994, frente a 0,61 usuarios por 1.000 pacientes-año en 2005)5. Este aumento en el uso de ASG se ha debido a un aumento de las prescripciones, pero también a que estos fármacos se emplean ahora durante más tiempo. En Holanda, la duración de los tratamientos con ASG en niños y adolescentes se dobló (de 0,8 años en 1998–1999 a 1,6 años en 2001–2001)7 (fig. 1).
El espectacular incremento del uso de ASG en los últimos 15–20 años ha puesto al descubierto una importante realidad de fondo: hay muy pocos estudios que comparen la tolerabilidad y la eficacia entre los distintos ASG y entre los ASG y los APG en el tratamiento de niños y adolescentes con trastornos del espectro psicótico (esquizofrenia, trastorno esquizoafectivo, trastorno esquizofreniforme, trastorno psicótico breve, trastorno psicótico no especificado, trastorno bipolar y episodio depresivo con síntomas psicóticos).
Los estudios de tolerabilidad de ASG en población infanto-juvenil han demostrado que, aunque los ASG tienen menos efectos secundarios neurológicos motores que los APG8, el consumo de ASG se asocia con un aumento del riesgo de aparición de complicaciones metabólicas, como obesidad, diabetes mellitus tipo 2, dislipemia y, en general, de alteraciones del espectro de la morbilidad cardiovascular8–11.
Por otro lado, las agencias internacionales reguladoras del uso de medicamentos (FDA en Estados Unidos y EMA en Europa) han seguido con cautela el importante incremento en las prescripciones de ASG en niños y adolescentes. De hecho, las aprobaciones de la FDA y la EMA para el empleo de ASG en población infanto-juvenil han ido, en líneas generales, por detrás del uso clínico y de los hallazgos de eficacia y tolerabilidad en los estudios clínicos de fase 4. Las recientes leyes de la FDA (Pediatric Research Equity Act, 2003) y la EMA (EU Paediatric Regulation, enero de 2007) que exigen la exclusividad y obligatoriedad de estudios específicos con población infanto-juvenil para la aprobación de fármacos en este grupo de edad han favorecido el desarrollo de estudios de eficacia y tolerabilidad de ASG en niños y adolescentes, pero también han ralentizado los procesos de aprobación de estos fármacos en población infanto-juvenil.
Este artículo ofrece una revisión general y sistemática del estado actual de la cuestión, prestando especial atención a los estudios clínicos que han comparado la eficacia y la tolerabilidad de distintos ASG entre sí y con respecto a APG en población infanto-juvenil con trastornos del espectro psicótico (tabla 1).
Antipsicóticos de segunda generación aprobados para el uso clínico en el tratamiento de trastornos psicóticos en niños y adolescentes
| FDA | EMA |
| Risperidona: | Aripiprazol: |
|
|
| Aripiprazol: | |
| |
| Olanzapina: | |
| |
| Quetiapina: | |
|
EMA: agencia europea del medicamento; FDA: agencia estadounidense del medicamento.
Los autores han realizado una búsqueda bibliográfica de los estudios publicados en revistas internacionales desde 1990 hasta enero de 2010, disponibles en Medline/PubMed/Google Scholar que comparaban la eficacia y/o la tolerabilidad entre distintos ASG, o entre algún ASG y algún APG, en niños y adolescentes con un trastorno psicótico. Para esta búsqueda se emplearon los siguientes palabras clave: antipsicótico, olanzapina, risperidona, aripiprazol, clozapina, quetiapina, ziprasidona, psicosis, psicosis de inicio precoz, esquizofrenia, trastorno bipolar, adolescente, niño, infantil, juvenil, efectos adversos, aumentos de peso, colesterol, prolactina, síndrome metabólico, parkinsonismo, discinesia, acatisia, eficacia. Los términos se introdujeron en inglés de la siguiente manera: «antipsychotic» or «olanzapine» or «risperidone» or «aripiprazole» or «clozapine» or «quetiapine» or «ziprasidone»; «psychosis» or «early onset psychosis» or «schizophrenia» or «bipolar disorder»; «adolescent» or «child» or «children» or «youth»; «adverse events» or «weight gain» or «cholesterol» or «prolactine» or «metabolic syndrome» or «parkinsonism» or «dyskinesia» or «akathisia»; «efficacy». La búsqueda informática se complementó con una búsqueda manual de artículos relacionados con este tema.
Una vez realizadas estas búsquedas se seleccionaron los artículos que cumplieran los siguientes criterios de inclusión: 1) estudios que comparan eficacia y/o tolerabilidad entre dos o más ASG; 2) estudios que comparan eficacia y/o tolerabilidad entre ASG y placebo; 3) estudios que comparan eficacia y/o tolerabilidad entre ASG y APG. Por otro lado, se excluyeron aquellos estudios que: a) no presentasen comparaciones entre fármacos o entre fármacos y placebo, y b) y cuya muestra mezclase datos de población infanto-juvenil con datos de población adulta, sin análisis diferencial.
Debido a la variabilidad de las medidas de tolerabilidad estudiadas en diferentes trabajos, este artículo se ha centrado en aquellas variables que han demostrado una mayor importancia en términos de morbilidad: índice de masa corporal (IMC, como evaluación del peso), prolactina, triglicéridos, colesterol, tensión arterial diastólica, perímetro abdominal, síndrome metabólico, parkinsonismo, discinesia y acatisia8,9,12–14. Por otro lado, para contextualizar los datos comparativos de eficacia y tolerabilidad, se han incluido también datos comparativos de eficacia y tolerabilidad entre ASG y placebo en esta población.
Esta revisión se ha centrado en niños y adolescentes con diagnóstico de trastorno psicótico (esquizofrenia, trastorno esquizoafectivo, trastorno esquizofreniforme, trastorno psicótico breve, trastorno psicótico no especificado, trastorno bipolar y episodio depresivo con síntomas psicóticos). Se ha decidido emplear el constructo genérico de trastorno psicótico a tenor de los resultados de los estudios sobre estabilidad diagnóstica en los casos de primer episodio psicótico, que demuestran que, al menos hasta completar el primer año de evolución, la estabilidad diagnóstica es limitada15.
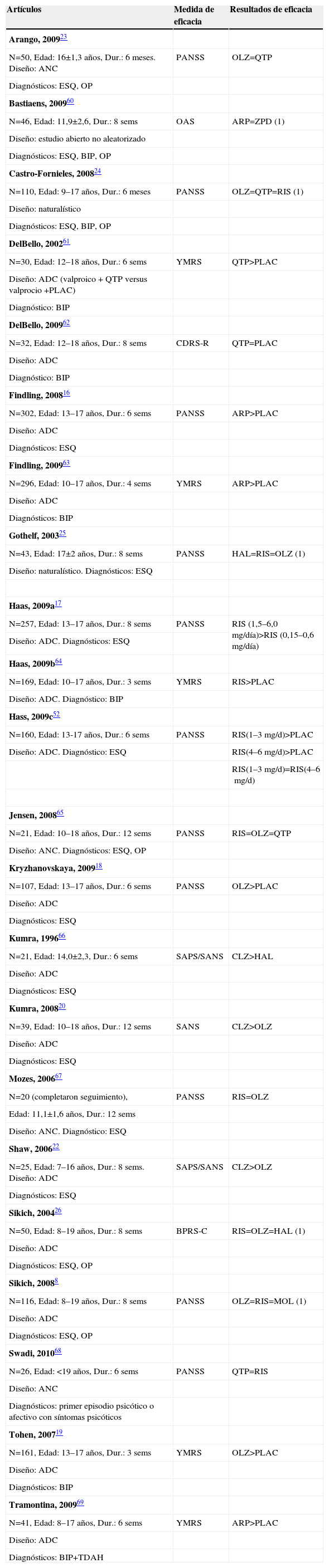
ResultadosEficaciaLa tabla 2 presenta los resultados de los estudios en los que se compara la eficacia clínica entre distintos antipsicóticos (tabla 2).
Resultados de estudios que comparan eficacia
| Artículos | Medida de eficacia | Resultados de eficacia |
| Arango, 200923 | ||
| N=50, Edad: 16±1,3 años, Dur.: 6 meses. Diseño: ANC | PANSS | OLZ=QTP |
| Diagnósticos: ESQ, OP | ||
| Bastiaens, 200960 | ||
| N=46, Edad: 11,9±2,6, Dur.: 8 sems | OAS | ARP=ZPD (1) |
| Diseño: estudio abierto no aleatorizado | ||
| Diagnósticos: ESQ, BIP, OP | ||
| Castro-Fornieles, 200824 | ||
| N=110, Edad: 9–17 años, Dur.: 6 meses | PANSS | OLZ=QTP=RIS (1) |
| Diseño: naturalístico | ||
| Diagnósticos: ESQ, BIP, OP | ||
| DelBello, 200261 | ||
| N=30, Edad: 12–18 años, Dur.: 6 sems | YMRS | QTP>PLAC |
| Diseño: ADC (valproico + QTP versus valprocio +PLAC) | ||
| Diagnóstico: BIP | ||
| DelBello, 200962 | ||
| N=32, Edad: 12–18 años, Dur.: 8 sems | CDRS-R | QTP=PLAC |
| Diseño: ADC | ||
| Diagnóstico: BIP | ||
| Findling, 200816 | ||
| N=302, Edad: 13–17 años, Dur.: 6 sems | PANSS | ARP>PLAC |
| Diseño: ADC | ||
| Diagnósticos: ESQ | ||
| Findling, 200963 | ||
| N=296, Edad: 10–17 años, Dur.: 4 sems | YMRS | ARP>PLAC |
| Diseño: ADC | ||
| Diagnósticos: BIP | ||
| Gothelf, 200325 | ||
| N=43, Edad: 17±2 años, Dur.: 8 sems | PANSS | HAL=RIS=OLZ (1) |
| Diseño: naturalístico. Diagnósticos: ESQ | ||
| Haas, 2009a17 | ||
| N=257, Edad: 13–17 años, Dur.: 8 sems | PANSS | RIS (1,5–6,0mg/día)>RIS (0,15–0,6mg/día) |
| Diseño: ADC. Diagnósticos: ESQ | ||
| Haas, 2009b64 | ||
| N=169, Edad: 10–17 años, Dur.: 3 sems | YMRS | RIS>PLAC |
| Diseño: ADC. Diagnóstico: BIP | ||
| Hass, 2009c52 | ||
| N=160, Edad: 13-17 años, Dur.: 6 sems | PANSS | RIS(1–3mg/d)>PLAC |
| Diseño: ADC. Diagnóstico: ESQ | RIS(4–6mg/d)>PLAC | |
| RIS(1–3mg/d)=RIS(4–6mg/d) | ||
| Jensen, 200865 | ||
| N=21, Edad: 10–18 años, Dur.: 12 sems | PANSS | RIS=OLZ=QTP |
| Diseño: ANC. Diagnósticos: ESQ, OP | ||
| Kryzhanovskaya, 200918 | ||
| N=107, Edad: 13–17 años, Dur.: 6 sems | PANSS | OLZ>PLAC |
| Diseño: ADC | ||
| Diagnósticos: ESQ | ||
| Kumra, 199666 | ||
| N=21, Edad: 14,0±2,3, Dur.: 6 sems | SAPS/SANS | CLZ>HAL |
| Diseño: ADC | ||
| Diagnósticos: ESQ | ||
| Kumra, 200820 | ||
| N=39, Edad: 10–18 años, Dur.: 12 sems | SANS | CLZ>OLZ |
| Diseño: ADC | ||
| Diagnósticos: ESQ | ||
| Mozes, 200667 | ||
| N=20 (completaron seguimiento), | PANSS | RIS=OLZ |
| Edad: 11,1±1,6 años, Dur.: 12 sems | ||
| Diseño: ANC. Diagnóstico: ESQ | ||
| Shaw, 200622 | ||
| N=25, Edad: 7–16 años, Dur.: 8 sems. Diseño: ADC | SAPS/SANS | CLZ>OLZ |
| Diagnósticos: ESQ | ||
| Sikich, 200426 | ||
| N=50, Edad: 8–19 años, Dur.: 8 sems | BPRS-C | RIS=OLZ=HAL (1) |
| Diseño: ADC | ||
| Diagnósticos: ESQ, OP | ||
| Sikich, 20088 | ||
| N=116, Edad: 8–19 años, Dur.: 8 sems | PANSS | OLZ=RIS=MOL (1) |
| Diseño: ADC | ||
| Diagnósticos: ESQ, OP | ||
| Swadi, 201068 | ||
| N=26, Edad: <19 años, Dur.: 6 sems | PANSS | QTP=RIS |
| Diseño: ANC | ||
| Diagnósticos: primer episodio psicótico o afectivo con síntomas psicóticos | ||
| Tohen, 200719 | ||
| N=161, Edad: 13–17 años, Dur.: 3 sems | YMRS | OLZ>PLAC |
| Diseño: ADC | ||
| Diagnósticos: BIP | ||
| Tramontina, 200969 | ||
| N=41, Edad: 8–17 años, Dur.: 6 sems | YMRS | ARP>PLAC |
| Diseño: ADC | ||
| Diagnósticos: BIP+TDAH |
ADC: aleatorizado doble ciego; ANC: aleatorizado no ciego; ANS: Schedule for the Assessments of Negative Symptoms; ARP: aripiprazol; BIP: trastorno bipolar; BPRS: Brief Psychiatric Rating Scale; BPRS-C: Brief Psychiatric Rating Scale for Children; CDRS-R: Children's Depression Rating Scale-Revised Version; CLZ: clozapina; CPRS: Children′s Psychiatric Rating Scale; Dur.: duración del tratamiento de estudio; ESQ: esquizofrenia o trastorno esquizoafectivo; HAL: haloperidol; MOL: molindona; N: número de sujetos incluido en el estudio; OAS: Overt Aggression Scale; OLZ: olanzapina; OP: Otros trastornos psicóticos, que incluye trastorno esquizofreniforme, trastorno psicótico breve, trastorno psicótico no especificado, depresión con síntomas psicóticos; PANSS: Positive and Negative Síndrome Scale; PLAC: placebo; QTP: quetiapina; RIS: risperidona; SANS: Schedule for the Assessments of Negative Symptoms; SAPS: Schedule for the Assessments of Positive Symptoms; TDAH: trastorno por déficit de atención e hiperactividad; YMRS: Young Mania Rating Scale.
El signo «>» significa «existen diferencias estadísticamente significativas (p<0,05) el parámetro medido con tratamiento A es mayor que con tratamiento B (A>B)». El signo «=» significa que no hubo diferencias en las medidas comparadas, o que si las hubo, estas no fueron estadísticamente significativas.
NOTAS:
- 1.
Los fármacos del estudio demostraron eficacia clínica general.
De forma esquemática, los resultados de los estudios de eficacia han sido: 1) Las comparativas entre ASG y placebo (o entre ASG a dosis terapéutica y ASG a dosis infraterapéutica) han mostrado la superioridad de los ASG16–19; 2) En el tratamiento de pacientes con esquizofrenia refractaria, la clozapina ha demostrado ser superior que los fármacos con los que se ha comparado20–22, y 3) No se han encontrado otras diferencias significativas en eficacia entre distintos ASG, ni entre ASG y APG8,23–26.
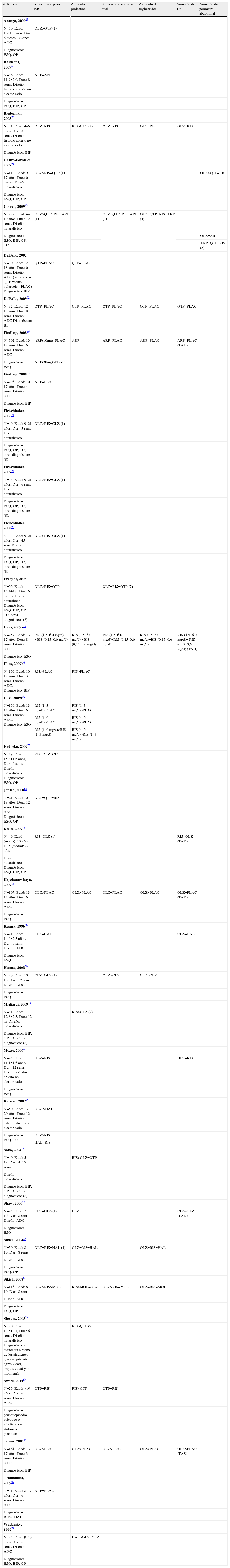
Tolerabilidad: efectos metabólicosLa tabla 3 presenta los resultados de los estudios que comparan los efectos secundarios metabólicos (aumento de peso, de perímetro abdominal, de colesterol total, de triglicéridos, de tensión arterial diastólica y de prolactina) entre distintos antipsicóticos (tabla 3).
Resultados de estudios que comparan tolerabilidad (complicaciones metabólicas)
| Artículos | Aumento de peso – IMC | Aumento prolactina | Aumento de colesterol total | Aumento de triglicéridos | Aumento de TA | Aumento de perímetro abdominal |
| Arango, 200923 | ||||||
| N=50, Edad: 16±1,3 años, Dur.: 6 meses. Diseño: ANC | OLZ>QTP (1) | |||||
| Diagnósticos: ESQ, OP | ||||||
| Bastiaens, 200960 | ||||||
| N=46, Edad: 11,9±2,6, Dur.: 8 sems. Diseño: Estudio abierto no aleatorizado | ARP=ZPD | |||||
| Diagnósticos: ESQ, BIP, OP | ||||||
| Biederman, 200570 | ||||||
| N=31, Edad: 4–6 años, Dur.: 8 sems. Diseño: Estudio abierto no aleatorizado | OLZ=RIS | RIS>OLZ (2) | OLZ=RIS | OLZ=RIS | OLZ=RIS | |
| Diagnósticos: BIP | ||||||
| Castro-Fornieles, 200824 | ||||||
| N=110, Edad: 9–17 años, Dur.: 6 meses. Diseño: naturalístico | OLZ>RIS=QTP (1) | OLZ>QTP=RIS | ||||
| Diagnósticos: ESQ, BIP, OP | ||||||
| Correll, 200913 | ||||||
| N=272, Edad: 4–19 años, Dur.: 12 sems. Diseño: naturalístico | OLZ>QTP=RIS=ARP (1) | OLZ=QTP=RIS=ARP (3) | OLZ=QTP=RIS=ARP (4) | |||
| Diagnósticos: ESQ, BIP, OP, TC | OLZ=ARP | |||||
| ARP=QTP=RIS (5) | ||||||
| DelBello, 200261 | ||||||
| N=30, Edad: 12–18 años, Dur.: 6 sems. Diseño: ADC (valproico + QTP versus valprocio +PLAC) Diagnóstico: BIP | QTP=PLAC | QTP=PLAC | ||||
| DelBello, 200962 | ||||||
| N=32, Edad: 12–18 años, Dur.: 8 sems. Diseño: ADC Diagnóstico: BI | QTP=PLAC | QTP=PLAC | QTP=PLAC | QTP=PLAC | QTP=PLAC | |
| Findling, 200816 | ||||||
| N=302, Edad: 13–17 años, Dur.: 6 sems. Diseño: ADC | ARP(10mg)=PLAC | ARP | ARP=PLAC | ARP=PLAC | ARP=PLAC (TAD) | |
| Diagnósticos: ESQ | ARP(30mg)>PLAC | |||||
| Findling, 200963 | ||||||
| N=296, Edad: 10–17 años, Dur.: 4 sems. Diseño: ADC | ARP=PLAC | |||||
| Diagnósticos: BIP | ||||||
| Fleischhaker, 200671 | ||||||
| N=49, Edad: 9–21 años, Dur.: 3 sem. Diseño: naturalístico | OLZ>RIS=CLZ (1) | |||||
| Diagnósticos: ESQ, OP, TC, otros diagnósticos (8) | ||||||
| Fleischhaker, 200727 | ||||||
| N=45, Edad: 9–21 años, Dur.: 6 sem. Diseño: naturalístico | OLZ>RIS=CLZ (1) | |||||
| Diagnósticos: ESQ, OP, TC, otros diagnósticos (8). | ||||||
| Fleischhaker, 200828 | ||||||
| N=33, Edad: 9–21 años, Dur.: 45 sem. Diseño: naturalístico | OLZ>RIS=CLZ (1) | |||||
| Diagnósticos: ESQ, OP, TC, otros diagnósticos (8) | ||||||
| Fraguas, 200810 | ||||||
| N=66, Edad: 15,2±2,9, Dur.: 6 meses. Diseño: naturalítico. Diagnósticos: ESQ, BIP, OP, TC, otros diagnósticos (8) | OLZ>RIS=QTP | OLZ=RIS=QTP (7) | ||||
| Haas, 2009a17 | ||||||
| N=257, Edad: 13–17 años, Dur.: 8 sems. Diseño: ADC | RIS (1,5–6,0mg/d) >RIS (0,15–0,6mg/d) | RIS (1,5–6,0mg/d) >RIS (0,15–0,6mg/d) | RIS (1,5–6,0mg/d)=RIS (0,15–0,6mg/d) | RIS (1,5–6,0mg/d)=RIS (0,15–0,6mg/d) | RIS (1,5–6,0mg/d)= RIS (0,15–0,6mg/d) (TAD) | |
| Diagnóstico: ESQ | ||||||
| Haas, 2009b64 | ||||||
| N=169, Edad: 10–17 años, Dur.: 3 sems. Diseño: ADC. Diagnóstico: BIP | RIS>PLAC | RIS>PLAC | ||||
| Hass, 2009c52 | ||||||
| N=160, Edad: 13–17 años, Dur.: 6 sems. Diseño: ADC. Diagnóstico: ESQ | RIS (1–3mg/d)>PLAC | RIS (1–3 mg/d)>PLAC | ||||
| RIS (4–6mg/d)>PLAC | RIS (4–6mg/d)>PLAC | |||||
| RIS (4–6mg/d)>RIS (1–3mg/d) | RIS (4–6mg/d)>RIS (1–3mg/d) | |||||
| Hrdlicka, 200972 | ||||||
| N=79, Edad: 15,8±1,6 años, Dur.: 6 sems. Diseño: naturalístico. Diagnósticos: ESQ, OP | RIS=OLZ=CLZ | |||||
| Jensen, 200865 | ||||||
| N=21, Edad: 10–18 años, Dur.: 12 sems. Diseño: ANC. Diagnósticos: ESQ, OP | OLZ=QTP=RIS | |||||
| Khan, 200973 | ||||||
| N=49, Edad (media): 13 años, Dur. (media): 27 días | RIS=OLZ (1) | RIS=OLZ (TAD) | ||||
| Diseño: naturalístico. Diagnósticos: ESQ, BIP, OP | ||||||
| Kryzhanovskaya, 200918 | ||||||
| N=107, Edad: 13–17 años, Dur.: 6 sems. Diseño: ADC | OLZ>PLAC | OLZ>PLAC | OLZ=PLAC | OLZ>PLAC | OLZ=PLAC (TAD) | |
| Diagnósticos: ESQ | ||||||
| Kumra, 199666 | ||||||
| N=21, Edad: 14,0±2,3 años, Dur.: 6 sems. Diseño: ADC | CLZ=HAL | CLZ=HAL | ||||
| Diagnósticos: ESQ | ||||||
| Kumra, 200820 | ||||||
| N=39, Edad: 10–18, Dur.: 12 sems. Diseño: ADC | CLZ=OLZ (1) | OLZ>CLZ | CLZ=OLZ | |||
| Diagnósticos: ESQ | ||||||
| Migliardi, 200974 | ||||||
| N=41, Edad: 12,8±2,3, Dur.: 12 m. Diseño: naturalístico | RIS>OLZ (2) | |||||
| Diagnósticos: BIP, OP, TC, otros diagnósticos (8) | ||||||
| Mozes, 200667 | ||||||
| N=25, Edad: 11,1±1,6 años, Dur.: 12 sems. Diseño: estudio abierto no aleatorizado | OLZ=RIS | OLZ=RIS | ||||
| Diagnósticos: ESQ | ||||||
| Ratzoni, 200275 | ||||||
| N=50, Edad: 13–20 años, Dur.: 12 sems. Diseño: estudio abierto no aleatorizado | OLZ >HAL | |||||
| Diagnósticos: ESQ, TC | OLZ>RIS | |||||
| HAL=RIS | ||||||
| Saito, 200476 | ||||||
| N=40, Edad: 5–18, Dur.: 4–15 sems | RIS>OLZ=QTP | |||||
| Diseño: naturalístico | ||||||
| Diagnósticos: BIP, OP, TC, otros diagnósticos (8) | ||||||
| Shaw, 200622 | ||||||
| N=25, Edad: 7–16, Dur.: 8 sems. Diseño: ADC | CLZ=OLZ (1) | CLZ | CLZ>OLZ (TAD) | |||
| Diagnósticos: ESQ | ||||||
| Sikich, 200426 | ||||||
| N=50, Edad: 8–19, Dur.: 8 sems | OLZ=RIS=HAL (1) | OLZ=RIS=HAL | OLZ=RIS=HAL | |||
| Diseño: ADC | ||||||
| Diagnósticos: ESQ, OP | ||||||
| Sikich, 20088 | ||||||
| N=116, Edad: 8–19, Dur.: 8 sems | OLZ>RIS>MOL | RIS>MOL=OLZ | OLZ>RIS=MOL | OLZ=RIS=MOL | ||
| Diseño: ADC | ||||||
| Diagnósticos: ESQ, OP | ||||||
| Stevens, 200577 | ||||||
| N=70, Edad: 13,5±2,4, Dur.: 6 sems. Diseño: naturalístico. Diagnóstico: al menos un síntoma de los siguientes grupos: psicosis, agresividad, impulsividad y/o hipomanía | RIS>QTP (2) | |||||
| Swadi, 201068 | ||||||
| N=26, Edad: <19 años, Dur.: 6 sems. Diseño: ANC | QTP=RIS | RIS>QTP | QTP=RIS | |||
| Diagnósticos: primer episodio psicótico o afectivo con síntomas psicóticos | ||||||
| Tohen, 200719 | ||||||
| N=161, Edad: 13–17 años, Dur.: 3 sems. Diseño: ADC | OLZ>PLAC | OLZ>PLAC | OLZ>PLAC | OLZ>PLAC | OLZ>PLAC (TAS) | |
| Diagnósticos: BIP | ||||||
| Tramontina, 200969 | ||||||
| N=41, Edad: 8–17 años, Dur.: 6 sems. Diseño: ADC | ARP=PLAC | |||||
| Diagnósticos: BIP+TDAH | ||||||
| Wudarsky, 199978 | ||||||
| N=35, Edad: 9–19 años, Dur.: 6 sems. Diseño: ANC | HAL>OLZ=CLZ | |||||
| Diagnósticos: ESQ, BIP, OP |
ADC: aleatorizado doble ciego; ANC: aleatorizado no ciego; ARP: aripiprazol; BIP: trastorno bipolar; CLZ: clozapina; Dur.: duración del tratamiento de estudio; ESQ: esquizofrenia o trastorno esquizoafectivo; HAL: haloperidol; IMC: índice de masa corporal: peso(kg)/talla (m)2; MOL: molindona; N: número de sujetos incluido en el estudio; OLZ: olanzapina; OP: Otros trastornos psicóticos, que incluye trastorno esquizofreniforme, trastorno psicótico breve, trastorno psicótico no especificado, depresión con síntomas psicóticos; PLAC: placebo; QTP: quetiapina; R: rango de edad; RIS: risperidona; TA: tensión arterial; TAD: tensión arterial diastólica; TAS: tensión arterial sistólica; TC: trastorno de conducta, trastorno de conducta oposicionista desafiante o trastorno de conducta alimentaria.
El signo «>» o «<» significa «existen diferencias estadísticamente significativas (p<0,05)»: el parámetro medido con tratamiento A es mayor que con tratamiento B (A>B) o es menor (A
NOTAS:
- 1.
Los datos mostraron un aumento significativo de peso en todos los grupos de fármacos de este estudio.
- 2.
Los datos mostraron un aumento significativo de prolactina en todos los grupos de fármacos de este estudio.
- 3.
En este estudio (Correll, 2009), las disferencias inter-grupos no fueron estadísticamente significativas. Las medidas intra-grupos (antes/después) mostraron que el tratamiento con OLZ y con QTP se asoció con aumento significativo de colesterol total. El tratamiento con ARP y RIS no se asoció con aumento significativo de colesterol.
- 4.
En este estudio (Correll, 2009), las medidas intra-grupos (antes/después) mostraron que el tratamiento con OLZ, RIS y QTP se asoció con aumento significativo de triglicéridos. El tratamiento con ARP no se asoció con aumento de triglicéridos.
- 5.
Los datos mostraron un aumento significativo de perímetro abdominal en todos los grupos de fármacos de este estudio.
- 6.
El tratamiento con ARP no se asoció con un aumento significativo de peso. La diferencia con respecto al PLAC es debida a que en le grupo PLAC se produjo una pérdida de peso.
- 7.
Las diferencias inter-grupos no fueron estadísticamente significativas. Las evaluaciones intra-grupos (antes/después) hallaron aumento significativo de colesterol en los sujetos que tomaron OLZ y QTP.
- 8.
Otros diagnóstico incluye: trastorno obsesivo compulsivo, autismo, trastorno generalizado del desarrollo, trastorno por tics, trastorno por déficit de atención e hiperactividad, retraso mental, trastorno de personalidad, trastorno de Gilles de la Tourette, trastorno de ansiedad, trastornos relacionados con el abuso de cannabis.
- 9.
El tratamiento con ARP produjo una disminución leve de los niveles de prolactina; la disminución en el grupo en tratamiento con ARP fue mayor que en la rama PLAC.
Los datos de aumento de peso señalan que, en términos generales, el tratamiento con ASG se asocia con un aumento significativo de peso. Sin embargo, la magnitud del aumento de peso difiere entre los distintos ASG. La olanzapina es el ASG que se relaciona con un mayor aumento de peso8,10,13,24,27,28.
Los datos sobre aumento de colesterol y de prolactina ofrecen más controversias. En líneas generales, y tomando como referencia un reciente ensayo clínico (aleatorizado, doble ciego) realizado8, se puede señalar que el aumento de colesterol es mayor en los tratamientos con olanzapina, mientras que el aumento de prolactina es mayor en los sujetos tratados con risperidona.
Tolerabilidad: alteraciones del movimientoLa tabla 4 presenta los resultados de los estudios que comparan las alteraciones del movimiento (parkinsonismo, discinesia o acatisia) secundarias al tratamiento con antipsicóticos (tabla 4).
Resultados de estudios que comparan tolerabilidad (trastornos del movimiento)
| Artículos | Aumento de Parkinsonismo | Aumento de discinesia | Aumento de acatisia |
| Arango, 200923 | |||
| N=50, Edad. 16±1,3 años, Dur.: 6 meses Diseño: ANC. Diagnósticos: ESQ, OP | OLZ>QTP (evaluado con SAS) | OLZ=QTP (evaluado con UKU) | OLZ=QTP (evaluado con BARS) |
| Castro-Fornieles, 200824 | |||
| N=110, Edad: 9–17 años, Dur.: 6 meses Diseño: naturalístico | RIS=OLZ=QTP (evaluado con UKU) | RIS>OLZ=QTP (evaluado con UKU) | RIS=OLZ=QTP (evaluado con UKU) |
| Diagnósticos: ESQ, BIP, OP | |||
| DelBello, 200261 | |||
| N=30, Edad: 12–18 años, Dur.: 6 sems Diseño: ADC (valproico + QTP versus valprocio +PLAC). Diagnóstico: BIP | QTP=PLAC (evaluado con SAS) | QTP=PLAC (evaluado con AIMS) | QTP=PLAC (evaluado con BARS) |
| DelBello, 200962 | |||
| N=32, Edad: 12–18 años, Dur.: 8 sems Diseño: ADC. Diagnóstico: BIP | QTP=PLAC (evaluado con SAS) | QTP=PLAC (evaluado con AIMS) | |
| Findling, 200816 | |||
| N=302, Edad: 13–17 años, Dur.: 6 sems | ARP>PLAC (evaluado con SAS) | ARP=PLAC (evaluado con AIMS) | ARP=PLAC (evaluado con BARS) |
| Diseño: ADC. Diagnósticos: ESQ | |||
| Gothelf, 200325 | |||
| N=43, Edad: 17±2 años, Dur.: 8 sems | HAL>RIS=OLZ (evaluado com UKU) | ||
| Diseño: naturalístico | |||
| Diagnósticos: ESQ | |||
| Haas, 2009a17 | |||
| N=257, Edad: 13–17 años, Dur.: 8 sems | RIS (1,5–6,0mg/d) >RIS (0,15–0,6mg/d) (evaluado con SAS) | RIS (1,5–6,0mg/d) >RIS (0,15–0,6mg/d) (evaluado con AIMS) | RIS (1,5–6,0mg/d) >RIS (0,15–0,6mg/d) (evaluado con BARS) |
| Diseño: ADC. Diagnósticos: ESQ | |||
| Hass, 2009c52 | |||
| N=160, Edad: 13–17 años, Dur.: 6 sems Diseño: ADC. Diagnóstico: ESQ | RIS (1–3mg/d)= RIS (4–6mg/d)=PLAC (evaluado con SAS) | RIS (1–3mg/d)= RIS (4–6mg/d)=PLAC (evaluado con AIMS) | RIS (1–3mg/d)= RIS (4–6mg/d)=PLAC (evaluado con BARS) |
| Jensen, 200865 | |||
| N=21, Edad: 10–18 años, Dur.: 12 sems Diseño: ANC. Diagnósticos: ESQ, OP | OLZ=QTP=RIS (evaluado con SAS) | OLZ=QTP=RIS (evaluado con AIMS) | |
| Kryzhanovskaya, 200918 | |||
| N=107, Edad: 13–17 años, Dur.: 6 sems Diseño: ADC. Diagnósticos: ESQ | OLZ=PLAC (evaluado con SAS) | OLZ=PLAC (evaluado con AIMS) | OLZ=PLAC (evaluado con BARS) |
| Mozes, 200667 | |||
| N=20 (completaron seguimiento), Edad: 11,1±1,6 años, Dur.: 12 sems | RIS=OLZ (evaluado con SAS) | RIS=OLZ (evaluado con BARS) | |
| Diseño: ANC. Diagnóstico: ESQ | |||
| Shaw, 200622 | |||
| N=25, Edad: 7–16 años, Dur.: 8 sems Diseño: ADC. Diagnósticos: ESQ | CLZ=OLZ (evaluado con SAS) | CLZ=OLZ (evaluado con AIMS) | |
| Sikich, 200426 | |||
| N=50, Edad: 8–19 años, Dur.: 8 sems | HAL>OLZ=RIS (evaluado con SAS) | HAL=OLZ=RIS (evaluado con AIMS) | |
| Diseño: ADC. Diagnósticos: ESQ, OP | |||
| Sikich, 20088 | |||
| N=116, Edad: 8–19 años, Dur.: 8 sems | OLZ=RIS=MOL (evaluado con SAS) | OLZ=RIS=MOL (evaluado con AIMS) | OLZ=RIS=MOL (1) (evaluado con BARS) |
| Diseño: ADC. Diagnósticos: ESQ, OP | |||
| Swadi, 201068 | |||
| N=26, Edad: <19 años, Dur.: 6 sems Diseño: ANC. Diagnósticos: primer episodio psicótico o afectivo con síntomas psicóticos | QTP=RIS (evaluado con SAS) | QTP=RIS (evaluado con AIMS) | QTP=RIS (evaluado con BARS) |
| Tohen, 200719 | |||
| N=161, Edad: 13–17 años, Dur.: 3 sems | OLZ=PLAC (evaluado con SAS) | OLZ=PLAC (evaluado con AIMS) | OLZ=PLAC (evaluado con BARS) |
| Diseño: ADC. Diagnósticos: BIP | |||
| Tramontina, 200969 | |||
| N=41, Edad: 8–17 años, Dur.: 6 sems Diseño: ADC. Diagnósticos: BIP+TDAH | ARP=PLAC (evaluado con una checklist de efectos adversos elaborada por los autores) | ARP=PLAC (evaluado con una checklist de efectos adversos elaborada por los autores) |
ADC: aleatorizado doble ciego; AIMS: abnormal involuntary movement scale, escala de evaluación de movimiento involuntarios anormales79; ANC: aleatorizado no ciego; ARP: aripiprazol; BARS: Barnes Akathisia rating Scale, escala de evaluación de acatisia de Barnes80; BIP: trastorno bipolar; CLZ: clozapina; Dur..: duración del tratamiento de estudio; ESQ: esquizofrenia o trastorno esquizoafectivo; HAL: haloperidol; MOL: molindona; N: número de sujetos incluido en el estudio; OLZ: olanzapina; OP: otros trastornos psicóticos, que incluye trastorno esquizofreniforme, trastorno psicótico breve, trastorno psicótico no especificado, depresión con síntomas psicóticos; PLAC: placebo; QTP: quetiapina; R: rango de edad; RIS: risperidona; SAS: escala Simpson Angus81; UKU: Udvalg for Kliniske Undersøgelser, escala de efectos adversos de fármacos82.
El signo «>» significa «existen diferencias estadísticamente significativas (p<0,05); el parámetro medido con tratamiento A es mayor que con tratamiento B (A>B)». El signo «=» significa que no hubo diferencias en las medidas comparadas, o que si las hubo, éstas no fueron estadísticamente significativas.
NOTAS:
- 1.
El análisis de llas medidas intra-grupos (antes/después) mostró que el tratamiento con MOL se asoció con aumento estadísticamente significativo de acatisia; no así el tratamiento con OLZ o RIS.
Los estudios de alteraciones del movimiento relacionadas con el tratamiento con antipsicóticos en niños y adolescentes han mostrado que el consumo de ASG se asocia con menor incidencia de parkinsonismo o acatisia que el consumo de APG (utilizando el haloperidol y la molindona, como referentes de APG)8,26.
DiscusiónLos datos de esta revisión permiten extraer dos conclusiones generales: 1) Los estudios que han comparado la eficacia clínica de distintos ASG en el tratamiento de niños y adolescentes con trastornos psicóticos no han encontrado diferencias significativas en las medidas de eficacia, con la excepción de la superioridad de la clozapina en pacientes con esquizofrenia refractaria a tratamiento20–22, y 2) La incidencia y la intensidad de los efectos adversos de los ASG dependen, en gran medida, del fármaco empleado, sin que se pueda establecer un patrón global de tolerabilidad de los ASG en niños y adolescentes. Es decir, los ASG no conforman un grupo homogéneo de fármacos, sino que bajo la denominación de ASG se encuentran medicamentos de diferentes perfiles. Estos resultados ponen sobre la mesa la importancia del perfil diferencial de los antipsicóticos en función de los efectos secundarios, especialmente de las complicaciones metabólicas.
Estudios de revisión sobre efectos secundarios de los antipsicóticos de segunda generaciónLa última década del siglo xx contempló un aumento espectacular en el uso de ASG en niños y adolescentes, auspiciado, entre otras cosas, por las grandes expectativas puestas en los ASG, entre las que destaca su presunta seguridad. En una publicación reciente, Vitiello et al3 revisan los principales factores que han contribuido al aumento de la prescripción de ASG en población infanto-juvenil. Destacan tres grandes aspectos: el auge en las dos últimas décadas del siglo xx del empleo de un modelo médico de enfermedad para explicar las alteraciones emocionales y comportamentales de niños y adolescentes, la aparente seguridad de los ASG frente a los antiguos APG, y la tendencia general a reducir los días de estancia en las unidades de hospitalización de psiquiatría, con la consiguiente presión a los clínicos por conseguir una más pronta estabilización3. Sin embargo, pese a la incuestionable utilidad de los ASG en el tratamiento de diferentes trastornos psiquiátricos en niños y adolescentes, el hallazgo de sus efectos adversos ha puesto en entredicho su supuesta seguridad. Por ello, en esta primera década del siglo xxi han aparecido distintos trabajos de revisión sobre los efectos secundarios de los ASG en niños y adolescentes1,3,12,29–43. Las primeras revisiones enfatizaron la importancia de estudiar los efectos secundarios de los ASG en población infanto-juvenil, ya que la inferencia de que los efectos de estos fármacos en niños y adolescentes eran equivalentes a los hallados en adultos suponía una gran limitación. Como después demostraron los datos, la respuesta de los ASG en niños y adolescentes no es directamente trasladable a la de los adultos: los estudios en población infanto-juvenil han encontrado que los efectos secundarios de los ASG son más acusados en niños y adolescentes que en adultos12,42,44. Los aumentos de peso y de prolactina secundarios al tratamiento con ASG son, de forma consistente en distintos estudios, mayores en niños y adolescentes que en adultos29. Además, en relación con el aumento de peso en niños y adolescentes pueden aparecer otros problemas como diabetes mellitus e hiperlipidemia, que condicionan notablemente la morbilidad futura.
Desde un principio, las revisiones en este campo han destacado que, con respecto a los efectos secundarios, los ASG no conforman un grupo homogéneo45,46. El efecto sobre el peso es un ejemplo paradigmático de esta heterogeneidad: los fármacos asociados con mayor aumento de peso han sido la clozapina y la olanzapina, mientras que la risperidona y la quetiapina se han asociado con un aumento moderado y la ziprasidona y aripiprazol con un bajo riesgo de aumento de peso30,31. Por otro lado, una reciente revisión sistemática (de artículos publicados entre 1965 y 2008) sobre el efecto de los antipsicóticos (APG y ASG) en los niveles de prolactina de niños y adolescentes ha mostrado que, entre los fármacos estudiados (haloperidol, pimozida, risperidona, olanzapina, clozapina, ziprasidona y quetiapina), todos los antipsicóticos, excepto la clozapina, ziprasidona y la quetiapina, incrementaban los niveles de prolactina, sin que el aumento de prolactina pueda servir para discriminar entre APG y ASG32.
Nuestra revisión ha evaluado un conjunto de trabajos muy heterogéneos, tanto en metodología, como en tiempo de seguimiento y tamaño muestral. Por ello, hay tener en cuenta estas limitaciones a la hora de realizar comparaciones entre los resultados de distintos estudios. La selección de los estudios incluidos en esta revisión impide realizar análisis estadísticos complejos como meta-análisis o estudios de cálculo NNT (número necesario para tratar) o number needed to harm (NNH, ‘número necesario para dañar’). Pese a ello, hemos decidido incluir todos estos artículos para ofrecer una revisión de todos los datos publicados hasta la fecha sobre resultados de comparativas de eficacia y tolerabilidad entre distintos ASG en población infanto-juvenil.
Los niños y adolescentes son más vulnerables que los adultos a los efectos secundarios de los antipsicóticosLos estudios de los ASG en población pediátrica han demostrado ser fundamentales, dado que los niños y adolescentes no solo son más vulnerables a los efectos secundarios de los fármacos antipsicóticos que los adultos, sino que además son más sensibles al impacto negativo que dichos efectos ejercen sobre la imagen corporal o la autoestima1.
En este sentido, el perfil diferencial de los antipsicóticos cobra un valor señalado en la población infanto-juvenil. Los niños y adolescentes son mucho más vulnerables que los adultos, desde la mirada del desarrollo de la personalidad, a cambios físicos como el que conlleva el aumento de peso1,3,29,42. Por otro lado, se ha comprobado que existe una fuerte relación entre la obesidad infantil y el riesgo cardiovascular infantil y adulto, esto es, los niños con obesidad tendrán, cuando sean adultos, un mayor riesgo cardiovascular que la población general47. Los sujetos tratados con antipsicóticos tienen, como hemos visto, mayor riesgo metabólico que aquellos que no toman antipsicóticos. Pero este mayor riesgo en las personas con trastornos psicóticos no solo es debido al tratamiento farmacológico. La presencia de un trastorno psicótico supone, en población adulta y probablemente también en niños y adolescentes (aún faltan estudios específicos en este grupo de edad), un mayor riesgo per se de aparición de complicaciones metabólicas. Es decir, las personas con psicosis tienen mayor riesgo metabólico que la población general, independientemente del tratamiento48. Esto implica que la vigilancia del riesgo cardiovascular en esta población infanto-juvenil es «triplemente» importante: por ser niños o adolescentes, por padecer psicosis y por tomar antipsicóticos.
Por supuesto, de igual manera que los sujetos con psicosis tienen más riesgo cardiovascular que la población general, cabe esperar que entre las distintas patologías que componen el heterogéneo grupo de los trastornos psicóticos, no todas asocien el mismo grado de riesgo metabólico. En línea con este planteamiento, un estudio reciente ha encontrado que entre los niños y adolescentes en tratamiento con ASG, la incidencia de síndrome metabólico asociada al tratamiento con ASG en adolescentes naïve para antipsicóticos es significativamente mayor en los pacientes con diagnóstico de trastorno bipolar que en sujetos con otros diagnósticos49. Estos datos nos emplazan a estudiar los, por ahora desconocidos, mecanismos fisiopatológicos que subyacen a esta asociación.
Relación entre los efectos adversos y la dosis de los fármacosLa experiencia clínica sugiere la existencia de una relación entre la dosis de ASG y la aparición de efectos secundarios. Sin embargo, son pocos los estudios que hayan investigado esta asociación. Una reciente revisión sobre este tema ha destacado que existe una correlación positiva entre el aumento de peso y las concentraciones plasmáticas de olanzapina y clozapina, aunque la relación entre el aumento de peso y las dosis es más controvertida. Los datos con respecto a risperidona son aún menos concluyentes50. Esta revisión llama la atención sobre la ausencia de información entre aumento de peso y dosis de otros ASG.
Con respecto al incremento de prolactina secundario al tratamiento con ASG en población infanto-juvenil, un estudio con sujetos procedentes de diferentes muestras ha encontrado una relación significativa entre las concentraciones plasmáticas de olanzapina y los niveles de prolactina, mientras que no encontró esta relación entre los tratados con haloperidol y clozapina51. Por otro lado, un estudio reciente ha hallado una relación positiva entre la dosis de risperidona y el aumento de prolactina en un seguimiento de 6 meses52.
Duración del tratamientoLa duración del tratamiento constituye una variable clave en el estudio de los efectos secundarios de los ASG. Sin embargo, la corta duración del seguimiento de los estudios de eficacia y tolerabilidad destaca, de manera casi sistemática, como limitación habitual de los estudios publicados37. Los estudios sobre complicaciones metabólicas analizados en esta revisión tienen unas cifras medias de duración del seguimiento (y, por tanto, de tratamiento) de 14,6 semanas, sin que llegue, en ningún caso, a superar un año. Esta corta duración del seguimiento podría limitar el valor de los hallazgos, sobre todo a la luz de recientes resultados que han cuestionado la estabilidad temporal de las diferencias de los efectos secundarios metabólicos entre distintos fármacos. Un estudio controlado y aleatorizado, con sujetos españoles, tanto adolescentes como adultos (N=144; Edad: 15–60 años), tratados con antipsicóticos (olanzapina, risperidona, y haloperidol), ha mostrado que a los 3 meses de tratamiento el aumento de peso era mayor en los pacientes tratados con olanzapina que en el resto (olanzapina>risperidona=haloperidol), mientras que a los 12 meses esta diferencia no era significativa (olanzapina=risperidona=haloperidol)53. Por otro lado, un estudio reciente, realizado también en población española, compara los efectos secundarios de antipsicóticos (APG y ASG) entre niños y adolescentes tratados durante menos de 30 días y sujetos tratados durante más de 12 meses. El grupo de sujetos con más de 12 meses de exposición a antipsicóticos presentó incrementos significativamente mayores de peso, colesterol, parkinsonismo y discinesia que los sujetos tratados durante menos de 30 días. No se encontraron diferencias entre ambos grupos en niveles de triglicéridos, tensión arterial o acatisia54.
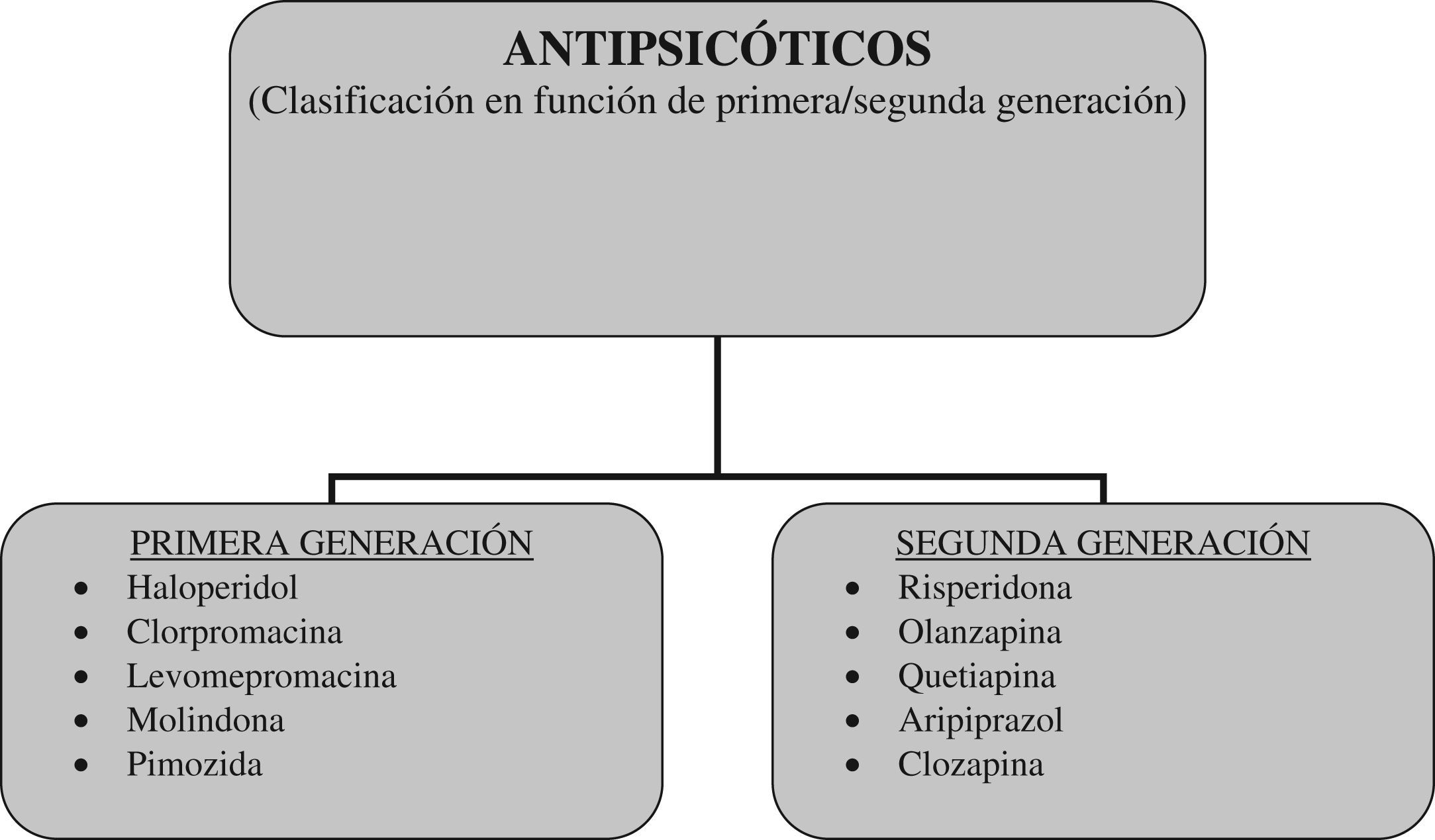
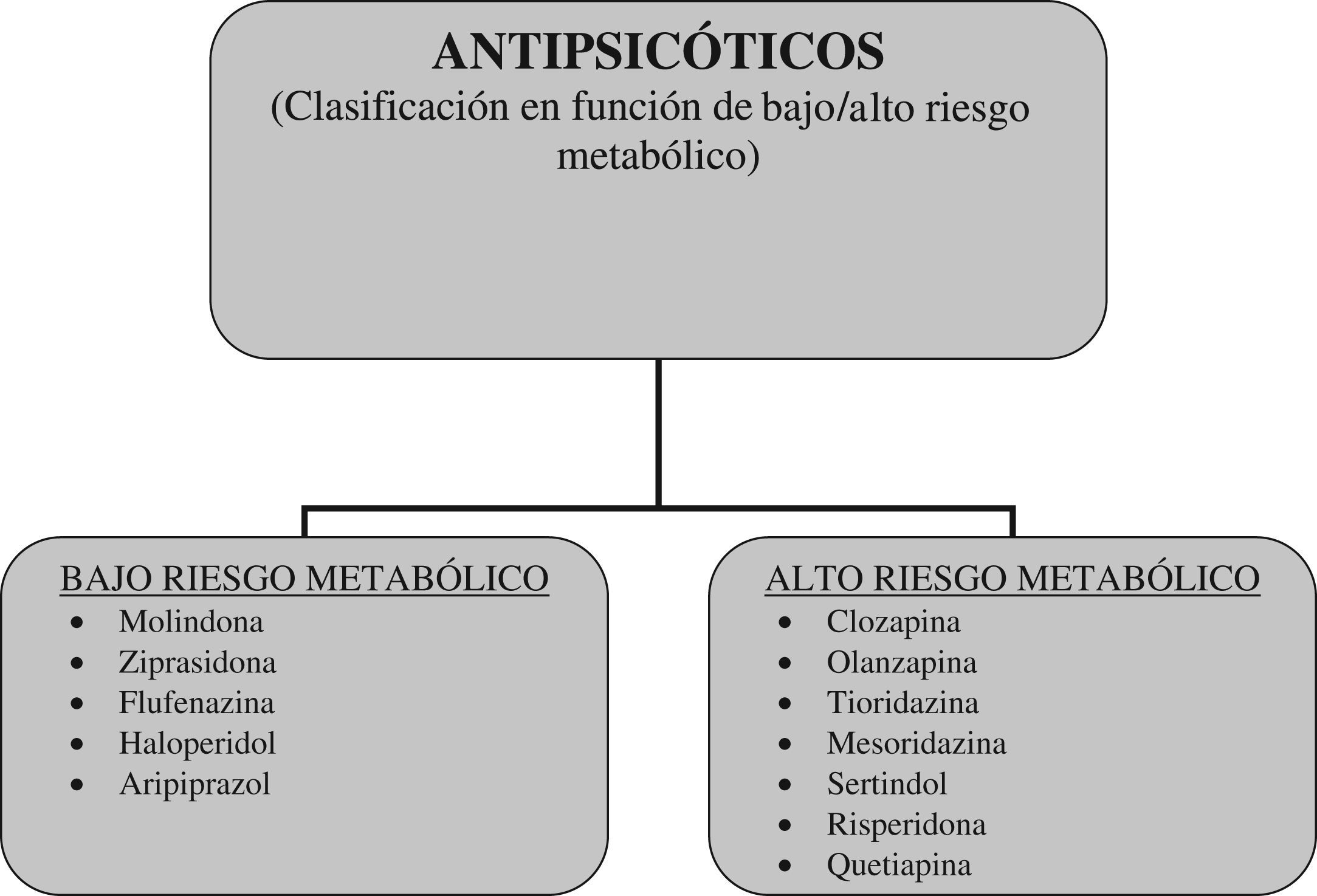
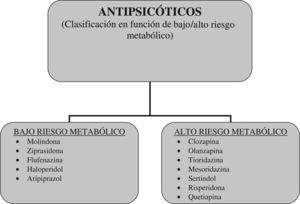
¿Es válida la distinción entre antipsicóticos de primera y segunda generación?Los datos sobre eficacia y tolerabilidad de los antipsicóticos ponen en cuestión la validez conceptual de la distinción entre APG y ASG. Un reciente meta-análisis, que ha comparado la eficacia y la tolerabilidad de APG y ASG en el tratamiento de adultos con esquizofrenia, ha destacado que los fármacos que componen el grupo de los ASG difieren en muchas propiedades y no forman un grupo homogéneo46. Repetidas voces han llamado la atención en los últimos años sobre la falta de homogeneidad de los ASG como grupo, tanto en su uso en adultos como en niños y adolescentes45,46,55,56. A la luz de estos datos, y considerando que las principales diferencias entre los ASG se refieren a los efectos adversos metabólicos, se ha propuesto sustituir la clasificación APG versus ASG por otra que distinga a los antipsicóticos en función de su riesgo metabólico. En este sentido se han pronunciado recientemente Carmel y Gorman, quienes han planteado introducir una clasificación de antispicóticos basada en el riesgo metabólico57. En esta clasificación propuesta, los antipsicóticos con bajo riesgo metabólico serían: molindona, ziprasidona, flufenazina, haloperidol, aripiprazol, mientras que los antipsicóticos con alto riesgo metabólico serían: clozapina, olanzapina, tioridazina, mesoridazina, sertindol, risperidona, quetiapina57 (fig. 2).
Clasificación de los antipsicóticos en función de su riesgo metabólico (bajo/alto riesgo metabólico) (basado en Carmel y Gorman, 200957).
La importancia de estos hallazgos subraya la necesidad de una monitorización cuidadosa de los efectos adversos de los ASG tanto en pacientes adultos como en niños y adolescentes58. Sin embargo, como hemos señalado a lo largo de esta revisión, los niños y adolescentes son especialmente vulnerables a los efectos adversos de los antipsicóticos. Por ello, es muy importante anticipar los riesgos implicados en el tratamiento con ASG en población infanto-juvenil para prevenir, en la medida de lo posible, las complicaciones derivadas del uso de estos fármacos (tabla 5). A tenor de todo esto, consideramos que la realización de un control rutinario de los efectos adversos de los ASG prescritos, incorporando tanto a los pacientes como a sus familiares en la evaluación de los riesgos-beneficios del uso de los medicamentos resulta de un valor fundamental. Desde la aparición de las primeras señales de alarma sobre los efectos metabólicos de los SGA en adultos, diferentes autores e instituciones han publicado guías de recomendación de control de los efectos adversos. Aunque estas guías han tenido, por lo general, poco impacto en el quehacer cotidiano de los médicos clínicos59, nosotros queremos enfatizar su importancia. Por ello, presentamos en la tabla 5 una guía de recomendación de la monitorización de los efectos adversos de los ASG en niños y adolescentes, basada en el trabajo de Correll (2008)9. En el caso de que aparecieran efectos secundarios graves sería necesario considerar un cambio a un medicamento de menor riesgo9.
Monitorización de efectos adversos de ASG en niños y adolescentes (Adaptado de Correll, 20089)
| Evaluación | Frecuencia |
| Historia personal y familiar |
|
| Estilos de vida saludables |
|
| Peso, talla, índice de masa corporal |
|
| Somnolencia /sedación |
|
| Función sexual |
|
| Tensión arterial, frecuencia cardiaca |
|
| Glucemia, perfil lipídico |
|
| Iones, hemograma, función renal, función hepática |
|
| Prolactina |
|
| Síntomas extrapiramidales, acatisia |
|
| Discinesia tardía |
|
| Electrocardiograma |
|
Este trabajo ha recibido apoyo editorial de Adelphi Targis, S.L y ha recibido financiación de BMS. Los autores asumen toda la responsabilidad por la información contenida en el manuscrito.