No hay datos experimentales que confirmen si, en cuanto al patrón de funcionamiento neuropsicológico, los pacientes con esquizofrenia resistente al tratamiento con neurolépticos difieren de los pacientes que muestran una respuesta farmacológica adecuada.
MétodoSe reclutó a 52 pacientes con psicosis resistente a tratamiento farmacológico (ERT) y 42 pacientes con esquizofrenia no resistente a tratamiento (ENRT), siguiendo los criterios de Kane et al (1988). Además, se reclutó una muestra de 46 controles sanos (NC) apareados por edad, sexo y nivel educativo. Las medidas clínicas incluidas fueron las escalas PANSS (Escala de Síntomas Positivos y Negativos), de discapacidad funcional (WHO-DAS) y de Impresión Clínica Global (CGI).
ResultadosMediante el empleo de análisis factorial confirmatorio, obtuvimos una estructura cognitiva latente de seis factores cognitivos: atención, velocidad de procesamiento, memoria verbal, memoria de trabajo, fluidez verbal y funciones ejecutivas. Como era esperable, el grupo control rindió mejor que los dos grupos de pacientes (tanto ERT como ENRT) en todos los dominios neuropsicológicos. Además, el grupo ERT rindió en tareas atencionales significativamente peor que el grupo ENRT, a pesar de que no diferían en edad de inicio de la enfermedad, número de hospitalizaciones y tiempo de hospitalización. Desde el punto de vista clínico, el grupo ERT presentaba mayor severidad de síntomas positivos (p<0,01) y mayor deterioro general (p<0,01), lo que no se traducía en mayor discapacidad funcional.
ConclusionesLos resultados obtenidos no permiten concluir la existencia de un perfil neuropsicológico específico en pacientes no respondedores al tratamiento con neurolépticos. El único parámetro diferencial fue el rendimiento en el dominio atencional. Nuestros hallazgos son más coherentes con la hipótesis del «fenómeno clínico continuo» y se distancian de la clasificación categórica de este trastorno mental.
There are no experimental data that demonstrate whether patients with neuroleptic-resistant schizophrenia differ or not in their pattern of neuropsychological functioning from patients with adequate drug response.
MethodFifty-two patients with drug-resistant psychosis (DRP) and 42 patients with schizophrenia not resistant to treatment (NDRP) were recruited following the criteria of Kane et al (1988). A sample of 45 healthy controls matched by age, sex and educational level was also recruited. The clinical evaluations used were the Positive and Negative Symptom Scale (PANSS), functional disability (WHO-DAS) and the Clinical Global Impression (CGI) scale.
ResultsThrough the use of confirmatory factor analysis, we obtained a latent cognitive structure of six cognitive factors: attention, processing speed, verbal memory, working memory, verbal fluency and executive functions. As expected, the control group performed better than the two patient groups (both DRP and NDRP) in all neuropsychological domains. Additionally, the DRP group scored significantly worse in attention than the NDRP group even though no differences between these two groups were found in age of disease onset, number of hospitalizations or length of hospitalization. From a clinical point of view, the DRP group showed greater severity of positive symptoms (p<0.01) and higher global deterioration (p<0.01), which did not translate into greater functional disability.
ConclusionsThe results obtained do not allow us to conclude that there is a specific neuropsychological profile in neuroleptic-resistant patients. The only differential parameter was performance in the attentional domain. Our findings better fit the hypothesis of a «clinical continuum» and differ from the categoric classification of this mental disorder.
La literatura científica ha señalado que los pacientes con esquizofrenia que muestran una mejoría con tratamiento antipsicótico y los que permanecen severamente sintomáticos a pesar del tratamiento farmacológico adecuado podrían representar dos subgrupos de pacientes con una patogenia diferenciada1–3. La esquizofrenia resistente al tratamiento (ERT) fue definida por Kane et al4 en el Clozapine Registration Trial como la falta de respuesta terapéutica del paciente a tres antipsicóticos diferentes a grandes dosis.
Los estudios previos que han identificado variables predictoras de buen o mal pronóstico en la esquizofrenia resistente al tratamiento (ERT) concluyen que el sexo femenino5, la edad de inicio tardía6, la ausencia de complicaciones obstréticas en el nacimiento7 y la menor presencia de signos neurológicos menores8 son predictores de buena respuesta terapéutica. Por el contrario, un mal ajuste premórbido7,9, un mal ajuste psicosexual durante la adolescencia tardía10, la duración de la psicosis no tratada11,12 y la calidad de vida13 se asocian a una respuesta no favorable al tratamiento antipsicótico. Sin embargo, los resultados de estudios sobre otras variables fisiológicas no han sido concluyentes hasta la fecha. Hay evidencia de que hallar altas concentraciones de ácido homovalínico antes del tratamiento se podría relacionar con una mejor respuesta a los fármacos antipsicóticos en la esquizofrenia14,15. No obstante, los estudios de neuroimagen con tomografía computarizada por emisión positrónica (PET) y monofotónica (SPECT) han hallado grados similares de ocupación de los receptores D2 en pacientes con ERT y pacientes que responden al tratamiento con antipsicóticos típicos16.
Estos hallazgos explicarían también la falta de mejoría por ambos grupos, respondedores y no respondedores, ante aumentos de las dosis significativos17. Todos estos resultados respaldan la hipótesis de que los pacientes con ERT podrían representar un fenotipo de esquizofrenia distinto1.
La disparidad de resultados en los estudios puede deberse en parte a la falta de consenso para definir el concepto de ERT. Originalmente, el concepto de ERT era sinónimo de esquizofrenia crónica o historia de múltiples hospitalizaciones18. La publicación de criterios alternativos por Kane et al4 y el Remission in Schizophrenia Working Group19 propiciaron una mayor caracterización del concepto y, en consecuencia, un aumento de la investigación experimental que trató de identificar las características particulares de este perfil en la esquizofrenia16,20–22. Los criterios del Remission in Schizophrenia Working Group se basan en la ausencia o la persistencia de algunos síntomas positivos y negativos medidos mediante las escalas PANSS, SANS/SAPS y BPRS.
Los criterios de Kane han mostrado una serie de inconvenientes que los conviertien en una herramienta de difícil utilización en el ámbito clínico, por las siguientes razones:
- •
Se basan sólo en la persistencia de síntomas positivos e ignoran la severidad de otros síntomas como los negativos o cognitivos. Sin embargo, serían los síntomas negativos, de acuerdo con hallazgos posteriores23, lo que explica gran parte de la variación de la discapacidad funcional en la esquizofrenia.
- •
Establecen clasificaciones rígidas de pacientes respondedores y no respondedores. Esta dicotomía no explica con precisión un hecho frecuentemente observado en la práctica clínica, y es que la respuesta al tratamiento se entiende mejor como un continuo más que como una dicotomía. La mayoría de los pacientes se incluirían en la categoría de «respondedores subóptimos» de Barnes et al17.
Por todo ello, los criterios de Kane han resultado ser excesivamente estrictos en su aplicación a la práctica clínica. Con todo, son los criterios de resistencia al tratamiento más fiables y más ampliamente utilizados en el ámbito de la investigación.
Con posterioridad al desarrollo de este estudio, el Remission in Schizophrenia Working Group19 desarrolló una definición consensuada de remisión aplicable a la esquizofrenia. Así, se definió la remisión utilizando un umbral absoluto de severidad de síntomas diagnósticos de la esquizofrenia, más que un porcentaje de mejoría a partir de una línea basal. Estos criterios de remisión definen la remisión como un nivel de intensidad de los síntomas bajo-medio, donde la ausencia o la presencia límite o leve de síntomas no influye en la conducta del individuo. Este grupo de trabajo excluye explícitamente de los criterios la mejoría en síntomas cognitivos y funcionamiento psicosocial por la falta de hallazgos en estos ámbitos. Aunque estos criterios definen con precisión lo que significa la remisión, fallan a la hora de designar todos los casos que se encuentran por encima del umbral de severidad de síntomas, por lo que no se los puede considerar en remisión. No está claro si se debería considerar estos casos de falta de remisión como no respondedores, refractarios o pacientes con ERT.
Ninguno de estos dos criterios (Kane y Andreasen) incluye factores cognitivos o funcionales, a pesar de la abundante evidencia que apoya la relevancia de estos déficit en la esquizofrenia, especialmente en las muestras crónicas. Dicha literatura ha confirmado un deterioro cognitivo específico y generalizado en pacientes con ERT en comparación con pacientes con esquizofrenia no resistente a tratamiento (ENRT). Joober et al24 publicaron el primer estudio basado específicamente en un subgrupo de pacientes con ERT con el objetivo de analizar el grado específico de deterioro en siete dominios cognitivos: atención-vigilancia, abstracción-flexibildad, organización espacial, procesamiento visuomotor, memoria visual, habilidades verbales y memoria verbal. Compararon a 39 pacientes con ERT, 36 pacientes con ENRT y 36 controles apareados. Tanto los pacientes con ERT como los de ENRT obtuvieron puntuaciones significativamente inferiores que el grupo control en todos los dominios evaluados. Sin embargo, los pacientes con ENRT presentaron la remisión total de los síntomas, no tuvieron recaídas y rindieron significativamente mejor que los pacientes con ERT en habilidades verbales, aprendizaje y memoria verbal y memoria visual. Consecuentemente, Joober et al indicaron que la peor respuesta a fármacos antipsicóticos y el deterioro cognitivo son dos rasgos compartidos por un subgrupo específico de pacientes. Además, los autores concluyeron que las variables neuropsicológicas podrían ser un marcador de la respuesta al tratamiento farmacológico en la ERT. Los déficit neuropsicológicos varían en el perfil y la severidad de la esquizofrenia25, y dicha dispersión podría esconder posibles perfiles de subgrupos en la enfermedad.
Este interesante hallazgo se opone a hipótesis previas1 acerca de la dificultad para subclasificar a los pacientes con esquizofrenia en subgrupos según su respuesta al tratamiento farmacológico. Barnes et al17 señalan que los pacientes con esquizofrenia podrían ser clasificados en grupos con una respuesta óptima al tratamiento frente a los que muestran una respuesta no óptima o mediante una variable de respuesta continua, más que categórica, de grupo de respondedores frente a no respondedores.
Por lo tanto, nuestro objetivo en este estudio es analizar la contribución de las variables neuropsicológicas como predictores diferenciales de la respuesta al tratamiento farmacológico en pacientes con esquizofrenia. Hipotetizamos que: a) los pacientes con ERT y ENRT presentarían un deterioro cognitivo significativo en comparación con el grupo control; b) el grupo de ERT presentaría unas tasas de deterioro cognitivo superiores a las mostradas por el grupo de ENRT, y c) en el grupo de ERT, el perfil cognitivo se relacionaría de manera diferencial con el resultado clínico y funcional.
MétodosParticipantesSe reclutó a 95 pacientes hospitalizados en el Hospital Psiquiátrico de Álava (76 varones, 14 mujeres; años de educación formal, 10,17±2,8), con edades de 18 a 65 años (media, 36,09±10,68). Los pacientes fueron diagnosticados de esquizofrenia según criterios del DSM-IV)26, mediante la entrevista clínica semiestructurada SCID-I. Los criterios de exclusión fueron historia previa de traumatismo craneoencefálico con más de 1h de pérdida de conciencia, retraso mental o condición neurológica relevante (accidente cerebrovascular, hipertensión o déficit sensoriales significativos).
La asignación a los grupos de ERT o ENRT se realizó en dos pasos. Primero se identificó a los pacientes con pobre respuesta al tratamiento de acuerdo con las historias clínicas y el juicio clínico del psiquiatra. En segundo lugar, siguiendo las directrices de Joober et al24, se estableció si los pacientes cumplían criterios de resistencia al tratamiento antipsicótico o no. Se clasificó a 52 como pacientes con ERT y a 43 como con ENRT, en concordancia con los criterios de Kane et al4.
Los pacientes con ERT debían cumplir, además de los criterios de inclusión:
- •
Historia de haber seguido tres o más periodos de tratamiento en los últimos 5 años con al menos dos fármacos antipsicóticos de familias diferentes, con una dosis equivalente a 1.000mg/día de clorpromazina por un periodo de 6 semanas sin un alivio significativo.
- •
Ausencia de un periodo de buen funcionamiento en los 5 años anteriores.
- •
En el momento de la evaluación debía presentar una puntuación en la Brief Psychiatric Rating Scale (BPRS)28 > 45 y en la escala CGI > 4.
- •
Una puntuación de 4 (moderado) en al menos dos de los siguientes ítems de la BPRS (desorganización conceptual, pensamientos inusuales, conducta alucinatoria y suspicacia).
- •
Fracaso en la reducción de un 20% del BPRS, así como un BPRS > 35 o un CGI > 3 tras un ensayo de tratamiento con haloperidol con dosis de entre 10 y 60mg/día.
Para salvar la dificultad de la bioequivalencia a la dosis de 1.000mg/día de clorpromazina para los antipsicóticos nuevos que no existían en el momento en que se publicaron los criterios de Kane et al, nuestro equipo empleó la solución propuesta por Woods27.
En el grupo de pacientes con ENRT, se incluyó a todos los pacientes que cumplieran los criterios de inclusión pero no cumplieran los criterios de refractariedad, es decir, que presentaran en su historia clínica periodos demostrables de buena respuesta clínica a los antipsicóticos. Este hecho se midió con una reducción en el BPRS superior al 20% y una puntuación total del BPRS<35 y en el CGI<3. Se seleccionó un número equivalente de casos de ERT al tamaño de la muestra del subgrupo de no respondedores (ENRT).
Para el grupo control (GC, se reclutó a 46 controles sanos a través de anuncios en periódicos o instituciones públicas. Se los seleccionó por edad, sexo, nivel educativo y características socioeconómicas para aparearlos con los grupos de pacientes. Se les realizó una entrevista clínica para descartar historia previa o actual de algún trastorno psiquiátrico, condición médica relevante para el sistema nervioso central o déficit sensoriales significativos. Los grupos no diferían en edad (F=1,09; p=0,34), sexo (χ2=5,93; p=0,06) o años de educación formal recibida (F=0,77; p=0,47). Se excluyó a 12 participantes del GC tras la entrevista inicial por no cumplir los criterios de inclusión.
Todos los sujetos (pacientes y grupo control) fueron voluntarios y dieron su consentimiento escrito para participar en el studio. El protocolo fue aprobado por el comité ético del hospital.
Evaluación clínicaTodos los pacientes fueron evaluados mediante una entrevista clínica y se les aplicaron las escalas PANNS29, BPRS y CGI. La discapacidad funcional fue evaluada mediante la WHO-DAS30. El cociente de fiabilidad entre examinadores para las escalas se estableció en un mínimo de kappa=0,8. Al final del periodo de entrenamiento, los valores de fiabilidad obtenidos se encontraban entre 0,83 y 0,91 para PANSS, BPRS, CGI y DAS-WHO.
Evaluación neuropsicológicaAtenciónBrief Test of Attention. El BTA31 consiste en dos formas paralelas que se presentan de forma oral. En la forma N (números), se le leen diez listas de letras y números que aumentan progresivamente en amplitud de 4 a 18 ítems. La tarea del participante es dejar a un lado las letras presentadas y contar cuántos números había en la lista. En la forma L (letras), se presenta la misma lista pero en este caso tiene que dejar de lado los números y contar cuántas letras había en la lista.
Memoria verbalSe utliizó la versión española de Memoria lógica de la Escala Weschler de Memoria-III del WAIS-III (WMS-III)32. En este test, el examinador lee dos historias, parando tras cada una de ellas, y le pide al participante que escriba todo lo que recuerde de la historia. Tras 20min, se le pide que recuerde las dos historias leídas anteriormente. Así se obtiene dos medidas, memoria inmediata (MI) y memoria a largo plazo (MLP).
Funciones ejecutivasWisconsin Card Sorting Test-CV6433. Las cartas de respuesta están numeradas del 1 al 64 para asegurar una aplicación estandarizada. Los participantes tienen que clasificar las cartas según criterios diferentes que van variando a lo largo del test.
Memoria de trabajoDígitos Directos del Weschler Adult Intelligence Scale-III (WAIS-III)34. El número de secuencias varía progresivamente de 2 a 8 dígitos presentados. Una vez que el participante oye cada lista, tiene que repetirla en el mismo orden de presentación.
Dígitos Indirectos (WAIS-III). El número de secuencias varía progresivamente de 2 a 8 dígitos presentados. Una vez que el participante oye cada lista, tiene que repetirla en orden inverso al de presentación.
Letras y Números (WAIS-III). En este test el participante oye unas listas de numeros y letras mezclados en orden aleatorio. El orden de presentación incluye progresivamente una mayor longitud en el número de ítems y se les pide que repitan primero los números en orden ascendente y después las letras en orden alfabético.
Fluidez verbalFluidez fonológica (FF)35. En este test se le pide que diga el máximo número posible de palabras que empiecen por la letra P en 3min, a excepción de nombres propios o la misma palabra con diferentes sufijos.
Fluidez semántica (FS). En este test se le pide que diga el máximo número posible de animales en 1min.
Velocidad de procesamientoTest de colores Stroop Color36. Sólo se incluyó el subtest Color. Se presenta una hoja con bloques de cruces en diferentes colores (rojo, verde y azul), y tienen que nombrar el color de la tinta tan rápido como puedan dentro de 45s.
Clave de números del WAIS-III. Se presentan líneas con cuadrados vacíos que tienen cifras en la parte superior. Se les pide que rellenen esos cuadrados uno por uno, lo más rápido posible, con el símbolo correspondiente, según un código cifra/símbolo que tienen constantemente presente.
Trail Making Test-Parte A37. Se presenta a los participantes una hoja con números aleatoriamente dispuestos del 1 al 25. Se les pide que dibujen una línea entre los números en orden ascendente lo más rápido posible.
Análisis de datosAnálisis factorial confirmatorio (AFC)Se utilizó el AFC para examinar las relaciones entre las variables observadas y los constructos subyacentes hipotetizados. El modelo de seis factores incluyó velocidad de procesamiento (TMT-A, Clave de números y Stroop-C), Atención (BTA-L, BTA-N), Memoria verbal (MI y MLP), Memoria de trabajo (Dígitos directos, inversos y Letras y números), Fluidez (FF y FS) y Funciones ejecutivas (WCST, categorías completadas y errores perseverativos). Este modelo se comparó con un modelo monofactorial.
El modelo monofactorial agrupó todos los tests en un único factor cognitivo general similar al factor g.
Los análisis se llevaron a cabo con el programa LISREL 8.8038 de estimación de máxima probabilidad. Se utilizaron cinco estadísticos de bondad de ajuste para valorar el ajuste de los modelos propuestos y los datos observados: χ2, χ2/grados de libertad (gl) (que tiene la ventaja de ser menos dependiente del tamaño muestral39), índice de ajuste comparativo (CFI), la raíz cuadrada media de error de aproximación (RMSEA) y el índice de ajuste no comparativo (NNFI).
Valores del NNFI y CFI ≥0,938,42 y valores del RMSEA<0,08 reflejan un buen ajuste40,41. Por último, puntuaciones de χ2/gl<3 se consideran adecuadas43.
Se utilizó el test de la χ2 para las diferencias por sexo entre los grupos y el de la t de Student para las características sociodemográficas y clínicas. Se usó el análisis múltiple de covarianzas (MANCOVA) con la variable grupo como factor intergrupal y los factores cognitivos como factor grupal. Se utilizó el test post-hoc de Tuckey para las comparaciones univariables. También se utilizó el coeficiente de correlación de Pearson para determinar la correlación entre variables. Todos los tests fueron bilaterales.
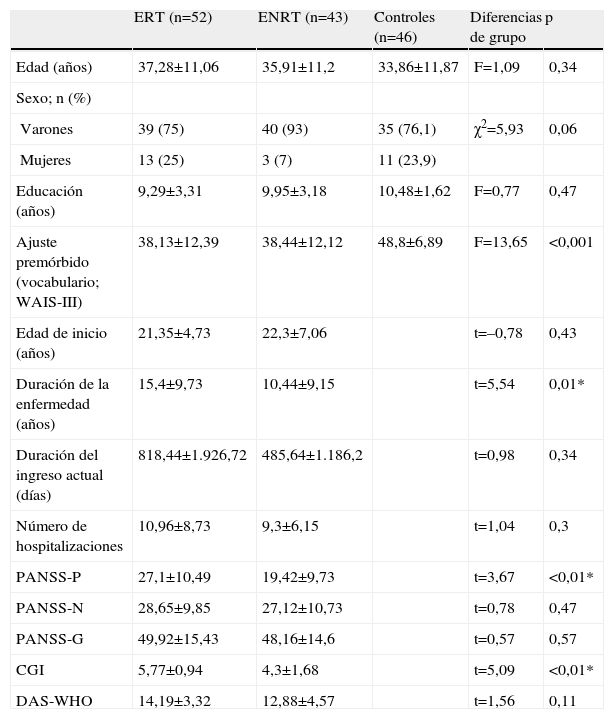
ResultadosDiferencias sociodemográficas y clínicas entre los gruposLas características sociodemográficas y clínicas de la muestra de describen en la tabla 1. No se encontraron diferencias entre los tres grupos en edad, sexo o nivel educativo.
Características sociodemográficas y clínicas de la muestra
| ERT (n=52) | ENRT (n=43) | Controles (n=46) | Diferencias de grupo | p | |
| Edad (años) | 37,28±11,06 | 35,91±11,2 | 33,86±11,87 | F=1,09 | 0,34 |
| Sexo; n (%) | |||||
| Varones | 39 (75) | 40 (93) | 35 (76,1) | χ2=5,93 | 0,06 |
| Mujeres | 13 (25) | 3 (7) | 11 (23,9) | ||
| Educación (años) | 9,29±3,31 | 9,95±3,18 | 10,48±1,62 | F=0,77 | 0,47 |
| Ajuste premórbido (vocabulario; WAIS-III) | 38,13±12,39 | 38,44±12,12 | 48,8±6,89 | F=13,65 | <0,001 |
| Edad de inicio (años) | 21,35±4,73 | 22,3±7,06 | t=–0,78 | 0,43 | |
| Duración de la enfermedad (años) | 15,4±9,73 | 10,44±9,15 | t=5,54 | 0,01* | |
| Duración del ingreso actual (días) | 818,44±1.926,72 | 485,64±1.186,2 | t=0,98 | 0,34 | |
| Número de hospitalizaciones | 10,96±8,73 | 9,3±6,15 | t=1,04 | 0,3 | |
| PANSS-P | 27,1±10,49 | 19,42±9,73 | t=3,67 | <0,01* | |
| PANSS-N | 28,65±9,85 | 27,12±10,73 | t=0,78 | 0,47 | |
| PANSS-G | 49,92±15,43 | 48,16±14,6 | t=0,57 | 0,57 | |
| CGI | 5,77±0,94 | 4,3±1,68 | t=5,09 | <0,01* | |
| DAS-WHO | 14,19±3,32 | 12,88±4,57 | t=1,56 | 0,11 |
CGI: impresión clínica general; DAS-WHO: escala de discapacidad funcional de la Organización Mundial de la Salud; ENRT: esquizofrenia no resistente el tratamiento; ERT: esquizofrenia resistente el tratamiento; PANSS-G: subescala de psicopatología general de la escala para la evaluación de síntomas positivos y negativos; PANSS-N: subescala negativa de la escala para la evaluación de síntomas positivos y negativos; PANSS-P: subescala positiva de la escala para la evaluación de síntomas positivos y negativos.
Los datos expresan n (%) o media±desviación estándar.
En cuanto a las características clínicas, ambos grupos de pacientes mostraron similares edad de inicio, duración de ingreso actual y número de hospitalizaciones previas (tabla 1), aunque diferían en la duración de la enfermedad desde el primer diagnóstico (p=0,01).
Las diferencias en psicopatología indican que los pacientes con ERT presentan más síntomas positivos (en concordancia con los criterios de admisión) según la puntuación en la escala PANSS (p<0,01). Sin embargo, no se hallaron diferencias en síntomas negativos ni psicopatología general de la PANSS. Los pacientes con ERT mostraron una severidad general mayor que los del grupo de ENRT medida con la escala CGI (p<0,01). A pesar de estos resultados, la puntuación en la escala WHO-DAS indica que ambos grupos muestran una discapacidad funcional similar.
Los resultados obtenidos en el subtest de vocabulario del WAIS-III mostraron diferencias significativas entre los grupos. Los análisis post-hoc de Tuckey revelaron que el GC rindió significativamente mejor que los dos grupos de pacientes, mientras que no hubo diferencias significativas entre los dos grupos de pacientes. La falta de diferencias en el funcionamiento premórbido entre los grupos confirma la ausencia de diferencias significativas en los años de educación formal recibida (tabla 1).
Análisis factorial confirmatorioLos estadísticos de bondad de ajuste indican que el modelo monofactorial (modelo g) no se ajusta a los datos observados para la muestra completa (χ2/df=6,7; RMSEA=0,2; NNFI=0,81; CFI=0,84). Los resultados fueron también pobres para el grupo de esquizofrenia (χ2/df=5,2; RMSEA=0,21; NNFI=0,63; CFI=0,68) y para el grupo control (χ2/df=5,9; RMSEA=0,3; NNFI=0,19; CFI=0,3). Por lo tanto, el modelo de factor único está lejos de representar una estructura latente adecuada que se ajuste a los datos obtenidos.
Los resultados indican que el modelo de seis factores hipotetizado obtiene un muy buen ajuste para la muestra completa (χ2/df=1,5; RMSEA=0,06; NNFI=0,98; CFI=0,99), así como para el grupo de esquizofrenia χ2/df=1,5; RMSEA=0,07; NNFI=0,95; CFI=0,96) y para el grupo control (χ2/df=1,3; RMSEA=0,07; NNFI=0,91; CFI=0,9).
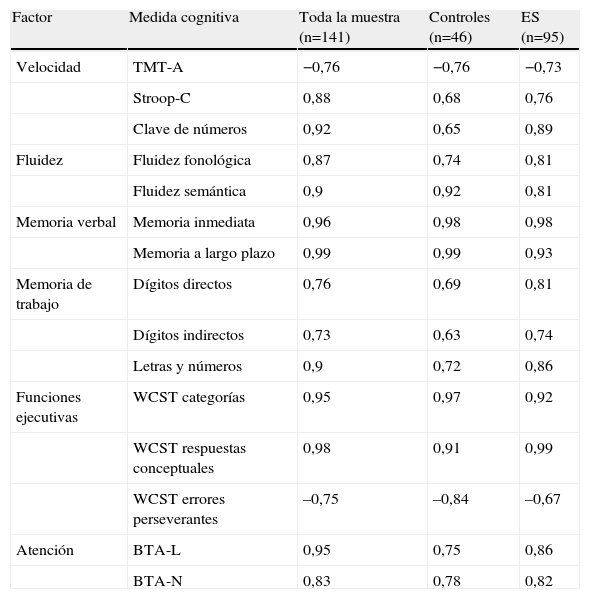
Las cargas factoriales estandarizadas se muestran en la tabla 2. Todas las cargas fueron significativas, lo que indica que las variables cargaron en el factor que pretendían medir. En general, la mayoría de las pruebas mostraron unas cargas factoriales altas en sus respectivos factores, desde –0,63 hasta 0,99. La carga factorial media para la muestra completa fue 0,87; para el grupo de esquizofrenia NC, 0,84 y para el GC, 0,8.
Resultados del análisis factorial confirmatorio para el modelo de seis factores para cada muestra con las cargas factoriales estandarizadas
| Factor | Medida cognitiva | Toda la muestra (n=141) | Controles (n=46) | ES (n=95) |
| Velocidad | TMT-A | −0,76 | −0,76 | −0,73 |
| Stroop-C | 0,88 | 0,68 | 0,76 | |
| Clave de números | 0,92 | 0,65 | 0,89 | |
| Fluidez | Fluidez fonológica | 0,87 | 0,74 | 0,81 |
| Fluidez semántica | 0,9 | 0,92 | 0,81 | |
| Memoria verbal | Memoria inmediata | 0,96 | 0,98 | 0,98 |
| Memoria a largo plazo | 0,99 | 0,99 | 0,93 | |
| Memoria de trabajo | Dígitos directos | 0,76 | 0,69 | 0,81 |
| Dígitos indirectos | 0,73 | 0,63 | 0,74 | |
| Letras y números | 0,9 | 0,72 | 0,86 | |
| Funciones ejecutivas | WCST categorías | 0,95 | 0,97 | 0,92 |
| WCST respuestas conceptuales | 0,98 | 0,91 | 0,99 | |
| WCST errores perseverantes | –0,75 | –0,84 | –0,67 | |
| Atención | BTA-L | 0,95 | 0,75 | 0,86 |
| BTA-N | 0,83 | 0,78 | 0,82 |
BTA-L: Brief Test of Attention-Letras; BTA-N: Brief Test of Attention-Números; ES: esquizofrenia; Stroop-C: subtest colores del Test Stroop; TMT-A: Trail Making Test Parte A; WCST: Wisconsin Card Sorting Test.
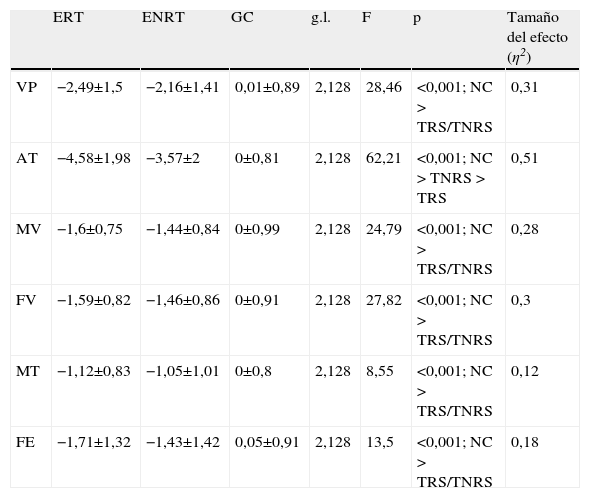
La tabla 3 muestra el rendimiento cognitivo y las diferencias entre los grupos. La prueba Vocabulario fue utilizada como covariable. Los análisis post-hoc de Tukey revelan que el GC obtuvo puntuaciones superiores que los pacientes con esquizofrenia en todos los factores cognitivos. El hallazgo principal fue la falta de diferencias significativas entre los grupos de ERT y de ENRT en los factores cognitivos. Sólo la atención mostró diferencias significativas entre los dos subgrupos (p<0,05), dado que el grupo de ENRT ofreció un mejor rendimiento.
Comparación entre los grupos control (GC), esquizofrenia resistente el tratamiento (ERT) y esquizofrenia no resistente el tratamiento (ENRT) en el funcionamiento cognitivo tras controlar el efecto de Vocabulario
| ERT | ENRT | GC | g.l. | F | p | Tamaño del efecto (η2) | |
| VP | −2,49±1,5 | −2,16±1,41 | 0,01±0,89 | 2,128 | 28,46 | <0,001; NC > TRS/TNRS | 0,31 |
| AT | −4,58±1,98 | −3,57±2 | 0±0,81 | 2,128 | 62,21 | <0,001; NC > TNRS > TRS | 0,51 |
| MV | −1,6±0,75 | −1,44±0,84 | 0±0,99 | 2,128 | 24,79 | <0,001; NC > TRS/TNRS | 0,28 |
| FV | −1,59±0,82 | −1,46±0,86 | 0±0,91 | 2,128 | 27,82 | <0,001; NC > TRS/TNRS | 0,3 |
| MT | −1,12±0,83 | −1,05±1,01 | 0±0,8 | 2,128 | 8,55 | <0,001; NC > TRS/TNRS | 0,12 |
| FE | −1,71±1,32 | −1,43±1,42 | 0,05±0,91 | 2,128 | 13,5 | <0,001; NC > TRS/TNRS | 0,18 |
AT: atención; FE: funciones ejecutivas; FV: fluidez verbal; g.l.: grados de libertad; MT: memoria de trabajo; MV: memoria verbal; VP: velocidad de procesamiento.
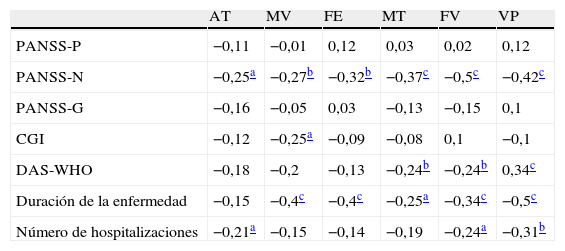
Los análisis de correlación entre los factores cognitivos y las variables clínicas se presentan en las tablas 4 y 5. Las correlaciones para la muestra total (tabla 4) indican que los factores cognitivos se relacionan con los síntomas negativos, pero no con los positivos o el nivel de psicopatología general. La velocidad de procesamiento, la fluidez y la memoria de trabajo se asociaron significativamente con la variable discapacidad funcional, mientras que la duración de la enfermedad se relacionó con todos los factores a excepción de la atención. El número de hospitalizaciones previas ofreció una relación significativa con el rendimiento en atención, fluidez verbal y velocidad de procesamiento.
Correlaciones entre las variables clínicas y las cognitivas en toda la muestra
| AT | MV | FE | MT | FV | VP | |
| PANSS-P | −0,11 | −0,01 | 0,12 | 0,03 | 0,02 | 0,12 |
| PANSS-N | −0,25a | −0,27b | −0,32b | −0,37c | −0,5c | −0,42c |
| PANSS-G | −0,16 | −0,05 | 0,03 | −0,13 | −0,15 | 0,1 |
| CGI | −0,12 | −0,25a | −0,09 | −0,08 | 0,1 | −0,1 |
| DAS-WHO | −0,18 | −0,2 | −0,13 | −0,24b | −0,24b | 0,34c |
| Duración de la enfermedad | −0,15 | −0,4c | −0,4c | −0,25a | −0,34c | −0,5c |
| Número de hospitalizaciones | −0,21a | −0,15 | −0,14 | −0,19 | −0,24a | −0,31b |
AT: atención; CGI: impresión clínica general; DAS-WHO: escala de discapacidad funcional de la Organización Mundial de la Salud; FE: funciones ejecutivas; FV: fluidez verbal; MT: memoria de trabajo; MV: memoria verbal; PANSS-G: subescala de psicopatología general de la escala para la evaluación de síntomas positivos y negativos; PANSS-N: subescala negativa de la escala para la evaluación de síntomas positivos y negativos; PANSS-P: subescala positiva de la escala para la evaluación de síntomas positivos y negativos; VP: velocidad de procesamiento.
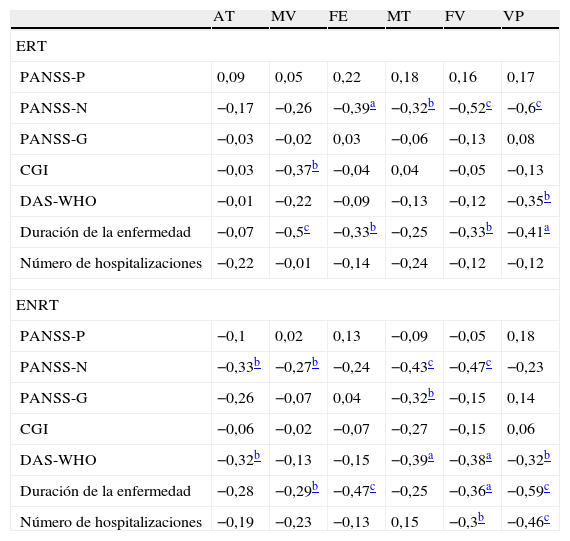
Correlaciones entre las variables clínicas y cognitivas en ERT y ENRT
| AT | MV | FE | MT | FV | VP | |
| ERT | ||||||
| PANSS-P | 0,09 | 0,05 | 0,22 | 0,18 | 0,16 | 0,17 |
| PANSS-N | −0,17 | −0,26 | −0,39a | −0,32b | −0,52c | −0,6c |
| PANSS-G | −0,03 | −0,02 | 0,03 | −0,06 | −0,13 | 0,08 |
| CGI | −0,03 | −0,37b | −0,04 | 0,04 | −0,05 | −0,13 |
| DAS-WHO | −0,01 | −0,22 | −0,09 | −0,13 | −0,12 | −0,35b |
| Duración de la enfermedad | −0,07 | −0,5c | −0,33b | −0,25 | −0,33b | −0,41a |
| Número de hospitalizaciones | −0,22 | −0,01 | −0,14 | −0,24 | −0,12 | −0,12 |
| ENRT | ||||||
| PANSS-P | −0,1 | 0,02 | 0,13 | −0,09 | −0,05 | 0,18 |
| PANSS-N | −0,33b | −0,27b | −0,24 | −0,43c | −0,47c | −0,23 |
| PANSS-G | −0,26 | −0,07 | 0,04 | −0,32b | −0,15 | 0,14 |
| CGI | −0,06 | −0,02 | −0,07 | −0,27 | −0,15 | 0,06 |
| DAS-WHO | −0,32b | −0,13 | −0,15 | −0,39a | −0,38a | −0,32b |
| Duración de la enfermedad | −0,28 | −0,29b | −0,47c | −0,25 | −0,36a | −0,59c |
| Número de hospitalizaciones | −0,19 | −0,23 | −0,13 | 0,15 | −0,3b | −0,46c |
AT: atención; CGI: impresión clínica general; DAS-WHO: escala de discapacidad funcional de la Organización Mundial de la Salud; ENRT: esquizofrenia no resistente el tratamiento; ERT: esquizofrenia resistente el tratamiento; FE: funciones ejecutivas; FV: fluidez verbal; MT: memoria de trabajo; MV: memoria verbal; PANSS-G: subescala de psicopatología general de la escala para la evaluación de síntomas positivos y negativos; PANSS-N: subescala negativa de la escala para la evaluación de síntomas positivos y negativos; PANSS-P: subescala positiva de la escala para la evaluación de síntomas positivos y negativos; VP: velocidad de procesamiento.
El patrón de correlaciones para cada subgrupo de pacientes se muestra en la tabla 5. Se halló un patrón de asociaciones diferente en cada grupo. En el grupo de ENRT los síntomas negativos se relacionaron con todos los factores cognitivos a excepción de funciones ejecutivas y velocidad de procesamiento. En el grupo de ERT, por el contrario, se asociaron con todos los factores a excepción de la atención y la memoria verbal.
DiscusiónNuestros datos no han replicado los hallazgos previos de Joober et al24 en la caracterización de los perfiles cognitivos en pacientes con ERT y ENRT, pues encontraron un mayor déficit en aprendizaje y memoria verbal en pacientes con ERT. Por lo tanto, no podemos concluir que exista una respuesta al tratamiento farmacológico diferencial en relación con los déficit cognitivos.
La estructura factorial de nuestro modelo es similar a la propuesta por la iniciativa MATRICS44. No obstante, hay dos diferencias relevantes entre ambas propuestas. Nuestro grupo obtuvo una solución factorial de seis dominios cognitivos —atención, velocidad de procesamiento, memoria verbal, memoria de trabajo, fluidez y funciones ejecutivas—, mientras que la propuesta de MATRICS incluyó además el factor de memoria visual. El factor adicional en nuestro estudio es la fluidez verbal.
En discordancia con nuestros datos, Joober et al hallaron diferencias significativas entre los pacientes con ERT y ENRT en el funcionamiento neuropsicológico. Hay una serie de factores que podrían explicar dichas discrepancias en los resultados. En primer lugar, nuestro estudio contiene un tamaño muestral mayor. También es destacable que no se encontraran diferencias en memoria verbal ni en memoria de trabajo en nuestro estudio. Ésta no fue evaluada en el estudio de Joober et al.
Una explicación alternativa se relaciona con la evidente diferencia entre los grupos de pacientes con ERT de ambos estudios. En el estudio de Joober et al, los autores incluyeron una muestra de pacientes descritos como autónomos (funcionamiento independiente en la sociedad) y con una evolución de la enfermedad óptima. A pesar de la alta media de años de evolución de la enfermedad de nuestro estudio (15 años), ellos incluyeron sólo a pacientes sin recaídas psicóticas durante el tratamiento psiquiátrico. Pero no son habituales los casos con tales evolución y respuesta terapéutica en la práctica clínica. Un análisis más detallado revela que Joober et al compararon dos grupos con una capacidad funcional muy diferente, mientras que en los grupos de nuestro estudio ambos tuvieron una capacidad funcional muy similar. Si a pesar de esto las diferencias neuropsicológicas se hubiesen mantenido similares, podríamos haber afirmado que el funcionamiento neuropsicológico varía en la enfermedad dependiendo de la respuesta al tratamiento farmacológico. Pero los resultados no apoyan esa conclusión. En concordancia con datos recientes45,46, déficit similares en el funcionamiento cognitivo se asociaron con un resultado funcional similar en ambos grupos, con evidencia adicional de la relación entre cognición y autonomía funcional en los pacientes. Ambos grupos mostraron el mismo nivel de deterioro en habilidades adaptativas. Considerando las conclusiones de Green et al23 sobre la relación entre el deterioro cognitivo y el resultado funcional, la falta de diferencias podría ser atribuible, al menos parcialmente, al similar grado de deterioro cognitivo de ambos grupos. Además, la mayor presencia de síntomas productivos en el grupo de pacientes con ERT no se correspondió con un aumento del deterioro funcional.
En nuestro estudio, la muestra de pacientes con ENRT consistió en pacientes hospitalizados por la falta de recursos alternativos o por la severidad de la psicopatología. Padecen mayores consecuencias funcionales y peor evolución a pesar de responder al tratamiento. Dada la estrecha relación que existe entre las alteraciones cognitivas y el resultado funcional en la esquizofrenia23,45,46, no resulta sorprendente hallar un funcionamiento cognitivo mejor en un grupo con una mejor situación funcional, tal y como se observa en el grupo de pacientes con ENRT de Joober et al24.
En resumen, estamos comparando dos grupos diferentes de pacientes con esquizofrenia. Mientras que Joober et al compararon a pacientes con un alto nivel de funcionamiento psicosocial (pacientes respondedores al tratamiento) con otros pacientes que mostraban un pobre funcionamiento psicosocial, el presente estudio compara dos grupos con pobre funcionamiento psicosocial.
La esquizofrenia crónica es un concepto con límites semánticos poco difusos. Aunque McKenna47 lo definió como esquizofrenia con al menos 2 años de evolución, a veces los investigadores no siguen estrictamente esta definición. Como consecuencia de esta falta de precisión, el término esquizofrenia crónica se ha utilizado indistintamente para «estados deficitarios», «síndrome deficitario», «esquizofrenia residual» o «esquizofrenia residual». Si nos basamos estrictamente en los términos temporales, la mayoría de nuestros pacientes respondedores al tratamiento cumplían este criterio de esquizofrenia crónica.
Como se ha indicado anteriormente, nuestras dos muestras eran homogéneas en edad, deterioro cognitivo, síntomas negativos y resultado funcional. Por lo tanto, nuestro estudio compara a pacientes con ERT y pacientes crónicos con esquizofrenia (pero respondedores al tratamiento). Los resultados obtenidos no nos permiten establecer categorías clínicas diferenciales según el funcionamiento neuropsicológico. Sin embargo, nuestro estudio pone de manifiesto algunas diferencias clínicas y demográficas entre los grupos. Los pacientes con ERT mostraron más años de evolución de la enfermedad, mayor proporción de mujeres, una mayor severidad de síntomas positivos y mayor severidad general medida mediante la escala CGI. Las muestras son más homogéneas respecto a aspectos muy relevantes de la enfermedad, como los síntomas negativos y los síntomas generales de la PANSS. Otros autores han usado explicaciones alternativas para los perfiles diferentes hallados en la ERT, como edad de inicio, número de hospitalizaciones y distinción entre pacientes hospitalizados y no hospitalizados6,7, pero nuestros datos superan algunos problemas metodológicos de estudios previos. Además, estos resultados son coherentes con las contribuciones realizadas a esta línea de investigación desde campos como la neuroimagen48. La evidencia empírica de estos estudios no apoya la hipótesis de un delimitado subgrupo de pacientes con ERT. El concepto de ERT como un subgrupo diferencial de esquizofrenia cuyos síntomas positivos no responden a varios tratamientos antipsicóticos perdería, por lo tanto, su sentido clínico. A pesar de ello, algunos autores siguen utilizando los criterios de Kane et al4 para diferenciar no sólo entre pacientes con esquizofrenia refractaria y no refractaria, sino también para identificar grupos de pacientes denominados superrefractarios al tratamiento13. Sin embargo, los resultados experimentales publicados por el grupo no indican la existencia de un perfil específico, salvo una mayor presencia de síntomas positivos en este grupo superresistente a la respuesta farmacológica.
Dado que la capacidad funcional de los pacientes puede explicarse principalmente mediante los síntomas negativos y cognitivos, los esfuerzos terapéuticos deberían ir dirigidos a mejorar estos síntomas. Consecuentemente, nuestro grupo propone que las definiciones futuras de falta de respuesta al tratamiento deberían incluir estos síntomas, además de los positivos. Así, los criterios de Brenner et al49 tienen mayor valor clínico para clasificar a los pacientes por su respuesta al tratamiento. Estos siete criterios incluyen un ítem que valora «el deterioro cognitivo en múltiples áreas que interfiere con el trabajo y el funcionamiento social». A pesar de este intento, el criterio está vagamente formulado y limita su medición cuantitativa sobre la severidad del deterioro y el impacto funcional. Por otro lado, la realidad clínica diaria no apoya la distinción categórica entre pacientes que responden al tratamiento y pacientes que no responden. La mayoría de los pacientes se hallarían en una situación intermedia. Debemos tener en cuenta la posibilidad, no probada todavía, de que cada paciente tuviera una evolución dinámica en su capacidad de respuesta al tratamiento antipsicótico. Además, la evolución podría ser modificada por cambios naturales que ocurren en la psicopatología de los pacientes a través de la progresión de la enfermedad. Este hecho es más promiente entre los pacientes con más años de evolución. Siguiendo este hilo, Owens et al50 examinaron a 510 pacientes hospitalizados durante más de 1 año (media, 13 años). Sólo el 30% de este grupo no mostró síntomas positivos. El resto de los pacientes (20%) presentó un máximo nivel de síntomas positivos. El 7% de la muestra no tuvo síntomas positivos ni negativos, aunque necesitaron hospitalizaciones más duraderas. En concordancia con estos datos, la mayor parte de los pacientes muestran un marcado déficit funcional a pesar de la eficacia del tratamiento en base a los síntomas clásicos de la esquizofrenia.
FinanciaciónEste trabajo fue parcialmente financiado por el Departamento Vasco de Educación, Universidades e Investigación, Código BFI05.456 a J. Peña, y por el Ministerio de Sanidad de España, Instituto de Salud Carlos III, CIBERSAM.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.