Introducción
El glutamato es el principal neurotransmisor excitador en el sistema nervioso central (SNC). Una vez liberado desde las vesículas presinápticas, se une a receptores postsinápticos ionotrópicos (NMDA, AMPA y kainato). Asimismo, activa receptores metabotrópicos (mGluR) que modulan su liberación, la respuesta postsináptica y la actividad de otras sinapsis. Hasta la fecha, se han descrito ocho subtipos de receptores metabotrópicos del glutamato (mGluR1-8), divididos en tres grupos diferenciados según su homología en la secuencia de aminoácidos, los mecanismos de transducción de señales, el sistema de segundos mensajeros al que se acoplan y su farmacología. Así, tenemos los receptores metabotrópicos del grupo I, que incluiría el mGlu1 y el mGlu5, los del grupo II, formado por los receptores mGlu2 y mGlu3 y, por último, los del grupo III, en el que estarían incluidos los receptores mGlu4, 6, 7 y 81-3.
Numerosos estudios indican que el glutamato está implicado en la regulación de la agresión. Así, en los primeros trabajos en los que se examinó la administración de antagonistas del receptor NMDA del glutamato, como la fenciclidina (PCP) o la dizocilpina (MK-801), se evidenciaron cambios en la conducta agresiva de los animales, aunque con resultados contradictorios, y se observó un efecto tanto proagresivo como antiagresivo, según los ligandos utilizados, las dosis administradas y la especies animales elegidas como sujetos experimentales4-6. Más recientemente, Belozertseva et al7, mediante un modelo de agresión inducida por aislamiento, analizaron el efecto de agentes que actuaban sobre el receptor NMDA con características farmacodinámicas distintas: antagonistas no competitivos (PCP, MK-801), antagonistas con poca afinidad por el receptor NMDA (memantina y MRZ 2/579) y antagonistas competitivos (D-CPPene). Los resultados mostraron que, a dosis bajas, aunque sin diferencias significativas, se apreciaba una tendencia proagresiva tras la administración de antagonistas no competitivos del receptor NMDA. Todos los agentes que demostraron un efecto antiagresivo lo hacían con dosis a las que también producían deterioros de la actividad motora, y la mayoría de ellos no aumentaba las conductas sociales no agresivas, a excepción del D-CPPene, único antagonista competitivo evaluado.
Por otro lado, se ha constatado la implicación del receptor AMPA en la conducta agresiva. Así, en un primer estudio, vekovischeva et al8 encontraron una reducción de la conducta agonista en ratones machos manipulados genéticamente que carecían de la subunidad GluR-A de este receptor. En un trabajo posterior, se comparó el efecto de distintos antagonistas del receptor AMPA, dos de ellos competitivos y poco selectivos (CNQX y NBQX) y uno no competitivo y muy selectivo (GYKI 52466), en la conducta agresiva de dos grupos de ratones que diferían en sus grados de agresión innata. Los resultados obtenidos pusieron de manifiesto que la administración de antagonistas competitivos disminuía el componente "morder" de la conducta de ataque en los dos grupos de ratones, mientras que la administración del antagonista no competitivo producía una disminución de todos los componentes de la conducta de ataque en ambos grupos. Aunque todos ellos ocasionaron una disminución de alguna categoría de la conducta agresiva, también incrementaron los grados de ansiedad durante el encuentro agonista9. Asimismo, otros fármacos que actúan (al menos parcialmente) en la modulación de la actividad de los receptores AMPA, como el topiramato, también han demostrado efectos antiagresivos en modelos animales10.
Una reciente línea de investigación se está centrando en la manipulación de la enzima dipeptidasa acídica acoplada a la α-N-acetilada (NAALADasa), que interviene en la formación de glutamato en el SNC. Esta enzima se caracteriza por hidrolizar el neurotransmisor N-acetil-aspartilglutamato (NAAG) y convertirlo en glutamato y N-acetilaspartato, con lo que su inhibición impide la trasformación de NAAG en glutamato; de este modo disminuye la cantidad de glutamato cerebral. Así, Lumley et al11 observaron que tras la administración de GPI-2232, agente farmacológico que inhibe la enzima NAALADasa, se producía un efecto antiagresivo, con un modelo de agresión inducida por aislamiento. La inhibición de esta enzima produce una disminución del glutamato cerebral por distintas vías. Por un lado, que NAAG no se transforme en glutamato hace que decaiga el valor de glutamato en el SNC y, por otra parte, esta inhibición origina una acumulación de NAAG en el cerebro, y esta sustancia actúa como agonista total para los receptores presinápticos mGlu3 del glutamato, que además es un agonista parcial para los receptores NMDA.
En contraste con los receptores inotrópicos de glutamato, escasamente se ha investigado la posible implicación de los receptores mGlu en la modulación de la conducta agresiva12-16. Navarro et al12 han encontrado que la administración de un antagonista no competitivo de los receptores mGlu5 (MPEP) produjo una reducción significativa de las conductas ofensivas (amenaza y ataque) en ratones machos. Más recientemente, se ha constatado que el bloque de los receptores mGlu1 (con el antagonista selectivo JNJ16259685) se asocia a una robusta reducción de la agresión14. Asimismo, aunque los resultados son menos claros, los receptores mGlu2/3 y mGlu7 (pero no los mGlu8) también podrían estar implicados en la regulación de la conducta agresiva en roedores15,16.
En un intento por profundizar en el papel de los receptores de glutamato AMPA y mGlu8 en la modulación de la conducta agresiva, realizamos un experimento para analizar el efecto de la administración de (RS)-3,4-DCPG (5, 10 y 20 mg/kg, intraperitoneal [i.p.]), un antagonista mixto de receptores AMPA y agonista de receptores mGlu8, en las interacciones agonistas entre ratones machos, mediante un modelo de agresión inducida por aislamiento. Su actividad antagonista AMPA está determinada por su isómero R, mientras que el isómero S es causal de sus propiedades agonistas mGlu817.
Metodología
Animales
Se utilizó un total de 94 ratones albinos adultos de la cepa OF.1. A la llegada a nuestro laboratorio todos los animales se alojaron en grupos de 5 durante una semana para permitir su adaptación a nuestras instalaciones y al ciclo de luz/ oscuridad impuesto (luz, desde las 20.00 a las 8.00), antes de iniciar el periodo de aislamiento. Transcurrido el periodo de adaptación, la mitad de los animales (n = 47) se distribuyó como grupos experimental y control, y se alojaron individualmente (durante un periodo de 30 días) en jaulas de plástico transparentes (Tecniplast-Letica, Madrid) de 24 × 13,5 × 13 cm. Una vez finalizado el periodo de aislamiento, estos animales fueron distribuidos aleatoriamente a las distintas condiciones experimentales (control y dosis de 5, 10 y 20 mg/kg de (RS)-3,4-DCPG. Los otros ratones se utilizaron como oponentes "anósmicos", y fueron alojados en grupos de 5 en jaulas de las mismas características que las anteriores hasta el momento de la realización de la prueba conductual. Para todos los animales la comida y la bebida se administraron ad libitum. Las condiciones ambientales del laboratorio donde estaban ubicados los animales fueron cuidadosamente controladas, manteniéndose una temperatura (20 °C) y una humedad constantes.
Este experimento se ha realizado de acuerdo con los principios de la guía para el cuidado y el uso de los animales de laboratorio aprobado por la Directiva del Consejo de la Comunidad europea (86/609/EEC).
Modelo de agresión inducida por aislamiento y descripción de la anosmia
En nuestra investigación hemos empleado el modelo de agresión inducida por aislamiento, considerado uno de los modelos de elección para provocar conductas ofensivas entre ratones machos. el procedimiento seguido consiste en alojar a los animales machos en jaulas individuales durante un periodo de 30 días, durante los cuales disponen de comida y bebida ad libitum. Pasado ese tiempo, se realizan los encuentros conductuales de agresión cuya duración es de 10 min. El animal dominante muestra conductas de amenaza y ataque dirigidas hacia el oponente, mientras que el subordinado no ataca y adopta posturas defensivas.
Numerosas evidencias implican al sistema olfatorio en el desencadenamiento de la conducta agresiva en roedores. Así, se ha demostrado que una vez extirpados los bulbos olfatorios, los animales ya no manifiestan conductas ofensivas, ni siquiera ante mordeduras entre miembros de una misma especie18. El procedimiento más habitual para producir una anosmia periférica (y transitoria) consiste en administrar sulfato de cinc (al 4%) a través de los orificios nasales, lo que origina una necrosis reversible del epitelio nasal. La razón por la cual los ratones machos no luchan contra sus oponentes se encuentra, probablemente, en que no pueden oler la feromona presente en la orina de los ratones, que es una señal desencadenante de la conducta ofensiva de los ratones con olfato normal19. En nuestro caso, la anosmia se llevó a cabo mediante instilación de un volumen de 0,025 ml de sulfato de cinc al 4% en cada orificio nasal de los roedores. Este procedimiento se efectuó los días 1 y 3 previos a la realización de cada prueba conductual.
Administración del fármaco
El (RS)-3,4-DCPG fue adquirido comercialmente en los laboratorios Tocris (Reino Unido), y disuelto en suero salino para preparar las dosis correspondientes. Las dosis elegidas para el tratamiento fueron 5, 10 y 20 mg/kg (n = 11 por grupo), mientras que los animales del grupo control recibieron suero salino (n = 14 por grupo). En ambos casos, la administración se realizó por vía i.p. y de forma proporcional al peso del animal (volumen constante de 10 ml/kg). Tanto el fármaco como el vehículo fueron administrados 30 min antes de la realización de la prueba conductual.
Evaluación conductual
Los encuentros agonistas entre los animales aislados (experimentales y controles) y los oponentes anósmicos tuvieron lugar en un área neutral. Como zona neutral se utilizó un recipiente de cristal transparente con dimensiones de 50 × 26 × 30 cm. Tras la realización de cada encuentro se renovaba el serrín de dicho recipiente, con el fin de evitar posibles interferencias de olores.
Antes de comenzar la prueba conductual se mantenía a los 2 animales en extremos opuestos del área neutral durante un periodo de adaptación de 1 min, tras lo cual se retiraba el separador y daba comienzo la prueba conductual, que duraba 10 min. Todos los encuentros agonistas se grabaron en vídeo para su posterior análisis etológico mediante un programa de ordenador diseñado al efecto20. Todas las pruebas conductuales se realizaron a los 30 min tras la administración del fármaco, y los encuentros agresivos se iniciaron en la segunda hora del periodo de oscuridad (y, por lo tanto, de actividad) de los ratones.
Las diez categorías conductuales analizadas fueron las siguientes: a) cuidado corporal; b) escarbar; c) exploración no social; d) exploración a distancia; e) investigación social; f) amenaza; g) ataque; h) evitación/huida; i) defensa/ sumisión, y j) inmovilidad. Cada categoría representa una suma de diferentes elementos y posturas. Una descripción más detallada de estas categorías, así como de sus elementos constituyentes, se puede encontrar en Brain et al20. La evaluación conductual se efectuó tan sólo sobre las conductas exhibidas por el animal experimental. La valoración se realizó de manera ciega, en la que el investigador inicialmente desconocía en qué condición experimental se encontraba cada animal evaluado.
Análisis estadístico
Con el objeto de establecer si había diferencias significativas entre los diferentes grupos experimentales (control y tratamiento) en cada una de las categorías conductuales evaluadas, se realizó un análisis de variancia no paramétrico (prueba de Kruskal-Wallis). Para realizar comparaciones entre pares de grupos se utilizó una prueba no paramétrica para muestras independientes (prueba de la U de Mann-Whitney).
Resultados y discusión
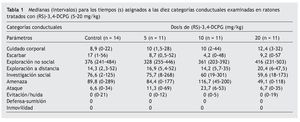
En la tabla 1 se muestran las medianas (con sus intervalos) del tiempo acumulado (en segundos) en cada una de las categorías conductuales para cada grupo de tratamiento. La prueba de Kruskal-Wallis indicó que no hubo diferencias estadísticamente significativas entre los distintos grupos experimentales. Del mismo modo, la prueba de Mann-Whitney no mostró diferencias estadísticamente significativas entre pares de grupos.
El modelo de agresión inducida por aislamiento (modelo de agresión ofensiva) ha demostrado poseer una significativa validez aparente y, especialmente, una excelente validez predictiva en relación con la agresión humana21. En este sentido, las conductas ofensivas evaluadas en este modelo se han comparado con la violencia impulsiva/reactiva/hostil definida en humanos22. Por otra parte, muchos de los fármacos que han resultado de utilidad para el control de la agresión en humanos han demostrado un evidente perfil antiagresivo al evaluarlos con este modelo de agresión23.
Los estudios farmacológicos para examinar el papel funcional de los receptores mGlu8 han estado limitados por la carencia de ligandos selectivos para dichos receptores. Recientemente, sin embargo, se han caracterizado varios fármacos que actúan como agonistas de dichos receptores y son activos cuando se administran sistémicamente24. Estos receptores se localizan principalmente a nivel presináptico y se considera que actúan como autorreceptores, y en los últimos años se los ha implicado en diversas funciones. Así, se ha apuntado a un papel potencial de dichos receptores en la regulación de la ansiedad24,25, la autoadministración de alcohol26 y la modulación del dolor en ratones27.
Como se aprecia en la tabla 1, ninguna de las dosis de (RS)-3,4-DCPG utilizadas en este estudio (5, 10 y 20 mg/kg, i.p.) modificó de forma estadísticamente significativa las conductas ofensivas (amenaza y ataque), en comparación con el grupo control. Del mismo modo, tampoco se observaron diferencias significativas en el resto de las categorías conductuales examinadas. Estos resultados están en consonancia con los encontrados tras la administración del enantiómero (S)-3,4-DCPG16, que actúa selectivamente en los receptores mGlu8, sin mostrar afinidad por los receptores AMPA.
En conclusión, los resultados obtenidos en el presente experimento indican que el antagonismo de los receptores AMPA por el isómero R y la estimulación de los receptores mGlu8 por el isómero S no parecen actuar sinérgicamente en la agresión en la forma racémica del 3,4-DCPG. Una limitación de este trabajo es que sólo se evalúa el perfil conductual de la forma racémica del 3,4-DCPG. Por lo tanto, son necesarios experimentos adicionales que comparen también entre sí ambos isómeros del DCPG.
*Autor para correspondencia.
Correo electrónico:navahuma@uma.es (J.F. Navarro).
Recibido el 20 de enero de 2009; aceptado el 6 de mayo de 2009