Los estudios reflejan datos contradictorios sobre un posible deterioro en el funcionamiento ejecutivo en niños y adolescentes con trastorno del espectro autista sin discapacidad intelectual (TEA-SDI). El objetivo del estudio es evaluar el perfil cognitivo de funcionamiento ejecutivo en niños y adolescentes con TEA-SDI y compararlo con el de controles sanos pareados en sexo, edad, estatus socioeconómico, nivel educacional y cociente intelectual (CI).
MétodosVeinticuatro pacientes con TEA-SDI (edad media 12,8±2,5 años; 23 varones; media de CI 99,20±18,81) y 32 controles (edad media 12,9±2,7 años; 30 varones; media de CI 106,81±11,02) fueron seleccionados.
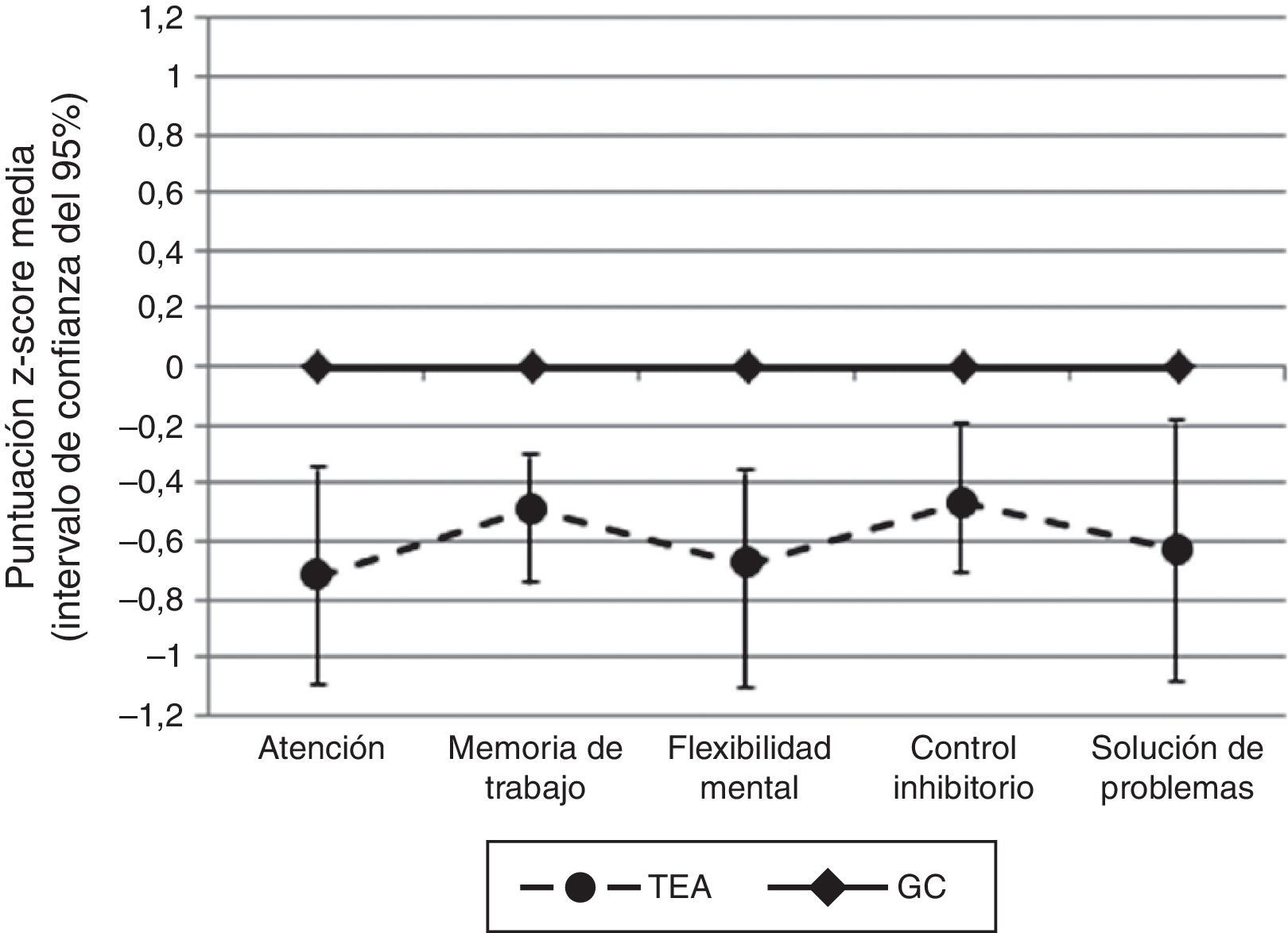
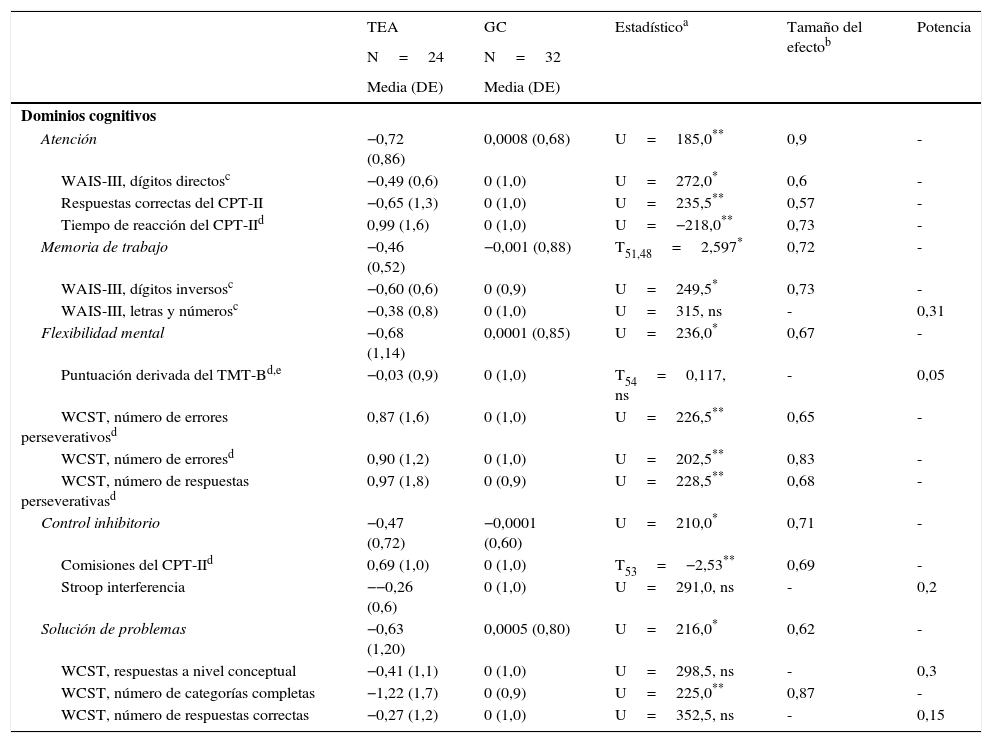
ResultadosSe encontraron diferencias estadísticamente significativas en todos los dominios cognitivos evaluados a favor de un mejor rendimiento por parte del grupo control: atención (U=185,0; p=0,0005; D=0,90), memoria de trabajo (T51,48=2,597; p=0,006; D=0,72), flexibilidad cognitiva (U=236,0; p=0,007; D=0,67), control inhibitorio (U=210,0; p=0,002; D=0,71) y solución de problemas (U=261,0; p=0,021; D=0,62). Estas diferencias se mantuvieron cuando se realizaron los análisis controlando por CI.
ConclusiónLos niños y adolescentes con TEA-SDI tienen dificultades para transformar y manipular mentalmente información verbal, presentan latencias de respuesta mayores, problemas atencionales (dificultades en el cambio del set), problemas en la inhibición de respuestas automáticas, así como en la solución de problemas, a pesar de tener un CI normal. Teniendo en cuenta las dificultades en funcionamiento ejecutivo de estos pacientes, se recomienda una intervención integral, que incluya el trabajo en este tipo de dificultades.
Studies of executive function in autism spectrum disorder without intellectual disability (ASD-WID) patients are contradictory. We assessed a wide range of executive functioning cognitive domains in a sample of children and adolescents with ASD-WID and compared them with age-, sex-, and intelligence quotient (IQ)-matched healthy controls.
MethodsTwenty-four ASD-WID patients (mean age 12.8±2.5 years; 23 males; mean IQ 99.20±18.81) and 32 healthy controls (mean age 12.9±2.7 years; 30 males; mean IQ 106.81±11.02) were recruited.
ResultsStatistically significant differences were found in all cognitive domains assessed, with better performance by the healthy control group: attention (U=185.0; P=.0005; D=0.90), working memory (T51.48=2.597; P=.006; D=0.72), mental flexibility (U=236.0; P=.007; D=0.67), inhibitory control (U=210.0; P=.002; D=0.71), and problem solving (U=261.0; P=0.021; D=0.62). These statistically significant differences were also found after controlling for IQ.
ConclusionChildren and adolescents with ASD-WID have difficulties transforming and mentally manipulating verbal information, longer response latency, attention problems (difficulty set shifting), trouble with automatic response inhibition and problem solving, despite having normal IQ. Considering the low executive functioning profile found in those patients, we recommend a comprehensive intervention including work on non-social problems related to executive cognitive difficulties.
Las personas con trastorno del espectro autista (TEA) desde la primera infancia presentan déficits en la comunicación social, así como estereotipias, comportamientos repetitivos e hiper/hiporreactividad a los estímulos sensoriales.
La relación entre funciones ejecutivas (FE) y autismo es muy debatida1. La literatura arroja datos contradictorios acerca de la existencia de un posible déficit o un rendimiento normal en pacientes con TEA en tareas de atención1–8, memoria de trabajo8–14, flexibilidad mental2,4,8,15, control inhibitorio3–8,15–18 y tareas de solución de problemas4,19, todas ellas consideradas parte de las FE. Sin embargo, las FE no son consideradas un constructo unitario20. El término FE a menudo incluye un conjunto de procesos cognitivos como la planificación, la memoria de trabajo, la atención, la solución de problemas, el razonamiento verbal, la inhibición, la flexibilidad mental, la multitarea, así como la iniciación y la monitorización de las acciones21. Otra manera de decirlo es que es un término genérico de habilidades neuropsicológicas que implican control mental y autorregulación. En pocas palabras, las FE son procesos de control superior necesarias para guiar el comportamiento22.
El objetivo de este trabajo es estudiar las FE en pacientes con autismo sin discapacidad intelectual, y comparar el rendimiento en funcionamiento ejecutivo con medidas generales de inteligencia, cuyo objetivo final es presentar de forma empírica los déficits en cognición no social de esta población; esto nos ayudará a diseñar programas de rehabilitación neuropsicológica apropiados. Los objetivos específicos de este estudio son evaluar las FE en una muestra homogénea de niños y adolescentes con TEA sin discapacidad intelectual (TEA-SDI), empleando una amplia batería neuropsicológica, y comparar las puntuaciones obtenidas por este grupo con un grupo control (GC) pareado. También quisimos analizar si los déficits en FE correlacionan con el nivel de funcionamiento y la severidad de los síntomas en el grupo de pacientes.
Nuestra hipótesis fue que los niños y los adolescentes con TEA-SDI presentarán puntuaciones inferiores y estadísticamente significativas en las tareas de FE evaluadas (atención, memoria de trabajo, flexibilidad mental, control inhibitorio y solución de problemas) comparados con un grupo control pareado en edad, años de educación y cociente intelectual (CI).
MétodosMuestraLos pacientes con TEA fueron reclutados en las consultas externas del Departamento de Psiquiatría del Niño y Adolescente, del Hospital General Universitario Gregorio Marañón, Madrid, España, entre mayo de 2005 y febrero de 200923. El grupo control fue escogido en colegios con características sociodemográficas similares a las de los pacientes (en colegios de la misma área y con características socioeconómicas similares).
Los criterios de inclusión para el estudio fueron los siguientes: a) edad comprendida entre los 7 y los 18 años; b) hablar correctamente español; c) diagnóstico de TEA-SDI (definido por el Manual Diagnóstico y Estadístico de los Trastornos Mentales en su cuarta edición [DSM-IV] como síndrome de Asperger o autismo de alto funcionamiento (AAF), y d) disponer de evaluación neuropsicológica completa. Los criterios de exclusión fueron: a) comorbilidad con otros trastornos del eje 1 en el momento de la selección; b) antecedentes de traumatismo craneoencefálico con pérdida de conciencia; c) CI<70; d) enfermedades significativas no relacionadas con el TEA; e) embarazo o lactancia, y f) abuso o dependencia de drogas.
En el GC, los criterios de inclusión y exclusión fueron los mismos, con excepción de la presencia de un TEA.
Después de recibir una explicación completa del estudio, todos los padres o representantes legales firmaron el consentimiento informado, y los pacientes dieron su asentimiento a participar. El estudio fue aprobado por el Comité de Ética e Investigación del Hospital General Universitario Gregorio Marañón.
MedidasDatos demográficos y clínicosLos datos demográficos fueron recogidos empleando una entrevista estructurada con los participantes y sus padres o representantes legales. El estatus socioeconómico de los padres se calculó empleando la escala Hollingshead-Redlich Scale24.
Todos los diagnósticos fueron realizados por psiquiatras infantiles. El procedimiento diagnóstico incluyó el registro de la historia médica de desarrollo y los antecedentes psiquiátricos, basándose en la entrevista clínica y la observación. El consenso diagnóstico fue realizado por psiquiatras del Hospital General Universitario Gregorio Marañón, del Departamento de Psiquiatría del Niño y del Adolescente, con más de 10 años de experiencia; para ello se emplearon los criterios del DSM-IV25, junto con los criterios de Gillberg26; clínicos certificados administraron el Autism Diagnostic Observation Schedule-Generic27 cuando los criterios del DSM-IV y los criterios de Gillberg no coincidían (10 pacientes con TEA; 35,7%). Para descartar comorbilidad psiquiátrica en el grupo de pacientes, así como para confirmar la no existencia de diagnóstico psiquiátrico en el GC se empleó la adaptación al español de la entrevista Kiddie-Sads-Present and Lifetime Version28. Se registró la medicación de aquellos pacientes que estaban tomando alguna en el momento de la inclusión en el estudio.
El funcionamiento psicosocial fue evaluado con la Children's Global Assessment Scale (C-GAS)29, en su versión española30. Puntuaciones en esta escala superiores a 70 son consideradas como indicativas de buen funcionamiento31.
En el grupo de pacientes se evaluó la severidad de los síntomas con la Clinical Global Impression Scale (CGI)32.
Evaluación del cociente intelectualTeniendo en cuenta que la estimación del cociente intelectual no es una medida válida para calcular la inteligencia en pacientes con TEA33, se decidió aplicar la escala completa para la obtención de un CI total (CIT), para lo que se usó la versión española de la escala Wechsler de inteligencia para adultos en su tercera edición (WAIS-III) o la escala de inteligencia para niños revisada (WISC-R)34,35, dependiendo de la edad.
En el caso del GC se estimó el CI empleando los subtest de Vocabulario y Cubos36 del WAIS-III o del WISC-R.
Evaluación de las funciones ejecutivasLas FE fueron medidas empleando una batería de pruebas neuropsicológicas compuesta por los siguientes test:
Test de palabras y colores de Stroop, tarea clásica de inhibición de respuesta verbal automática, que ha demostrado una fiabilidad consistente (con un rango de 0,73 a 0,86)37,38.
Trail Making Test (TMT)39, que mide la velocidad de procesamiento y cambio atencional, y que ha demostrado una consistencia en grupos clínicos entre 0,69 y 0,94 para la parte A y entre 0,66 y 0,86 en la parte B40. En este test se calculó la siguiente puntuación: puntuación derivada del TMT (B)=(tiempo empleado en completar el TMT [B]−tiempo empleado en completar el TMT [A])/tiempo empleado en completar el TMT (A).
Test de Clasificación de Cartas de Wisconsin (versión de mesa) (WCST), tarea que mide la generación de conceptos, el cambio de set cognitivo, la habilidad para inhibir respuestas prepotentes, el razonamiento abstracto, la solución de problemas y la atención sostenida41. El WCST ha demostrado una generalización de sus componentes que oscila en un rango de 0,52 a 0,7142.
Continuous Performance Test-II (CPT-II) es una medida de atención sostenida, control de impulsos y de velocidad de procesamiento de la información, que ha demostrado una consistencia interna de las diferentes variables que componen el test de entre 0,83 y 0,9443.
La prueba de los dígitos directos es una tarea de atención, y la de los dígitos inversos es una tarea de memoria de trabajo verbal que mide la habilidad de transformar y manipular mentalmente la información. En esta tarea empleamos el span obtenido en cada uno de ellos (máximo número de elementos recordados).
El subtest de letras y números es una tarea de memoria de trabajo que mide la habilidad para transformar y manipular mentalmente información. En esta tarea empleamos el span obtenido (máximo número de elementos recordados).
Los subtest de dígitos, y letras y números han demostrado una validez y fiabilidad de 0,82 y de 0,60 a 0,80, respectivamente.
Se construyeron 5 dominios de FE (atención, memoria de trabajo, flexibilidad mental, control inhibitorio y solución de problemas) a partir de una selección de medidas de los test neuropsicológicos descritos anteriormente. La decisión de agrupar cada una de las medidas neuropsicológicas en los diferentes dominios cognitivos (tabla 1) se hizo teniendo en cuenta las funciones cognitivas que evalúan cada uno de los test41,44,45.
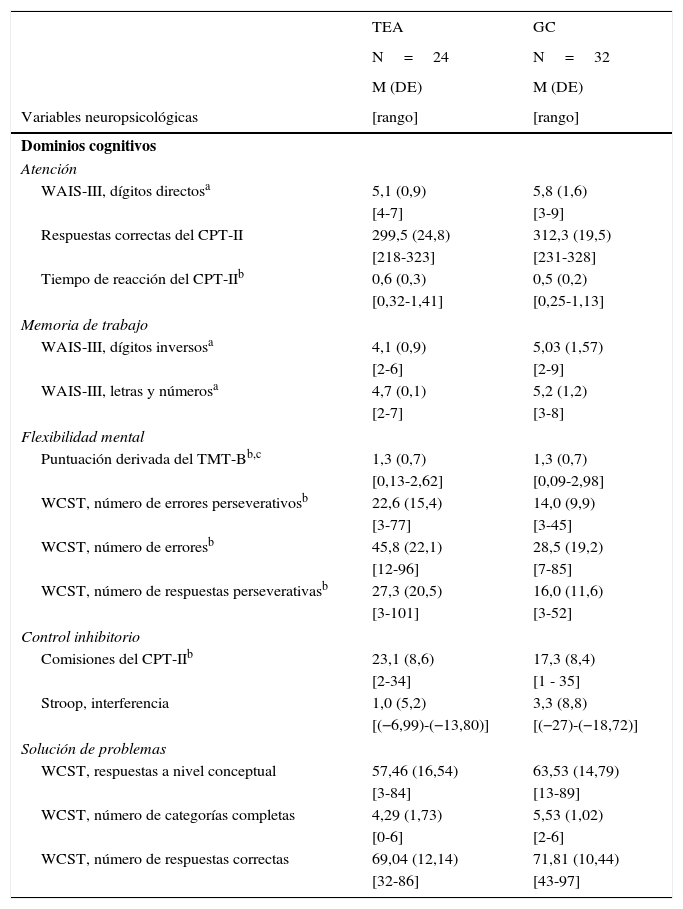
Dominios cognitivos y puntuaciones directas en pacientes con trastornos del espectro autista sin discapacidad intelectual y controles sanos
| TEA | GC | |
|---|---|---|
| N=24 | N=32 | |
| M (DE) | M (DE) | |
| Variables neuropsicológicas | [rango] | [rango] |
| Dominios cognitivos | ||
| Atención | ||
| WAIS-III, dígitos directosa | 5,1 (0,9) | 5,8 (1,6) |
| [4-7] | [3-9] | |
| Respuestas correctas del CPT-II | 299,5 (24,8) | 312,3 (19,5) |
| [218-323] | [231-328] | |
| Tiempo de reacción del CPT-IIb | 0,6 (0,3) | 0,5 (0,2) |
| [0,32-1,41] | [0,25-1,13] | |
| Memoria de trabajo | ||
| WAIS-III, dígitos inversosa | 4,1 (0,9) | 5,03 (1,57) |
| [2-6] | [2-9] | |
| WAIS-III, letras y númerosa | 4,7 (0,1) | 5,2 (1,2) |
| [2-7] | [3-8] | |
| Flexibilidad mental | ||
| Puntuación derivada del TMT-Bb,c | 1,3 (0,7) | 1,3 (0,7) |
| [0,13-2,62] | [0,09-2,98] | |
| WCST, número de errores perseverativosb | 22,6 (15,4) | 14,0 (9,9) |
| [3-77] | [3-45] | |
| WCST, número de erroresb | 45,8 (22,1) | 28,5 (19,2) |
| [12-96] | [7-85] | |
| WCST, número de respuestas perseverativasb | 27,3 (20,5) | 16,0 (11,6) |
| [3-101] | [3-52] | |
| Control inhibitorio | ||
| Comisiones del CPT-IIb | 23,1 (8,6) | 17,3 (8,4) |
| [2-34] | [1 - 35] | |
| Stroop, interferencia | 1,0 (5,2) | 3,3 (8,8) |
| [(−6,99)-(−13,80)] | [(−27)-(−18,72)] | |
| Solución de problemas | ||
| WCST, respuestas a nivel conceptual | 57,46 (16,54) | 63,53 (14,79) |
| [3-84] | [13-89] | |
| WCST, número de categorías completas | 4,29 (1,73) | 5,53 (1,02) |
| [0-6] | [2-6] | |
| WCST, número de respuestas correctas | 69,04 (12,14) | 71,81 (10,44) |
| [32-86] | [43-97] | |
CPT-II: Continuous Performance Test-II; DE: desviación estándar; GC: grupo control; M: media; Stroop: test de palabras y colores Stroop; TEA: trastorno del espectro autista; TMT (A-B): Trail Making Test (partes A y B); WAIS-III: Escala Wechsler de Inteligencia para Adultos; WCST: Test de Clasificación de Cartas de Wisconsin.
Las puntuaciones directas de cada una de las variables neuropsicológicas se transformaron en puntuaciones z (media=0±1); esta transformación se hizo con base en las puntuaciones obtenidas por el grupo control: se empleó la media y la desviación estándar obtenida en cada una de las variables neuropsicológicas del GC y se empleó la siguiente fórmula: z=X1-X¯2 /¿2 para el cálculo de las mismas, donde X1 es la puntuación directa obtenida por cada uno de los pacientes en las variables neuropsicológicas y X¯2 y ¿2 se corresponden con la media y la desviación estándar obtenida por el GC, en cada una de las variables cognitivas, respectivamente.
Todas las puntuaciones z fueron calculadas de tal forma que las altas siempre indicaban una buena ejecución. Para aquellas medidas cognitivas en las que puntuaciones directas altas eran indicativas de una pobre ejecución (puntuación derivada del TMT-B, número de errores perseverativos del WCST, número de errores del WCST, número de respuestas perseverativas del WCST, errores de comisión del CPT-II y tiempo de reacción del CPT-II) se cambió el signo de la puntuación z, cambiando de más a menos o viceversa, dependiendo de la variable.
Las puntuaciones z de cada una de las variables neuropsicológicas se agruparon en los diferentes dominios cognitivos construidos para el estudio mediante una media aritmética de las variables incluidas en cada uno de ellos.
La batería de pruebas neuropsicológicas fue aplicada a pacientes y controles en una habitación sin distractores. Las tareas fueron presentadas en un orden preestablecido. Todos los test fueron administrados y corregidos por 3 neuropsicólogos siguiendo las instrucciones de los manuales correspondientes.
Antes de dar comienzo el estudio, todos los neuropsicólogos demostraron una buena fiabilidad interjueces en la administración y la corrección de las pruebas. La fiabilidad interjueces se calculó para el subtest de vocabulario de WAIS-III/WISC-R y para el WCST con la evaluación de 10 casos, en los que se obtuvo un coeficiente de correlación interclase de entre 0,95 y 1,00 en ambos test.
Análisis estadísticosCon fines descriptivos se proporcionan la media y la desviación estándar de las variables cuantitativas, y las frecuencias y los porcentajes de las cualitativas.
Para comparar las variables cualitativas de ambos grupos se empleó el test Chi cuadrado (χ2) para la variable género, y el test exacto de Fisher para las variables raza y estatus socioeconómico.
En el caso de las variables cuantitativas (edad, años de educación, medidas neuropsicológicas, dominios cognitivos, C-GAS y CGI) se comprobó la asunción del modelo lineal general empleando los test de Kolmogorov-Smirnov y Shapiro-Wilk. La comparación entre grupos de las variables cuantitativas se realizó con el test T de Student para las variables que seguían una distribución normal y el test U de Mann-Whitney para aquellas que no seguían una distribución normal.
Con el fin de estudiar la relación entre los dominios de la FE y el CI se realizó un análisis de correlación bivariada entre los dominios cognitivos y el CIT, CI verbal y CI manipulativo; para ello se emplearon los coeficientes de Spearman o Pearson, dependiendo de la distribución de las variables.
A pesar de que nuestra muestra de pacientes y controles estaba pareada por CI, también analizamos las diferencias en FE entre pacientes y controles controlando por CI, para lo que realizamos un ANCOVA, en el que la variable grupo (TEA-SDI/GC) fue el factor fijo, las puntuaciones z de cada uno de los dominios de FE fueron las variables dependientes, y el CI, la covariable.
Para estudiar la relación entre los dominios cognitivos y las variables clínicas de funcionamiento y severidad de los síntomas (C-GAS y CGI, respectivamente) en el grupo de pacientes se realizaron correlaciones bivariadas; para ello se emplearon los coeficientes de Spearman o Pearson, dependiendo de la distribución de las variables.
Se calculó el tamaño del efecto para todos los análisis en los que se obtuvieron diferencias estadísticamente significativas entre los grupos. Los datos se proporcionan a través del coeficiente D de Cohen (donde 0,2 es indicativo de un tamaño del efecto pequeño, 0,5 es indicativo de un tamaño del efecto medio, y 0,8, de un gran tamaño del efecto). Debido al número limitado de participantes (controles y pacientes) incluidos en el estudio, y con el fin de descartar un posible error tipo ii, se calculó también el poder estadístico de todas aquellas variables que no habían resultado estadísticamente significativas al comparar entre grupos.
Se consideró significativo un valor de p menor de 0,05. Los análisis se realizaron con el paquete estadístico SPSS® 18.0 para Windows®.
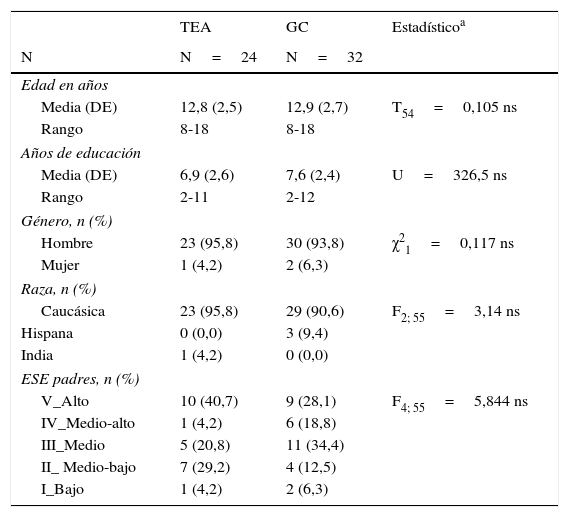
ResultadosMuestraDatos demográficos y clínicosVeinticuatro pacientes con TEA (22 con síndrome de Asperger y 2 AAF de acuerdo con los criterios del DSM-IV) y 32 controles cumplieron los criterios de inclusión en el estudio. No se encontraron diferencias estadísticamente significativas en ninguna de las variables sociodemográficas entre el grupo TEA y el GC (edad, años de educación, género, raza y estatus socioeconómico de los padres). Estos resultados se muestran en la tabla 2.
Datos sociodemográficos
| TEA | GC | Estadísticoa | |
|---|---|---|---|
| N | N=24 | N=32 | |
| Edad en años | |||
| Media (DE) | 12,8 (2,5) | 12,9 (2,7) | T54=0,105 ns |
| Rango | 8-18 | 8-18 | |
| Años de educación | |||
| Media (DE) | 6,9 (2,6) | 7,6 (2,4) | U=326,5 ns |
| Rango | 2-11 | 2-12 | |
| Género, n (%) | |||
| Hombre | 23 (95,8) | 30 (93,8) | χ21=0,117 ns |
| Mujer | 1 (4,2) | 2 (6,3) | |
| Raza, n (%) | |||
| Caucásica | 23 (95,8) | 29 (90,6) | F2; 55=3,14 ns |
| Hispana | 0 (0,0) | 3 (9,4) | |
| India | 1 (4,2) | 0 (0,0) | |
| ESE padres, n (%) | |||
| V_Alto | 10 (40,7) | 9 (28,1) | F4; 55=5,844 ns |
| IV_Medio-alto | 1 (4,2) | 6 (18,8) | |
| III_Medio | 5 (20,8) | 11 (34,4) | |
| II_ Medio-bajo | 7 (29,2) | 4 (12,5) | |
| I_Bajo | 1 (4,2) | 2 (6,3) | |
DE: desviación estándar; ESE: estatus socioeconómico calculado con la escala Hollinshead (Hollingshead y Redlich, 1958); GC: grupo control; ns: no significativo; TEA: trastorno del espectro autista.
Se encontraron diferencias estadísticamente significativas en la C-GAS entre el grupo TEA y el GC (TEA: puntuación media 53,25±12,8; intervalo de confianza [IC] del 95% 47,9 a 58,7; rango 35-85; mediana 50. GC: puntuación media 92,52±5,07; IC del 95% 90,6 a 94,5; rango 75-100; mediana 91. U: 1,0; p<0,0001).
Con respecto a las puntuaciones en la escala CGI, 8 pacientes (33,3%) estaban medianamente enfermos, 9 (37,5%) estaban moderadamente enfermos, 6 (25%) estaban marcadamente enfermos y uno (4,2%) estaba severamente enfermo.
MedicaciónOcho pacientes con TEA (39,29%) estaban tomando tratamiento psicofarmacológico (un paciente estaba tomando aripiprazol; 2, risperidona; uno, risperidona y sertralina; uno, risperidona y fluoxetina; uno, risperidona, metilfenidato y topiramato; y 2, metilfenidato).
Evaluación del cociente intelectualLa media del CI estimado en el GC fue de 106,81±11,02. En el grupo de pacientes con TEA, la media de CIT fue 99,20±18,81. No se encontraron diferencias estadísticamente significativas entre los grupos.
Evaluación de las funciones ejecutivasLas puntuaciones directas, la desviación estándar y el rango obtenidos por los pacientes y controles en cada una de las variables cognitivas se muestran en la tabla 1.
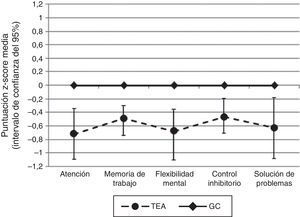
Cuando se compararon las puntuaciones z en cada uno de los dominios de FE evaluados (atención, memoria de trabajo, control inhibitorio, flexibilidad mental y solución de problemas) se encontraron diferencias estadísticamente significativas a favor de un mejor rendimiento por parte del GC. Cuando se compararon las puntuaciones z de cada una de las medidas cognitivas de forma individual, encontramos diferencias estadísticamente significativas en las siguientes: dígitos directos del WAIS-III, respuestas correctas del CPT-II y tiempo de reacción del CPT-II (variables incluidas en el dominio de atención); dígitos inversos del WAIS-III (variable incluida en el dominio de memoria de trabajo); número de errores perseverativos del WCST, número de errores del WCST, número de respuestas perseverativas del WCST (variables incluidas en el dominio de flexibilidad mental); errores de comisión del CPT-II (variable incluida en el dominio de control inhibitorio); número de categorías completas del WCST (variable incluida en le el dominio de solución de problemas) (tabla 3).
Puntuaciones z de los dominios cognitivos en función ejecutiva de los pacientes con trastorno del espectro autista y controles sanos
| TEA | GC | Estadísticoa | Tamaño del efectob | Potencia | |
|---|---|---|---|---|---|
| N=24 | N=32 | ||||
| Media (DE) | Media (DE) | ||||
| Dominios cognitivos | |||||
| Atención | −0,72 (0,86) | 0,0008 (0,68) | U=185,0** | 0,9 | - |
| WAIS-III, dígitos directosc | −0,49 (0,6) | 0 (1,0) | U=272,0* | 0,6 | - |
| Respuestas correctas del CPT-II | −0,65 (1,3) | 0 (1,0) | U=235,5** | 0,57 | - |
| Tiempo de reacción del CPT-IId | 0,99 (1,6) | 0 (1,0) | U=−218,0** | 0,73 | - |
| Memoria de trabajo | −0,46 (0,52) | −0,001 (0,88) | T51,48=2,597* | 0,72 | - |
| WAIS-III, dígitos inversosc | −0,60 (0,6) | 0 (0,9) | U=249,5* | 0,73 | - |
| WAIS-III, letras y númerosc | −0,38 (0,8) | 0 (1,0) | U=315, ns | - | 0,31 |
| Flexibilidad mental | −0,68 (1,14) | 0,0001 (0,85) | U=236,0* | 0,67 | - |
| Puntuación derivada del TMT-Bd,e | −0,03 (0,9) | 0 (1,0) | T54=0,117, ns | - | 0,05 |
| WCST, número de errores perseverativosd | 0,87 (1,6) | 0 (1,0) | U=226,5** | 0,65 | - |
| WCST, número de erroresd | 0,90 (1,2) | 0 (1,0) | U=202,5** | 0,83 | - |
| WCST, número de respuestas perseverativasd | 0,97 (1,8) | 0 (0,9) | U=228,5** | 0,68 | - |
| Control inhibitorio | −0,47 (0,72) | −0,0001 (0,60) | U=210,0* | 0,71 | - |
| Comisiones del CPT-IId | 0,69 (1,0) | 0 (1,0) | T53=−2,53** | 0,69 | - |
| Stroop interferencia | −−0,26 (0,6) | 0 (1,0) | U=291,0, ns | - | 0,2 |
| Solución de problemas | −0,63 (1,20) | 0,0005 (0,80) | U=216,0* | 0,62 | - |
| WCST, respuestas a nivel conceptual | −0,41 (1,1) | 0 (1,0) | U=298,5, ns | - | 0,3 |
| WCST, número de categorías completas | −1,22 (1,7) | 0 (0,9) | U=225,0** | 0,87 | - |
| WCST, número de respuestas correctas | −0,27 (1,2) | 0 (1,0) | U=352,5, ns | - | 0,15 |
CPT-II: Continuous Performance Test-II; DE: desviación estándar; GC: grupo control; ns: no significativo; TEA: trastorno del espectro autista; TMT (A-B): Trail Making Test (partes A y B); WAIS-III: Escala Wechsler de Inteligencia para Adultos; WCST: Test de Clasificación de Cartas de Wisconsin.
En todas aquellas variables neuropsicológicas en las que no encontramos diferencias estadísticamente significativas entre los grupos (letras y números del WAIS-III, puntuación derivada del TMT-B, interferencia del Stroop, respuestas a nivel conceptual del WCST y número de respuestas correctas del WCST) calculamos el poder estadístico y este no fue mayor de 0,31 (fig. 1).
No encontramos diferencias estadísticamente significativas en ninguno de los dominios de FE entre aquellos pacientes que estaban con tratamiento psicofarmacológico y los que no (atención: U=63,0, p=0,951; memoria de trabajo: T22=1,026, p=0,316; flexibilidad mental: U=61,0, p=0,854; control inhibitorio: U=53,0, p=0,501; solución de problemas: U=59,500, p=0,783).
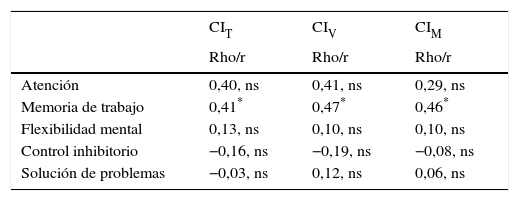
Función ejecutiva y cociente intelectualEn el grupo de pacientes con TEA no encontramos correlaciones estadísticamente significativas entre CIT, CI verbal, CI manipulativo y ninguno de los dominios de FE evaluados, con excepción del dominio de memoria de trabajo. Se ofrecen más detalles en la tabla 4.
Correlaciones bivariadas entre inteligencia y funciones ejecutivas en pacientes con trastorno del espectro autista sin discapacidad intelectual
| CIT | CIV | CIM | |
|---|---|---|---|
| Rho/r | Rho/r | Rho/r | |
| Atención | 0,40, ns | 0,41, ns | 0,29, ns |
| Memoria de trabajo | 0,41* | 0,47* | 0,46* |
| Flexibilidad mental | 0,13, ns | 0,10, ns | 0,10, ns |
| Control inhibitorio | −0,16, ns | −0,19, ns | −0,08, ns |
| Solución de problemas | −0,03, ns | 0,12, ns | 0,06, ns |
CIM: cociente intelectual manipulativo; CIT: cociente intelectual total (WAIS-III o WISC-R); CIV: cociente intelectual verbal; ns: no significativo.
Estadísticos: Pearson (r) o Spearman (Rho), dependiendo de las características de las variables.
Las diferencias en los dominios de FE entre pacientes y controles continuaron siendo significativas incluso controlando por CI: atención (F(1)=7,495; p=0,007; D=0,13), memoria de trabajo (F(1)=4,452; p=0,04; D=0,07), flexibilidad mental (F(1)=4,804; p=0,03; D=0,08), control inhibitorio (F(1)=6,638; p=0,013; D=0,11) y solución de problemas (F(1)=5,247; p=0,02; D=0,09).
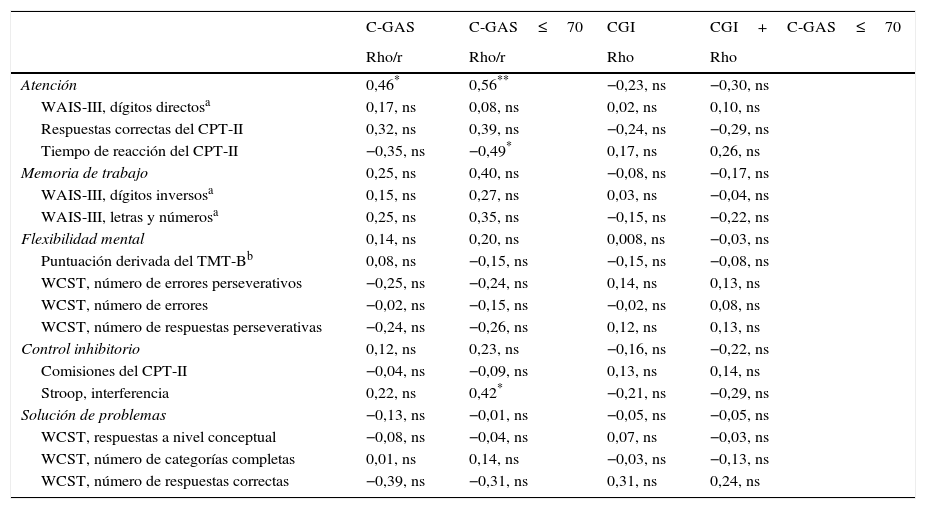
Función ejecutiva y funcionamiento adaptativoSolo en el dominio de atención las puntuaciones correlacionan con las de funcionamiento medidas con las C-GAS. Ninguno de los dominios de FE correlaciona con la severidad de los síntomas medidos con la escala CGI. Se ofrecen más detalles en tabla 5.
Correlaciones bivariadas entre variables clínicas y funciones ejecutivas en pacientes con trastorno del espectro autista sin discapacidad intelectual
| C-GAS | C-GAS≤70 | CGI | CGI+C-GAS≤70 | |
|---|---|---|---|---|
| Rho/r | Rho/r | Rho | Rho | |
| Atención | 0,46* | 0,56** | −0,23, ns | −0,30, ns |
| WAIS-III, dígitos directosa | 0,17, ns | 0,08, ns | 0,02, ns | 0,10, ns |
| Respuestas correctas del CPT-II | 0,32, ns | 0,39, ns | −0,24, ns | −0,29, ns |
| Tiempo de reacción del CPT-II | −0,35, ns | −0,49* | 0,17, ns | 0,26, ns |
| Memoria de trabajo | 0,25, ns | 0,40, ns | −0,08, ns | −0,17, ns |
| WAIS-III, dígitos inversosa | 0,15, ns | 0,27, ns | 0,03, ns | −0,04, ns |
| WAIS-III, letras y númerosa | 0,25, ns | 0,35, ns | −0,15, ns | −0,22, ns |
| Flexibilidad mental | 0,14, ns | 0,20, ns | 0,008, ns | −0,03, ns |
| Puntuación derivada del TMT-Bb | 0,08, ns | −0,15, ns | −0,15, ns | −0,08, ns |
| WCST, número de errores perseverativos | −0,25, ns | −0,24, ns | 0,14, ns | 0,13, ns |
| WCST, número de errores | −0,02, ns | −0,15, ns | −0,02, ns | 0,08, ns |
| WCST, número de respuestas perseverativas | −0,24, ns | −0,26, ns | 0,12, ns | 0,13, ns |
| Control inhibitorio | 0,12, ns | 0,23, ns | −0,16, ns | −0,22, ns |
| Comisiones del CPT-II | −0,04, ns | −0,09, ns | 0,13, ns | 0,14, ns |
| Stroop, interferencia | 0,22, ns | 0,42* | −0,21, ns | −0,29, ns |
| Solución de problemas | −0,13, ns | −0,01, ns | −0,05, ns | −0,05, ns |
| WCST, respuestas a nivel conceptual | −0,08, ns | −0,04, ns | 0,07, ns | −0,03, ns |
| WCST, número de categorías completas | 0,01, ns | 0,14, ns | −0,03, ns | −0,13, ns |
| WCST, número de respuestas correctas | −0,39, ns | −0,31, ns | 0,31, ns | 0,24, ns |
C-GAS: Children's Global Assessment Scale; CGI: Clinical Global Impression Scale; CGI+C-GAS≤70: puntuaciones en la Clinical Global Impression Scale de pacientes con una puntuación en la Children's Global Assessment Scale≤70; CPT-II: Continuous Performance Test-II; ns: no significativo; TEA: trastorno del espectro autista; TMT (A-B): Trail Making Test (partes A y B); WAIS-III: Escala Wechsler de Inteligencia para Adultos; WCST: Test de Clasificación de Cartas de Wisconsin
Nuestros resultados muestran que los niños y los adolescentes con TEA-SDI presentan alteraciones en FE. A pesar de tener un CI normal, su perfil cognitivo se caracteriza por presentar déficits en los 5 dominios de FE evaluados (atención, memoria de trabajo, flexibilidad mental, control inhibitorio y solución de problemas). Además, estos déficits encontrados en FE no correlacionan con el CI en esta muestra de pacientes.
Durante las últimas 3 décadas, numerosos estudios han avalado la existencia de alteraciones en el funcionamiento ejecutivo en pacientes con autismo46–55. Sin embargo, muchos de estos estudios no han empleado baterías de pruebas neuropsicológicas completas, limitando su trabajo al estudio de un único dominio de FE.
En primer lugar, en el dominio de atención, nuestros resultados evidencian dificultades en tareas de atención sostenida y atención selectiva, así como latencias de respuesta mayores en el caso de los pacientes con TEA. Problemas similares se encuentran en la literatura1–3,56. Kilinçaslan et al. (2010) no encontraron diferencias estadísticamente significativas en tareas de atención sostenida cuando compararon pacientes con TEA con controles sanos; en cambio, sí que encontraron diferencias cuando los pacientes con TEA presentaban comorbilidad psiquiátrica con trastorno por déficit de atención e hiperactividad (TDAH)4. Es importante señalar que aunque ninguno de los pacientes incluidos en nuestro estudio presentaba comorbilidad psiquiátrica con TDAH, probablemente tenían síntomas subumbrales de déficit de atención, sin llegar a cumplir criterios diagnóstico para TDAH, como así ha demostrado un estudio previo57. Dada la importancia de la atención para el rendimiento académico, deberían tenerse en cuenta las dificultades en atención para la creación de programas de intervención en población infantojuvenil con TEA, incluso en aquellos pacientes con TEA que no presentan comorbilidad con TDAH.
En segundo lugar, se encontraron problemas de inhibición de respuestas automáticas en los pacientes con TEA de nuestro estudio, en la línea con lo encontrado en la literatura previamente publicada3–5,7,8,13,15,18. Estos déficits muestran que los pacientes con TEA presentan dificultades para inhibir respuestas prepotentes, implicando tiempos mayores para el procesamiento de la información y realización de tareas. Estos resultados se encuentran en la línea de estudios previos con pacientes con TEA, que han demostrado que estos presentan problemas en la velocidad de procesamiento, los cuales están presentes a lo largo de su vida58–62. Dificultades en la velocidad de procesamiento se han asociado con problemas severos de comunicación en niños con AAF60, siendo predictoras del rendimiento académico en matemáticas y lectoescritura63.
Problemas en la flexibilidad mental también han sido reportados previamente4,7,8,15,17,64, con la excepción de autores como Kaland et al. (2008), quienes emplearon la versión informatizada del WCST2 para medirla en pacientes con TEA. Sus resultados están en la línea de algunos estudios que han encontrado una mejor ejecución de estos pacientes cuando la tarea se aplica en su versión informatizada16,65. Una pobre flexibilidad mental se manifiesta con comportamientos perseverativos y estereotipados, así como con dificultades en la regulación y la modulación de acciones motoras47. De hecho, aunque las correlaciones entre el comportamiento repetitivo, la insistencia en la igualdad y la perseveración cognitiva no se han establecido claramente, la insistencia en la igualdad es una característica que se ha incluido en los síntomas centrales del autismo por algunos de los autores más representativos66–68. En el recientemente publicado DSM-569, el cumplimiento del criterio B que comprende la insistencia en la igualdad, junto con otros comportamientos repetitivos o estereotipados y/o anomalías sensoriales, se convierte en obligatorio para el diagnóstico de TEA.
Los déficits en memoria de trabajo verbal encontrados en nuestro estudio están en la línea de estudios previos de la literatura que indican que los pacientes con TEA presentan dificultades en retener y manipular mentalmente información tanto verbal como visual7–9,13–16. Cui et al. (2010) midieron y compararon la memoria de trabajo verbal y visual y encontraron que los niños con TEA presentaban un mejor rendimiento en tareas de memoria de trabajo verbal y peor en tareas de memoria de trabajo visual, evidenciando un posible disbalance en la memoria de trabajo durante el desarrollo de los niños con TEA12. Teniendo en cuenta estos resultados y el modelo de Baddley de memoria de trabajo70, nuestros resultados no nos permiten dilucidar si las personas con TEA-SDI presentan un problema en el ejecutivo central que, a su vez, afecta al proceso fonológico y visoespacial, o si estas alteraciones son independientes.
Igualmente, las personas con TEA presentan dificultades en el dominio de la resolución de problemas. De acuerdo con estos resultados, Troyb et al. (2014) encontraron que pacientes con AAF eran menos eficaces en tareas de planificación y resolución de problemas71. Algunos autores explican esta alteración como consecuencia de un déficit de procesamiento global en el autismo72–74.
Estos resultados muestran que las personas con TEA-SDI presentan problemas importantes de disfunción ejecutiva. En este estudio también hemos encontrado que estas alteraciones que se observan en FE no correlacionan con el CI en nuestra muestra de niños y adolescentes con TEA. Esta posible correlación entre FE y CI en pacientes con TEA ha sido debatida por numerosos autores7,75-77. En un estudio previo encontramos que los perfiles de inteligencia que medimos con el WAIS-III y con el WISC-R presentaban perfiles similares33, aunque aquellos pacientes a los que se les aplicó la escala WAIS-III obtuvieron un mayor número de puntuaciones por debajo del rango considerado normal. En nuestra muestra, nosotros únicamente encontramos una correlación positiva del CI con el dominio de memoria de trabajo, evidenciando que puntuaciones más altas en inteligencia correlacionarían con una mejor ejecución en tareas de memoria de trabajo. No obstante, este resultado debe ser interpretado con precaución, ya que en nuestro estudio el dominio de memoria de trabajo estaba constituido por 2 subtest incluidos en el cálculo del CI (dígitos inversos y letras y números del WAIS-III), que podría explicar la correlación encontrada. Estos resultados indican que sería necesario estudiar esta posible relación con otras tareas de memoria de trabajo con el fin de confirmar o refutar los resultados encontrados en nuestro estudio. Además, cuando los pacientes fueron comparados con los controles controlando por CI siguieron existiendo diferencias estadísticamente significativas, siendo los pacientes con TEA los que presentaban un peor rendimiento en tareas de FE.
En la misma línea que nuestros resultados, en una muestra de pacientes con TEA que se comparó con un grupo control (no pareado en CI), Narzisi et al. (2013) encontraron que los déficits en funcionamiento ejecutivo continuaban siendo significativos incluso cuando se controlaba el efecto del CI verbal y las habilidades lingüísticas, a favor de una disfunción ejecutiva en el grupo de TEA7. En este estudio, la batería de pruebas neuropsicológicas empleada para medir el perfil cognitivo, dentro del cual se evalúa la FE, fue la NEPSY-II78. Aunque nosotros empleamos una batería de pruebas neuropsicológicas diferente para la medición de la FE en pacientes con TEA-SDI, nuestros resultados son similares en todos los dominios evaluados, incluso cuando los grupos comparados están pareados por CI, como es el caso de nuestro estudio.
Una recomendación derivada de los resultados de este estudio es la realización de una evaluación neuropsicológica de las FE como parte de la evaluación completa de los pacientes con TEA, así como en otras enfermedades psiquiátricas79, cuyo propósito sea el diseño de intervenciones, teniendo en cuenta que la medición del CI general en estos pacientes no es suficiente para poder disponer de una idea completa de sus habilidades cognitivas.
El recientemente publicado DSM-5 proporciona especificadores clínicos para el diagnóstico de TEA, facilitando una imagen completa del perfil clínico de estos pacientes, y para orientar las intervenciones clínicas.
Podríamos argumentar que una evaluación de las FE debería formar parte de una evaluación integral con fines terapéuticos; a la luz de nuestros resultados, teniendo en cuenta únicamente el funcionamiento cognitivo general a partir de la evaluación del CI, podríamos sobrestimar la capacidad cognitiva de los pacientes con TEA.
La evaluación neuropsicológica de las FE en estos pacientes debería incluir la evaluación de los dominios cognitivos de atención, memoria de trabajo (verbal, visual y espacial), control inhibitorio, flexibilidad mental, planificación y resolución de problemas. Con el fin de asegurarnos de que las habilidades de procesamiento globales de estos pacientes no interfieren en la ejecución de las tareas de funcionamiento ejecutivo, deberían seleccionarse las tareas basándose en el nivel de habilidades cognitivas que presenta el paciente a evaluar, teniendo en cuenta que sus déficits están especialmente relacionados con el incremento de la dificultad de la tarea cognitiva76,80–83, así como el empleo de pruebas informatizadas, siempre que el soporte de la tarea lo proporcione, siguiendo las indicaciones de estudios que han encontrado que estos pacientes presentan mejores rendimientos en tareas de estas características16,65.
No hemos encontrado ninguna correlación en los resultados obtenidos cuando hemos estudiado en el grupo de pacientes con TEA la posible relación entre el funcionamiento ejecutivo y las variables clínicas de funcionamiento psicosocial y severidad de los síntomas. Sin embargo, estas no son medidas sutiles del rendimiento académico o vocacional, aspectos muy importantes de cara a un pronóstico a largo plazo. Por lo tanto, desde una perspectiva clínica sería interesante explorar cómo el rendimiento en los test de FE correlacionan con los cuestionarios que evalúan la FE en la vida real reportados por los padres y profesores, con cuestionarios como el Behavior Rating Inventory of Executive Function84, o con otras medidas que proporcionen información sobre su funcionamiento en la vida real.
Los TEA suelen diagnosticarse durante la primera infancia, por lo que es importante tener en cuenta los cambios que se dan en el rendimiento de FE a lo largo del desarrollo para los planes de tratamiento7,15,85,86. En esta línea, algunos estudios han encontrado diferencias relacionadas con la edad en memoria de trabajo e iniciación85, inhibición, planificación y flexibilidad86 en niños y adolescentes con TEA, teniendo en cuenta los cuestionarios cumplimentados por los padres.
Los resultados obtenidos en el presente estudio deben ser interpretados con precaución, puesto que presenta algunas limitaciones metodológicas. En primer lugar, el tamaño de la muestra de pacientes con TEA-SDI es pequeño. No obstante, cabe señalar que pese al reducido tamaño de la muestra se encontraron diferencias estadísticamente significativas en las variables principales de estudio (dominios de FE). En segundo lugar, para la aplicación del WCST empleamos la versión de mesa, y algunos estudios han encontrado que pacientes con TEA obtienen mejores puntuaciones cuando se les aplica la versión informatizada16,65. En tercer lugar, aunque la evaluación cognitiva fue realizada con una batería de pruebas neuropsicológicas muy amplia, en esta no se incluían tareas de memoria visual y espacial, ni fluidez fonológica ni semántica. La fortaleza principal de este estudio fue que se midió un amplio rango de dominios de FE en una muestra homogénea de pacientes con TEA pareada con un grupo control. Los 5 dominios fueron evaluados con una batería de pruebas neuropsicológicas muy completa, compuesta por test especialmente diseñados para la evaluación de las FE.
Futuras investigaciones deben considerar el estudio de las FE en pacientes con TEA que presenten comorbilidad psiquiátrica.
Como conclusiones finales del estudio, encontramos que los niños y los adolescentes con TEA-SDI tienen dificultades en retener y manipular mentalmente información verbal, tienen una latencia de respuesta mayor, presentan problemas atencionales (shifting), dificultades en la inhibición de respuestas automáticas prepotentes y dificultades en la resolución de problemas, a pesar de tener un CI en la media. Teniendo en cuenta el bajo perfil cognitivo en FE encontrado en este grupo de pacientes, recomendamos una intervención integral que incluya programas de rehabilitación complementaria en los dominios de cognición no social.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste trabajo se ha realizado con el apoyo del Ministerio de Economía y Competitividad, el Instituto de Salud Carlos III, CIBERSAM, la Comunidad de Madrid (Ayudas I+D en Biomedicina S2010/BMD-2422 AGES) y los Fondos Estructurales de la Unión Europea, la Fundación Alicia Koplowitz, la Fundación Mutua Madrileña y ERA-NET NEURON (Network of European Funding for Neuroscience Research).
Conflicto de interesesJessica Merchán-Naranjo declara no tener ningún conflicto de intereses.
Leticia Boada declara no tener ningún conflicto de intereses.
Ángel del Rey-Mejías declara no tener ningún conflicto de intereses.
María Mayoral ha recibido una beca de investigación de la Comunidad de Madrid (beca predoctoral), del Instituto de Salud Carlos III y del Ministerio de Economía y Competitividad.
Cloe Llorente declara no tener ningún conflicto de intereses.
Celso Arango ha sido consultor y ha recibido honorarios o subvenciones de Abbot, AMGEN, AstraZeneca, Bristol-Myers Squibb, Caja Navarra, CIBERSAM, Fundación Alicia Koplowitz, Instituto de Salud Carlos III, Janssen Cilag, Lundbeck, Merck, Ministerio de Ciencia e Innovación, Ministerio de Sanidad, Ministerio de Economía y Competitividad, Mutua Madrileña, Otsuka, Pfizer, Roche, Servier, Shire, Schering-Plough y Takeda.
Mara Parellada ha recibido subvenciones para formación y viajes de la Fundación Alicia Koplowitz y de Otsuka.
Al Ministerio de Economía y Competitividad, Instituto de Salud Carlos III, CIBERSAM, Comunidad de Madrid y Fondos Estructurales de la Unión Europea, Fundación Alicia Koplowitz, Fundación Mutua Madrileña y ERA-NET NEURON (Network of European Funding for Neuroscience Research).