Evaluar el impacto de la sobreimpresión con fracción única de braquiterapia de alta tasa en estadios iniciales del cáncer de mama en términos de control local, supervivencia global y toxicidad.
Pacientes y métodosTras un tratamiento conservador, 137 pacientes, con una edad media de 57 años, recibieron sobreimpresión con braquiterapia de alta tasa en fracción única de 7Gy entre enero de 2002 y diciembre de 2012. Recibieron quimioterapia el 70% y hormonoterapia el 67%.
ResultadosCon un seguimiento medio de casi 8 años, la supervivencia global a los 5 y 10 años fue de 89,5 y 87,7%, respectivamente, con una supervivencia libre de recaída local a los 5 años del 99,3%. Los factores favorecedores de recaída local fueron el tamaño tumoral, la presencia de carcinoma in situ, un margen próximo y un grado iii. La toxicidad aguda fue poco frecuente y de rápida resolución. La fibrosis moderada fue el efecto secundario tardío predominante.
ConclusionesLa sobreimpresión con braquiterapia intersticial en fracción única de 7Gy en estadios iniciales del cáncer de mama es una técnica bien tolerada, con toxicidades tardías aceptables, que permite un excelente control local tumoral acortando el tiempo de tratamiento.
To evaluate the impact of single fraction boost high-dose rate brachytherapy for breast cancer in early stages in terms of local control, overall survival and toxicity.
Patients and methodsAfter conservative treatment 137 patients, mean age was 57 years, received high-dose rate brachytherapy boost in only fraction of 7Gy between January 2002 and December 2012. Chemotherapy was used in 70% of the patients and hormone treatment in 67%.
ResultsAt a mean follow-up 90 months, at 5 and 10 years the overall survival was 89.5 and 87.7%, respectively, and local recurrence free survival was 99.3% at 5 years. The risk factors for local recurrence were tumor size, carcinoma in situ, involved margins and grade iii. Acute toxicity was rare and rapid resolution. Moderate fibrosis was the most common late effect.
ConclusionsHigh-dose rate brachytherapy boost in only fraction of 7Gy to the tumour bed in early stage breast cancer is well tolerated with long term aceptable toxicities and improved local tumor control with a short duration of treatment.
Pese a la elevada incidencia del cáncer de mama en nuestra sociedad, la mortalidad en los últimos años ha descendido, acercando la enfermedad más al terreno de la cronicidad, entre otras razones gracias a un diagnóstico más temprano y a la efectividad de los tratamientos complementarios.
En el campo de la Oncología Radioterápica se han producido grandes avances al incorporar técnicas optimizadas y tecnología sofisticada con el fin de conseguir una mayor curación con la menor toxicidad posible.
Con base en estas mejoras técnicas y en el descubrimiento de nuevos conceptos y modelos radiobiológicos, los resultados en cuanto a control local y supervivencia libre de enfermedad obtenidos con cirugía conservadora seguida de radioterapia son comparables a los conseguidos con mastectomía en los estadios iniciales (i, ii) del cáncer de mama1,2.
Son muchos los estudios que han demostrado que el control local de la enfermedad es dependiente de la dosis, por lo que la sobreimpresión del lecho tumoral con electrones3,4 o braquiterapia5 tras administrar 50Gy de forma homogénea a toda la glándula mamaria disminuye el riesgo de recidiva cuando se aúnan factores considerados de riesgo para fracaso local6–8.
La braquiterapia intersticial de alta tasa9,10 es una técnica sencilla que consigue un excelente control local de la enfermedad reduciendo el tiempo total de tratamiento. Consiste en la colocación de fuentes radioactivas mediante agujas vectoras, directamente en el seno o lecho tumoral, para administrar una dosis alta de radiación a un volumen concreto con un alto gradiente de dosis en los tejidos circundantes.
En este estudio evaluaremos la eficacia de una única fracción de braquiterapia intersticial de alta tasa como sobreimpresión tras tratamiento conservador en estadios precoces del cáncer de mama, en términos de control local, supervivencia global y toxicidad a corto-largo plazo.
Pacientes y métodosSe realizó un estudio observacional retrospectivo en pacientes diagnosticadas de cáncer de mama estadio i/ii, que tras cirugía conservadora y radioterapia externa recibieron sobreimpresión del lecho quirúrgico con braquiterapia intersticial de alta tasa (Ir-192) entre enero de 2002 y diciembre de 2012.
Pasado un período mínimo de 4 semanas desde la cirugía, todas las pacientes recibieron radioterapia externa, mediante simulación virtual y planificación 3D, sobre toda la glándula mamaria mediante haces externos de fotones de energías de 6 y 15MV procedentes de un acelerador lineal. La dosis total administrada fue de 50-50,4Gy en fracciones de 1,8-2Gy, una sesión al día, 5 días a la semana, cumpliendo todos los criterios de restricción dosimétricos prescritos de acuerdo con los criterios QUANTEC11.
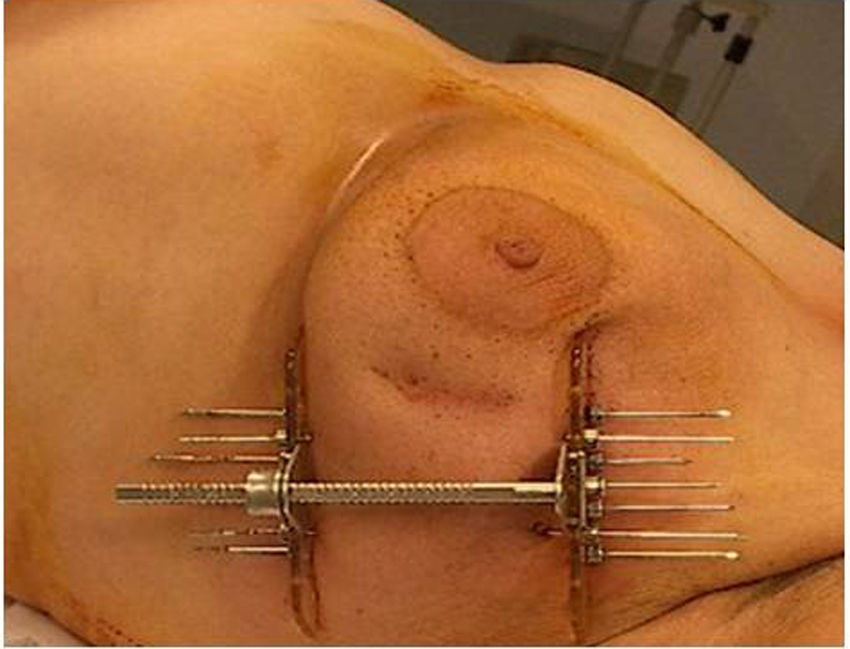
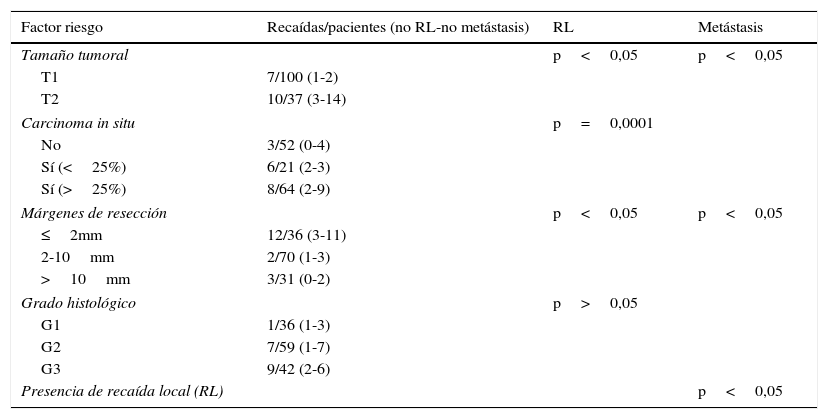
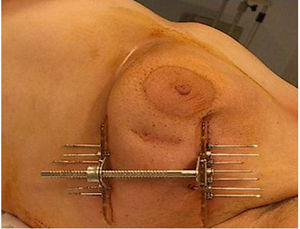
El procedimiento de braquiterapia se realizó entre la primera y la tercera semana tras finalizar el tratamiento con radioterapia externa (el tiempo medio son 15 días). Después de localizar por palpación y/o ecografía el lecho quirúrgico, se procedió a la inserción con anestesia local de las agujas vectoras rígidas (en la mayoría de los casos en número de 7), que serán dispuestas en paralelo, equidistantes y formando un triángulo (utilizando 1-3 planos), con fijación externa mediante template y puente metálico (figs. 1 y 2).
Se administró una única fracción de 7Gy a la isodosis del 85%, siguiendo el cálculo dosimétrico del Sistema de París.
La duración del procedimiento fue de unas 3-4h, siendo de escasos minutos el tiempo de irradiación. Tras la finalización del mismo, se retiran los implantes y la paciente permanece en observación un corto período de tiempo, tras el cual es dada de alta con vigilancia ambulatoria.
Los criterios de inclusión para la realización de la braquiterapia de mama fueron: tamaño tumoral menor de 5cm, histología infiltrante, suficiente volumen mamario (el implante de braquiterapia no debe ocupar más de un tercio del volumen mamario), separación entre el lecho quirúrgico y el reborde costal de más de 2cm y separación entre el lecho quirúrgico y la piel de más de 1cm.
En cuanto a los criterios de exclusión, fueron la histología no infiltrante, la multicentricidad, la escasez de tejido mamario y alteraciones graves de la coagulación y/o la agregación.
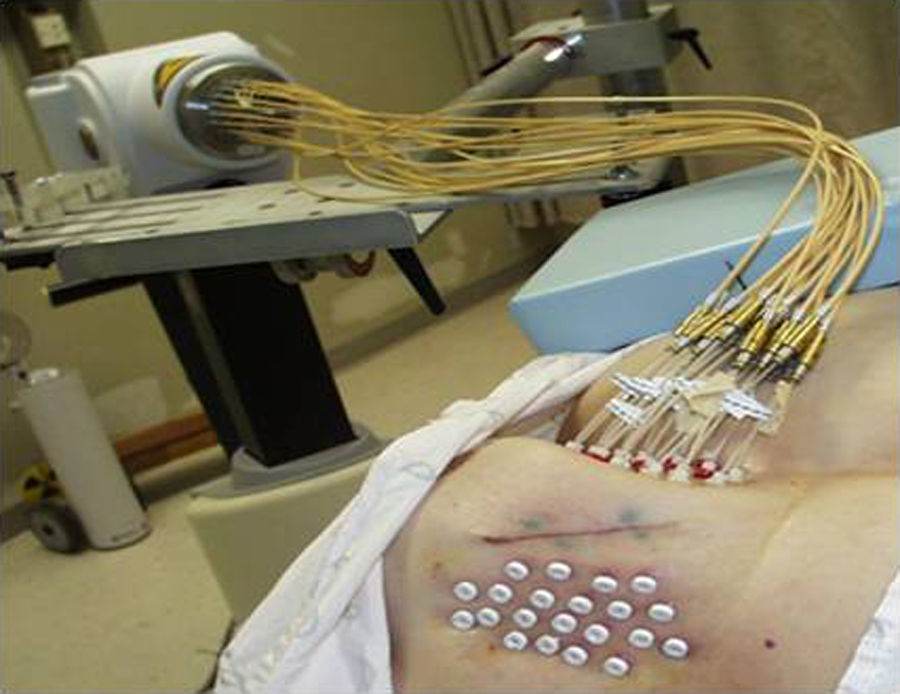
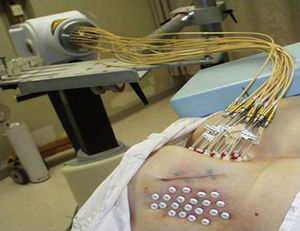
Dicha técnica fue realizada con un equipo de braquiterapia HDR con 18 canales, una actividad de 396GBq e Ir-192 como radionucleido (MicroSelectron; Nucletrón) (fig. 3).
Durante el tratamiento con radioterapia externa, las pacientes fueron examinadas al menos una vez a la semana por el facultativo responsable para evaluar los posibles efectos adversos agudos, y tras completar la braquiterapia, fueron evaluadas de forma periódica/conjunta por todos los servicios implicados. La toxicidad crónica fue clasificada de acuerdo por los criterios publicados por RTOG/EORTC12.
El período de seguimiento considerado en el estudio fue la diferencia en meses desde la realización del implante de braquiterapia hasta la valoración en la última consulta, y el intervalo libre de enfermedad, la diferencia en meses desde la realización del implante hasta la confirmación de la recaída (local y/o a distancia).
Para el análisis estadístico se utilizó el programa SPSS. La asociación entre 2 variables categóricas para poder evaluar posibles factores pronósticos de recaída local (RL) fue calculada utilizando el test Chi-cuadrado de Pearson. Una p<0,05 fue considerada estadísticamente significativa. El estudio de supervivencia (supervivencia global, supervivencia por causa específica) fue realizado utilizando el método de Kaplan-Meier.
ResultadosSe incluyeron un total de 138 pacientes. Las características de estas se describen en la tabla 1. El seguimiento medio del estudio fue de 90,2±30,1 meses (rango 1,2-133,9).
Características de las pacientes
| Características | n (%) |
|---|---|
| Pacientes, n | 137 |
| Seguimiento medio (rango) | 90,2 (1,2-133,9) |
| Edad (años) | |
| Media (rango) | 57,26 (27-83) |
| ≤40 | 10 (7,3) |
| 40-50 | 25 (18,2) |
| ≥50 | 102 (74,5) |
| Estadio patológico (TNM) | |
| Tamaño tumoral | |
| pT1 | 100 (73) |
| pT2 | 37 (27) |
| Estado ganglionar | |
| pN0 | 101 (73,7) |
| pN1 | 24 (17,6) |
| pN2 | 11 (8) |
| pN3 | 1 (0,7) |
| Histología tumoral | |
| Ductal infiltrante | 111 (81) |
| Lobulillar infiltrante | 11 (8) |
| Otros | 15 (11) |
| Localización de la lesión | |
| Cuadrante superior externo | 73 (53,3) |
| Cuadrante inferior externo | 13 (9,5) |
| Unión cuadrantes superiores | 20 (14,6) |
| Otras | 31 (22,6) |
| Componente intraductal | |
| No | 52 (38) |
| Sí (<25%) | 21 (15,3) |
| Sí (>25%) | 64 (46,7) |
| Grado | |
| I | 36 (26,3) |
| II | 59 (43) |
| III | 42 (30,7) |
| Invasión linfovascular | |
| Sí | 34 (24,8) |
| No | 103 (75,2) |
| Márgenes de resección | |
| Afectos (hasta 2mm) | 36 (26,3) |
| Próximos (>2mm-<1cm) | 70 (51,1) |
| Libres (≥1cm) | 31 (22,6) |
| Quimioterapia | |
| Sí | 96 (70,1) |
| No | 41 (29,9) |
| Hormonoterapia | |
| Sí | 92 (67,2) |
| No | 45 (32,8) |
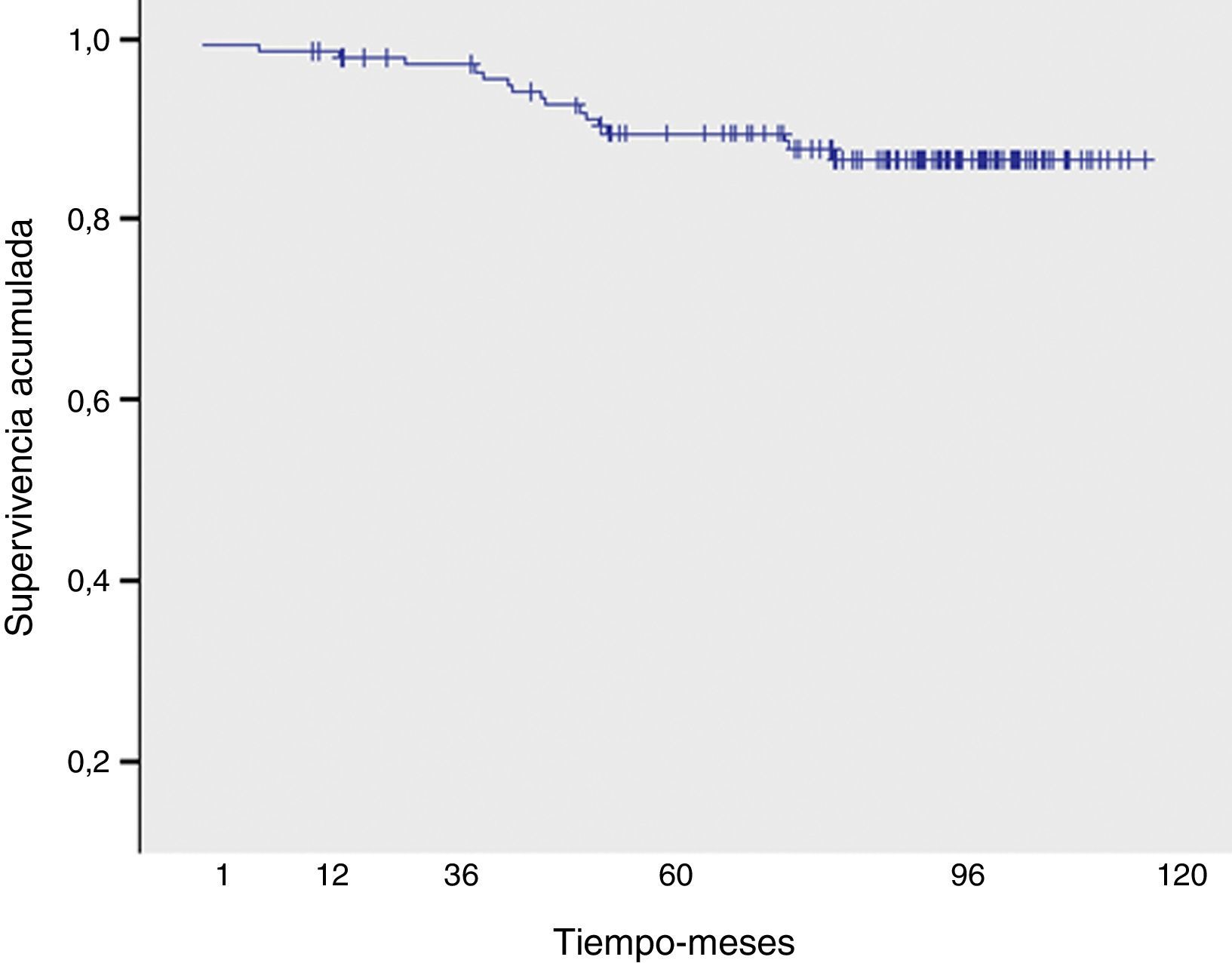
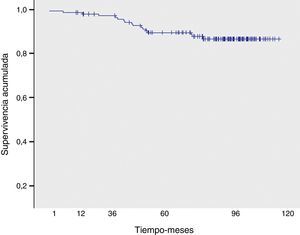
Durante el período de estudio fallecieron 16 pacientes, 8 por su enfermedad oncológica de base 8 (50%) y las restantes por causas externas diversas (neoplasia de páncreas, shock séptico, infarto agudo de miocardio, neoplasia de ovario, accidente de tráfico y otras no registradas). La supervivencia global a los 5 y 10 años fue del 89,5 y 87,7%, respectivamente.
En 17 (12,4%) se objetivó recaída de la enfermedad, una paciente a nivel local y 16 a distancia (en 3 de ellas se confirmó al mismo tiempo RL). Ninguna paciente presentó recaída ganglionar. La supervivencia libre de RL y la supervivencia libre de recaída a distancia fueron del 99,3 y 95,6% a los 5 años y del 99,3 y 94,1% a los 10 años, respectivamente.
Se realizó un análisis univariante de los factores de riesgo teóricos para RL y recaída a distancia (tabla 2).
Análisis univariante de los factores pronósticos
| Factor riesgo | Recaídas/pacientes (no RL-no metástasis) | RL | Metástasis |
|---|---|---|---|
| Tamaño tumoral | p<0,05 | p<0,05 | |
| T1 | 7/100 (1-2) | ||
| T2 | 10/37 (3-14) | ||
| Carcinoma in situ | p=0,0001 | ||
| No | 3/52 (0-4) | ||
| Sí (<25%) | 6/21 (2-3) | ||
| Sí (>25%) | 8/64 (2-9) | ||
| Márgenes de resección | p<0,05 | p<0,05 | |
| ≤2mm | 12/36 (3-11) | ||
| 2-10mm | 2/70 (1-3) | ||
| >10mm | 3/31 (0-2) | ||
| Grado histológico | p>0,05 | ||
| G1 | 1/36 (1-3) | ||
| G2 | 7/59 (1-7) | ||
| G3 | 9/42 (2-6) | ||
| Presencia de recaída local (RL) | p<0,05 | ||
Se objetivó un mayor fracaso local en tumores T2 (10; 27%) y ante la presencia de carcinoma in situ extenso (18; 28,1%). Solo 6 (0,06%) T1 recurrieron localmente.
Se observó una mayor RL en tumores de alto grado histológico, aunque no se pudo demostrar una relación estadísticamente significativa: 1 (3%) en grado i, 7 (11,9%) en grado ii, 8 (19%) en grado iii.
Los márgenes quirúrgicos estaban afectados en 36 (26,3%) pacientes (afectación focal, extensa o proximidad inferior a 2mm), próximos en 70 (51,1%; a más de 2mm pero a menos de 1cm) y libres en 31 (22,6%; a más de 1cm de distancia).
Se objetivó recaída de la enfermedad en 2 (5,5%) pacientes con margen afecto (en una de ellas con RL, en la otra con RL y a distancia) y en 2 (2,9%) pacientes con margen próximo (ambas con recaída a distancia).
De las pacientes que recibieron quimioterapia, 6 (6,3%) sufrieron recaída de la enfermedad. De las pacientes que no la recibieron, se constató recaída en una de ellas.
De las 4 pacientes que presentaron recaída de la enfermedad a nivel local, en 3 de ellas se constató también recaída a distancia (simultánea o de manera consecutiva).
No se encontró ninguna asociación significativa entre el control local y la edad, los receptores hormonales o la invasión linfovascular.
En cuanto a la toxicidad secundaria al tratamiento, consideramos toxicidad aguda la que aparece durante este y hasta los 6 primeros meses de la finalización, y toxicidad tardía la que puede aparecer a partir de los 6 meses desde que finaliza el tratamiento radioterápico.
En relación con la toxicidad aguda, 121 pacientes presentaron radiodermitis (grado iii en 9 pacientes) que no requirió la suspensión del tratamiento y 3 pacientes presentaron mastitis (resuelta con medicación antibiótica y analgésica por vía oral). No se recogió ningún evento de neumonitis aguda.
En relación con la toxicidad tardía, 45 pacientes presentaron fibrosis mamaria (grado iii en 8 pacientes) y 5, telangiectasias. No se objetivó ningún caso de neumonitis crónica, necrosis cutánea, evento cardiológico ni fractura costal. La supervivencia global a los 5 y 10 años fue del 89,5 y 87,7%, respectivamente (fig. 4).
DiscusiónEn las últimas décadas se ha aceptado el tratamiento conservador como «gold standard» en el manejo del cáncer de mama en estadio inicial, demostrando que la radioterapia adyuvante juega un papel indispensable en el control local de la enfermedad.
Alrededor del 70-80% de las RL tienen lugar en el lecho tumoral o en su proximidad, por lo que muchos estudios avalan que una sobreimpresión del mismo mediante electrones3,4 o braquiterapia5 disminuye más el riesgo de recaída ipsilateral.
Una serie de braquiterapia de alta tasa presentada por Hammer et al.13 en la que se administraba una dosis única de 10Gy mostró un fracaso local a los 5 años del 3,5%.
En nuestro estudio, la RL a 5 y 10 años es comparable a la de otras series10,14,15. Analizamos los factores pronósticos de RL más importantes descritos en la literatura, tales como la edad, la proximidad de los márgenes de resección quirúrgica, la presencia de carcinoma in situ, la invasión linfovascular y el grado histológico.
Hay estudios en los que la edad es un factor de mal pronóstico, como el de Ryoo et al.16, en el que el 16% de las pacientes menores de 40 años presentaron RL y solo un 5% de las mayores de 40 años. Otros autores, sin embargo, no han encontrado relaciones significativas, como ocurre en nuestro estudio.
Un mayor tamaño tumoral aumenta el riesgo de RL según varios estudios3,13,17 incluido el nuestro, aunque en otros 10,18 no sea significativo.
La proximidad de los márgenes quirúrgicos al lecho tumoral es también para algunos autores el factor pronóstico más importante para RL y/o a distancia, pero es importante conocer la definición de márgenes para cada uno. Para unos autores se considera libre si está a más de 1cm19, mientras que para otros debe estar a más de 5mm16 y para otros no deben existir células tumorales3. En nuestro estudio consideramos afectados los márgenes situados hasta 2mm (la afectación focal fue menor del 30%, la mayoría presentaban márgenes a 1-2mm), próximos de 2-5mm y libres cuando están a más de 1cm. Hay estudios que recomiendan administrar sobreimpresión y no una reintervención20, mientras que otros plantean que una segunda cirugía es la mejor opción17.
Voogd et al.7 encontraron un aumento de la RL en márgenes afectos. El Ensayo Budapest21 mostró un fallo local a los 5 años de un 8,2% para libres, un 30% para inferiores a 2mm y un 34,7% para márgenes afectos. Sin embargo, en otros estudios no se encontraban diferencias significativas10.
El impacto del grado histológico en la RL ha sido estudiado en numerosos estudios3,6, al igual que la invasión linfovascular22,23 con y sin significación estadística.
La presencia de carcinoma in situ en nuestra serie es un factor de riesgo de RL, al igual que lo considerado en otras5.
En relación con la dosis total de braquiterapia, hay muchos estudios que atribuyen un aumento del control local a una mayor dosis, así como peores resultados estéticos24. Las dosis varían de 7Gy con alta tasa en fracción única25 a 15Gy en varias fracciones26.
En nuestro centro, hasta el año 2012, tras irradiar toda la glándula mamaria con 50Gy, se decidió administrar braquiterapia de alta tasa sobre el lecho tumoral en fracción única de 7Gy (equivalente a 10Gy con electrones) para evitar en la medida de lo posible importantes complicaciones tardías. Con los buenos resultados obtenidos en cuanto a control local y toxicidades tardías, podemos considerarla una buena técnica y una buena alternativa a la sobreimpresión con electrones.
En conclusión, de todos los factores analizados en el estudio, alcanzan significación estadística para la aparición de RL el tamaño tumoral, el componente in situ extenso, el estado de los márgenes quirúrgicos y el grado histológico, y para recaída a distancia, el tamaño tumoral y la RL.
Las toxicidades aguda y tardía objetivadas son poco frecuentes y de fácil manejo clínico, lo que facilita el cumplimiento terapéutico y permite cumplir los tiempos previstos de realización del mismo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores quieren mostrar su gratitud a la Unidad de Apoyo a la Investigación del Hospital Meixoeiro (Vigo), en particular a Manuela Fontanillo y Ángel Salgado, así como agradecer especialmente el apoyo otorgado por la Sociedad Española de Senología y Patología Mamaria.