Revisión bibliográfica del diagnóstico y tratamiento actual del angiosarcoma radioinducido de mama.
PacientesPresentamos dos casos de angiosarcoma radioinducido de mama comentándose los aspectos clínicos, diagnósticos y terapéuticos de interés.
ConclusiónEl angiosarcoma de mama radioinducido es un tumor infrecuente que se presenta como complicación tardía en pacientes sometidas a tratamiento conservador del cáncer de mama mediante cirugía y radioterapia. La cirugía es el único tratamiento curativo, aunque su elevada tasa de recaída local requiere de tratamiento multimodal para optimizar los resultados de control local.
Literature review of the diagnosis and treatment of radiotherapy related angiosarcoma of the breast.
Case reportWe present two cases of radiotherapy-related angiosarcoma of the breast treated in our hospital and describe the clinical, diagnostic, and therapeutic features.
ConclusionRadiotherapy-related angiosarcoma of the breast is an uncommon tumour that usually presents as a late complication in patients who have undergone surgery and radiotherapy as conservative treatment for breast cancer. Surgery is the only curative treatment. However, because of its high rate of local recurrence, multimodal therapy is required to optimise prevention of recurrence.
Los angiosarcomas de mama son tumores malignos agresivos que derivan de células endoteliales. Diferenciamos dos tipos, el angiosarcoma primario que se desarrolla en mujeres jóvenes sin historia previa de cáncer, y el angiosarcoma radioinducido que se presenta en el campo de la radioterapia en mujeres de edad más avanzada, siendo este más agresivo, con una alta recurrencia y supervivencia tras el diagnóstico de unos dos años. Debido a su baja frecuencia, el diagnóstico inicial de esta entidad resulta complejo y existen pocos estudios prospectivos que definan un tratamiento óptimo. En este trabajo, realizamos una búsqueda bibliográfica acerca del manejo de esta infrecuente patología.
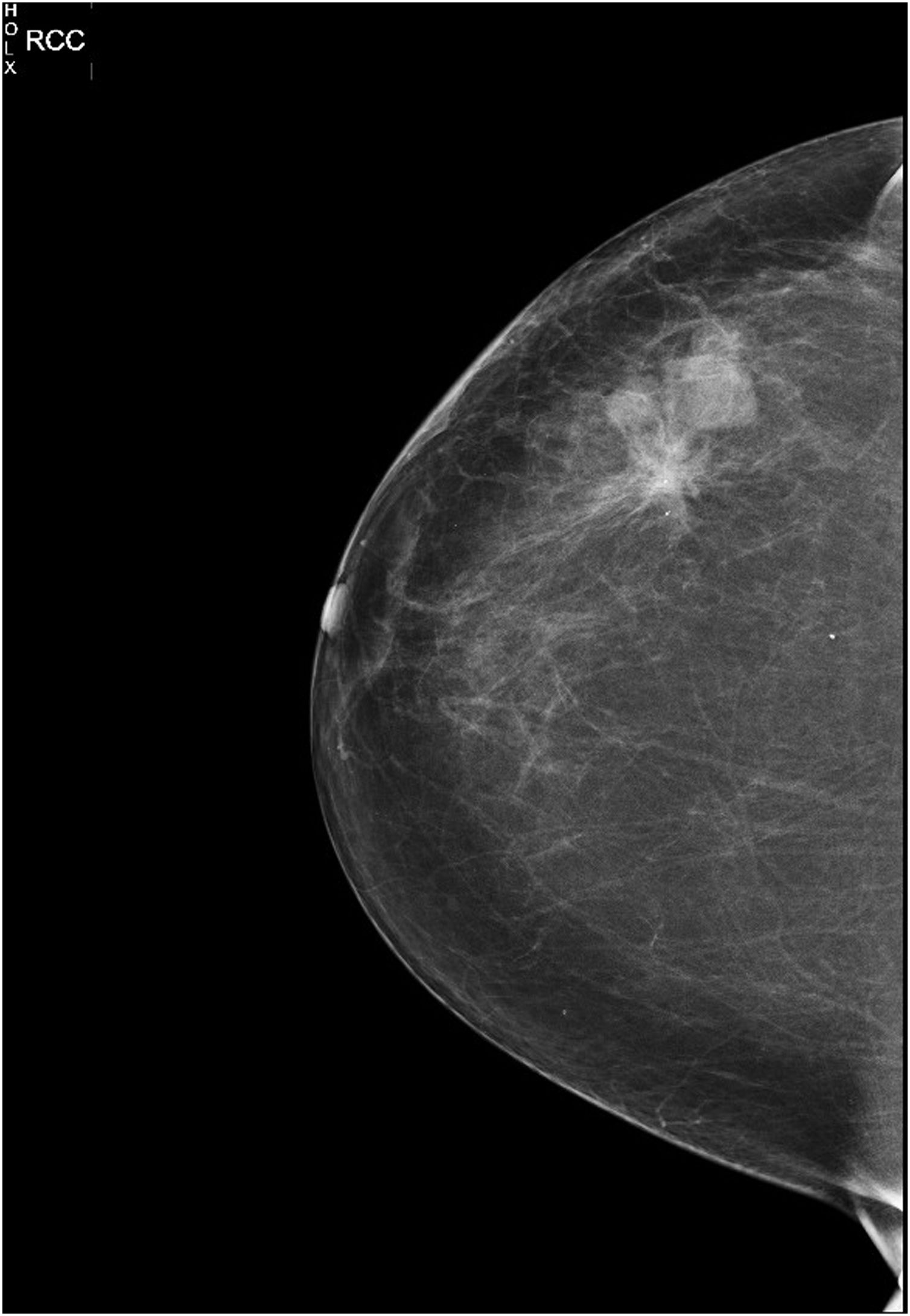
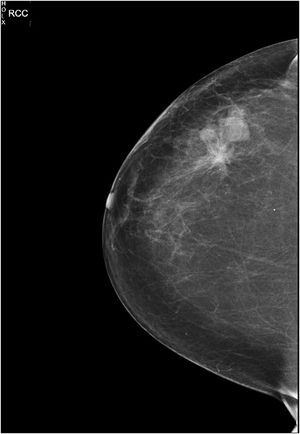
Material y métodosCaso 1Mujer de 64 años de edad que fue intervenida por carcinoma lobulillar infiltrante (triple negativo) de mama derecha a los 50 años de edad mediante tumorectomía y linfadenectomía axilar (pT1cN0M0), quimioterapia y radioterapia adyuvante (dosis total de 50 Gy), 13 años después, se realiza mamografía de control en paciente asintomática con trastorno arquitectural de 4 cm en relación con la cicatriz de tumorectomía (fig. 1). Se realiza BAG que informó de proliferación vascular atípica, en probable contexto de angiosarcoma. Se interviene realizando mastectomía simple con resultado de anatomía patológica de infiltración por elementos vasculares de crecimiento aberrante (3,8 x 2,5 cm) con elevada atipia, necrosis en > 40-50% de extensión, expresión de CD31 y CD34 y Ki70-80% compatible con angiosarcoma. Al cumplir criterios de alto riesgo por histología y tamaño mayor de 3 cm, tratamiento con paclitaxel durante cuatro meses. Actualmente sin evidencia de enfermedad (ILP siete meses)
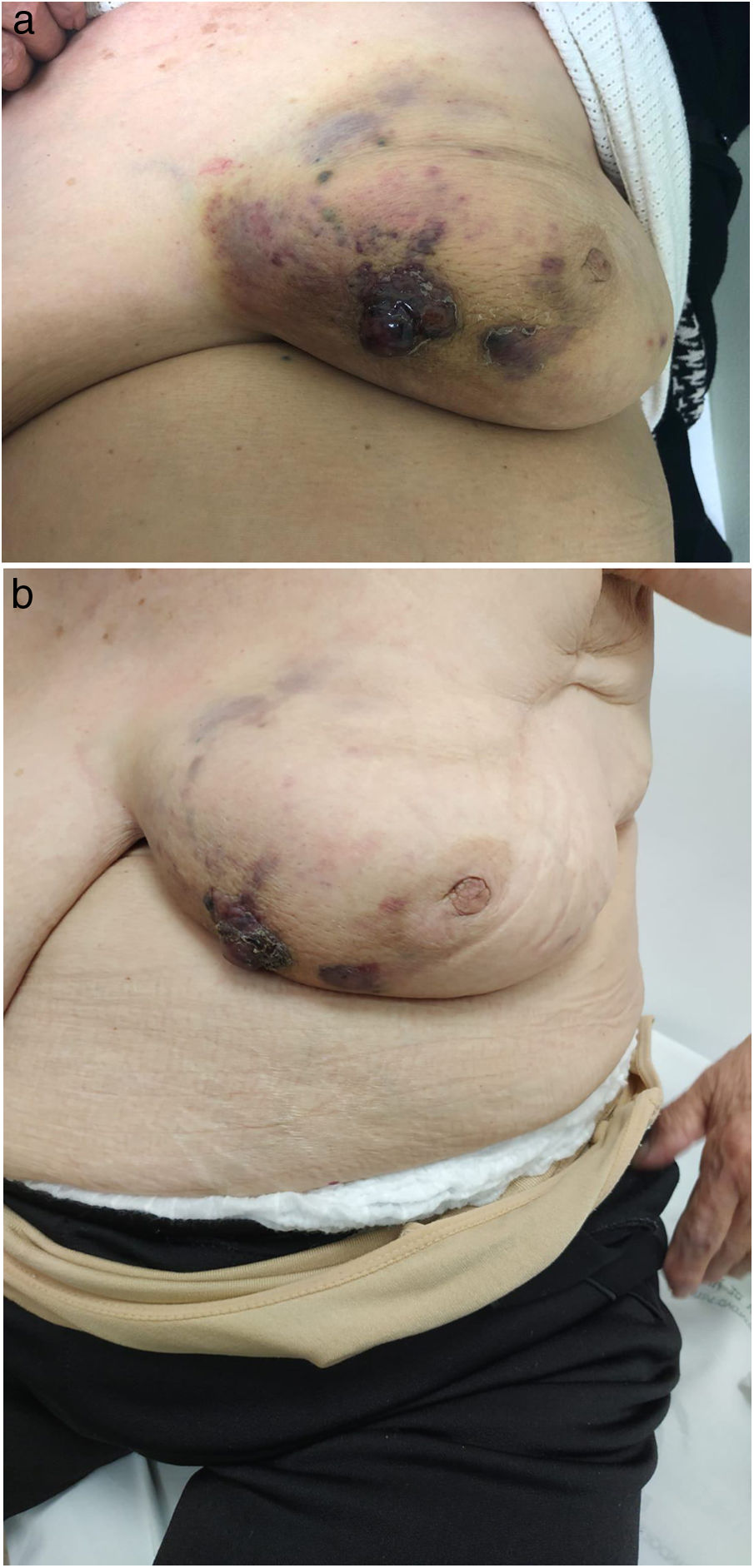
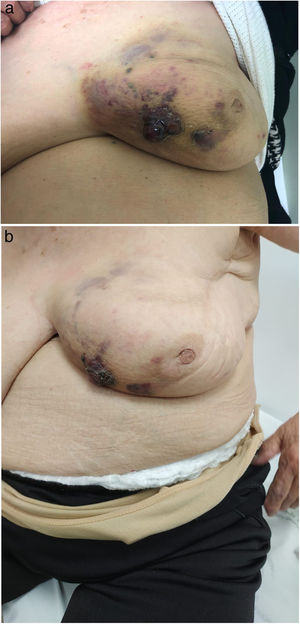
Caso 2Paciente de 79 años de edad con carcinoma ductal infiltrante (Luminal A) de mama izquierda que a los 70 años presentó tumorectomía con linfadenectomía axilar (pT2N0). Inicia tratamiento con anastrozol durante cinco años y radioterapia (dosis total 40 Gy); cinco años después presenta lesión dérmica violácea e indurada a nivel cuadrante inferointerno con biopsia que descarta infiltración neoplásica. Tras dos meses sin respuesta al tratamiento habitual, con crecimiento de la lesión hasta (3 x 2 cm) sobreelevada y ulcerada de color violáceo oscuro, se toma una nueva biopsia que confirma la sospecha diagnóstica de angiosarcoma (fig. 2), sin hallazgos patológicos en la mamografía de control. Se realiza mastectomía con reconstrucción mediante colgajo de dorsal ancho. La AP informa de angiosarcoma (10 x 15 cm) con índice mitótico alto, atipia nuclear moderada, Ki67 de 70% y positividad para marcadores CD31 y CD34.
A los tres meses de la cirugía presenta letálides con biopsia positiva para angiosarcoma. Inicia tratamiento con paclitaxel semanal durante cuatro meses con respuesta completa, por lo que se interrumpe el tratamiento. Tras dos meses presenta nueva progresión reintroduciendo paclitaxel con una nueva respuesta completa. Durante dos años se sigue esta estrategia de pauta intermitente de paclitaxel controlando la enfermedad. A los dos años se decide cambiar a tratamiento de segunda línea con doxorrubicina con ILP de tres meses. En tercera línea se cambia a gemcitabina con respuesta, pero toxicidad hematológica grado 3, de modo que, a la progresión, se decide manejo por la unidad de Cuidados Paliativos.
DiscusiónLos sarcomas mamarios son lesiones infrecuentes, representando menos del 1% de los tumores malignos de mama. Se ha descrito el angiosarcoma como el subtipo más frecuente (2% a 10% de los sarcomas), con cierta prevalencia en la mama con respecto a otras localizaciones donde esta relación no se cumple. Se pueden clasificar en tres grupos con base en su relación o no con la radioterapia. Así diferenciamos los angiosarcomas primarios, secundarios al tratamiento con radioterapia o asociados al Síndrome de Stewart-Treves con linfedema de larga evolución, este último actualmente es menos frecuente gracias a la implementación de la cirugía conservadora. A diferencia de las pacientes afectas del síndrome de Stewart-Treves que desarrollan el angiosarcoma en el brazo ipsilateral a la mama afectada, las pacientes tratadas con radioterapia desarrollan las lesiones angiomatosas en la mama o en la pared torácica. Respecto a los angiosarcomas primarios se presentan en pacientes más jóvenes (20 a 40 años) y son más agresivos en comparación con la edad de presentación (60 a 70 años) y el pronóstico de los angiosarcomas radioinducidos.
Los angiosarcomas radioinducidos de mama se presentan en pacientes con cáncer de mama tratadas mediante cirugía y radioterapia, con una latencia media de unos siete años1. Su incidencia ha aumentado en los últimos años debido al uso creciente de la radioterapia, situándose entre el 0,05% a 0,3% según las series. Para su diagnóstico precisa cumplir los conocidos como Criterios de Cahan, que son el tratamiento previo con radioterapia, que esté localizado dentro del campo de radiación y su diagnóstico anatomopatológico sea diferente al tumor primario. Recientemente se está empleando la determinación del MYC-mutado, ya que en un estudio genético el 55% de los angiosarcomas radioinducidos se evidenció una alta amplificación del gen MYC, pero no en los angiosarcomas primarios2. La presentación clínica es muy variable, lo que hace difícil su diagnóstico, presentándose en forma de pápulas violáceas, máculas, equimosis, engrosamiento cutáneo y ulceración indolorosa3. Las lesiones de bajo grado suelen presentarse como pápulas o máculas, mientras que las de alto grado suelen sobreelevarse, crecen rápidamente, sangran y se ulceran con más facilidad. En un primer momento pueden considerarse benignas, e incluso obtener falsos negativos en la biopsia. La sospecha clínica es fundamental. El diagnóstico diferencial incluye otras lesiones vasculares principalmente como hemangiomas o angiomatosis, pero debe incluir también el carcinoma inflamatorio, vasculitis o incluso lesiones de origen infeccioso. Los hallazgos de un engrosamiento cutáneo y cambios en la coloración de la piel del área radiada en el seguimiento de una paciente tratada con cirugía conservadora, deben hacernos sospechar la existencia de un angiosarcoma radioinducido, con la indicación de biopsia inmediata. El diagnóstico definitivo se realiza mediante estudio histológico completado con la determinación de positividad en los marcadores de diferenciación endotelial (factor VIII, CD31 y CD 34).
La cirugía es el único tratamiento curativo, siendo la terapia de elección la mastectomía simple con márgenes amplios, considerando los márgenes negativos el factor pronóstico más importante4 cuando sean factibles. En esta entidad los márgenes quirúrgicos considerados adecuados es de mínimo 3 cm, preferiblemente obtener de 4,5 cm siempre y cuando la relación entre el tamaño tumoral y tamaño mamario lo permita. Debido a la alta tasa de recurrencia en el primer año, se pospone la reconstrucción mamaria hasta comprobar que no exista recidiva precoz5. En caso de recurrencia no se excluyen nuevos intentos de rescate quirúrgico, incluso con carácter curativo. La linfadenectomía axilar no está indicada, ya que no disemina por vía linfática. Sí se realizaría en casos de confirmación de afectación por ecografía o PAAF6.
Como tratamiento complementario la quimioterapia no está indicada de rutina, recomendándose en pacientes con alto riesgo (tumor > 5 cm, alto grado y/o afectación ganglionar), sarcoma recurrente y con menor evidencia en paciente con tamaño tumoral entre 3 y 5 cm (grado 2 C). No existe un esquema terapéutico específico, empleando los fármacos más activos en los esquemas generales en el manejo de los sarcomas, como las antraciclinas o la ifosfamida.
El estudio ANGIOTAX explora el papel de paclitaxel semanal en el tratamiento del angiosarcoma avanzado. Incluye casos de angiosarcomas mamarios primarios y radioinducidos. La supervivencia libre de progresión (SLP) fue de cuatro meses y la supervivencia global (SG) de ocho meses7. Aunque sólo son datos retrospectivos, la actividad de doxorrubicina y paclitaxel semanal en primera línea de enfermedad avanzada es superponible, por lo que la elección del régimen va a depender del perfil de toxicidad y la localización del primario8.
La aprobación de pazopanib en sarcomas vasculares avanzados se basó en los resultados del estudio PALETTE9, estudio retrospectivo, donde la tasa de respuesta fue del 20% con una SG de 9,9 meses sin diferencias entre primarios cutáneos y viscerales o entre radioinducidos y primarios.
La combinación de ambos fármacos se evaluó en el estudio GISG-06 EVA10, estudio fase II del grupo alemán, con un solo brazo que valora la combinación de pazopanib a dosis estándar y paclitaxel semanal, cuyo objetivo principal fue tasa de SLP a seis meses. En un análisis intermedio, se decidió cerrar el estudio por falta de actividad, no evidenciando ninguna respuesta en pacientes con afectación hepática ni en aquellos que habían recibido irradiación corporal, aunque con resultados prometedores en casos superficiales.
En la misma línea se ha investigado el papel de bevacizumab11, estudio fase II randomiza a recibir paclitaxel semanal con o sin bevacizumab. El objetivo primario era SLP a los seis meses, considerando que al menos debía alcanzar el 40% para considerarse un régimen activo. En ambos brazos se cumplió el objetivo, aunque la mayor toxicidad del brazo de combinación hace que los autores concluyan en que no debe administrarse bevacizumab en combinación con paclitaxel semanal.
El pronóstico de este tipo de tumores es desfavorable, con una elevada tendencia a la recurrencia, que en la mayoría de los casos es a nivel local y menos frecuente en forma de metástasis a distancia, siendo la localización más frecuente el pulmón seguido de la mama contralateral12.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y han obtenido los permisos correspondientes.
FinanciaciónLos autores declaran no haber recibido fuentes de financiación para la realización del trabajo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.