INTRODUCCION
En la actualidad se acepta que el cáncer de mama es una enfermedad sistémica que puede recurrir incluso décadas después de la cirugía1. La disección axilar es un procedimiento obligatorio para estadificar la enfermedad y decidir la conveniencia de tratar con quimioterapia adyuvante. El treinta por ciento de las mujeres en el momento del diagnóstico no tienen adenopatías axilares metastásicas (N0) y, de ellas, el setenta por ciento se curan con la cirugía1,2. Sin embargo, muchas pacientes de ellas desarrollan enfermedad sistémica sin que actualmente podamos predecir esta progresión. Es muy probable que el porcentaje de mujeres nuevamente diagnosticadas con N0 se incremente hasta un 50 % como resultado de las campañas de cribado y la mayor concienciación de la población3. El beneficio de la quimioterapia adyuvante en la supervivencia de pacientes con cáncer de mama es incuestionable4,5, pero su coste y toxicidad hacen imprescindible disponer de información pronóstica fiable en el grupo de pacientes N0 para seleccionar al subgrupo de mayor riesgo. Una información proveniente del estudio de marcadores moleculares con significado pronóstico podría contribuir a identificar a estas pacientes.
El objetivo de este estudio es analizar la utilidad de los marcadores tumorales de nueva aparición en comparación a los ya aceptados, sobre la base de la información disponible en la literatura. Según la solidez de la evidencia disponible se recomendará su empleo clínico en según los siguientes parámetros: utilidad diagnóstica y en la monitorización del tratamiento, capacidad pronóstica, predicción de recurrencias tras la cirugía y radioterapia, y evaluación de la respuesta en tumores metastásicos.
La utilidad de muchos de ellos deberá ser aún validada mediante estudios prospectivos a gran escala antes de su definitiva incorporación a la toma de decisiones en la práctica onco-ginecológica. De lo contrario, su uso podría ocasionar disparidad de resultados, errores graves en la toma de decisiones, confusión, consumo innecesario de recursos y en definitiva perjuicio para las pacientes.
MÉTODOS
Se ha realizado una revisión bibliográfica de la información relevante disponible en la literatura sobre nuevos marcadores biológicos en el periodo comprendido entre enero de 1988 y enero de 2002.
Descripción y clasificación de los marcadores tumorales
Los marcadores tumorales son proteínas asociadas a tumores malignos que se pueden determinar en el tejido tumoral, en la sangre, ganglios linfáticos, médula ósea, heces o fluidos como la orina o el líquido ascítico. Desde el punto de vista de su especificidad se pueden clasificar en tres categorías:
A. Proteínas específicas del tumor: como las denominadas proteínas de fusión en la leucemia mieloide crónica o en algunos tumores mesodérmicos, donde se produce una translocación de un oncogén y se fusiona con un promotor activo de otro gen. El resultado es la producción masiva de una proteína que activa el ciclo celular y origina un clon celular maligno.
B. Proteínas no específicas o marcadores relacionados con las células malignas: son marcadores menos restrictivos pero muy útiles, como es el caso de los antígenos o proteínas oncofetales, presentes en determinados tumores pero también en el tejido embrionario. Son ejemplos el antígeno carcinoembrionario (CEA) o la alfafetoproteína.
C. Proteínas específicas de las células normales pero sobre-expresadas por células tumorales: se producen en determinados tejidos sanos pero en mayor cantidad por los tejidos transformados en tumores malignos como sucede en el cáncer de próstata (PSA).
Los nuevos marcadores que hemos evaluado solos, en combinación entre sí o con los marcadores clásicos son: 1) familia de las glucoproteínas: CA 15.3, CA 27.29; 2) determinación de la cantidad de DNA y/o fracción "S" del ciclo celular; 3) urokinasa activadora del plasminógeno (uPA) e inhibidor 1 de la actividad del plasminógeno (PAI-1); 4) activación de oncogenes o inactivación de genes supresores: 4a) HER-2/neu o c-erbB2 y 4b) proteína p53 mutada; 5) catepsina-D; 6) Ki 67, y 7) miscelánea.
Esta búsqueda se ha realizado mediante la base de datos MEDLINE, utilizando una o varias palabras claves para su búsqueda, solas o combinadas. Posteriormente se han seleccionado los artículos que por su metodología aportan información útil sobre la aplicación clínica potencial en el futuro. El criterio de selección metodológica y de utilidad de los trabajos se ha basado en:
1. Estudios de asociación entre la presencia del nuevo marcador y la supervivencia y/o periodo libre de recurrencia.
2. Cumplimiento de los criterios de utilidad de la conferencia de consenso del Instituto Nacional de la Salud de Estados Unidos en 1990 (NIH) y que delimita las características que debe reunir un nuevo marcador antes de ser plenamente aceptado como clínicamente útil6:
a) Valor predictivo independiente e importante validado por estudios clínicos.
b) Determinación factible, accesible, reproducible y disponible con controles de calidad adecuados.
c) Debe ser fácilmente interpretado por el clínico e implicar decisiones terapéuticas útiles.
Los factores pronósticos plenamente aceptados son: el tamaño tumoral, el número de adenopatías axilares metastásicas, el tipo de tumor (p. ej., carcinoma ductal infiltrante u otros tipos histológicos como el tubular, coloide y papilar), el grado histológico (p. ej., nuclear, histológico o ambos) e infiltración de vasos linfáticos7,8. El estado del receptor tumoral (positividad o negatividad del receptor estrogénico y de progesterona) es un factor pronóstico débil pero facilita la decisión de instaurar tratamiento con hormonoterapia. Existen dos tipos diferentes de receptores estrogénicos: el ERa, es el clásico, su positividad predice generalmente la respuesta a la terapia endocrina y la isoforma ERb, más recientemente descrita, tiene un papel desconocido pero puede estar asociado a pronóstico favorable9.
Valoración de la utilidad clínica de los nuevos marcadores en el cáncer de mama
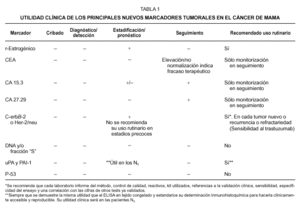
CEA, CA 15.3 y CA 27.29
Dentro de la familia de las glucoproteínas, el CEA fue el primero en desarrollarse. No es órgano-específico y su utilidad se limita a la monitorización de las recurrencias o la eficacia del tratamiento en enfermedad diseminada10,11. Otras glucoproteínas de la familia de la mucina epitelial polimórfica (MUC-1) son el CA 15.3 y CA 27.29. Sus niveles se correlacionan con el estadio tumoral aunque, según los datos agrupados de la literatura, los niveles de CA 15.3 están elevados en un rango de 5-30 % en el estadio I, 15-50 % en el estadio II, 60-70 % y 65-90 % en los estadios III y IV respectivamente11. Por lo tanto su sensibilidad es escasa en los estadios precoces.
Se han propuesto el CA 15.3 y el CA 27.29, solos o en combinación con el CEA, como marcadores pronósticos12,13. Los datos no son suficientes para recomendar su uso en este sentido y en la actualidad el empleo de CA 15.3 y CEA se limita a la monitorización del tratamiento y detección de recurrencia14. Existe un estudio multicéntrico bien diseñado que muestra que la elevación del CA 27.29 es útil para detectar recurrencia15 y su sensibilidad parece superior a la del CA 15.3; su especificidad y sensibilidad fue del 98 % y 58 % respectivamente en estadio II, por este motivo, la FDA ha aprobado el test del CA 27.29 como ayuda para monitorizar la recurrencia, aunque su uso no modifica las opciones terapéuticas ni ha mostrado impacto sobre el pronóstico o calidad de vida. Esta ausencia de beneficio clínico originó que en las conclusiones del panel de expertos de la Sociedad Americana de Oncología Clínica (ASCO), no se recomiende su uso rutinario16.
La Federación de Centros Franceses del Cáncer (FNCLCC), acepta el CA 15.3 y CEA como los marcadores más empleados en el cáncer de mama y recomienda que si el CA 15.3 está elevado en el momento de la detección del tumor no es necesario el uso de otros marcadores, siendo imprescindible que la determinación analítica se realice siempre en el mismo laboratorio y con la misma técnica. Cuando el valor inicial es mayor de 50 kU/L, se debe buscar enfermedad diseminada antes decidir cualquier tratamiento. Por otra parte, una elevación inicial del CA 15.3 que no revierte a la normalidad tras la cirugía o quimioterapia refleja una falta de respuesta al tratamiento y es un factor pronóstico adverso. Su exactitud como indicador precoz de enfermedad metastásica es un hecho reconocido pero sin beneficio clínico demostrado (tabla 1). Estos mismos expertos no recomiendan el empleo del CA 15.3 como cribado o diagnóstico17.
Determinación de la cantidad de DNA y/o fracción "S" del ciclo celular
La citometría de flujo determina la cantidad de DNA y/o la fracción "S" del ciclo celular en el tejido tumoral (proliferación) o el grado de ploidia para asignar subgrupos de pacientes a categorías pronósticas diferentes. En la actualidad no existen datos suficientes en la literatura para recomendar su uso en la clínica: no ha mostrado por sí sola utilidad pronóstica13,16,18 y tampoco asociada a otros marcadores como la determinación de receptores estrogénicos o de progesterona19.
Urokinasa activadora del plasminogeno (uPA) e inhibidor 1 del activador del plasminogeno (PAI-1)
Son proteasas involucradas en los procesos de invasión del cáncer y metástasis, participan en la degradación de la matriz extracelular que mantiene cohesionadas las células normales en los tejidos20,21. Se ha evaluado su determinación en el pronóstico del cáncer de mama22-26, en diferentes subgrupos de la enfermedad. Su concentración elevada predijo una menor supervivencia y un periodo libre de enfermedad más corto en todos los subgrupos23. La combinación de estos dos marcadores ofrece resultados muy prometedores20,21-29.
Muy recientemente se han presentado resultados del empleo combinado de uPA y PAI-1, en una revisión sistemática de los datos aportados por la Organización Europea para la Investigación y Tratamiento del Cáncer-Grupo Europeo de Biomarcadores y Receptores del Cáncer (EORT-RBG), que incluyeron 8.377 pacientes, tratadas entre 1978 y 1995 en 18 hospitales europeos25; en el análisis multivariante se incluyeron factores de riesgo establecidos como la edad, tamaño tumoral, número de adenopatías, estado de receptores esteroideos y el uso de quimioterapia adyuvante. Con una mediana de seguimiento de 79 meses, los niveles de uPA y PAI-1 fueron los segundos factores predictivos más potentes en el intervalo libre de recurrencia y supervivencia global después del número de adenopatías axilares y en las pacientes N0 fue el predictor mas potente de recidiva25. En este último sub-grupo, formado por 3.362 pacientes, su elevación predijo recurrencia. Estos mismos resultados se han confirmado en un estudio prospectivo alemán en 556 pacientes N021, que encontraron recurrencias a los 3 años en el 6,7 % de las que presentaban niveles intratumorales bajos de uPA y PAI-1 y en el 14,6 % de las que presentaban niveles altos, resultados que se han confirmado en seguimiento a largo plazo26,27. La conclusión es que se puede evitar la quimioterapia en casi la mitad de las mujeres con N0 y niveles bajos de uPA y PAI-1. Un problema logístico importante es la disponibilidad rutinaria del ELISA para determinar estos marcadores en tejido tumoral fresco o congelado, lo que se podría obviar si se pudiera realizar su determinación en tejido fijado en parafina22.
Activación de oncogenes e inactivación de genes supresores
HER2/neu o c-erbB2: la activación de oncogenes celulares o c-oncogenes y/o la pérdida de función de genes supresores puede jugar un papel importante en la formación de cánceres humanos. El oncogén c-erbB2 codifica una glucoproteína trans-membrana de 185 KD con actividad intracelular tirosina kinasa. Pertenece a la familia de los factores de crecimiento epidérmicos que son fundamentales en la activación de señales intracelulares y controlan el crecimiento y la diferenciación celular epitelial30-32. Aproximadamente el 20-40 % de los cánceres de mama sobre-expresan o amplifican el HER 2/neu y se ha propuesto como un marcador biológico de nueva generación en el cáncer de mama (tabla 1).
La amplificación del ADN del c-erbB2 se ha correlacionado con peor pronóstico y predice mejor que la expresión de la proteína correspondiente33-38. Según otros autores, la expresión de la oncoproteína erb-B2 ayuda a predecir de forma independiente el pronóstico38-44. Las pacientes que sobreexpresan el erbB2 son, además, candidatas a tratamiento con trastuzumab (Herceptina). La sobreexpresión de C-erbB-2/Her-2/neu se debe determinar en cada tumor nuevamente diagnosticado, sobre cada recurrencia o sobre tumores resistentes al tratamiento. Su positividad distingue un subgrupo en el que el beneficio de las antraciclinas es mayor, aunque su negatividad no excluye la posibilidad de recibir tal tratamiento. Se desconoce si las pacientes positivas responden peor a los regímenes sin antraciclinas (CMF). También su determinación permite seleccionar los casos que se puedan beneficiar del trastuzumab, en pacientes con tumores no resecables, metastásicos, recurrentes y refractarios16.
Proteina p-53 mutada: la proteína p-53 es codificada por el proto-oncogén p-53. Es una proteina nuclear fosforilada que se expresa normalmente a niveles muy bajos y juega un papel importante en el control del ciclo celular. La acumulación de la proteína p-53 mutada (expresión de la mutación y pérdida de función del gen supresor p-53) se correlacionó con peor pronóstico45. Esta mutación representa un acontecimiento precoz en la progresión del cáncer. En pacientes N0 su expresión predijo un mayor riesgo de recidiva44,45. Los datos son insuficientes para recomendar su uso rutinario16 (tabla 1). Se ha comunicado preliminarmente, un método para la determinación de la proteína p-53 en sangre periférica46 aunque se desconoce su utilidad práctica.
Catepsina D
La catepsina D es una proteasa lisosómica, cuya síntesis es estimulada por estrógenos en líneas celulares RE positivas, si bien está constitutivamente presente en las RE negativos, y facilita la aparición de metástasis tumorales, probablemente mediante la degradación de la matriz extracelular y la liberación de factores de crecimiento epidérmicos47. Su concentración tisular en el cáncer de mama está aumentado y predice una peor evolución48-50, y se correlacionó con el receptor del factor epidérmico de crecimiento en pacientes con cáncer de mama50. Sin embargo, su valor pronóstico en pacientes N0 es cuestionable51 y en la actualidad se necesitan más datos antes de recomendar su uso16.
Ki 67
Es un antígeno nuclear celular que se expresa más cuanto mayor es la proliferación celular. El empleo de inmunohistoquímica en preparaciones fijadas en formol e incluidas en parafina ha demostrado utilidad para evaluar la cinética celular del tejido tumoral52,53. En un estudio con 371 pacientes N0, las que presentaban un índice de marcaje # 10 % tenían un pronóstico similar al de la población de mujeres sanas de su misma edad, mientras que un índice elevado se asoció a una mortalidad 20 veces mayor54. Recientemente, se ha publicado una revisión de estudios grandes (mas de 200 pacientes) y con seguimiento prolongado en la que se ha encontrado que el Ki-67 es uno de los factores que mejor predicen el curso evolutivo53,54.
Miscelánea
Los marcadores genéticos como las mutaciones en el cromosoma 1p o algunos marcadores histológicos como la diferenciación apocrina o antígenos codificados por el oncogén Ha-ras 9p-21, también se han relacionado con un peor pronóstico55-58. La proteína relacionada con la haptoglobina predijo según algún trabajo, en combinación con la positividad de receptores de la progesterona, peor pronóstico en estadios precoces59. La expresión de las proteínas de los oncogenes Ha-ras, c-myc, c-fos y p-53 confieren al tumor un fenotipo agresivo60 pero es preciso confirmar estas observaciones.
Aunque en un trabajo la combinación rEGF + recuento intratumoral de vasos fue capaz de discriminar el pronóstico en diferentes subgrupos61, el valor pronóstico de diferentes índices de angiogénesis no se ha establecido62.
Diferencias entre factores predictivos y factores pronósticos
Los factores pronósticos estiman el curso evolutivo independientemente de una determinada terapia específica (p. ej., la presencia de adenopatías axilares). Reflejan la capacidad tumoral para proliferar, invadir o diseminarse. En el caso del c-erbB-2, para evaluar su valor pronóstico puro, es decir no interferido por la terapia sistémica como variable de confusión, requeriría diseñar un estudio que incluyera muestras de pacientes que no reciban tratamiento. Esto representa problemas clínicos y éticos que hace improbable su realización.
Por el contrario, los factores predictivos implican una sensibilidad o resistencia relativa a terapias específicas. Muchos marcadores aportan información pronóstica y predictiva, como el estado del RE es tanto un factor pronóstico favorable débil como un factor predictivo fuerte en lo que se refiere a respuesta a la terapia endocrina. El C-erbB-2 es a la vez un factor pronóstico y predictivo en cáncer de mama porque su amplificación y/o sobre-expresión se asocia a peor pronóstico63 y a una sensibilidad relativa o resistencia a diversas terapias como la terapia endocrina, radioterapia, trastuzumab, y antraciclinas.
DISCUSION
Hasta la fecha, los principales indicadores pronósticos que cumplen los requerimientos de la conferencia de consenso del NIH, siguen siendo los ya establecidos, es decir, el tamaño tumoral, número de adenopatías, el grado y tipo histológico, la invasión linfática y probablemente, aunque débil, el estado hormonal.
Actualmente, marcadores utilizados en sangre periférica como el CEA y el CA 15.3 y el CA 27.29, que posiblemente se emplee en breve con mayor frecuencia, tienen su utilidad limitada a la monitorización de las recurrencias o la eficacia del tratamiento en enfermedad diseminada. Los datos aportados hasta el momento no son suficientes para recomendar su uso como marcadores pronósticos y no se recomienda su uso como método diagnóstico o de cribado en pacientes asintomáticas.
Se espera que en un futuro próximo podamos disponer de nuevos marcadores pronósticos, validados sobre la base de estudios amplios y con seguimiento prolongado para seleccionar las pacientes N0 candidatas a tratamiento con quimioterapia adyuvante. En este sentido, debe confirmarse la utilidad de la determinación de uPA y PAI-1 en muestras de tejido tumoral incluidas en parafina mediante inmunohistoquímica y que hasta el momento sólo ha sido mostrada con método ELISA en muestras congeladas. En la actualidad, no puede recomendarse su uso habitual fuera de estudios. De confirmarse la utilidad pronóstica de la proteína p-53 y la utilidad del test que determina su concentración en sangre periférica46, es previsible que sea uno de los primeros y nuevos marcadores que se incorporen a la rutina clínica en onco-ginecología en combinación con los ya establecidos.
La sobreexpresión de C-erbB-2/Her-2/neu se debe determinar en cada tumor nuevamente diagnosticado ó resistente al tratamiento ó en cada recurrencia. Su positividad permite seleccionar un subgrupo con mayor beneficio del tratamiento con antraciclinas y seleccionar pacientes con tumores no resecables, metastásicos, recurrentes y refractarios que puedan beneficiarse del trastuzumab.