Conocer la situación actual de la cirugía locorregional y reconstrucción mamaria (RM) en pacientes con cáncer de mama metastásico (CMM) en España.
MétodoDesde abril a septiembre de 2016 se recogieron datos de una encuesta online difundida a médicos implicados en el tratamiento de este grupo de pacientes.
ResultadosHubo un total de 124 encuestados: 46% cirujanos plásticos, 17,5% cirujanos generales, 30% ginecólogos especializados en enfermedad mamaria y 6,5% de otras especialidades no quirúrgicas. El 47,5% de los encuestados indicó la cirugía locorregional en el CMM al diagnóstico. El 80% de los encuestados aceptó la RM en el CMM, de los cuales un 71,5% lo consideraría previa solicitud por la paciente. En pacientes que no recibirán radioterapia, el 84% de los encuestados optó por RM inmediata, el 72,5% mediante prótesis. En pacientes radiadas, el 77,5% de los encuestados optó por reconstrucción autóloga, un 74,5% con colgajo miocutáneo dorsal ancho; no hubo diferencias entre RM inmediata o RM diferida. Factores considerados para aceptar la RM fueron una expectativa de vida de al menos 2 años, las comorbilidades, la carga tumoral, la respuesta al tratamiento sistémico o un tiempo de enfermedad estable superior a 6 meses. Motivos para no realizar la RM fueron un mal pronóstico asociado y el riesgo de progresión metastásica ante la suspensión temporal del tratamiento sistémico.
ConclusiónLa mitad de los encuestados consideró la RM en una paciente con CMM al diagnóstico, valorando la carga tumoral, la expectativa de vida y la enfermedad estable. Se necesitan protocolos de actuación al respecto.
To identify the current situation of locoregional surgery and breast reconstruction (BR) in patients with metastatic breast cancer (MBC) in Spain.
MethodFrom April to September 2016, data were collected from an online survey sent to physicians involved in treating this group of patients.
ResultsThere were 124 respondents: 46% plastic surgeons, 17.5% general surgeons, 30% gynecologists specialized in breast disease and 6.5% physicians from other specialties. A total of 47.5% of the respondents recommended locoregional surgery in MBC at the time of diagnosis. Eighty percent of respondents performed BR in MBC, of which 71.5% would consider it after a patient request. In patients not receiving radiotherapy, 84% of respondents chose immediate BR, 72.5% of them with a prosthesis. In irradiated patients, 77.5% of respondents preferred autologous reconstruction, 74.5% of them with latissimus dorsi myocutaneous flap. There were no differences between immediate BR or delayed-BR. Factors important in the decision to accept or refuse BR were a life expectancy of at least 2 years, the patient's comorbidities, tumor burden, response to systemic treatment, or more than 6 months of stable disease. The reasons for not performing BR were a poor prognosis and the risk of metastatic progression due to a temporary suspension of systemic treatment.
ConclusionHalf of the respondents considered BR in a patient with MBC at diagnosis, assessing tumor burden, life expectancy, and stable disease. Protocols are required in this regard.
Se estima que un 5% de las mujeres con cáncer de mama presentan afectación metastásica al diagnóstico1,2. El cáncer de mama metastásico (CMM) se considera clásicamente incurable y de pronóstico limitado2. Los tratamientos principales son la quimioterapia y la hormonoterapia, en tanto que la cirugía y la radioterapia (RT) han sido relegadas a situaciones paliativas1, asumiendo que no hay opción de mejorar la supervivencia aplicándolas. La evidencia científica actual apunta a un beneficio de la cirugía sobre el tumor primario, no solo estético, psicológico o en la calidad de vida, sino en la supervivencia3.
La evolución en las técnicas diagnósticas y las estrategias terapéuticas ha aumentado la supervivencia media hasta los 24 meses, con supervivencias globales a 3 y 5 años del 44 y el 28%, respectivamente1, en las que la reconstrucción mamaria (RM) puede plantearse.
Los beneficios de la RM son tanto psicológicos como cosméticos y en la calidad de vida. Hasta la actualidad, no hay ningún consenso que contraindique ni establezca criterios para la RM en el CMM. Sin embargo, el número de mujeres con CMM que se someten a RM, ya sea inmediata o diferida, es bajo.
Estamos ante cambios en la estrategia terapéutica de las pacientes con CMM, que junto con un aumento en la demanda de RM, nos hacen considerar la necesidad de establecer criterios pronósticos uniformes para cirugía locorregional, así como procedimientos reconstructivos adecuados.
El objetivo de esta encuesta fue conocer la situación de la práctica clínica en España con respecto a la cirugía locorregional y/o RM en el CMM a través de las opiniones de los profesionales españoles implicados en su tratamiento.
MétodosSe realizó una revisión de los últimos avances en la base de datos Medline a través del portal PubMed, búsqueda ejecutada aplicando los términos normalizados: «stage iv breast cancer», «breast reconstruction», «locorregional surgery» y «survival». Se seleccionaron algunos de los artículos de revisión y trabajos originales más relevantes publicados en los últimos 5 años.
Teniendo como referencia el trabajo de Durrant et al.3, se realizó un estudio observacional descriptivo de corte transversal ejecutado mediante encuesta, de difusión online y acceso web o móvil, creada a través de formularios de Google. El cuestionario constó de 20 preguntas tipo test de respuesta única o múltiple, distribuidas en 6 bloques (Apéndice 1): 1) datos demográficos y profesionales; 2) cirugía locorregional en el CMM al diagnóstico; 3) RM en el CMM al diagnóstico; 4) RM en pacientes con progresión o recaída a CMM tras el tratamiento primario; 5] no RM en el CMM, y 6) aportaciones y valoración de la encuesta. Se difundió mediante invitación por correo electrónico a cirujanos de la mama y otros profesionales implicados, abarcando toda la geografía española. Las respuestas fueron recogidas del 1 de abril al 18 de septiembre de 2016, ambos inclusive, de manera totalmente anónima y voluntaria. El análisis estadístico se realizó a través del propio software de la web.
ResultadosEl total de encuestados fue de 124. Existe una representación amplia de 15 comunidades autónomas (41% Madrid, 15% Cataluña, 7% Valencia, 6% Andalucía, 6% Islas Canarias, 6% Castilla y León, 19% resto de las comunidades autónomas), excepto Extremadura y La Rioja.
Ochenta y seis encuestados (69,5%) trabajaban en hospitales de nivel iii, 25 (20%) de nivel ii y 13 (10,5%) de nivel i. Noventa y uno (73,5%) dedicaban su actividad asistencial principalmente a la sanidad pública y 33 (26,5%) a la privada. Cincuenta y siete (46%) son cirujanos plásticos, 22 (17,5%) cirujanos generales, 37 (30%) ginecólogos especializados en enfermedad mamaria y 8 (6,5%) son de otras especialidades no quirúrgicas (5 oncólogos médicos, un médico nuclear, un radiólogo y un oncólogo radioterapeuta). La mayoría de los encuestados (88,5%) estaban implicados directamente en la cirugía mamaria o reconstructiva, el 67,5% de forma habitual.
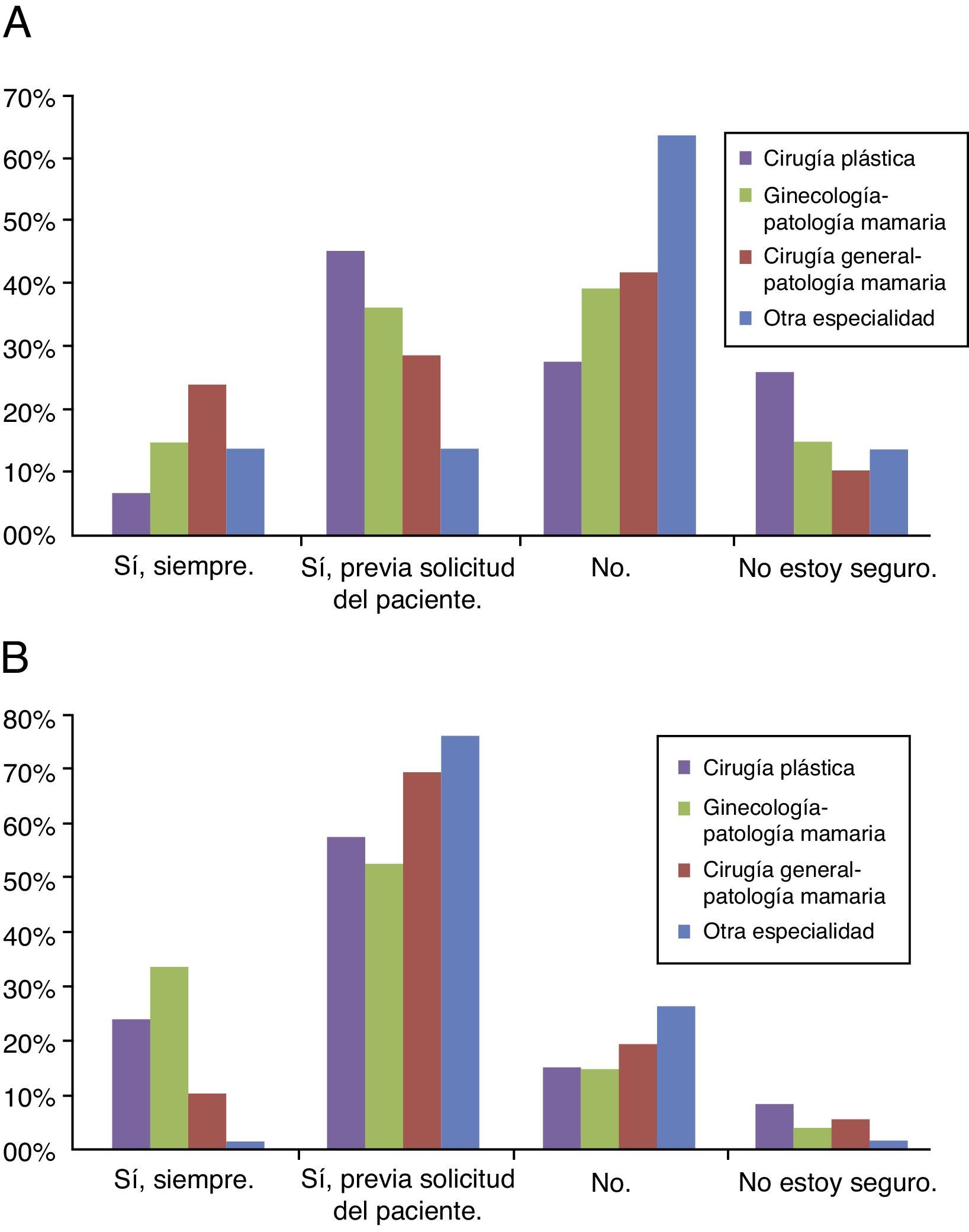
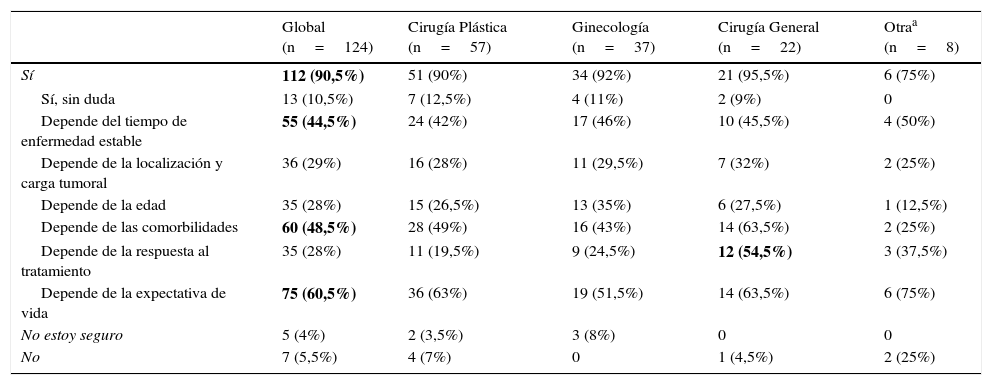
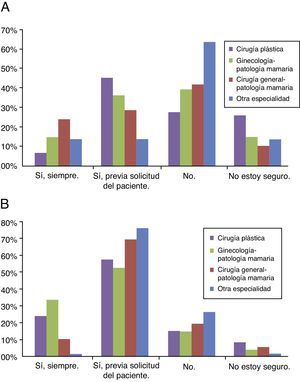
Cincuenta y nueve (47,5%) encuestados consideraron que la cirugía está indicada en el CMM al diagnóstico. Según especialidades, tanto entre los cirujanos plásticos como entre los ginecólogos y los cirujanos generales, casi la mitad de los encuestados (49, 48,5 y 50%, respectivamente) se plantearon la cirugía locorregional, mientras que solo lo hicieron un 25% de los médicos de las otras especialidades no quirúrgicas (fig. 1A).
A. Respuestas de los encuestados, según especialidad, en cuanto a aceptar o no la cirugía locorregional en pacientes con CMM. Veinticinco cirujanos plásticos (44%), 13 (35%) ginecólogos y 6 (27,5%) cirujanos generales valorarían la cirugía con o sin RM solo si la paciente lo solicita,. No considerarían la cirugía en pacientes metastásicas 15 (26%) cirujanos plásticos, 14 (38%) ginecólogos, 9 (41%) cirujanos generales y 5 (62,5%) especialistas no quirúrgicos. B. Respuestas de los encuestados, según especialidad, en cuanto a aceptar o no la RM en pacientes con CMM. El 80% de los encuestados considerarían la RM, siendo dominante en el 71,5% la valoración de RM previa solicitud de la paciente, representando 32 (56%) cirujanos plásticos, 19 (51,5%) ginecólogos, 15 (68%) cirujanos generales y 6 (75%) especialistas no quirúrgicos.
CMM: cáncer de mama metastásico; RM: reconstrucción mamaria.
La principal indicación quirúrgica en una paciente con CMM fue el beneficio psicológico (70%), seguido del control local de la enfermedad (59%), un potencial beneficio en la supervivencia (37%) y una mejor respuesta al tratamiento sistémico tras la cirugía (21%).
Noventa y nueve (80%) encuestados consideraron la RM indicada, de los cuales 71 (71,5%) solo la realizará previa solicitud de la paciente, 19 (15,5%) no contemplaban la RM y 6 (5%) no estaban seguros. Por especialistas, existió una distribución uniforme, procediendo con cirugía locorregional el 79% de los cirujanos plásticos, el 83,5% de los ginecólogos, el 77% de los cirujanos generales y el 75% de otras especialidades, siendo dominante la indicación previa solicitud de la paciente (fig. 1B).
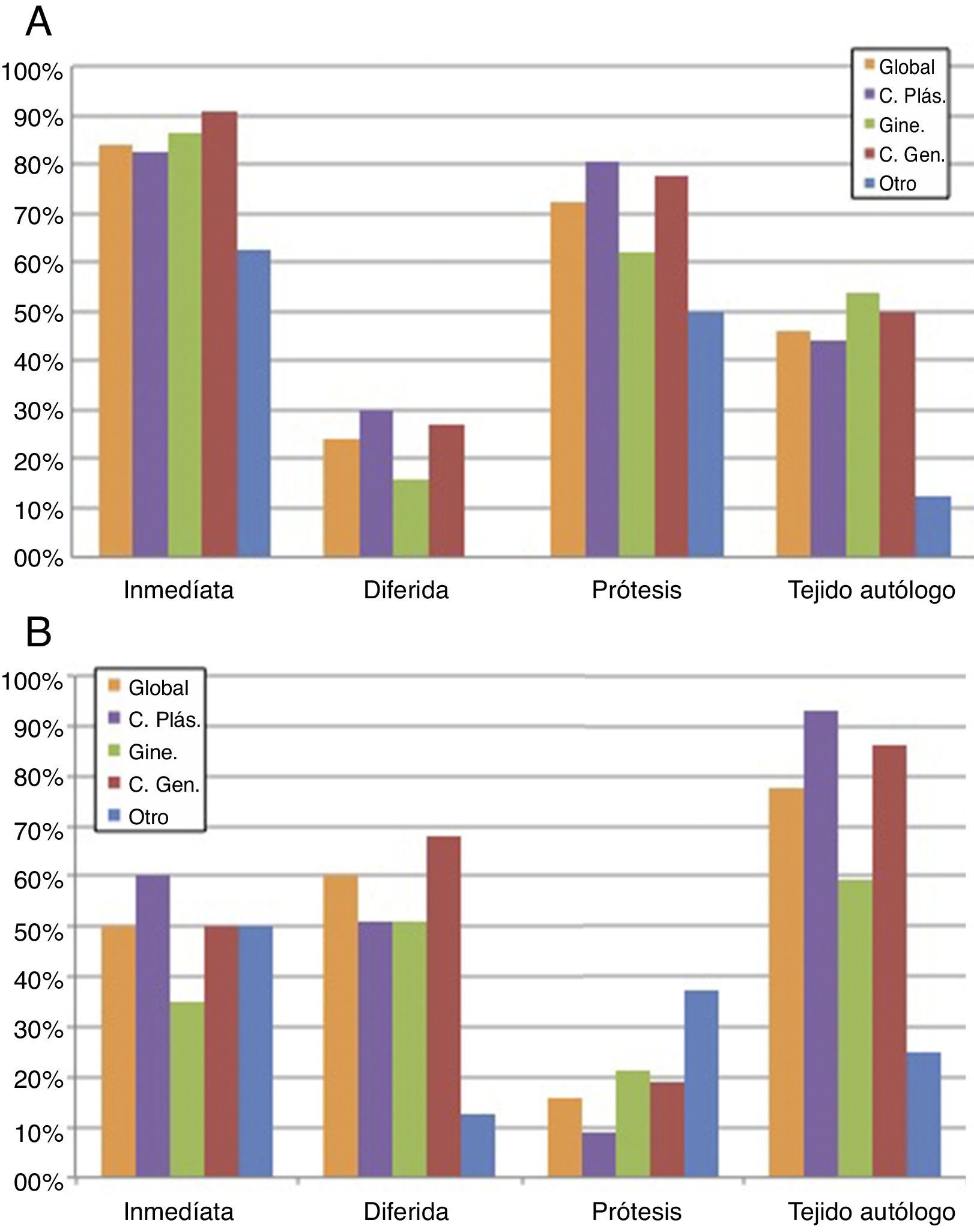
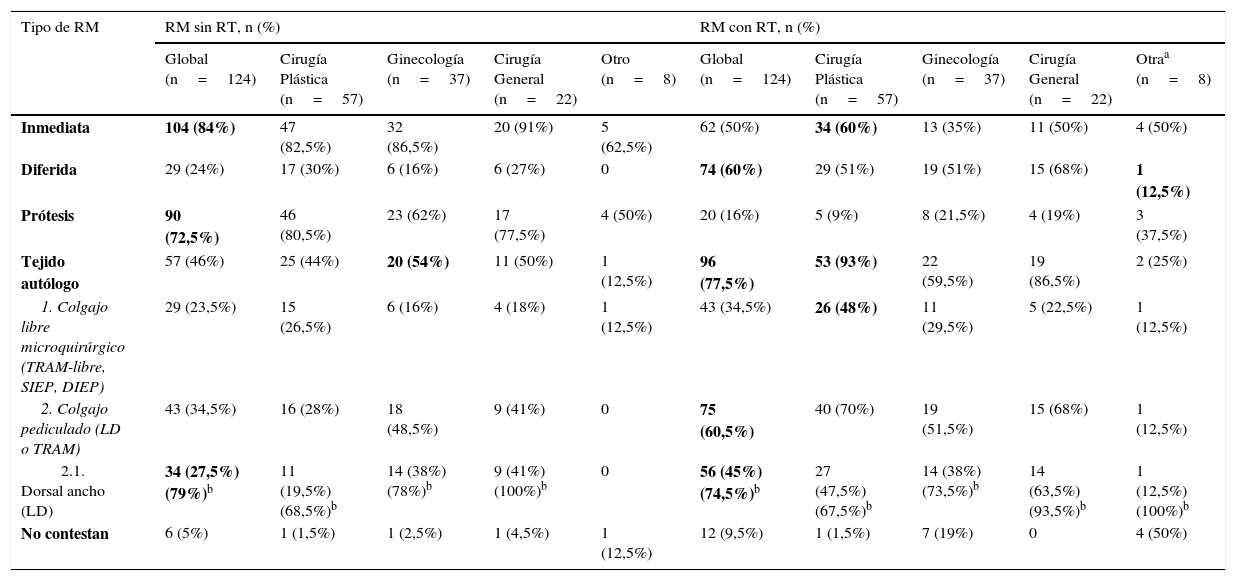
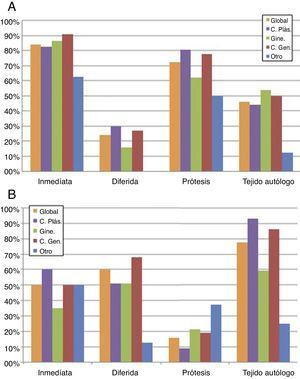
En cuanto al tipo de reconstrucción según el planteamiento de RT locorregional o no, representado en la tabla 1 y la figura 2, 104 (84%) encuestados optarían por la reconstrucción mamaria inmediata (RMI) en pacientes sin RT previa ni prevista tras cirugía. El procedimiento reconstructivo fue en 90 (72,5%) encuestados la prótesis y para 57 (46%), el tejido autólogo. Dentro de las reconstrucciones autólogas, 43 (34,5%) optaron por una reconstrucción con colgajo pediculado, siendo en el 79% de los casos mediante colgajo dorsal ancho (fig. 2A).
Distribución por tipo de reconstrucción mamaria más adecuada según si la paciente con cáncer de mama metastásico ha recibido o va a recibir radioterapia sobre el lecho quirúrgico
| Tipo de RM | RM sin RT, n (%) | RM con RT, n (%) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Global (n=124) | Cirugía Plástica (n=57) | Ginecología (n=37) | Cirugía General (n=22) | Otro (n=8) | Global (n=124) | Cirugía Plástica (n=57) | Ginecología (n=37) | Cirugía General (n=22) | Otraa (n=8) | |
| Inmediata | 104 (84%) | 47 (82,5%) | 32 (86,5%) | 20 (91%) | 5 (62,5%) | 62 (50%) | 34 (60%) | 13 (35%) | 11 (50%) | 4 (50%) |
| Diferida | 29 (24%) | 17 (30%) | 6 (16%) | 6 (27%) | 0 | 74 (60%) | 29 (51%) | 19 (51%) | 15 (68%) | 1 (12,5%) |
| Prótesis | 90 (72,5%) | 46 (80,5%) | 23 (62%) | 17 (77,5%) | 4 (50%) | 20 (16%) | 5 (9%) | 8 (21,5%) | 4 (19%) | 3 (37,5%) |
| Tejido autólogo | 57 (46%) | 25 (44%) | 20 (54%) | 11 (50%) | 1 (12,5%) | 96 (77,5%) | 53 (93%) | 22 (59,5%) | 19 (86,5%) | 2 (25%) |
| 1. Colgajo libre microquirúrgico (TRAM-libre, SIEP, DIEP) | 29 (23,5%) | 15 (26,5%) | 6 (16%) | 4 (18%) | 1 (12,5%) | 43 (34,5%) | 26 (48%) | 11 (29,5%) | 5 (22,5%) | 1 (12,5%) |
| 2. Colgajo pediculado (LD o TRAM) | 43 (34,5%) | 16 (28%) | 18 (48,5%) | 9 (41%) | 0 | 75 (60,5%) | 40 (70%) | 19 (51,5%) | 15 (68%) | 1 (12,5%) |
| 2.1. Dorsal ancho (LD) | 34 (27,5%) (79%)b | 11 (19,5%) (68,5%)b | 14 (38%) (78%)b | 9 (41%) (100%)b | 0 | 56 (45%) (74,5%)b | 27 (47,5%) (67,5%)b | 14 (38%) (73,5%)b | 14 (63,5%) (93,5%)b | 1 (12,5%) (100%)b |
| No contestan | 6 (5%) | 1 (1,5%) | 1 (2,5%) | 1 (4,5%) | 1 (12,5%) | 12 (9,5%) | 1 (1,5%) | 7 (19%) | 0 | 4 (50%) |
DIEP: colgajo de la arteria epigástrica inferior profunda; LD: colgajo ancho dorsal; SIEP: colgajo de la arteria epigástrica inferior superficial; TRAM: músculo transverso del músculo recto abdominal.
Distribución uniforme en cuanto a recomendación de RM inmediata con prótesis en pacientes no radiadas y diferida con colgajo autólogo si RT. Existe una tendencia en el grupo de ginecólogos a realizar reconstrucción autóloga en pacientes sin RT, y en los cirujanos plásticos a RM inmediata con colgajo microquirúrgico independientemente de la RT. El colgajo más recomendado es el dorsal ancho.
Datos relevantes destacados en negrita.
Las frecuencias obtenidas no son sumatorias debido a que cada encuestado ha podido seleccionar varias opciones como respuesta.
Distribución de respuestas globales y por especialidades en cuanto al tipo de RM en paciente con CMM según RT local previa o prevista tras cirugía. A. Opciones de RM en CMM sin RT. Ciento cuatro (84%) encuestados optarían por RMI en pacientes sin RT previa ni prevista tras cirugía. El procedimiento reconstructivo dominante es la prótesis (72,5%), seguida del colgajo autólogo (46%). Se objetiva una tendencia en los ginecólogos hacia la reconstrucción autóloga. B. Opciones de RM en CMM con RT. Distribución uniforme entre la opción de RM diferida (60%) o RMI (50%). Veinte encuestados (16%) optarían por una prótesis y 96 (78%) por el colgajo autólogo. Se objetiva una tendencia en los cirujanos plásticos hacia la reconstrucción autóloga.
C. Gen.: Cirugía General; C. Plást.: Cirugía Plástica; CMM: cáncer de mama metastásico; Gine.: Ginecología; Otro: otra especialidad no quirúrgica (Oncología Médica, Medicina Nuclear, Radiodiagnóstico, Radioterapia); RM: reconstrucción mamaria; RMI: reconstrucción mamaria inmediata.
En cuanto a las respuestas en relación con la RM con RT previa o prevista tras cirugía, existía una tendencia a la reconstrucción mamaria diferida (RMD) (60%) frente a la RMI (50%). Veinte encuestados (16%) optaron por reconstrucción con prótesis y 96 (77,5%) por el colgajo autólogo. Dentro de las reconstrucciones autólogas, 43 (34,5%) indicaron la reconstrucción microquirúrgica frente a 75 (60,5%) con colgajo pediculado, siendo en el 74,5% de los casos el colgajo dorsal ancho (fig. 2B).
El 90,5% de los encuestados consideró la RM en una paciente con CMM detectado tras cirugía locorregional. El 37,1% de los encuestados no consideró necesario demorar la RM si la paciente lo solicitaba y presenta buen estado general. Según el 60,5% de los encuestados, la expectativa de vida fue el factor más importantes para aceptar la cirugía reconstructiva, seguida de las comorbilidades (48,4%) y el tiempo de enfermedad estable (44,4%). Tanto los cirujanos generales como otras especialidades encuestadas incluyeron como relevante la respuesta al tratamiento sistémico (tabla 2).
Respuestas a la pregunta de si considera o no la reconstrucción mamaria en una paciente con cáncer de mama metastásico tras mastectomía y, en caso afirmativo, cuál(es) serían los factores más importantes a tener en cuenta
| Global (n=124) | Cirugía Plástica (n=57) | Ginecología (n=37) | Cirugía General (n=22) | Otraa (n=8) | |
|---|---|---|---|---|---|
| Sí | 112 (90,5%) | 51 (90%) | 34 (92%) | 21 (95,5%) | 6 (75%) |
| Sí, sin duda | 13 (10,5%) | 7 (12,5%) | 4 (11%) | 2 (9%) | 0 |
| Depende del tiempo de enfermedad estable | 55 (44,5%) | 24 (42%) | 17 (46%) | 10 (45,5%) | 4 (50%) |
| Depende de la localización y carga tumoral | 36 (29%) | 16 (28%) | 11 (29,5%) | 7 (32%) | 2 (25%) |
| Depende de la edad | 35 (28%) | 15 (26,5%) | 13 (35%) | 6 (27,5%) | 1 (12,5%) |
| Depende de las comorbilidades | 60 (48,5%) | 28 (49%) | 16 (43%) | 14 (63,5%) | 2 (25%) |
| Depende de la respuesta al tratamiento | 35 (28%) | 11 (19,5%) | 9 (24,5%) | 12 (54,5%) | 3 (37,5%) |
| Depende de la expectativa de vida | 75 (60,5%) | 36 (63%) | 19 (51,5%) | 14 (63,5%) | 6 (75%) |
| No estoy seguro | 5 (4%) | 2 (3,5%) | 3 (8%) | 0 | 0 |
| No | 7 (5,5%) | 4 (7%) | 0 | 1 (4,5%) | 2 (25%) |
Las frecuencias obtenidas no son sumatorias debido a que cada encuestado ha podido seleccionar varias opciones como respuesta.
Datos relevantes destacados en negrita.
El tiempo considerado como enfermedad metastásica estable fue de al menos 12 meses en 44 (35,5%) encuestados, entre 6 y 12 meses en 20 (16%) e inferior a 6 meses en 14 (11,5%). La expectativa de vida adecuada fue de al menos 2 años para 35 (28%) encuestados, mientras que para 45 (36,5%) médicos se debía incidir en la importancia de valorar más factores.
El 47,5% de los encuestados se planteó la RM independientemente de la localización de la enfermedad metastásica. El 42,5% de los encuestados consideró la carga tumoral un factor más importante que la localización de la enfermedad metastásica. Atendiendo a la localización metastásica, 58 (46,8%) de los encuestados consideró las metástasis cerebrales con un peor pronóstico, seguidas de la localización metastásica pulmonar con un 21,8%, hepática con un 20,2% y ósea con un 3,2%. El 54% de los encuestados no consideró como factor pronóstico el tipo histológico.
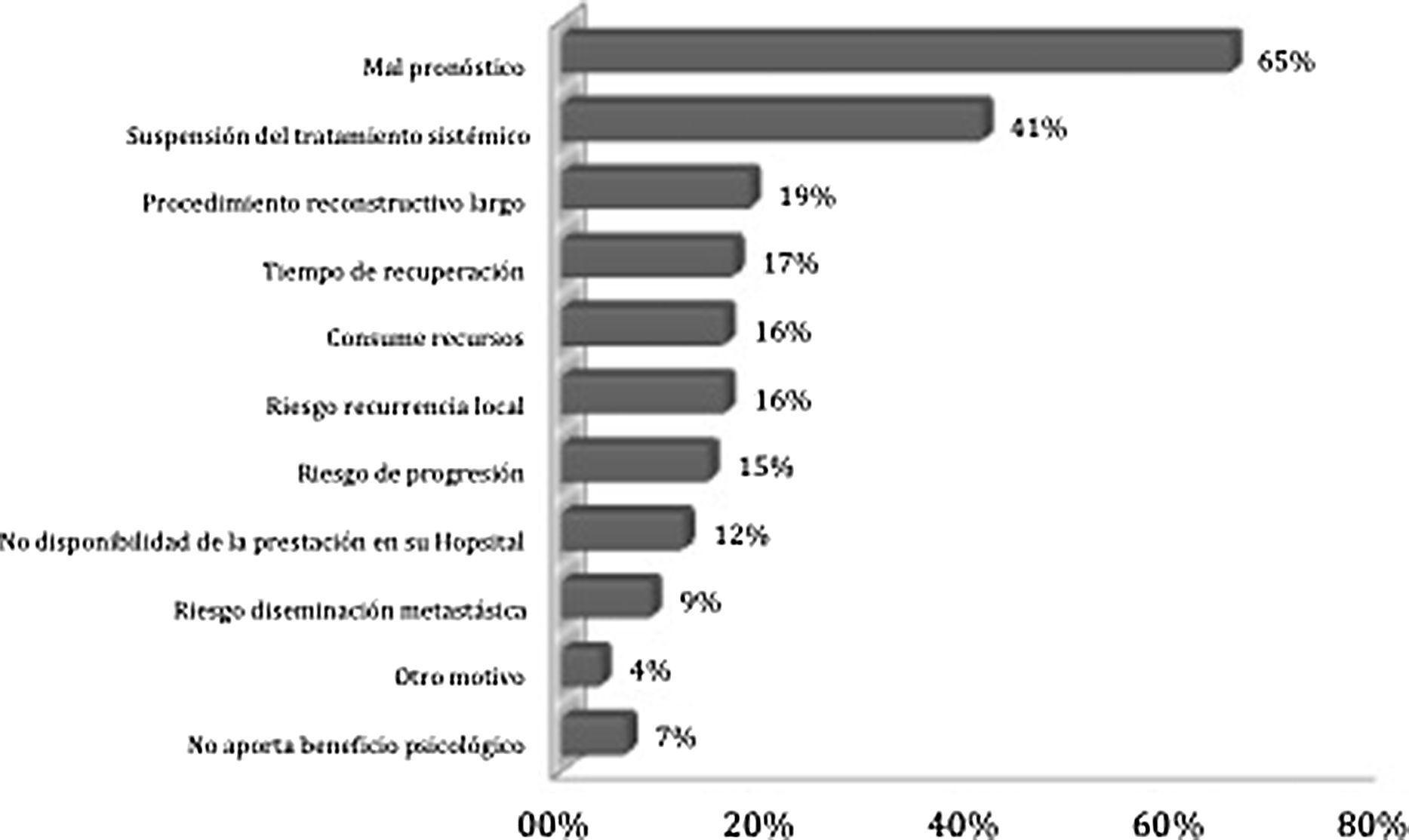
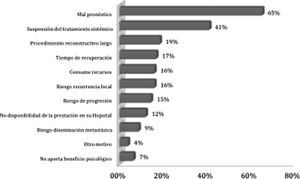
Los motivos más destacados para rechazar la RM en una paciente con CMM son el mal pronóstico per se del CMM (65%) y la suspensión temporal del tratamiento sistémico (41%) (fig. 3).
El 88,8% de los encuestados mostró sentirse satisfecho (81,5%) o muy satisfecho (7,3%) al finalizar la encuesta. Las aportaciones más destacadas de los encuestados fueron las siguientes:
- –
«Llegado a ese punto tengo la sensación de que muchas pacientes no desean RM. El simple planteamiento de RM les genera mucho estrés».
- –
«No desahuciar a las pacientes con CMM; la supervivencia no se calcula».
- –
«Es necesario escuchar e individualizar la situación de cada paciente. Ajustar el esfuerzo reconstructivo a cada paciente».
- –
«Muchas decisiones en CMM están fuera de protocolos establecidos».
- –
«Se debe asesorar muy bien a la paciente en la toma de decisión y disponer de un soporte psicológico».
Menos de la mitad de los encuestados planteó la cirugía del tumor primario en pacientes con CMM al diagnóstico. En la encuesta de Durrant et al.3 el 78,7% de los encuestados realizaría mastectomía en el CMM, mientras que según Nguyen et al.4, solo un 34% de las pacientes son operadas del tumor primario, siendo estos datos comparables con nuestros resultados.
La mayor evidencia disponible en el abordaje quirúrgico del CMM proviene de estudios retrospectivos2, metaanálisis de series clínicas5,6 o registros de tumores7, evidenciando una ligera ventaja en la supervivencia tras la exéresis del tumor primario1,8,9 con márgenes libres4,10, aunque no se puede descartar un posible sesgo de selección de pacientes con CMM a las que se realizó cirugía2,5,6.
La cirugía sobre el tumor primario es un factor independiente de supervivencia (HR 0,69)6,10. La decisión de extirpar el tumor primario está condicionada por múltiples factores relacionados11. En general, las pacientes que se benefician de la cirugía locorregional son más jóvenes (muchos autores limitan la inclusión a pacientes menores de 65 años; el trabajo de Nguyen et al.4 solo incluye menores de 50 años), con buen estado de salud y escasa comorbilidad. Neuman et al.12 determinaron que el subgrupo hormonodependiente y HER2-neu positivo asociaba una mejor supervivencia tras la cirugía (p=0,004), sin beneficio en tumores triple negativo, lo que apoya la utilidad de las dianas terapéuticas. Factores de mejor pronóstico fueron un menor tamaño tumoral, escasa comorbilidad y baja carga tumoral13, junto con la localización metastásica ósea o pulmonar5.
Los trabajos prospectivos en pacientes con CMM al diagnóstico están limitados a 6 ensayos clínicos1,14, algunos en curso15,16; solo 2 de ellos han presentado datos17,18. El ensayo clínico realizado por el grupo turco liderado por el Soran et al.19 comunicó en ASCO 2016 unos resultados preliminares17 prometedores con las primeras 274 mujeres incluidas. Aunque no evidenció diferencias significativas a 36 meses, la supervivencia media fue 9 meses superior en el grupo operado frente al no operado (46 vs. 37 meses). La supervivencia global estimada a 5 años en el grupo operado fue del 42%, frente al 25% en el grupo no operado. Además, las pacientes con CMM hormonodependiente, HER2-neu negativo, metástasis ósea única y menores de 55 años de edad obtuvieron un beneficio superior tras la cirugía inicial (p=0,01), siendo peor en fenotipos agresivos y localización metastásica pulmonar o hepática.
El ensayo clínico TATA, realizado en la India, aleatorizó a las pacientes con respuesta a primera línea de tratamiento sistémico. Incluyó 350 mujeres, 173 operadas, con una supervivencia media de 19 meses, sin observar mejoría (supervivencia global a 2 años del 41% si cirugía vs. 43.5% si no cirugía)18. Los resultados han sido criticados por importantes limitaciones que no lo hacen comparable a nuestro grupo poblacional20.
Debido a la heterogeneidad en la distribución sanitaria y de recursos, es habitual que la RM solo se realice en centros de nivel iii o privados, con unidades multidisciplinares. En nuestro caso, la mayoría de los profesionales pertenecen a centros de nivel iii de la sanidad pública.
El 80% de los encuestados optó por RM en pacientes con CMM al diagnóstico y el 90,5% en recaída metastásica tras tratamiento primario locorregional, considerando la previa solicitud de la paciente. Según Godfrey et al.21, la RM debe ser valorada en pacientes motivadas, independientemente del estadio de la enfermedad. La guía NICE, actualizada en 2014, publica que solo en la mitad de las pacientes que solicitan la RM, se realizará22.
Se agrupan los factores pronósticos a tener en cuenta para considerar o no la RM, según dependan de la paciente (la edad, las comorbilidades, los deseos y las expectativas), de la enfermedad (el intervalo libre de enfermedad, el tiempo de enfermedad estable, las características moleculares de la enfermedad, la localización y la carga tumoral metastásica) o del tratamiento (la respuesta al tratamiento sistémico, el número de líneas recibidas y las opciones terapéuticas existentes)23. De acuerdo con los resultados de la encuesta, los factores considerados a la hora de plantear un procedimiento quirúrgico o reconstructivo fueron, de mayor a menor frecuencia: la expectativa de vida, las comorbilidades, el tiempo de enfermedad estable y la respuesta al tratamiento sistémico. Se aceptó adecuado un tiempo de enfermedad estable previa de al menos 6 meses, aunque un porcentaje alto de encuestados no consideró necesario demorarlo si la paciente lo había solicitado, lo cual puede ser una conducta arriesgada para determinadas pacientes. Por otro lado, parece correcto considerar un tiempo medio de esperanza de vida de al menos 2 años antes de aceptar la RM en pacientes con CMM, operada o no del tumor primario.
Los encuestados consideraron la localización metastásica de mejor pronóstico el hueso o el pulmón, teniendo en cuenta la carga tumoral metastásica, pero sin dar relevancia al tipo histológico. En el estudio realizado por Rapiti et al.24 se objetivó una mejor supervivencia tras cirugía del tumor mamario primario en pacientes con márgenes quirúrgicos libres y afectación metastásica única en hueso. Al respecto, Rhu et al.25 obtuvieron una mejor supervivencia en los pacientes con metástasis en un solo órgano, especialmente en hueso.
No existe un consenso de reconstrucción inmediata o diferida, autóloga o heteróloga para pacientes con CMM21. La RM puede implicar un proceso largo en el tiempo y, en cierta manera, controvertido26. Dado que no es conveniente suspender el tratamiento sistémico por largo tiempo, se tiende a una actitud menos invasiva y más resolutiva.
La RT sobre la pared torácica modifica la conducta quirúrgica reconstructiva, siendo más adecuada la RMD con colgajo autólogo3. La RMI seguida de RT mejoró los resultados estéticos, aunque debe valorarse el mayor riesgo de complicaciones generales y tardías. Según Lee et al.27, se incrementan significativamente las complicaciones en el grupo de pacientes con RT, y aunque el 74% de ellas estaban satisfechas con su resultado estético, este era peor en pacientes radiadas tras RM. Concluyeron que aunque actualmente no está consensuada la necesidad de esperar un tiempo definido tras el tratamiento primario sistémico para realizar la RM, esta no debe iniciarse hasta pasados 12 meses desde el fin de la RT. Baumann et al.28 proporcionaron evidencia de que el momento óptimo para la RM es una vez han transcurrido 12 meses de la finalización de la RT, debido al efecto residual inflamatorio3,29.
Asimismo, no se recomienda el uso de expansores tisulares. El expansor equivale al implante, sin ser permanente. Asocia una elevada tasa de complicaciones y no impide la realización de varias intervenciones30.
La RM mediante prótesis, aunque es un procedimiento sencillo, asocia más complicaciones, especialmente en tejidos radiados31. El-Sabawi et al.31 objetivaron que la RT después de la reconstrucción protésica asocia una mayor incidencia de complicaciones, con un 37% de reintervenciones y un 16,8% de procesos reconstructivos fracasados.
Debido a que muchas pacientes con CMM reciben o recibirán quimioterapia y RT, se recomienda el uso de tejido autólogo en la medida de lo posible11,27. Tsoi et al.30 observaron que sobre tejido radiado, el colgajo autólogo tenía menos riesgo de complicaciones mayores que un implante. Aunque es una intervención compleja, dependiente del cirujano, con una recuperación más larga para el paciente y no exenta de fallo reconstructivo32, el colgajo autólogo minimiza a largo plazo la morbilidad, con una durabilidad permanente y adaptada a los cambios físicos, lo que promueve una alta satisfacción estética33. Para Tanos et al.34 y Newman et al.35 la reconstrucción autóloga es preferible debido a las mayores complicaciones y el peor resultado estético que muestran los implantes.
Según la encuesta de Durrant et al.3, se prefiere la RMD con colgajo de dorsal ancho. Los cirujanos plásticos mostraron una mayor tendencia a la RMI autóloga que los cirujanos de la mama, equiparable a nuestros resultados. Los profesionales encuestados, en caso de no plantearse o haber recibido RT, optaron por RMI con prótesis, siendo una opción el colgajo autólogo pediculado de dorsal ancho con o sin prótesis, ofreciendo una rápida recuperación y escasas complicaciones. Existe una tendencia a que los ginecólogos prefieran la reconstrucción autóloga, evitando así las complicaciones derivadas de la prótesis.
Ante RT locorregional, se optó por RMD con colgajo autólogo pediculado; hubo una tendencia a que los cirujanos plásticos realizaran microcirugía, procedimiento desaconsejado en pacientes metastásicas por la mayor complejidad.
Un mal pronóstico y la necesidad de suspender el tratamiento sistémico temporalmente fueron los principales motivos para rechazar la cirugía y/o la RM en mujeres con CMM. Otros autores consideraron el riesgo de estimular un rápido crecimiento tumoral o promover la diseminación metastásica36. En el trabajo de Godfrey et al.21 no se objetivó un retraso en el inicio del tratamiento sistémico o la RT tras reconstrucción autóloga.
El trabajo está limitado por una distribución entre comunidades autónomas no uniforme y una baja participación, que no ha permitido obtener una muestra homogénea entre las distintas especialidades. Por otra parte, no se incluyeron cuestiones acerca de la opción de cirugía conservadora o el papel de la linfadenectomía axilar, igualmente controvertidos.
En conclusión, la mitad de los encuestados aceptó la RM en el CMM de novo, previa solicitud de la paciente y teniendo en cuenta criterios pronósticos como la carga tumoral, la esperanza de vida y la estabilidad de la enfermedad. La evidencia disponible y la falta de criterios uniformes no permiten justificar el tratamiento quirúrgico locorregional de manera rutinaria en el CMM. Es necesaria la finalización de los ensayos clínicos en curso, que aportarán nuevos conocimientos al respecto. Finalmente, sería conveniente realizar estudios prospectivos de calidad de vida en este grupo de pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen la colaboración de la Asociación Española de Cirujanos de la Mama, la Sociedad Española de Cirugía Plástica, Reparadora y Estética y el Grupo de Jóvenes Ginecólogos Oncólogos de la Sociedad Española de Ginecología y Obstetricia en la difusión de la encuesta.
| Encuesta de Reconstrucción Mamaria En Pacientes con Cancer De Mama Metastásico | ||
|---|---|---|
| Bloque & Pregunta | Tipo de respuesta | Opciones de Respuesta |
| Bloque 1. Datos demográficos y profesionales. | ||
| 1. Comunidad Autónoma donde trabaja. | Respuesta única | A. Galicia – B. Asturias – C. Cantabria – D. País Vasco E. Navarra – F. Andorra – G. Aragón – H. Cataluña I. Castilla-León – J. Castilla-La Mancha – K. Madrid L. Extremadura – M. Valencia – N. Murcia – O. Andalucía P. Baleares – Q. Canarias – R. Otra |
| 2. Nivel del Hospital en el que trabaja prioritariamente. | Respuesta única | A. I (Centro de Especialidades) B. II (Hospital Regional, Hospital Periférico) C. III (Hospital General, Centro Especializado, Complejo Sanitario) D. Otro (especificar) |
| 3. Ámbito sanitario en el que desarrolla su actividad asistencial principalmente. | Respuesta única | A. Privada B. Pública C. Otro (especificar) |
| 4. ¿Cuál es su especialidad? | Respuesta única | A. Cirugía Mamaria (Ginecología). B. Cirugía Mamaria (Cirugía General). C. Reconstrucción Mamaria (Cirugía Plástica). D. Oncología Radioterápica. E. Oncología Médica. F. Otra (especificar). |
| 5. ¿Está usted implicado en los procedimientos de cirugía mamaria o reconstructiva? | Respuesta única | A. Si, habitualmente. B. Si, ocasionalmente. C. No, indirectamente. D. No, nunca. |
| Bloque 2. Cirugía locoregional en el Cáncer de Mama Metastásico “de novo” (al diagnóstico de la enfermedad). | ||
| 6. ¿ Considera que la cirugía está indicada en el paciente con cáncer de mama metastásico al diagnóstico de la enfermedad? | Respuesta única | A. Si, siempre. B. Si, sólo si la paciente lo solicita expresamente. C. No. D. No estoy seguro. |
| 7. ¿Cuáles serían sus indicaciones para cirugía en el cáncer de mama metastásico “de novo”? | - Marque la respuesta que considera más adecuada. - Puede señalar varias respuestas. | A. Control local de la enfermedad. B. Potencial mejoría en la supervivencia. C. Potencial mayor respuesta al tratamiento. D. Beneficio psicológico. E. No estoy seguro. F. Otra (especificar, ej. estética, a petición). |
| Bloque 3. Reconstrucción Mamaria en el Cáncer de Mama Metastásico “de novo” (al diagnóstico de la enfermedad). | ||
| 8. ¿Ofrecería Reconstrucción Mamaria si se planteara cirugía locoregional (mastectomía o conservadora) a una paciente con Cáncer de Mama Metastásico “de novo”? | Respuesta única | A. Si, siempre. B. Si, sólo si la paciente lo solicita expresamente. C. No. D. No estoy seguro. |
| 9. ¿Qué técnica consideraría más adecuada para la Reconstrucción Mamaria de una paciente con Cáncer de Mama Metastásico sin Radioterapiaprevia ni prevista sobre la pared torácica? | - Marque la respuesta que considera más adecuada. - Puede señalar varias respuestas. | A. Inmediata con colgajo autólogo libre o microquirúrgico (ej. TRAM-libre, DIEP, SIEP). B. Diferida con colgajo autólogo libre o microquirúrgico (ej. TRAM-libre, DIEP, SIEP). C. Inmediata con colgajo autólogo pediculado (TRAM-pediculado). D. Diferida con colgajo autólogo pediculado (TRAM-pediculado). E. Inmediata con Dorsal ancho (LD-pediculado) con o sin prótesis F. Diferida con Dorsal ancho (LD-pediculado) con o sin prótesis. G. Inmediata con prótesis. H. Diferida con prótesis. I. No estoy seguro. |
| 10. ¿Qué técnica consideraría más adecuada para la Reconstrucción Mamaria de una paciente con Cáncer de Mama Metastásico con Radioterapiaprevia o prevista sobre la pared torácica? | - Marque la respuesta que considera más adecuada. - Puede señalar varias respuestas. | J. Inmediata con colgajo autólogo libre o microquirúrgico (ej. TRAM-libre, DIEP, SIEP). K. Diferida con colgajo autólogo libre o microquirúrgico (ej. TRAM-libre, DIEP, SIEP). L. Inmediata con colgajo autólogo pediculado (TRAM-pediculado). M. Diferida con colgajo autólogo pediculado (TRAM-pediculado). N. Inmediata con Dorsal ancho (LD-pediculado) con o sin prótesis O. Diferida con Dorsal ancho (LD-pediculado) con o sin prótesis. P. Inmediata con prótesis. Q. Diferida con prótesis. R. No estoy seguro. |
| Bloque 4. Reconstrucción Mamaria en pacientes con progresión o recaída a Cáncer de Mama Metastásico tras tratamiento primario. | ||
| 11. ¿Consideraría Reconstrucción Mamaria en una paciente ya mastectomizada con Cáncer de Mama Metastásico? | - Marque la respuesta que considera más adecuada. - Puede señalar varias respuestas. | A. Si, sin duda. B. Si, depende del tiempo de enfermedad estable. C. Si, depende de la localización y la carga tumoral metastásica. D. Si, depende de la edad. E. Si, depende de las comorbilidades. F. Si, depende de la respuesta al tratamiento sistémico. G. Si, depende de la expectativa de vida. H. No. I. No estoy seguro. J. Otra (especificar) |
| 12. ¿En cuánto tiempo consideraría la enfermedad metastásica estable y consideraría aceptable plantear la Reconstrucción Mamaria en paciente mastectomizada con Cáncer de Mama Metastásico? | Respuesta única | A. Al menos 6 meses. B. Entre 6 a 12 meses. C. Al menos 12 meses. D. No es necesario demorar si la paciente tiene buena calidad de vida y solicita la Reconstrucción Mamaria. |
| 13. ¿En qué localizaciones de enfermedad metastásica nunca se plantearía Reconstrucción Mamaria por su peor pronóstico? | - Marque la respuesta que considera más adecuada. - Puede señalar varias respuestas. | A. En ningún caso plantearía Reconstrucción Mamaria en una paciente metastásica. B. Independientemente de la localización, si la paciente lo desea y la enfermedad está estable, valoro Reconstrucción Mamaria. C. Cerebrales D. Óseas E. Hígado F. Pulmonares |
| 14. ¿Influye más en su decisión el número/volúmen de las metástasis que la localización metastásica? | Respuesta única | A. Si B. No C. No estoy seguro. |
| 15. ¿Influye más en su decisión el tipo histológico tumoral que la localización metastásica? | Respuesta única | D. Si E. No F. No estoy seguro. |
| 16. ¿Cuántos años de expectativa de vida calculada considera adecuados para valorar Reconstrucción Mamaria en el Cáncer de Mama Metastásico? | Respuesta única | G. No se tiene en cuenta la expectativa de vida sino otros factores. H. Al menos 2 años. I. Superior a 2 años. J. No estoy seguro. K. Otra (especificar) |
| Bloque 5. No Reconstrucción Mamaria en Cáncer de Mama Metastásico. | ||
| 17. ¿Cuáles son sus razones para no ofrecer Reconstrucción Mamaria a una paciente con Cáncer de Mama Metastásico? | - Marque la respuesta que considera más adecuada. - Puede señalar varias respuestas. | A. Mal pronóstico. B. Falta de recursos sanitarios. C. Efecto sobre la progresión de la enfermedad metastásica. D. Promueve la diseminación metastásica. E. Posible recurrencia local. F. Suspensión temporal del tratamiento sistémico para la cirugía. G. Largo tiempo de recuperación. H. Larga duración del procedimiento reconstructivo. I. Falta de acceso a un servicio de cirugía reconstructiva de la mama. J. En esa situación no aporta beneficio psicológico. K. Otro (especificar) |
| Bloque 6.1. Aportaciones y opiniones | ||
| 18. Por favor, añada cualquier comentario que considera relevante y no ha sido mencionado. | Respuesta libre | |
| Bloque 6.2. Valoración de la encuesta | ||
| 19. En relación a sus respuestas a lo largo de la encuesta, usted se siente: | Respuesta única | A. Muy satisfecho B. Satisfecho C. Poso satisfecho D. Insatisfecho |
| 20. La encuesta le ha parecido. | Respuesta única | A. Mala B. Regular C. Buena D. Muy buena E. Excelente |
Acrónimos: DIEP: colgajo de la arteria epigástrica inferior profunda; LD: colgajo ancho dorsal; SIEP: colgajo de la arteria epigástrica inferior superficial; TRAM: músculo transverso del músculo recto abdominal.