INTRODUCCION
Habitualmente cuando se habla de los procesos mamarios, se piensa sólo en la mujer por ser en ella, con mucho, donde se muestra su mayor incidencia. Sin embargo, no debemos olvidar que las glándulas mamarias del hombre, también se enferman, presentando afecciones, en gran parte semejantes a las de la mujer y, alguna, con especial idiosincrasia. Un indicador de la trascendencia del tema es el hecho de que en U.S.A. se diagnostican cada año 600 nuevos casos de cáncer de mama en el varón y mueren anualmente 250 hombres por esa causa.
CUADROS CITOPATOLOGICOS (Tabla 1)
Procesos inflamatorios
Mastitis. Abscesos.
Los caracteres citológicos son análogos a los que se observan en la mujer. En las mastitis agudas se observan numerosos neutrófilos y restos necróticos. En algunos casos se han descrito abscesos subareolares18,25 caracterizados por células pavimentosas, anucleadas y nucleadas y fondo inflamatorio. No debe confundirse con carcinoma mamario.
En las mastitis crónicas, el cuadro citológico es polimorfo, con variables grados de celularidad. Las células ductales pueden mostrar anisonucleosis y nucléolos destacados y se acompañan de linfocitos, células plasmáticas y macrófagos.
Ginecomastia
Concepto. Es un agrandamiento benigno, no tumoral, del tejido mamario del hombre. Puede ser uni o bilateral.
Cuadros clínico-patológicos. Siguiendo las orientaciones de Haagensen (1987) y Johnson (1987)8, hemos considerado oportuno distinguir en la ginecomastia dos cuadros clínico-patológicos de utilidad en la valoración de su citopatología.
Hipertrofia puberal
Concepto. Agrandamiento discoide de la glándula mamaria de 2,3 cm situado inmediatamente debajo de la areola.
Histopatología. Morfológicamente le corresponde un patrón florido, manifestación de la fase precoz del desorden, mientras que un segundo patrón fibroso es un estado involutivo.
Se presenta con una proliferación irregular de los conductos que muestran varias capas de células epiteliales con núcleos hipercromáticos y una capa de células mioepiteliales. También existe una proliferación del estroma; rodeando a los ductos un conectivo edematoso, laxo, que motiva una característica coloración azulada en H-E.
En los casos de extrema hiperplasia epitelial, los ductos están limitados por proyecciones papilares, a veces con zonas de metaplasia escamosa focal que pueden fragmentarse y descamar en la luz del ducto. Difieren del carcinoma in situ micropapilar por faltar el carácter bulboso y rígido.
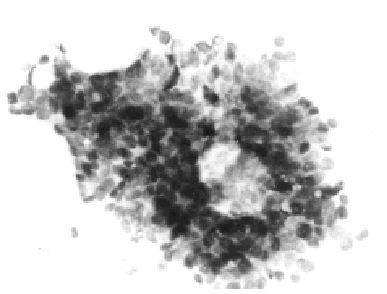
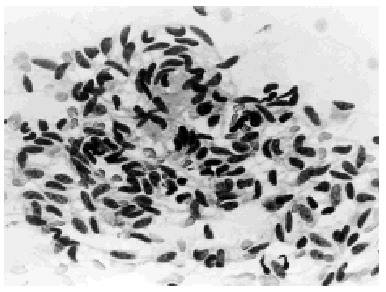
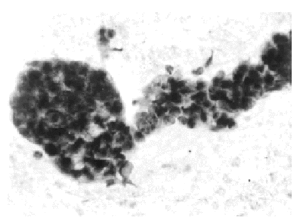
Citopatología. Los aspirados por PAAF contienen numerosas placas de células epiteliales que se parecen a las que se observan en el fibroadenoma de las mamas femeninas, con núcleos redondos u ovales, pálidos, de cromatina finamente granular y micronucléolos, (fig. 1). Entre las células epiteliales e observan células mioepiteliales con núcleos densos y escaso citoplasma. Ocasionalmente, aparecen estructuras papilares multiestratificadas, compuestas por células epiteliales, núcleos grandes hipercromáticos, a veces con superposición y moldeamiento nuclear. En ausencia de células aisladas malignas, debe evitarse supravalorar las estructuras papilares como malignas. Evita la sobrevaloración maligna la presencia de una población celular mixta y la cohesión de los fragmentos24,17.
Fig. 1. Ginecomastia. PAAF mostrando placas de células ductales hiperplásicas. Papanicolaou, x 400.
Para la PAAF de una ginecomastia es aconsejable utilizar anestesia local o por pulverización, pues las placas suelen estar muy cohesionadas y se precisa una penetración vigorosa de la aguja.
Hipertrofia senil
Concepto. Se presenta en paciente de 50 a 70 años, similar a la puberal, aunque con más frecuencia es unilateral. Es un nódulo discoide, sensible, debajo de la areola, de 2-4 cm de diámetro17.
Histopatología. Corresponde al patrón fibroso cuya clave diagnóstica es la presencia de un estroma denso, fibroso, escasamente celular, con bastante menos células epiteliales que el patrón florido. Ausencia de edema periductal y escasez o ausencia de tejido adiposo.
Los ductos muestran mayor distorsión y dilatación pero están limitados por un epitelio con mínima hiperplasia.
Hay forma de transición de ginecomastia con ambos patrones, florido y fibroso. A veces se observan cambios apocrinos e hiperplasia atípica.
Citopatología. Extendidos escasamente celulares, con pequeñas placas ductales de apenas hiperplasia y una substancia de fondo con pequeños fragmentos de tejido conjuntivo.
Se pueden observar importantes anomalías nucleares en ginecomastias de pacientes tratados con quimioterapia por cáncer, radioterapia o finasteride23,32.
Diagnóstico diferencial (tabla 2). Los principales con que tenemos que realizar el diagnóstico diferencial de la ginecomastia son:
1. Seudoginecomastia, que sólo presenta un incremento de tejido adiposo sin proliferación del tejido mamario.
2. Proceso fibroquístico que muestra mayor número de células apocrinas y espumosas.
3. Fibroadenoma. Cierta forma de ginecomastia puede recordar macroscópicamente al fibroadenoma. Este presenta en la PAAF más células bipolares y ausencia de células columnares aisladas.
4. El carcinoma escirro puede ser imitado por formas fibrosas de ginecomastia debido a su consistencia dura e irregular, mientras que el carcinoma tubular puede confundirse también con focos de ginecomastia fibrosa, exigiendo una cuidadosa interpretación microscópica. Ayuda en el diagnóstico diferencial de la ginecomastia con el cáncer, la existencia de una población doble de células ductales y núcleos desnudos que identifica el cuadro como benigno.
Fibroadenoma
Muy raros y sin especificidad por el sexo. Se observan grupos de células ductales sin atipias significativas, fragmentos de tejido fibroso, frecuentes núcleos bipolares de origen conjuntivo y escasa sustancia seroalbuminosa de fondo.
Papilomatosis
No difiere de la observada en la mujer. Habitualmente, son extendidos muy celulares, con células ductales formando grupos multiestratificados, algunos con morfología papilar. El derrame por el pezón sólo se presenta en el 2 % de las enfermedades benignas y si el derrame es sanguinolento, generalmente se trata de un papiloma ductal, aunque naturalmente debemos descartar la posibilidad de un cáncer intraductal, mediante examen citológico de todo el material que se recoja, en una completa expresión de la mama y el pezón.
Hiperplasia mamaria
Citológicamente es interesante conocer el cuadro de secreción sanguinolenta producida iatrogénicamente en niños pequeños, comedores habituales de pollo con engordamiento favorecido por estrógenos12. Suelen ser niños entre 12 y 24 meses con derrames unilaterales por el pezón y sintomatología clínica de ginecomastia bilateral. Histopatológicamente se observa una dilatación ductal con presencia de un material grumoso eosinófilo y una hiperplasia del epitelio más o menos importante. No se aprecia lobulillos ni ácinos.
El examen citológico del derrame muestra agrupaciones de células ductales hiperplásicas y células espumosas diseminadas en sustancia de fondo sero-albuminosa y hemática.
Cáncer de mama
Clínica. Suele presentarse como un tumor mal delimitado, localizado centralmente, debajo del pezón y areola y donde las metástasis axilares son muy frecuentes y extensas. A menudo se evidencia una secreción sanguinolenta por el pezón.
Anatomía patológica. El carcinoma de mama en el varón tiene una incidencia del 7,3 % de las lesiones mamarias14. Se encuentran iguales tipos histológicos que en la mujer, aunque suelen ser formas más diferenciadas.
Carcinoma in situ. Su incidencia es alrededor del 5 % del total de carcinomas mamarios en el varón. Es habitual la presentación subareolar, partiendo de los conductos de primer orden. Como en la mujer, pueden encontrarse lesiones borderline con la hiperplasia epitelial intensa.
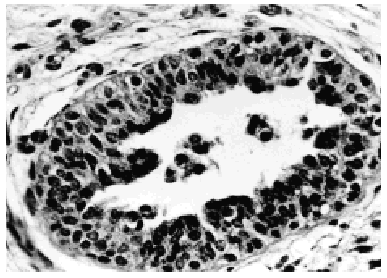
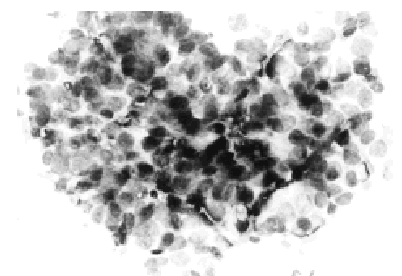
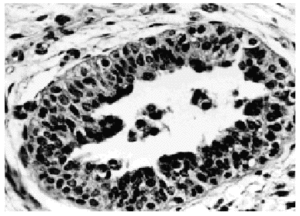
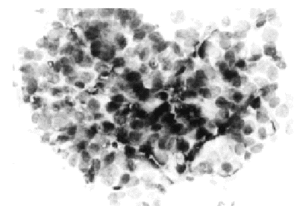
Patrones histopatológicos: sólido, comedo, cribiforme (figs. 2 y 3) y papilar, con los mismos criterios diagnósticos que en la mujer. De 90 casos publicados sólo 3 han sido diagnosticados por secreción y el resto por PAAF19,21. El diagnóstico diferencial incluye papiloma intraductal, carcinoma papilar y tumores metastásicos en mama.
Fig. 2. Carcinoma in situ en mama de varón. Hematoxilina-Eosina, x 400.
Fig. 3. PAAF de carcinoma in situ de mama de varón. Papanicolaou, x 400.
Carcinoma invasivo. Similar a la mujer, la mayoría tiene aspecto escirro, con masas grises a tostadas.
Se encuentran todos los tipos histológicos, excepto el carcinoma lobulillar, debido a que la mama masculina carece de lóbulos, aunque eventualmente puede formarlos por estrogenoterapia prolongada. El 75-80,3 % corresponden al carcinoma ductal infiltrante no específico, iniciándose en los grandes ductos.
Son de muy escasa incidencia los carcinomas mucinoso, cribiforme, medular y coloide y la forma clínica de carcinoma inflamatorio. El carcinoma papilar muestra un crecimiento lento y una mayor incidencia (5 %) que en la mujer (1 %). El patrón organoide y gránulos + al Grimelius y enolasa permiten el diagnóstico de tumor carcinoide (F. Schmitt)6,25.
Tumores metastásicos en mama. Representan el 8,8 % de todas las lesiones de la mama. Mientras en la mujer las metástasis son del 0,5-5,1 % de todos los cánceres mamarios, en la serie de Sneige (1993)27 en el varón alcanza el 58 %29.
Unilaterales, clínicamente son indistinguibles del carcinoma primario de la mama. Su origen más frecuente son el linfoma, el carcinoma broncogénico y el carcinoma de células transicionales.
Citopatología (tabla 3). La citología es indistinguible de los que se presentan en la mujer.
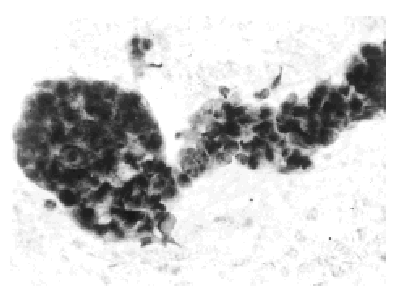
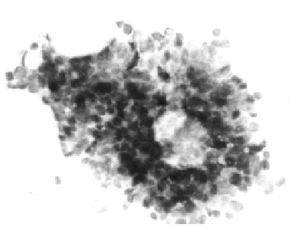
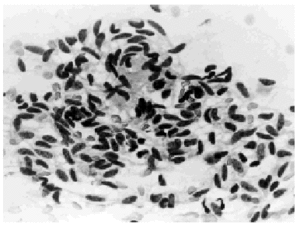
El cáncer ductal infiltrante muestra abundantes células cancerosas, de presentación aislada o en placas pequeñas y grandes, con gran polimorfismo15. Los núcleos son grandes, irregulares, con cromatina groseramente granular (figs. 4 y 5), observándose ocasionalmente vacuolas intracitoplásmicas.
Fig. 4. Carcinoma ductal infiltrante. PAAF de mama de varón. Papanicolaou, x 400.
Fig. 5. Recurrencia en citatriz de mastectomía de carcinoma de mama de varón. Papanicolapou, x 400.
Citología de las neoplasias metastásicas en mama. La naturaleza metastásica de las células se establece sabiendo que pueden minimizar los tumores primarios en base a:
1.Historia clínica completa.
2.Sospecha ante cuadro citológico:
a) Inusual: carcinoma neuroendocrino de células pequeñas: escaso citoplasma y cromatina en "sal y pimienta"; próstata: aspecto sincitial y, a veces, estructuras adenomatosas. Expresión de anticuerpos prostáticos. Melanoma. Hematopoyéticos.
b)Indistinguibles del primario: poca diferenciación. En estos casos ayuda más observar la arquitectura del tejido, en inclusión, donde se observan los conductos y lobulillos desplazados, sin participar en el proceso neoplásico.
3.Útiles: inmunocitoquímica y microscopia electrónica.
El diagnóstico con PAAF de metástasis en mama es fundamental para evitar mastectomías innecesarias y aconsejar apropiada quimio o radioterapia.
Enfermedad de Paget. Es más común que en la mujer y presenta los mismos rasgos clínicos y patológicos. El material puede obtenerse por impronta de la areola y por punción retroareolar. Se observan extendidos inflamatorios, con células ductales voluminosas, de núcleos excéntricos, grandes e hipercromáticos, y citoplasmas vacuolizados. También se identifican células pavimentosas con rasgos neoplásicos e inflamatorios.
Diagnóstico diferencial. Incluye, como más frecuentes, a los siguientes procesos11:
1. Ginecomastia con hiperplasia activa, que presenta una mama sensible a la palpación sin afectación de la areola. En general en el carcinoma se observa gran celularidad frente a la pobreza de la ginecomastia. A veces en la ginecomastia hay un aumento de la celularidad con disociación de las placas y anisonucleosis, que puede confundir con el carcinoma. Ayuda la presencia en la ginecomastia de cromatina fina y membrana nuclear blanda y población celular doble en contraste con la disociación celular y anisonucleosis en el carcinoma.
2. Lesiones del pezón. Principalmente cuadros de eczema o de adenoma pueden ser confundidos con carcinoma, debiéndose recurrir a la menor sospecha a la biopsia intraoperatoria.
3. Alteraciones por radiación, que motiva fibrosis y necrosis grasa.
4. Tumores metastásicos en la mama. Pueden ser de origen epitelial o linfoproliferativo y ya han sido comentados anteriormente.
TUMORES NO EPITELIALES DE LA MAMA
Concepto. Son considerados como tales por Visfeldt y Scheike31, aunque Crichlow4, arguye que son tumores en y no de la mama y que no guardan ninguna relación con la mama, como órgano especial. Azzopardi1 acepta ambos criterios.
Dada la rareza de los sarcomas es muy escasa la experiencia con PAAF18.
Clasificación. Koss et al18, consideran dos tipos de tumores malignos no epiteliales de la mama: sarcoma del estroma y linfomas malignos.
1. Sarcomas del estroma. Término introducido por Berg et al (1962)2, para comprender a todos los sarcomas de la mama con excepción del Phyllodes maligno. Presentan los mismos elementos del Phyllodes, pero falta el elemento epitelial.
Tanto en las mujeres como en el hombre, los principales tipos de sarcomas del estroma son:
a) Fibrosarcoma puro: es el más frecuente. Se extiende a pulmón, huesos y, rara vez, a los ganglios linfáticos. El extendido de PAAF, muestra numerosas y extensas placas de células malignas de tipo elongado, con núcleos ovales o en forma de puro, a veces muy pleomorfos. También se observan células aisladas y núcleos desnudos.
b) Liposarcoma puro: son excepcionales, gran parte son Phyllodes con diferenciación sarcomatosa.
c) Osteosarcoma: excepcional. Diagnóstico diferencial con el carcinoma metaplásico.
d) Miosarcoma: el leiomiosarcoma es excepcional. Presenta células en huso con núcleos en cigarro puro y cromatina en grumos.
Tenemos publicado el primer caso de la literatura de un hemangiopericitoma en la mama del varón12. Se trata de un tumor vascular muy raro, desarrollado a expensas de los pericitos (fig. 6), células epitelioides del glomus. La PAAF mostraba agrupaciones tridimensionales, a modo de protuberancias y fragmentos capilares rodeados de células endoteliales en disposición radial. También se observaron células fusiformes y ovoides, hipercromáticas y de cromatina irregular (pericitos). La inmunocitoquímica mostró positividad a la vimentina y negatividad para desmina y queratina.
Fig. 6. Hemangiopericitoma de mama de varón con típicas células fusiformes de núcleos hipercromáticos. Papanicolaou, x 300.
2. Linfomas malignos. Es muy importante distinguirlos del carcinoma, pues el tratamiento es completamente distinto. Se diferencian los extendidos correspondientes a leucemias de los linfomas malignos de la mama. En ambos procesos se observan frotis muy celulares con grupos diseminados de células ductales benignas. En las leucemias se observa marcada variación de la población celular, mostrando algunos elementos núcleos irregulares y, otros, gránulos citoplásmicos. En contraste, los linfoma ofrecen infiltrados más monomorfos, a veces con protrusiones nucleares.
RESULTADOS DE LA CITOPATOLOGIA EN EL ESTUDIO DE LAS ALTERACIONES DE LA GLANDULA MAMARIA DEL VARON
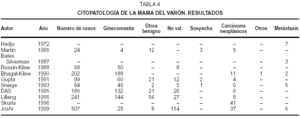
Presentamos los resultados de las series más importantes publicadas sobre la citopatología de la glándula mamaria del varón. La recogida del material citológico se ha realizado mayoritariamente mediante PAAF aprovechándose también, en algunos casos, la existencia de secreciones por el pezón (tabla 4).
Hajdu (1973)9, del Memorial Hospital, tiene publicada la serie más extensa de tumores metastásicos de mama, donde en 4.000 pacientes con tumores malignos de mama se diagnosticaron 51 tumores metastásicos, 7 en hombres. Silverman (1987)26, en 2429 PAAF de mama, encontró 18 casos de metástasis en mama, 3 de ellos en varones (1 de próstata, 2 oat-cell). No identificaron falsos negativos y ningún caso de esta serie fue interpretado como carcinoma primario de mama. La fidelidad diagnóstica desciende en la publicación de Martin Bates (1985)22, acaso por su experiencia más limitada en una patología de por sí, infrecuente: en 25 PAAF encontraron 2 falsos negativos con material insuficiente al ser revisada la muestra, y en los 5 pacientes dados como carcinoma sólo en 3 se confirmó, resultando en los otros 2 una ginecomastia florida.
Bhagat y Kleine (1990)3, tienen una publicación muy extensa sobre citopatología de la glándula mamaria del varón con 202 pacientes, 188 diagnosticados de ginecomastia y 14 con tumores malignos: 10 carcinomas ductales, 1 infiltrante, 1 leiomiosarcoma y 2 carcinomas metastásicos (1 de colon y otro de próstata). Gupta (1991)7, en 99 casos, encontró 2 falsos positivos, motivados por una proliferación muy atípica de células ductales que, en contadas ocasiones, se observan en la ginecomastia. En el resto de los pacientes, la histopatología confirmó el diagnóstico citológico. Excelentes son los resultados de Sneige y Katz (1993)30, del M.D. Anderson Cáncer Center, que en 64 pacientes no encontraron falsos positivos ni negativos, resultando el caso sospechoso un carcinoma primario de mama. Shukla (1996)28, diagnostica con PAAF 41 cánceres mamarios. Finalmente la publicación más extensa y reciente es la de Joshi 16, de New Delhi con 507 pacientes, 22,5 % de PAAF insatisfactorios; no falsos positivos ni negativos y sensibilidad y especificidad del 100 %. Cuando se incluyen resultados de citología no conclusiva, la sensibilidad es del 100 %, la especificidad 80,5 %, el valor predictivo positivo 83,7 % y el negativo 100 %.