El cáncer de mama en los hombres es poco frecuente, representa menos del 1% de todos los cánceres masculinos. Comparte similitudes con el cáncer de mama en la mujer, pero también importantes diferencias. Se presenta entre los 60 y 70 años con un pico de edad de 67 años. El carcinoma ductal invasivo es el que prevalece en los varones, clínicamente se detecta como un nódulo unilateral indoloro. A diferencia de la mujer, donde se realizan estudios de cribado, en los hombres suele diagnosticarse más tarde, porque buscan atención médica tardíamente por la poca incidencia de cáncer en los pacientes masculinos y por la ausencia de signos y síntomas tempranos. El diagnóstico suele ser clínico, pero actualmente se puede utilizar la mamografía para diferenciar entre enfermedades mamarias benignas y malignas. En este artículo se presenta un caso clínico de un varón diagnosticado de carcinoma apocrino de mama triple negativo localmente avanzado.
Breast cancer in men is rare, accounting for less than 1% of all male cancers. It shares similarities with breast cancer in women, but also important differences. It occurs between 60 and 70 years with a peak age of 67 years. Invasive ductal carcinoma is the one that prevails in men, clinically it is detected as a painless unilateral nodule. Unlike women, where screening studies are carried out, men are usually diagnosed later, because they seek medical attention late due to the low incidence of cancer in male patients and the absence of early signs and symptoms. The diagnosis is usually clinical, but mammography can currently be used to differentiate between benign and malignant breast diseases. This article presents a clinical case of a man diagnosed with locally advanced triple-negative apocrine carcinoma of the breast.
Entre el 0,6 y el 1% del total de cáncer de mama afecta al varón1,2. Supone casi el 1% del total de las neoplasias masculinas.
Suele diagnosticarse a partir de los 60 años y su incidencia aumenta con la edad. En el 85% de los casos el diagnóstico es clínico. Es de etiología desconocida, aunque existen factores de riesgo predisponentes como los traumatismos, exposición a radiaciones, administración exógena de estrógenos y síndrome de Klinefelter. El 10–15% tienen una mutación genética asociada3.
Caso clínicoSe trata de un hombre de 63 años con un carcinoma de mama apocrino triple negativo localmente avanzado. Consultó a urgencias por la aparición de una masa en la mama izquierda, de unos 6 meses de evolución.
Como antecedentes, el paciente no presentaba alergias, solamente EPOC y psoriasis, con una hermana con neoplasia de mama, desconociendo la edad al diagnóstico.
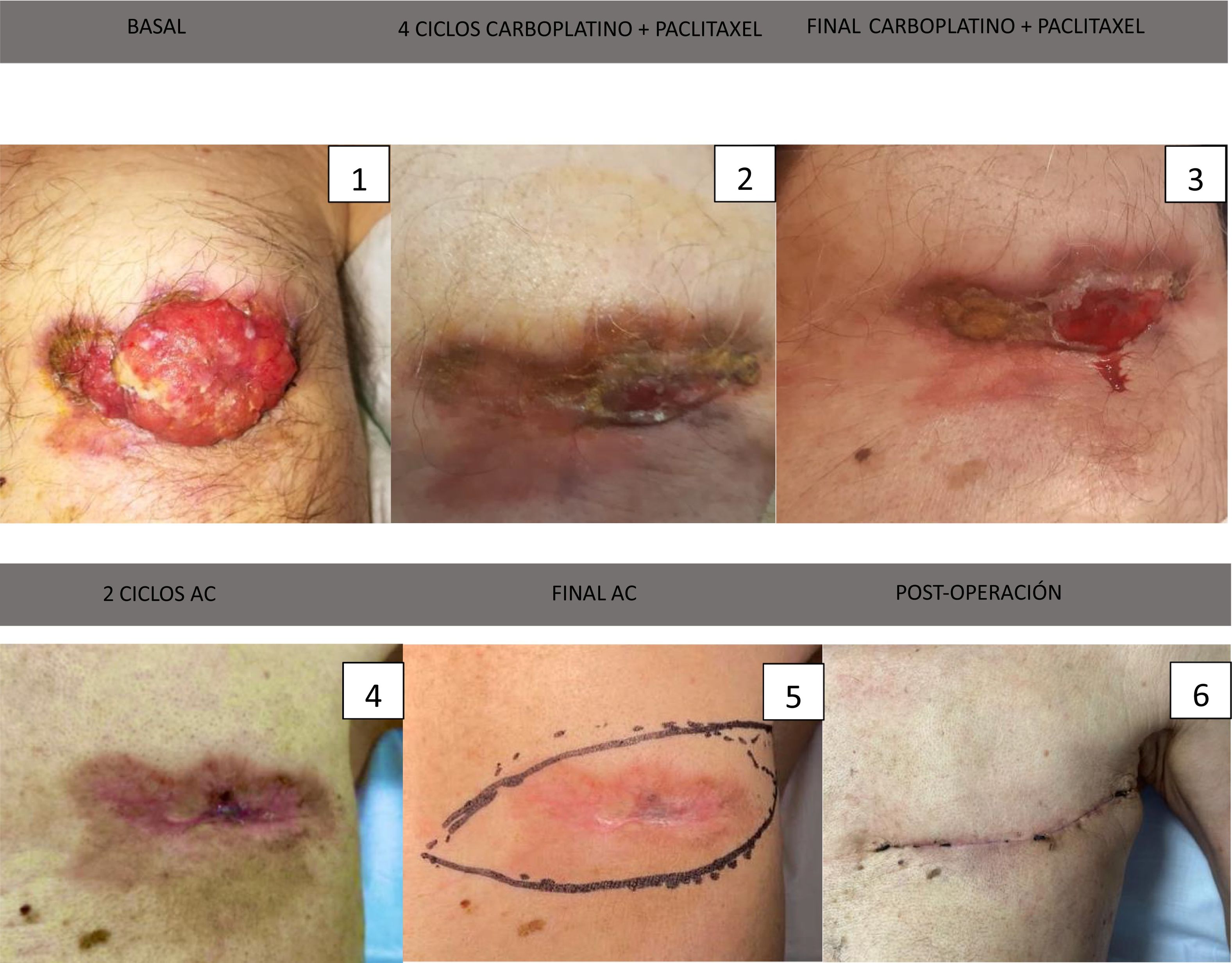
En el examen físico se identificó una gran masa ulcerada con supuración serosanguinolenta en la zona mamaria izquierda, adherida a la pared torácica, mal delimitada, que ocupaba casi toda la mama. Se palpó una adenopatía axilar indurada de unos 4 cm de diámetro y múltiples adenopatías supraclaviculares izquierdas (fig. 1).
La mamografía y la ecografía mamaria identificaron una gran masa tumoral en la mama izquierda con múltiples adenopatías axilares izquierdas patológicas (BI-RADS 5).
Se le realizó una biopsia con aguja gruesa (BAG) de la zona mamaria y axilar. En la BAG de la adenopatía axilar se informó de una infiltración por carcinoma con diferenciación apocrina con imágenes de invasión linfovascular. En la biopsia de la mama izquierda se informó de carcinoma infiltrante con diferenciación apocrina grado histológico 3. En el estudio inmunohistoquímico se mostraron receptores de estrógenos y progesterona negativos, HER2 negativo (1+), E-Cadherina positiva y un índice proliferativo Ki67 del 40%. Clasificación molecular: triple negativo.
La resonancia magnética mamaria mostró una masa neoformativa sólida que ocupaba toda la mama izquierda con componente neoformativo exofítico hipercaptante de contraste de forma heterogénea de 94 x 50 x 60 mm. La lesión infiltraba la piel a nivel anterior. A nivel posterior, estaba en contacto con el músculo pectoral, pero sin signos de infiltración. A nivel axilar se visualizó un conglomerado adenopático en la zona izquierda de aspecto neoformativo e hipercaptante en los niveles I y II de Berg, con adenopatías de 26 mm en el nivel I y una adenopatía en cadena mamaria interna de 6 mm. Estadio clínico cT4b cN3.
En la TAC y la gammagrafía ósea no se mostraron signos metastásicos a distancia.
En el estudio por paneles de genes no se demostró ninguna variante patogénica en los genes analizados. Se realizó análisis de mutaciones puntuales de las regiones codificantes e intrónicas adyacentes de los genes ATM (LRG_135, t1); BRCA1 (LRG_292, t1); BRCA2 (LRG_293, t1); BRIP1 (LRG_300, t1); CHEK2 (NM_007194.3; NG_008150.1); MLH1 (LRG_216, t1); MSH2 (LRG_218, t1); MSH6 (LRG_219, t1); PALB2 (LRG_308, t1); RAD51C (LRG_314, t1) y RAD51D (LRG_516, t1) mediante secuenciación masiva con la plataforma Illumina.
Se comentó el caso en el comité de patología mamaria y se decidió iniciar el tratamiento con neoadyuvancia al tratarse de un tumor localmente avanzado triple negativo.
Se inició la quimioterapia con el esquema carboplatino y paclitaxel por 12 ciclos, seguido de AC (doxorrubicina más ciclofosfamida) por 4 ciclos, los 2 primeros a dosis densas y, debido a neutropenia afebril, los 2 últimos ciclos se realizaron cada 3 semanas.
Una vez finalizado el tratamiento con carboplatino y paclitaxel se evidenció una clara mejoría clínica y en la resonancia magnética se evidenció una respuesta mayor concéntrica. El tamaño del tumor pasó a 17,4 x 15,3 x 7,7 mm y respuesta completa a nivel axilar con persistencia de la adenopatía en la cadena mamaria interna de 6 mm.
Una vez finalizado todo el tratamiento sistémico primario se evidencia una respuesta completa en la mama, axila y mamaria interna por resonancia magnética. En la exploración física no se palpaban tumoraciones, solamente se evidenció la piel debilitada y de coloración rosada (figs. 1 y 2).
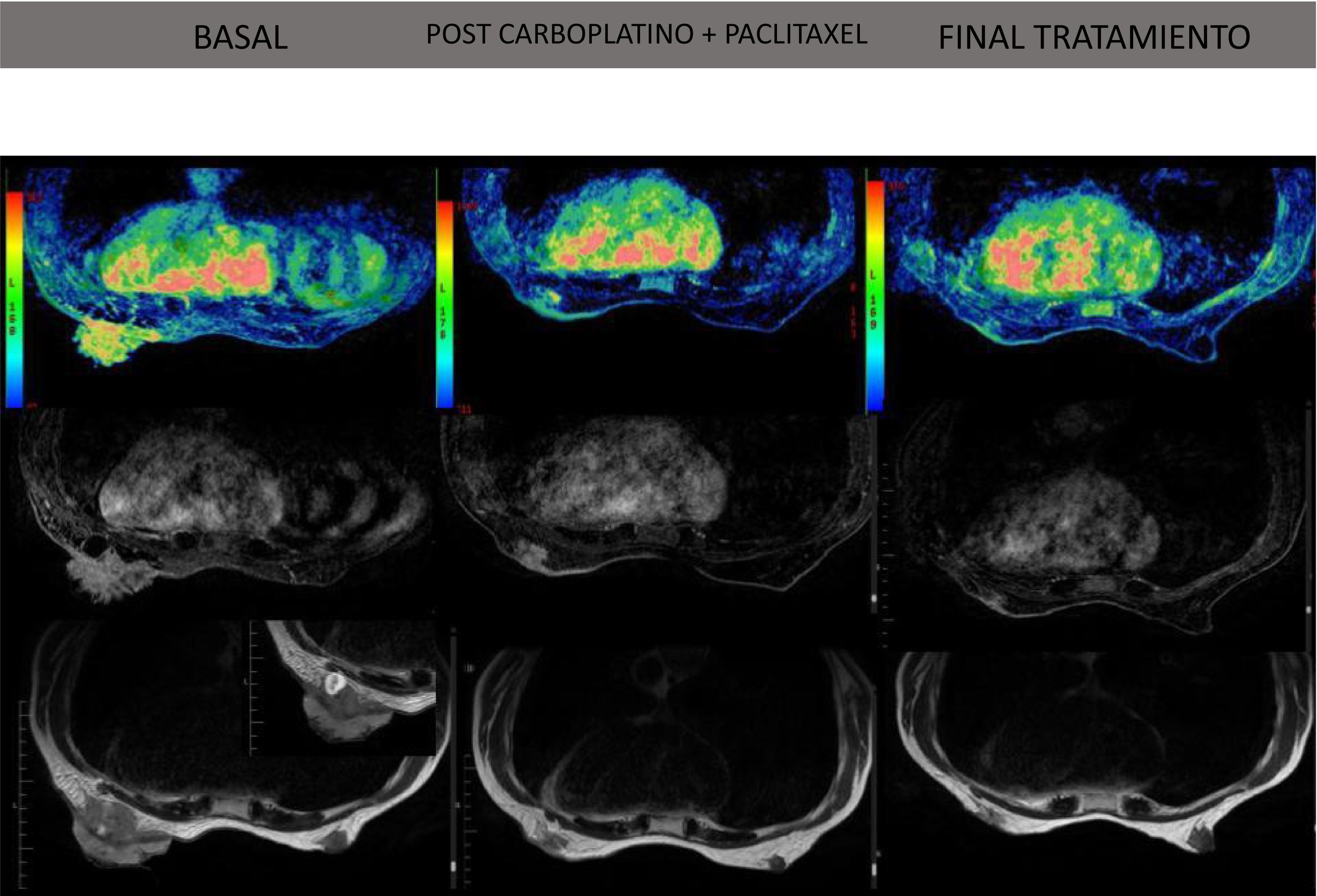
Resonancia magnética donde podemos ver la evolución de la enfermedad a lo largo del tratamiento.
En la primera y segunda fila observamos la secuencia Vibrant con contraste. La última fila es la secuencia basal T2 (es la imagen más anatómica).
Columna 1: estudio basal antes del tratamiento. Observamos una masa exofítica y endofítica irregular, espiculada y digitiforme con áreas necróticas internas. Patrón de captación de contraste heterogéneo. Las medidas de la masa son 94 x 50 x 60 mm.
Columna 2: final del tratamiento con carboplatino y paclitaxel, observamos una respuesta completa ganglionar y respuesta concéntrica mayor en la masa mamaria (17 x 15 x 7 mm).
Columna 3: final del tratamiento con antraciclinas. Respuesta completa mamaria y axilar.
Resonador General Electric Sigma de campo magnético 1.5 Teslas con contraste (Gadobutrol).
Se comentó de nuevo el caso en el comité de mama y se decidió realizar una mastectomía con linfadenectomía, aun teniendo respuesta completa por resonancia, dada la afectación inicial.
Los resultados anatomopatológicos mostraron en la pieza de la mastectomía un carcinoma infiltrante con diferenciación apocrina grado 2 de 40 x 22 x 10 mm sobre un lecho tumoral de 60 x 37 x 20 mm. También carcinoma in situ de alto grado con aislados focos tumorales y márgenes libres. Afectación de la dermis cutánea a nivel de la cicatriz. Metástasis de 2 ganglios linfáticos de los 18 encontrados, estadio TNM ypT2ypN1a. La respuesta tumoral al tratamiento fue de RCB III. El estudio inmunohistoquímico en la pieza fue el mismo que el inicial triple negativo, pero con un Ki67 menor de 5%.
Dado que existía una enfermedad residual postratamiento quimioterápico primario, se decidió realizar tratamiento adyuvante con capecitabina por 6–8 ciclos y radioterapia en la mama y la axila.
El paciente llevó un posoperatorio satisfactorio, sin complicaciones, únicamente seroma que requirió drenaje en 2 ocasiones.
DiscusiónEn los Estados Unidos y en el Reino Unido, el cáncer de mama en el varón (carcinoma infiltrante e in situ) representa entre el 0,5 y el 1% de todos los cánceres diagnosticados cada año1,2.
La incidencia de cáncer de mama en los hombres aumenta con la edad4,5–10.
Como factores de riesgo tenemos los antecedentes familiares, el aumento de estrógenos (por ingesta, disfunción hepática, obesidad, consumo de marihuana, enfermedad tiroidea o síndrome de Klinefelter), afecciones testiculares5,9,11 (orquitis, criptorquidia) y la exposición a radiaciones12,13.
Aproximadamente del 15 al 20% de los hombres con cáncer de mama tienen antecedentes familiares en comparación con solo el 7% de la población general masculina7. Los genes BRCA1 y BRCA2, dan lugar a la mayoría de los casos conocidos de cáncer de mama hereditario, sobre todo con las mutaciones BRCA213–21.
Se diagnostica en una etapa más avanzada que el cáncer de mama femenino, probablemente debido a la ausencia de exámenes de detección de rutina22. No obstante, la mayoría de los hombres son diagnosticados con la enfermedad en un estadio temprano (95%) y solo el 3,8% presenta enfermedad metastásica de novo23.
Suelen manifestarse generalmente con una masa firme e indolora que suele ser subareolar, con afectación del pezón del 40 al 50% de los casos7,24. La mama izquierda se afecta con más frecuencia y menos del 1% de los casos son bilaterales.
Aproximadamente del 85 al 90% de los cánceres de mama en los hombres son carcinomas ductales invasivos7,23, los cánceres lobulillares representan el 0,5 y el 1%25,26. El subtipo histológico lobulillar es menos frecuente debido a la a la falta de acinos y lóbulos en la mama masculina normal.
El CDIS en los hombres ocupa un 7% de todos los cánceres de mama y tiende a ocurrir a una edad más avanzada, se presenta con mayor frecuencia en forma papilar intraductal y es más a menudo de bajo grado27–36. La enfermedad de Paget y el cáncer de mama inflamatorio, rara vez se han descrito en hombres37–40.
El inmunofenotipo más frecuente en el varón es el Luminal-like7,10,25,41.
El diagnóstico diferencial de una masa mamaria en un hombre incluye42: ginecomastia, seudoginecomastia, infecciones, lipoma, hiperplasia estromal seudoangiomatosa, tumor de células granulares, fibromatosis, enfermedad metastásica, schwannoma, miofibroblastoma, fibroadenomas y los hemangiomas.
El tratamiento del cáncer de mama en el hombre es similar al de las mujeres ya que no existen estudios randomizados en hombres30–36.
En los casos con cáncer de mama receptor hormonal positivo, recomendamos la terapia endocrina después de la cirugía. Se prefiere el tamoxifeno, en lugar de un inhibidor de la aromatasa (IA), en ausencia de contraindicaciones43, aunque un IA con GnRHa es una alternativa aceptable. Existe evidencia en estudios retrospectivos de mejoras en la supervivencia global de los hombres con enfermedad con receptores hormonales positivos tratados con tamoxifeno adyuvante44,45.
Las tasas de supervivencia global en hombres son inferiores a la de las mujeres46,47. Esta diferencia se debe a estadios más avanzados y a la mayor edad al diagnóstico, también a una menor esperanza de vida en los varones. Existen estudios que han evaluado la supervivencia en pacientes masculinos con cáncer de mama4,25,48–54.
En general, los hombres tratados por cáncer de mama deben recibir a un seguimiento similar a la de las mujeres. Sin embargo, se desconoce si la mamografía es de utilidad o no. Si bien los pocos estudios reportados sugieren que estos pacientes tienen un mayor riesgo de cáncer de mama contralateral55,56, el riesgo absoluto parece ser bajo57. El cribado sugerido es43 mamografía anual ipsilateral a los hombres tratados con lumpectomía, independientemente de la predisposición genética.
ConclusionesEl cáncer de mama es mucho menos común en los hombres que en las mujeres. Los hombres tienden a presentarse a una edad más avanzada que las mujeres.
Se requiere una biopsia para confirmar el diagnóstico y el análisis de los receptores hormonales y la expresión del receptor HER2, los cuales pueden influir en la selección del tratamiento. El inmunofenotipo que se da con más frecuencia son los Luminal-like.
La mayoría de los hombres con cáncer de mama se tratan de forma similar a las mujeres ya que no existen estudios randomizados solo en la población masculina.
Responsabilidades éticasLos autores declaran que han seguido los protocolos y las guías de actuación según los criterios éticos de su institución y han obtenido los permisos correspondientes.
Consentimiento informadoSe han respetado los derechos de privacidad de la paciente y se cuenta con el consentimiento para la publicación.
FinanciaciónNo se ha recibido financiación para la realización del artículo.
Conflicto de interesesNo existe conflictos de intereses por parte de los autores.