La quimioterapia neoadyuvante (NACT) se ha convertido en el tratamiento estándar para el cáncer de mama de alto riesgo. El estudio patológico de las piezas quirúrgicas post-NACT, siempre complejo y todavía insuficientemente estandarizado, sigue siendo el gold-standard para la evaluación definitiva de la respuesta, cuyos patrones morfológicos deben ser reconocidos. En consecuencia, los patólogos deben identificar los cambios inducidos por la NACT tanto en las células tumorales y estroma asociado al tumor como en el tejido mamario de fondo. El volumen de tumor residual tras NACT es un importante factor pronóstico y se han propuesto distintos métodos para su cuantificación. Los más utilizados son el RCB y el Miller-Payne. Aunque ambos índices son capaces de estratificar la respuesta, el RCB tiene mayor poder predictivo. Ninguno de ellos, sin embargo, aporta información sobre ciertos patrones morfológicos de respuesta poco reconocidos que, aún sin tumor estromal residual, no deben considerarse respuesta patológica completa y cuyo significado biológico y valor pronóstico son controvertidos. Presentamos un caso de respuesta con tumor residual linfovascular puro, caracterización morfológica y diagnóstico diferencial, así como la aplicabilidad de los índices RCB y Miller-Payne en estos casos.
Neoadjuvant chemotherapy (NACT) has become the standard treatment for high-risk breast cancer. The pathological study of post-NACT surgical specimens, always complex and still insufficiently standardised, remains the gold standard for the definitive assessment of response, the morphological patterns of which must be identified. Pathologists, therefore, must identify NACT-induced changes in both tumour cells and tumour-associated stroma, as well as in the background breast tissue. Residual tumour volume after NACT is a significant prognostic factor and different methods have been proposed to quantify it. The most commonly used are the RCB and Miller-Payne systems. Although both indices are capable of stratifying response, the RCB has greater predictive power. Neither, however, provides information on certain poorly recognised morphological response patterns that, even without residual stromal tumour, should not be considered complete pathological response and their biological significance and prognostic value are controversial. We present a case of pure lymphovascular residual tumour response, morphological characterisation, and differential diagnosis, together with the applicability of the RCB and Miller-Payne indices in these cases.
La quimioterapia neoadyuvante (NACT) se ha convertido en el tratamiento estándar para el cáncer de mama de alto riesgo, incluida la enfermedad triple negativa (TNBC) y HER2-positiva, habiéndose alcanzado en la actualidad tasas de respuesta que oscilan en torno al 60%, tanto en la mama como en la axila1.
Las pacientes que alcanzan una respuesta patológica completa, definida por la ausencia de carcinoma infiltrante en la mama y en los ganglios linfáticos, con o sin componente intraductal (CDIS), tienen un pronóstico excelente2.
Las escalas más utilizadas para evaluar la respuesta patológica son el Miller-Payne3 y el Residual Cancer Burden (RCB)4. El primero relaciona la celularidad tumoral residual con la del tumor pre-TSP, tanto en la mama como en la axila, habiéndose demostrado su valor pronóstico. El RCB incluye la medida del lecho tumoral en milímetros y la evaluación minuciosa del porcentaje de células tumorales, tanto in situ como infiltrantes, en cada uno de los bloques incluidos, así como el diámetro mayor de la mayor metástasis ganglionar, medida en milímetros. Es un índice pronóstico y predictivo.
Sin embargo, ocasionalmente se observan patrones morfológicos de respuesta que plantean dilemas diagnósticos, pronósticos y predictivos, y que no acaban de encajar en los índices de medición de respuesta utilizados.
Presentamos un caso con patrón de respuesta infrecuente y discutimos los retos que plantea.
Caso clínicoPaciente de sexo femenino de 47 años, no fumadora, bebedora ocasional. Sin dislipidemia, diabetes mellitus ni hipertensión arterial.
Historia obstétrica: menarquia 12-13. Tres embarazos y un aborto.
Antecedentes oncológicos: prima materna con carcinoma de mama a los 40 años y tío paterno con carcinoma de pulmón a los 65. Estudio genético negativo.
Historia oncológica: consulta por nódulo palpable en la mama izquierda (MI).
Exploración radiológica: RM de la mama izquierda: nódulo de bordes no circunscritos de 21 x 21 x 15 mm en el cuadrante súpero-interno de la mama izquierda (MI). BIRADS 5, cT2N1. Mama derecha sin alteraciones. Se realiza BAV de MI.
Diagnóstico patológico BAV: carcinoma infiltrante NST de la MI, subtipo intrínseco seudo Her2/luminal B.
Intervención terapéutica: inclusión en ensayo clínico Phergain2 (Chemotherapy-free pCR-guided strategy with subcutaneous trastuzumab-pertuzumab and T-DM1 in HER2-positive early breast cancer), que la paciente acepta, con cirugía posterior (mastectomía posterior y biopsia de ganglio centinela si cyN0).
Evaluación radiológica post-NACT: respuesta radiológica completa en la mama y la axila.
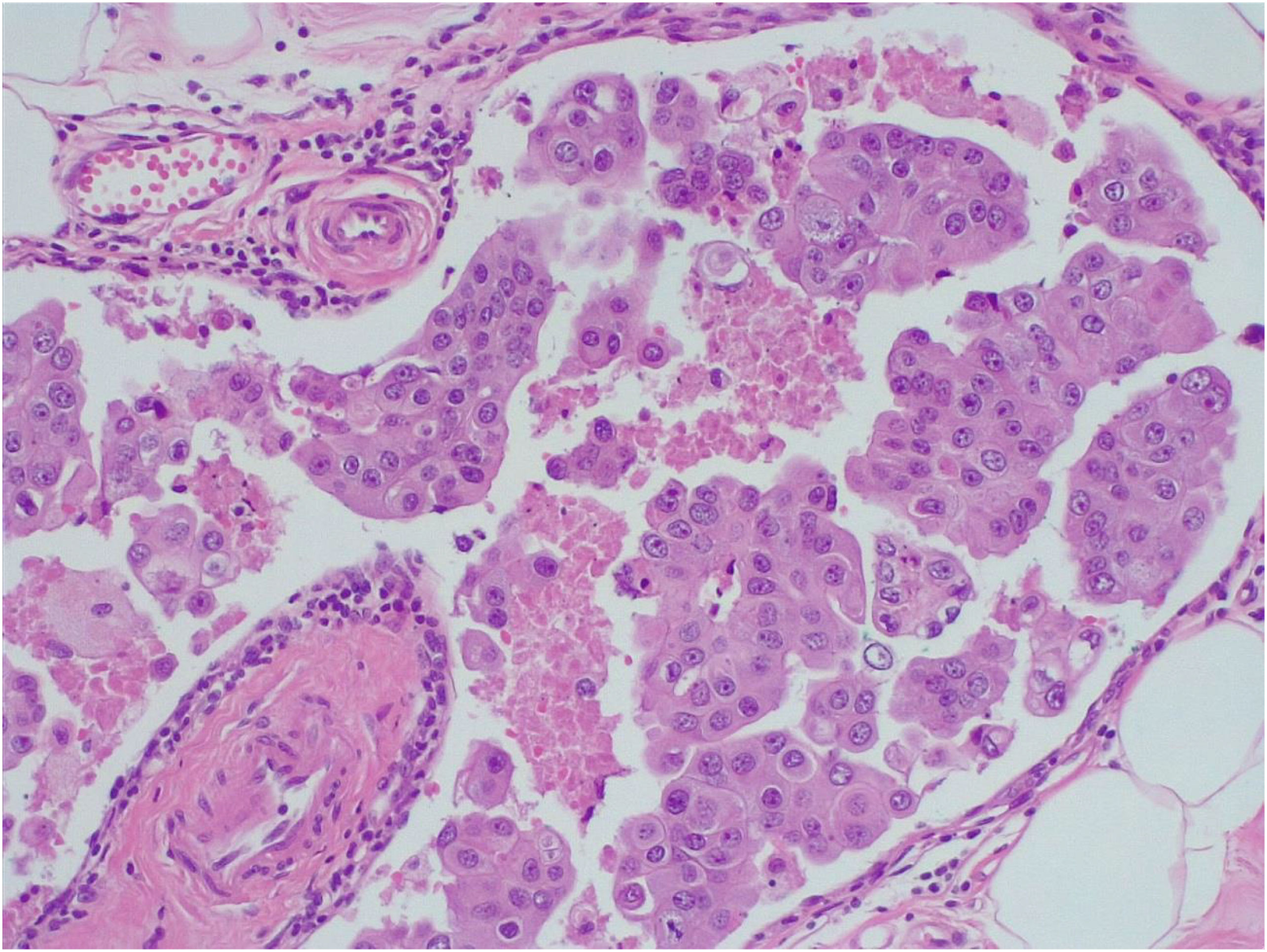
Diagnóstico patológico de la pieza quirúrgica: tumorectomía izquierda post-NACT de 10,4 x 7 x 1,9 cm, marcada con clip de hidrogel. Macroscópicamente, no se identifica el lecho tumoral. Microscópicamente, ausencia de tumor estromal residual, in situ ni infiltrante. Se identificó infiltración linfovascular extensa por carcinoma de mama. Las células tumorales eran de citoplasma amplio y eosinófilo con núcleos atípicos y nucleolos prominentes. Se disponían formando nidos sólidos o estructuras micropapilares intravasculares (fig. 1). El diámetro de los vasos embolizados oscilaba entre 2 y 3 mm. El inmunofenotipo del tumor residual fue seudo Her2/ luminal A, distinto al del tumor original en la expresión de RP (negativo en el tumor original y 70%, intensidad 3/3 en el tumor residual).
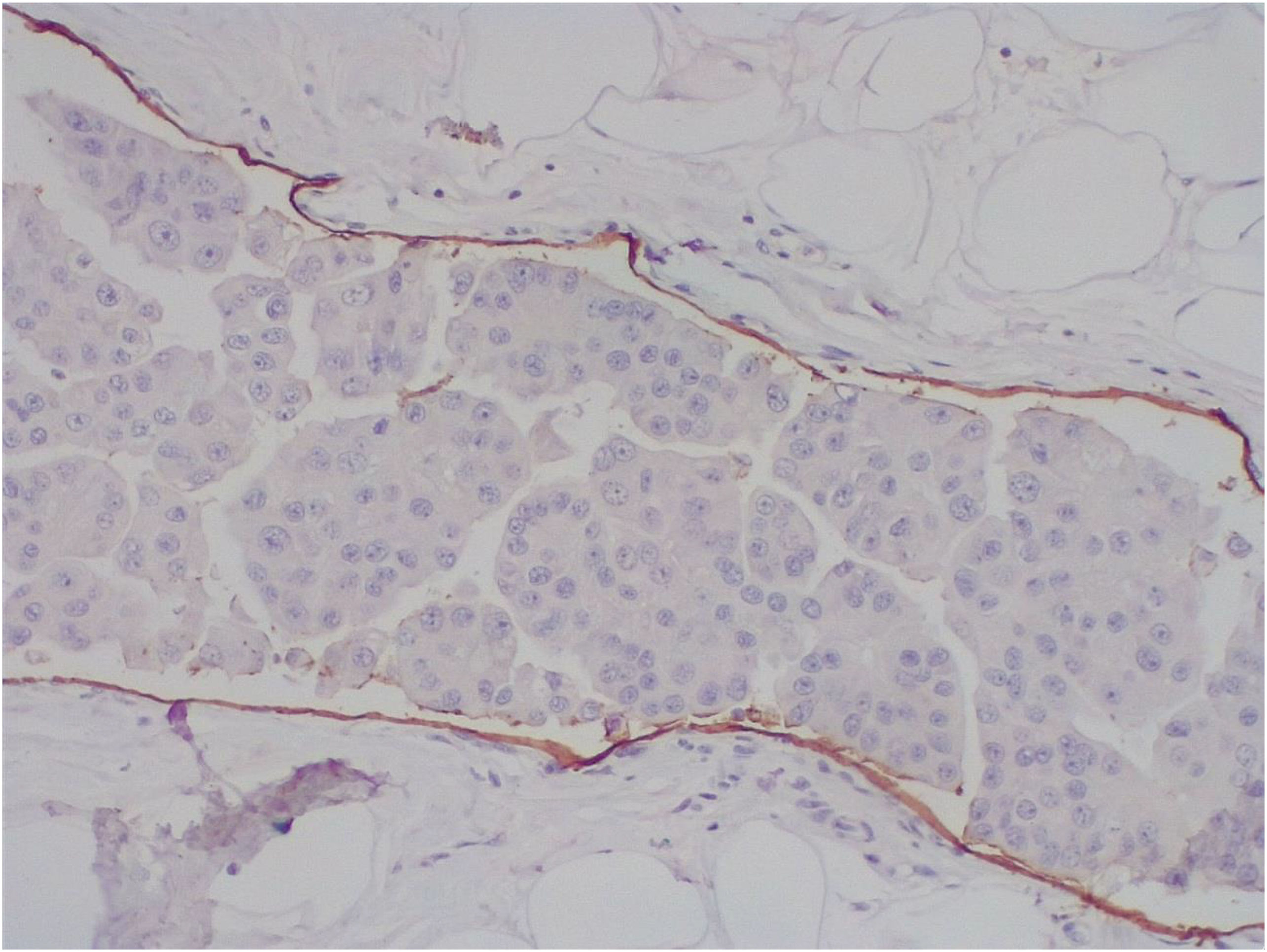
El tapizamiento endotelial de los vasos fue inmunohistoquímicamente (IHQ) positivo para D240 (fig. 2) y CD31, demostrando su origen vascular y linfático. Se identificaron 2 ganglios centinelas en cuyo estudio OSNA se mostró menos de 160 copias de ARNm-citoqueratina 19/ul (negativos para metástasis).
Conclusión diagnóstica: ausencia de respuesta patológica completa, pyTx N0 L/V1 G3. RCB: no aplica. Miller-Payne: no aplica.
Seguimiento: dada la evidencia de tumor residual, se solicitó tratamiento con TDM-1. Actualmente, tras 3 meses de seguimiento, la paciente está viva y sigue en tratamiento.
DiscusiónLa respuesta patológica completa (RpC) tras NACT es considerada un factor de buen pronóstico.
Aunque la RM es una prueba excelente para evaluar la respuesta post-NACT, todavía existen discordancias entre los hallazgos radiológicos y el estudio patológico de la pieza quirúrgica, atribuibles, fundamentalmente, a áreas de captación no-masa, mutifocalidad/multicentricidad en la RM pre-TSP, tumores estrogénicos y bajo grado nuclear, que se asocian de manera significativa a falsos negativos en la valoración de la respuesta radiológica. Por otra parte, los casos falsos positivos (FP) pueden ser debidos a tejido de granulación con abundante vascularización y células inflamatorias y necrosis secundarias a la TSP5.
En este contexto, el diagnóstico patológico de las piezas quirúrgicas post-TSP sigue siendo el gold-standard6. Sin embargo, el estudio macro y microscópico de dichas piezas es complejo y puede constituir un reto para el patólogo, especialmente cuando no es posible la identificación macroscópica del lecho tumoral. Por otro lado, microscópicamente, los cambios regresivos, caracterizados por fibrosis, cambios mixoides del estroma, microcalcificaciones e inflamación pueden enmascarar algunas veces la observación del carcinoma residual cuando es de pequeño tamaño. El marcaje de la lesión pre-TSP es imperativo, en este contexto, para que el patólogo pueda identificar de manera inequívoca el/las área/s de interés.
Nuestro caso es un ejemplo de discordancia radio-patológica post-NACT debido a un patrón morfológico de respuesta muy inusual, FN en las pruebas de imagen, consistente en ausencia de carcinoma infiltrante e in situ estromal con extensa infiltración linfovascular tanto en la zona con cambios microscópicos atribuibles a lecho tumoral (marcada con clip) como en el resto de la pieza. Revisada la literatura, hemos encontrado solo 27 casos descritos con ese patrón de respuesta7–10.
La imagen histológica plantea el diagnóstico diferencial entre carcinoma in situ, linfoma y retracción del estroma alrededor de los nidos de carcinoma infiltrante estromal fundamentalmente. Las técnicas IHQ son fundamentales para llegar al diagnóstico correcto.
Se ha demostrado que la invasión linfovascular en asociación con carcinoma infiltrante después de TSP es un factor predictivo independiente de supervivencia10.
El valor pronóstico de la invasión linfovascular (ILV) pura, sin tumor estromal, es controvertido. Hasta donde alcanza nuestro conocimiento, los 2 primeros estudios describen 12 pacientes de los cuales 9 fallecieron por cáncer de mama, la mayoría de ellos en los primeros 4 años de seguimiento9–11.
Sin embargo, un estudio posterior7 describe que, en general, las pacientes tuvieron un pronóstico favorable, con un 72% (13/18 pacientes) vivas y libres de enfermedad en un seguimiento medio de 63,8 meses.
Ello puede ser debido a diferencias en el tratamiento de las pacientes, ya que los criterios de indicación para TSP aplican actualmente a un número mucho mayor de pacientes que hace unos años (en los que solo aplicaba a tumores localmente avanzados), a diferencias en el tamaño del tumor o a diferencias en subtipo intrínseco.
De manera similar, algunos estudios encuentran una fuerte asociación entre este patrón de respuesta y la sobreexpresión de Her212, mientras que otros autores no confirman esta relación13. También se ha publicado una asociación entre presencia de ILV y el número de ganglios linfáticos afectos14, asociación que, en nuestro caso, tampoco se pudo demostrar.
Los mecanismos moleculares que subyacen en la ILV en el carcinoma infiltrante de mama están aún mal comprendidos, aunque parece desarrollarse a través de mecanismos moleculares complejos relacionados con el microambiente de las células endoteliales y con la adquisición de habilidades invasivas y de migración por parte de las células tumorales. En el escenario pre-TSP, se han identificado 86 genes diferencialmente expresados en carcinoma de mama con ILV. Entre ellos, EPAS1 que estimula la producción de VEGF y TNFSF11, ambos facilitadores de la invasión, migración y metástasis. Hasta donde alcanza nuestro conocimiento, no hay datos al respecto en el escenario de la respuesta ILV pura o predominante post-TSP y no se ha detectado aún una firma genética ni proteómica que pueda relacionarse con la ILV15.
La octava edición del manual de estadificación del cáncer de la AJCC16, en oposición al criterio de la séptima edición, recomienda no considerar la ILV pura como respuesta patológica completa, aunque no propone una categoría «T» para este hallazgo. Ciertos autores proponen una clasificación T especial de «TX-IVL» para la ILV pura, a fin de identificar prospectivamente a pacientes adicionales mediante búsquedas basadas en texto, lo que permitiría una evaluación más sólida de la importancia pronóstica de este patrón de respuesta.
En nuestra opinión, independientemente de la respuesta axilar (ypN), la clasificación «ypT0» del ypTNM implica ausencia de células tumorales en la mama, concepto que no refleja la observación de «invasión linfovascular pura», cuyo diagnóstico y pronóstico no deben equipararse, con base en el conocimiento actual, al de la respuesta completa patológica post-ACT («ypT0»).
Interesante reseñar que los índices de respuesta RCB y Miller-Payne evalúan el volumen residual de tumor estromal post-NACT, por lo que consideramos que no aplican en los casos con ILV pura al no identificarse tumor estromal residual en ese patrón de respuesta post-NACT.
En nuestra opinión, la clasificación «ypT0» del ypTNM implica ausencia de células tumorales en la mama, concepto que no refleja la observación de «invasión linfovascular pura», cuyo diagnóstico ni pronóstico deben, con base en el conocimiento actual, equipararse al de la respuesta completa patológica post-NACT.
En conclusión, el ILV residual puro (sin infiltración estromal) es un patrón poco frecuente de enfermedad residual tras la TSP que no debe ser considerado, en ningún caso, como respuesta patológica completa, lo cual ofrece opciones terapéuticas adicionales que pueden mejorar el pronóstico de las pacientes post-TSP.
En nuestro caso, la paciente se halla libre de enfermedad con terapia TD-M1 adicional tras 3 meses de seguimiento.
Responsabilidades éticasLos autores declaran que han seguido las Guías CARE para el desarrollo de esta publicación.
Consentimiento informadoSolicitamos exención del consentimiento informado ya que la publicación de este manuscrito incluye un caso anonimizado, que no implica ningún cambio en el manejo de la paciente y que es difícil contactar con la misma en este momento.
FinanciaciónLos autores declaran que no han recibido ningún tipo de financiación para la preparación de este manuscrito
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de interés.