El tratamiento neoadyuvante es una práctica estándar en las pacientes con cáncer de mama, que permite realizar cirugías más conservadoras, aporta información pronóstica adicional y es muy útil para evaluar la eficacia de los fármacos. Los patólogos tienen una gran importancia en este contexto. La evaluación del tumor en la biopsia diagnóstica es esencial para una correcta selección de las pacientes candidatas a terapia neoadyuvante. Para estandarizar el manejo y la evaluación patológica de las piezas de la mama y la axila que han recibido este tratamiento, se ha establecido una definición homogénea de respuesta patológica completa y en el caso de existir una enfermedad residual, se recomienda su cuantificación mediante el sistema RCB por ser un método objetivo, reproducible y clínicamente útil. El muestreo de estas piezas y su estudio microscópico, debe poder aportar los datos necesarios para el diagnóstico correcto de la respuesta patológica completa y para poder cuantificar la carga tumoral residual.
Neoadjuvant treatment is a standard practice in patients with breast cancer that allows to perform more conservative surgeries, provides additional prognostic information and is very useful for evaluating the efficacy of drugs. Pathologists are of great importance in this context. The evaluation of the tumor in diagnostic biopsy is essential for a correct selection of patients who are candidates for neoadjuvant therapy. In order to standardize the management and pathological evaluation of breast and axillary specimens that have received treatment, a homogeneous definition of complete pathological response has been established and, in the case of residual disease, its quantification using the RCB system is recommended because it is objective, reproducible and clinically useful. The sampling of these specimens and the subsequent microscopic study should be able to provide the necessary data for the correct diagnosis of the complete pathological response and to be able to quantify the residual cancer burden (RCB).
Cualquier paciente que vaya a recibir un tratamiento sistémico adyuvante (después de la cirugía) para el cáncer de mama (CM), puede recibir el mismo tratamiento de forma neoadyuvante antes de la cirugía. En ambos casos, la eficacia del tratamiento sistémico es similar y no existen diferencias en la supervivencia1.
Inicialmente el tratamiento neoadyuvante (TNA) se empleó en los tumores localmente avanzados buscando la posibilidad de una cirugía en las lesiones que eran previamente irresecables. Con los años, la reducción en el tamaño tumoral por efecto de la respuesta a la terapia sistémica primaria se ha utilizado con frecuencia creciente en las pacientes con CM precoz para transformar cirugías radicales en cirugías conservadoras, y para reducir en estas últimas el volumen de tejido extirpado buscando mejores resultados estéticos2. Algunos estudios encuentran una reducción en las tasas de reintervenciones por bordes afectos tras cirugías conservadoras en las pacientes tratadas con el TNA, independientemente del estadio de la enfermedad y del subtipo molecular3. Sin embargo, otros análisis describen mayor frecuencia de recurrencias locales tras una cirugía conservadora, pero sin impactar en la supervivencia global1. La respuesta a nivel ganglionar con la eliminación de las metástasis axilares presentes al diagnóstico también permite desescalar la cirugía axilar, reduciendo su morbilidad e incrementando la calidad de vida de las pacientes4.
En la práctica clínica, el abordaje neoadyuvante permite iniciar de forma inmediata tratamientos sistémicos potencialmente curativos sin necesidad de esperar a la recuperación tras la cirugía, lo que puede ser de gran importancia, especialmente en las pacientes con tumores de crecimiento rápido.
El TNA ofrece además otras ventajas evidentes frente al abordaje adyuvante convencional: permite evaluar objetivamente la eficacia de los fármacos empleados, proporcionando información pronóstica en función del grado de respuesta al tratamiento. La respuesta patológica completa (RPC) tras el TNA se asocia con una mejor supervivencia para todos los subtipos de CM, y especialmente para la enfermedad triple negativa (TN) y HER2+5–8. Por ello, la U.S. Food and Drug Administration aprobó en 2014 el uso de la RPC como indicador subrogado de supervivencia para los ensayos clínicos de neoadyuvancia en CM de alto riesgo9. Así, la RPC puede emplearse como objetivo primario de estos ensayos clínicos sustituyendo a la mejora en la supervivencia. Los ensayos con el TNA permiten obtener resultados clínicamente objetivos en pocos meses, tratando a grupos seleccionados de pocas pacientes y, al utilizar la RPC como objetivo, la evidencia de eficacia de un tratamiento permite la aprobación acelerada de fármacos que benefician a las pacientes de alto riesgo en un marco temporal mucho más corto que el requerido en los ensayos clínicos tradicionales, cuyo objetivo es demostrar una mejoría en la supervivencia tras seguimientos a largo plazo. En la situación contraria, las pacientes con enfermedad residual tras el TNA asocian un peor pronóstico, lo que define una nueva categoría de pacientes de «alto riesgo» a las que se pueden aplicar nuevas estrategias como el seguir con un tratamiento sistémico adyuvante posterior a la cirugía, seleccionando nuevos fármacos que eviten terapias inefectivas e incluso introduciendo nuevos ensayos clínicos en este contexto10,11.
En investigación, la neoadyuvancia es un modelo perfecto para el desarrollo de nuevos fármacos, y el estudio de biomarcadores predictivos de respuesta que pueden ser analizados «in vivo» permite avanzar en el conocimiento de la biología del CM.
En consonancia con lo expuesto anteriormente, diferentes guías clínicas establecen que el TNA es el tratamiento de elección para las pacientes con carcinoma de mama inflamatorio, irresecable o localmente avanzado, pero también debe ofrecerse para reducir la extensión de la cirugía tanto en la mama como en la axila, así como a las pacientes con carcinomas TN o HER2+ de alto riesgo en las que el hallazgo de enfermedad residual haga recomendable un tratamiento adyuvante posterior12,13. El TNA debe considerarse, por tanto, como una opción terapéutica para el CM localizado, y resulta ser una potente herramienta para comprender la biología de este cáncer y para la investigación de nuevas aproximaciones terapéuticas14.
La instauración de la neoadyuvancia, no solo en el contexto de ensayos clínicos sino también en la práctica clínica de rutina, y la trascendencia de sus resultados sobre el manejo de las pacientes obliga a una estandarización de la evaluación de las piezas de CM tratadas con el TNA, estableciendo una definición homogénea de RPC, definiendo criterios mínimos para el muestreo y estudio de las piezas, y estableciendo sistemas validados y reproducibles de evaluación de la respuesta15–17.
Selección de las pacientes para el tratamiento neoadyuvanteLas decisiones sobre las necesidades terapéuticas en CM se toman, para cada paciente, evaluando factores pronósticos y predictivos, tanto clínico-radiológicos (tamaño tumoral, estado ganglionar), como patológicos (tipo y grado histológico, receptores hormonales, HER2, Ki67). La biopsia con aguja gruesa (BAG) proporciona un material adecuado para el diagnóstico y la evaluación de los biomarcadores tumorales. Los patólogos debemos ser conscientes de que nuestros informes son decisivos para la selección terapéutica, lo que obliga a asegurar la calidad de las determinaciones.
Es también esencial la participación en comités multidisciplinares para la toma de decisiones. En el TNA los patólogos participamos en primera instancia, pues la información proporcionada por la BAG permite seleccionar el tratamiento. Todo informe de biopsia de un CM debe contener como información mínima un diagnóstico inequívoco de carcinoma invasivo, junto con el grado histológico y los biomarcadores esenciales: receptor de estrógenos (ER), receptor de progesterona (PR), Ki67 y HER218. La calidad de los resultados en el análisis de estos biomarcadores requiere del empleo de controles adecuados y deben seguirse las guías internacionales para su determinación. Además, deben ajustarse los tiempos de demora diagnóstica para no retrasar el inicio del tratamiento.
La respuesta al TNA incluyendo la posibilidad de alcanzar una RPC está estrechamente relacionada con la biología tumoral5–8. Los subtipos de CM con mayores tasas de respuesta, y por tanto, con mayor beneficio del TNA son los HER2+ y los TN. En los carcinomas HER2+ la respuesta depende del estado de los receptores hormonales, de forma que en las pacientes con tumores ER-negativos se consigue hasta un 60% de RPC cuando se añade trastuzumab a la quimioterapia estándar6–8 e incluso alcanzan el 80% con doble bloqueo anti-HER2 (trastuzumab y pertuzumab)19. Los carcinomas TN constituyen un grupo muy heterogéneo, pero en conjunto alcanzan tasas de RPC tras el TNA del 40-45%, con una fuerte asociación a una mejor supervivencia6–8. Los tumores luminales (ER+) presentan tasas bajas de RPC (0-15%) pero mantienen un buen pronóstico en los casos de enfermedad residual tras el TNA debido a la respuesta al tratamiento endocrino adyuvante6–8. El uso de plataformas de expresión génica sobre el tumor presente en la BAG diagnóstica puede ayudar a una mejor precisión en la selección de las pacientes candidatas al TNA20,21.
En las últimas décadas han sido muchos los estudios que han confirmado el valor pronóstico de los linfocitos intratumorales (Tumor-infiltrating lymphocytes, TIL) en CM, y se ha podido demostrar que altos niveles de TIL en el tumor primario son predictores de RPC tras el TNA sobre todo en los subtipos TN y HER2+22–24.
En toda paciente candidata a recibir el TNA es necesario dejar alojado un marcador radiológico en el tumor en el momento de la toma de biopsias (o varios marcadores si las lesiones son múltiples), incluso aunque se planifique una mastectomía11. Estos marcadores permiten localizar el tumor en las técnicas de imagen que se realicen para evaluar la respuesta al TNA, así como la colocación de arpones o semillas radioactivas para guiar la cirugía conservadora, y facilitan al patólogo la localización del tumor o del lecho tumoral en el análisis de las piezas de resección tras el TNA15–17.
La afectación ganglionar axilar al diagnóstico es un parámetro clásico para seleccionar a las pacientes candidatas al TNA. Las guías recomiendan evaluar ecográficamente la axila al mismo tiempo que la mama en cualquier paciente con sospecha de cáncer, tomando muestras mediante PAAF o BAG en caso de identificar ganglios morfológicamente anormales, y dejando también alojados marcadores radiológicos en los ganglios biopsiados si se plantea realizar el TNA4,15,16.
Definición de la respuesta patológica completaEl empleo de diferentes definiciones para la RPC ha dificultado la comparación de resultados entre los ensayos clínicos en neoadyuvancia. Para poder estandarizar los estudios se recomienda considerar como RPC la ausencia de carcinoma invasivo residual tanto en la mama como en todos los ganglios linfáticos muestreados tras el TNA: ypT0/ypTis ypN0 utilizando la nomenclatura de la American Joint Committee on Cancer (AJCC) para la estadificación TNM, con el prefijo «y» para indicar que se determina tras el TNA25.
Cualquier enfermedad residual en la axila, incluyendo las células tumorales aisladas (CTA) y las micrometástasis, se asocia con un peor pronóstico independientemente de la respuesta en la mama5,26–28. Por este motivo la identificación de CTA, aunque tienen un estadio ypN0(i+), no se consideran RPC15,16,25.
Existen más controversias con respecto al carcinoma ductal in situ (CDIS) residual tras el TNA. Algunos estudios no encuentran diferencias en supervivencia entre la RPC y CDIS residual6,29, mientras que en otras series el CDIS residual asocia una peor supervivencia libre de enfermedad (DFS) aunque no influye en la supervivencia global (OS)5.
Una situación rara pero problemática es la identificación de la invasión linfovascular (ILV) en ausencia de carcinoma invasivo residual. Aunque la estadificación en esta situación es ypN0, tampoco se considera como RPC15,16, y en algunas series se asocia con un peor pronóstico30.
Sistemas de evaluación de la respuesta al tratamiento neadyuvanteHay 2 formas principales de evaluar la respuesta al TNA. La primera consiste en comparar la celularidad tumoral antes y después del tratamiento. La reducción en la celularidad tras el TNA se considera una respuesta y asocia una mejor supervivencia, y es la base del sistema de gradación de Miller-Payne31, que ha sido tradicionalmente uno de los más utilizados por los patólogos para evaluar la respuesta al TNA. Requiere conocer el grado de celularidad tumoral presente en la biopsia diagnóstica, tiene un alto nivel de subjetividad y no tiene en cuenta ni el tamaño tumoral ni el estado ganglionar.
La segunda aproximación consiste en cuantificar la enfermedad residual tras el TNA analizando el tamaño y el grado de celularidad invasiva residual. El principal ejemplo es el sistema de cuantificación de la carga tumoral residual (RCB, residual cancer burden) propuesto por Symmans et al.32. Se basa en la medición objetiva de variables obtenidas del estudio de la pieza de mama y los ganglios resecados tras el TNA: tamaño máximo del tumor invasivo residual medido en 2 dimensiones, porcentaje del área tumoral ocupado por celularidad residual, porcentaje de enfermedad residual que es in situ, número de ganglios positivos y tamaño de la metástasis mayor. Estos parámetros se combinan en un algoritmo accesible online (http://www.mdanderson.org/breastcancer_RCB) en forma de una sencilla calculadora que proporciona un índice RCB como variable continua, y 3 categorías desde RCB-I (mínima enfermedad residual) a RCB-III (mala respuesta) que demuestran tener valor pronóstico32. En la misma página web se proporcionan manuales y herramientas para una correcta determinación del RCB.
Este método es actualmente el más utilizado. Ha sido validado, es simple y reproducible33, y ha demostrado una potente correlación con el pronóstico para todos los subtipos moleculares, que se mantiene a largo plazo34. Por estos motivos el manual de estadificación del cáncer AJCC en su 8° edición recomienda emplear el método RCB, que proporciona una información cuantitativa complementaria a la de la clasificación ypTNM25. También lo recomienda la 5° edición de la Clasificación de los Tumores de Mama de la OMS, por ser un sistema estandarizado y clínicamente validado que incorpora la respuesta tanto en la mama como en los ganglios en un sistema de puntuación que puede ser combinado con otros factores pronósticos emergentes35.
Un reciente metaanálisis incluyendo datos de más de 5.000 pacientes con seguimiento a largo plazo, confirma el valor pronóstico independiente del RCB, apoyando el empleo de este sistema de evaluación de respuesta como parte del informe anatomopatológico estandarizado del CM tras el TNA8.
Estudio macroscópico de piezas de mama y axila tras el tratamiento neoadyuvanteLas piezas de resección tras el TNA son probablemente las más complejas en la práctica de la enfermedad mamaria, siendo necesario un detallado estudio macroscópico y una correcta selección de las muestras para poder determinar con precisión la existencia de RPC, la evaluación de la respuesta y la estadificación tumoral.
En primer lugar, es necesaria la colaboración del equipo multidisciplinar, pues el patólogo debe disponer de una información clínica adecuada para evaluar cada pieza. Además de saber que la paciente ha recibido tratamiento, la información mínima incluye la localización, el número y el tamaño del tumor, así como la presencia y el tipo de marcadores radiológicos. Es también importante conocer el estado ganglionar previo al tratamiento, el grado de respuesta clínico-radiológica al TNA tanto en la mama como en la axila, y las características del tumor primario15,16.
El estudio patológico de estas piezas debe permitir evaluar que la cirugía ha sido adecuada, identificando el tumor residual o en su defecto el lecho tumoral. Para informar con garantías la RPC se debe muestrear correctamente la zona afecta inicialmente por el tumor, y en caso de enfermedad residual debe determinarse su extensión, así como el estado de los márgenes. Las premisas básicas utilizadas en el manejo de piezas quirúrgicas de mama, incluidas las condiciones preanalíticas, se mantienen tras el TNA. Las piezas grandes deben seccionarse en fresco para asegurar su correcta fijación.
La extensión del muestreo debe estar guiada por la información clínico-radiológica sobre el tumor primario. Un muestreo selectivo y dirigido por esta información es más adecuado y efectivo que un muestro aleatorizado de un número predeterminado de bloques. Las muestras deben incluir no solo la zona o zonas con alteración macroscópica, o alrededor de un marcador radiológico, sino toda el área con posible afectación por el tumor antes del tratamiento.
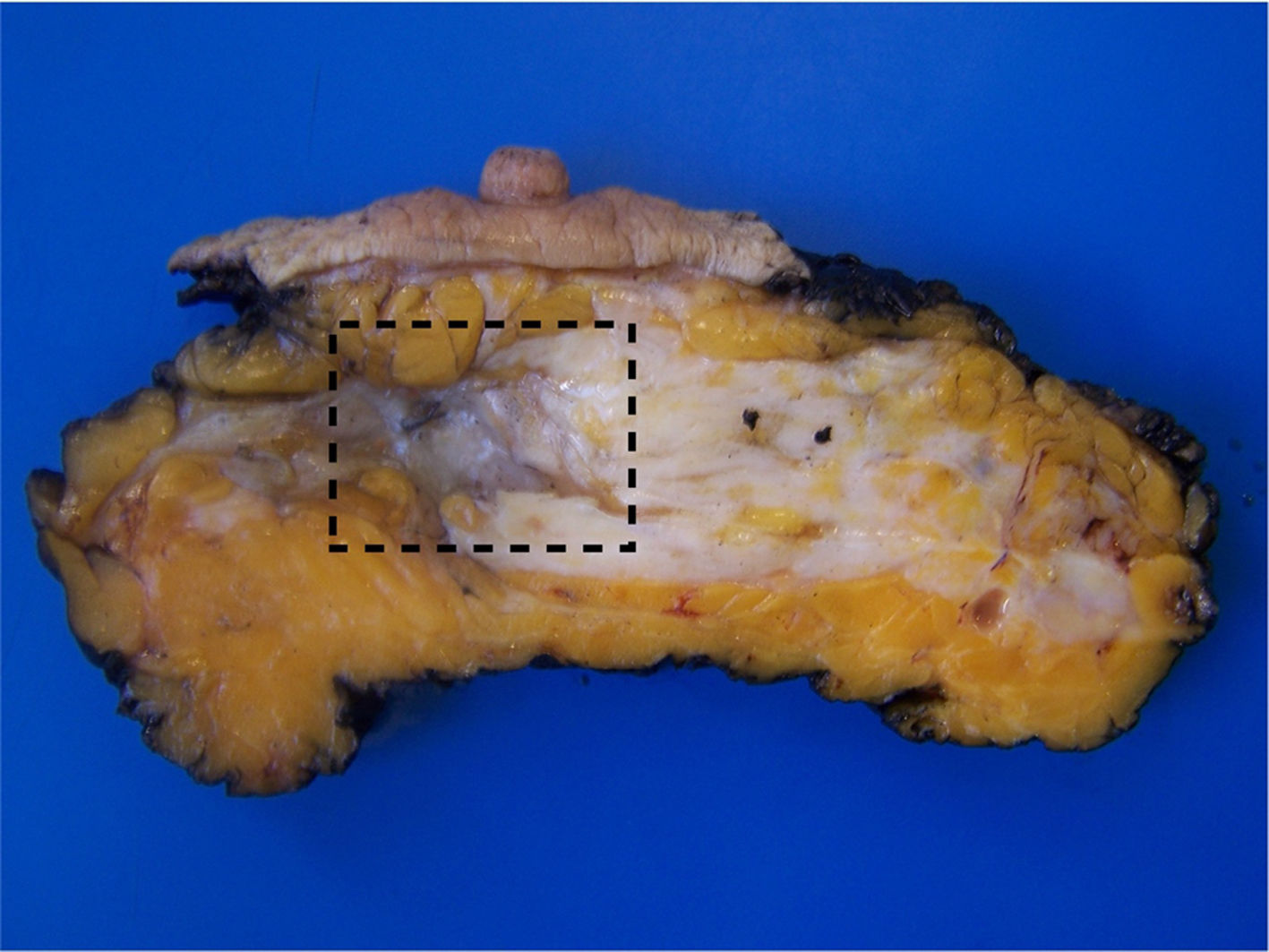
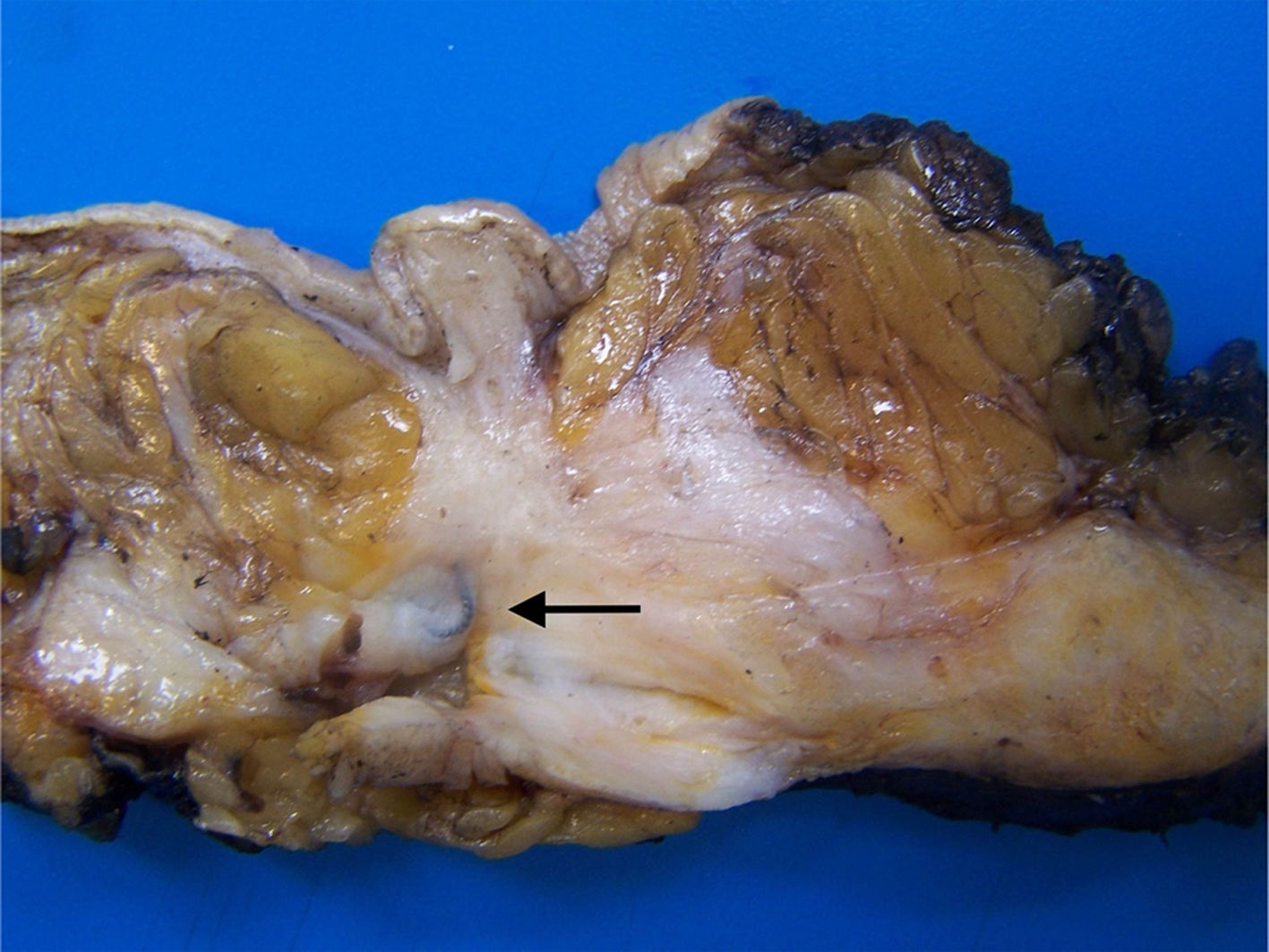
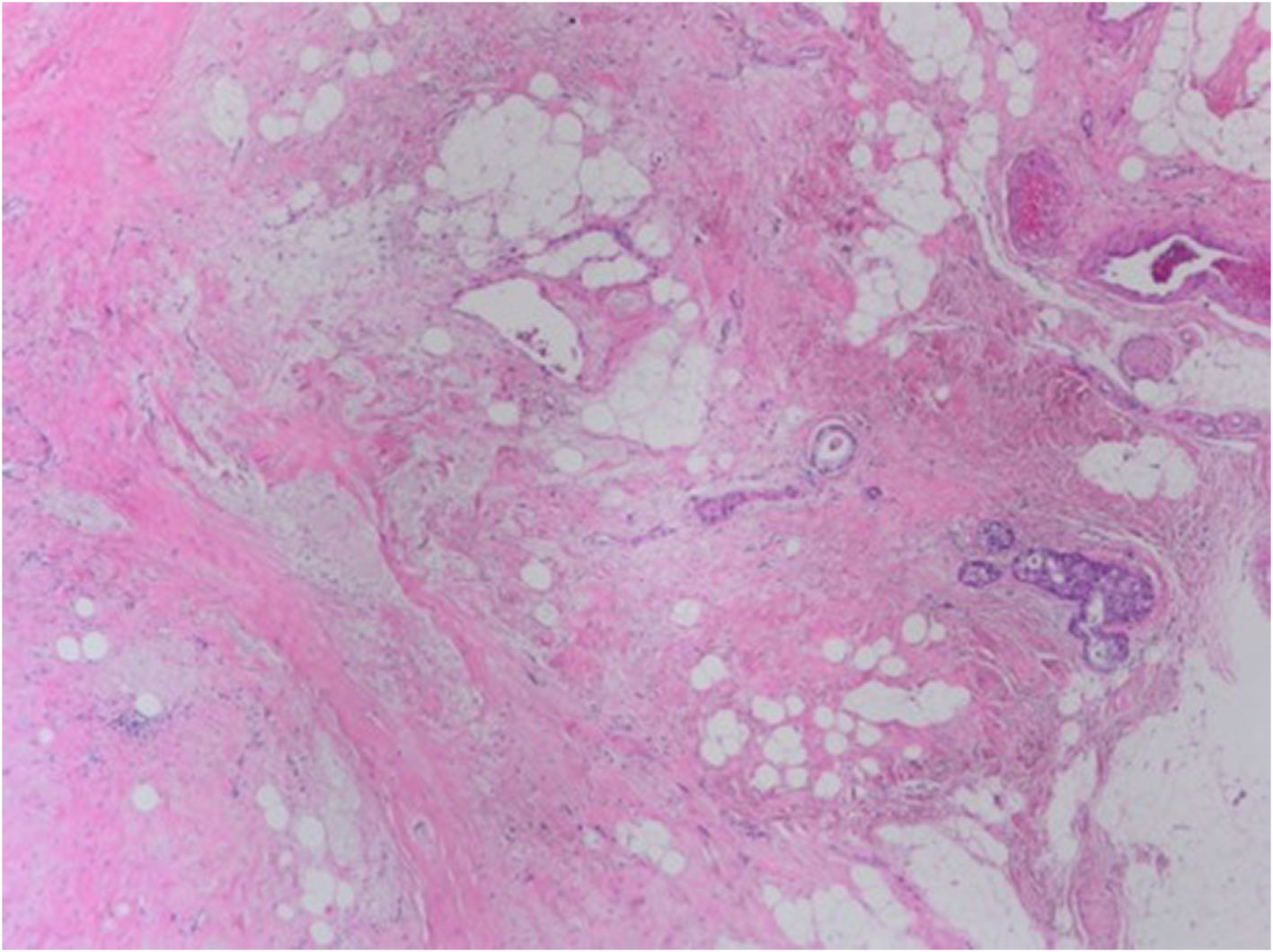
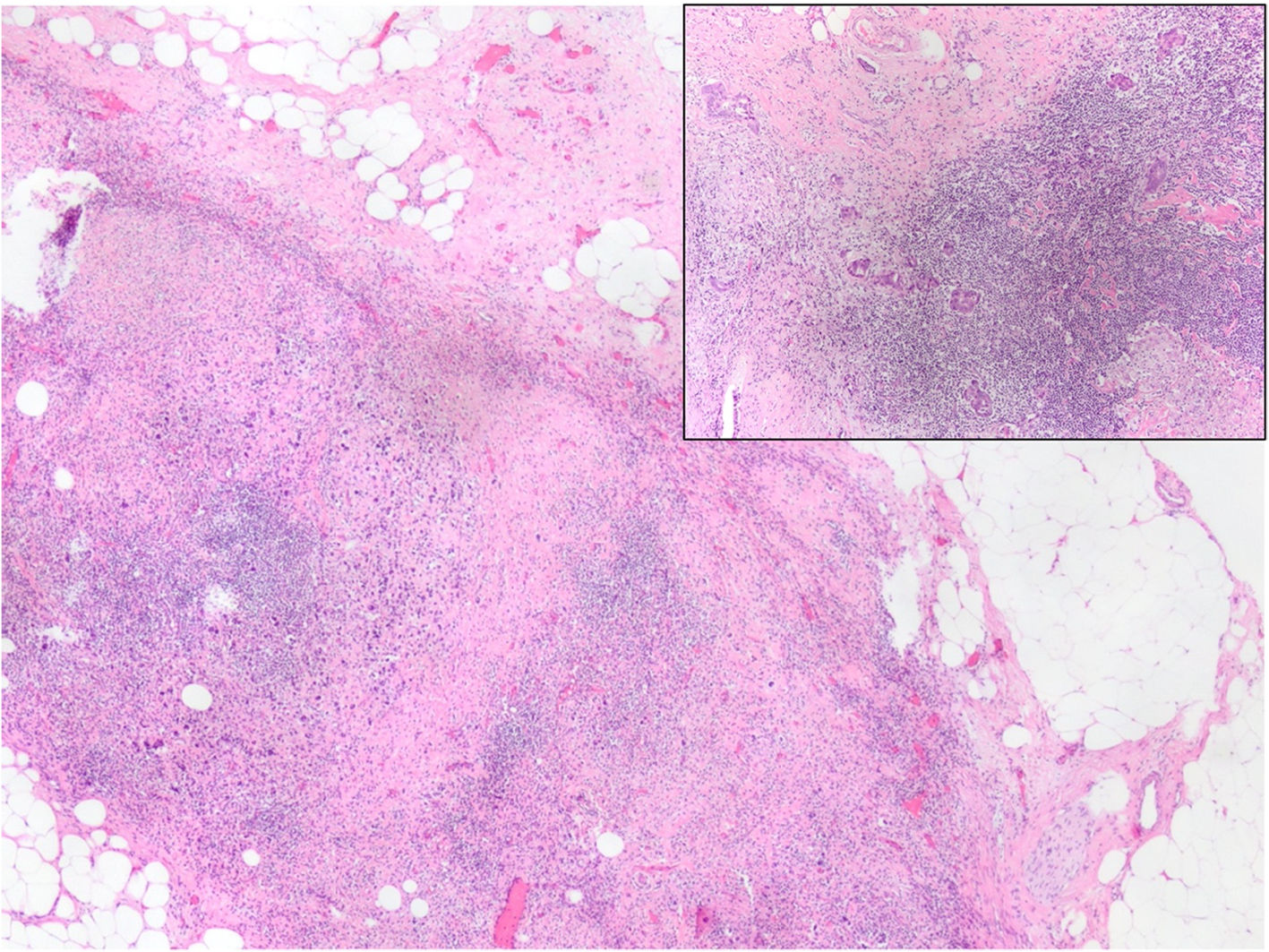
El lecho tumoral tras el TNA suele aparecer como un área fibrosa o gomosa, mal definida, de morfología irregular, con coloración blanco-grisácea o pardo-rojiza (fig. 1). Puede presentar un aspecto granujiento si existen calcificaciones. En mamas densas, con tejido glandular abundante, los tumores con buena respuesta pueden aparecer más blandos y retraídos con respecto al tejido circundante. Los marcadores radiológicos deben ser correctamente identificados, y son de gran ayuda para localizar la zona de lecho tumoral (fig. 2).
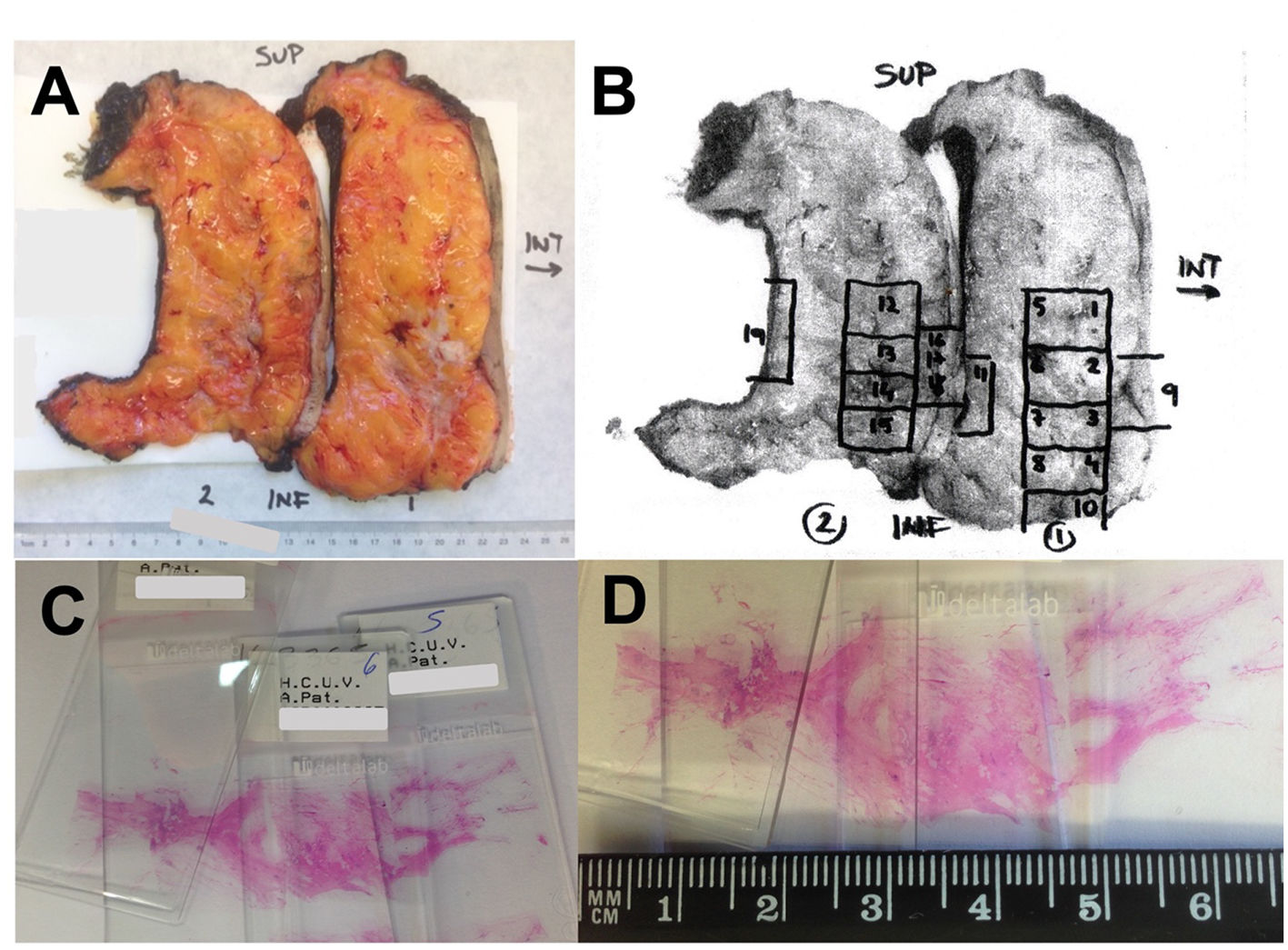
En los tumores pequeños, menores de 3 cm, se recomienda la inclusión total, mientras que en los tumores grandes, la recomendación es incluir al menos 5 bloques representativos de las secciones transversales que abarquen el diámetro máximo del tumor al diagnóstico (una sección por cada 1-2 cm de diámetro inicial), hasta un máximo de 25 bloques15. La U.S. Food and Drug Administration recomienda incluir al menos un bloque de tumor por cada cm de tamaño tumoral al diagnóstico, o al menos 10 bloques de tumor9. Si en el estudio inicial no se identifica tumor o está incompleto en las muestras, debe ampliarse el muestreo. El uso de este protocolo permite establecer la existencia de RPC o de enfermedad residual, obtener los datos necesarios para el cálculo del RCB así como la estadificación según criterios AJCC36. Es muy útil el empleo de imágenes (radiografías, fotografías y diagramas) para el mapeo de la posición de los bloques, y su integración con los hallazgos microscópicos ayuda a determinar la extensión de los tumores (fig. 3).
Ejemplo de muestreo de una pieza de mastectomía tras el TNA. A) Fotografía de la pieza seccionada. B) Sobre la fotografía impresa se marcan las zonas muestreadas en cada bloque. C) Preparaciones que abarcan una sección completa del tumor residual en su máxima extensión. D) Tras comprobar la presencia microscópica de tumor residual pueden determinarse sus máximos diámetros utilizando las laminillas.
Los ganglios axilares pueden ser difíciles de identificar tras el TNA por atrofia y fibrosis. Por ello es recomendable incluir cualquier nódulo sospechoso, por pequeño que sea. Deben incluirse para el estudio microscópico todos los ganglios linfáticos identificados, individualizados y seccionados cada 1-2 mm siguiendo el eje mayor, para garantizar la identificación del máximo número de lesiones metastásicas y determinar su extensión. No está establecida la necesidad de realizar un estudio sistemático de cortes por niveles seriados ni tampoco el empleo de inmunohistoquímica excepto cuando existan dudas diagnósticas4.
Estudio microscópicoTodas las características histopatológicas con valor pronóstico y predictivo que tradicionalmente se analizan en el CM son también importantes en los tumores residuales tras el TNA, pero su evaluación puede ser más complicada por efecto del tratamiento. Diferentes autores han publicado recomendaciones para el estudio de estas piezas17,36–41, siendo especialmente relevantes los artículos del Residual Disease Characterization Working Group en el esfuerzo para estandarizar el estudio histopatológico15,16. Aunque las recomendaciones se establecen para el manejo de piezas en el contexto de los ensayos clínicos, son aplicables a cualquier pieza en la práctica clínica17,41.
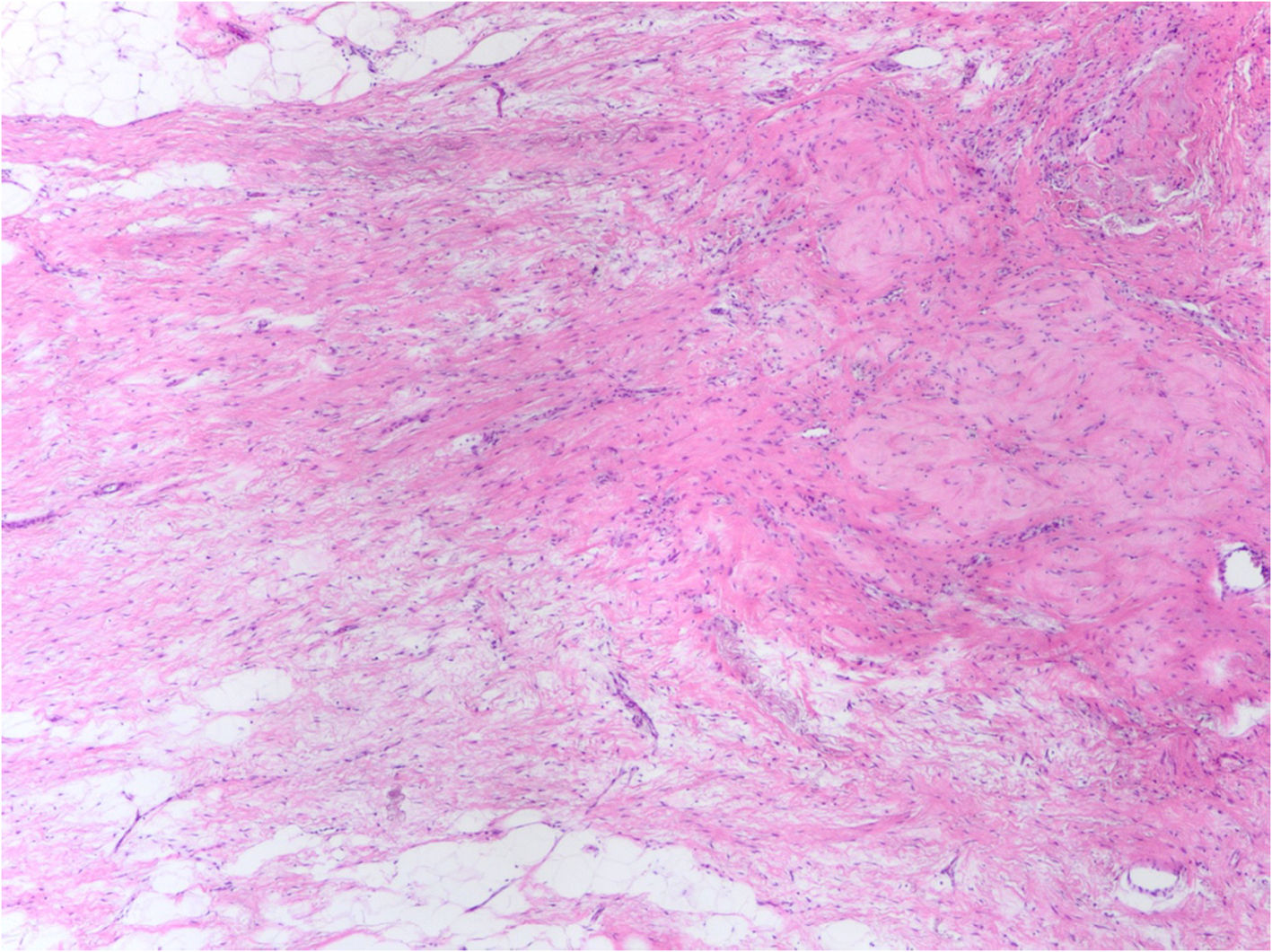
En ausencia de enfermedad residual, el establecimiento de una RPC requiere de la identificación correcta del lecho tumoral. Suele aparecer en forma de zonas con colagenización irregular, con incremento en la microvascularización, reducción o ausencia de estructuras glandulares normales (fig. 4), pudiendo asociar infiltrados inflamatorios con macrófagos y/o linfocitos, calcificaciones, depósitos de hemosiderina, o granulomas con células gigantes multinucleadas. En ocasiones puede haber edema o cambio mixoide. Si no aparecen cambios estructurales en la zona en la que se aloja el marcador radiológico, debe ampliarse el muestreo al tejido adyacente, pues los marcadores pueden desplazarse en el curso del tratamiento, durante la cirugía o por la manipulación de la pieza.
Si existe carcinoma invasivo residual, el tipo histológico se determina según los criterios de la clasificación OMS35. Tras el TNA suele mantenerse el mismo tipo histológico presente al diagnóstico, aunque puede haber variaciones en el aspecto celular. Algunos carcinomas infiltrantes sin tipo especial con buena respuesta pueden presentar un patrón de crecimiento simulando carcinoma lobulillar. Algunos carcinomas mucinosos pueden responder quedando solo lagos de mucina y si no se demuestra la existencia de celularidad invasiva residual se considera RPC.
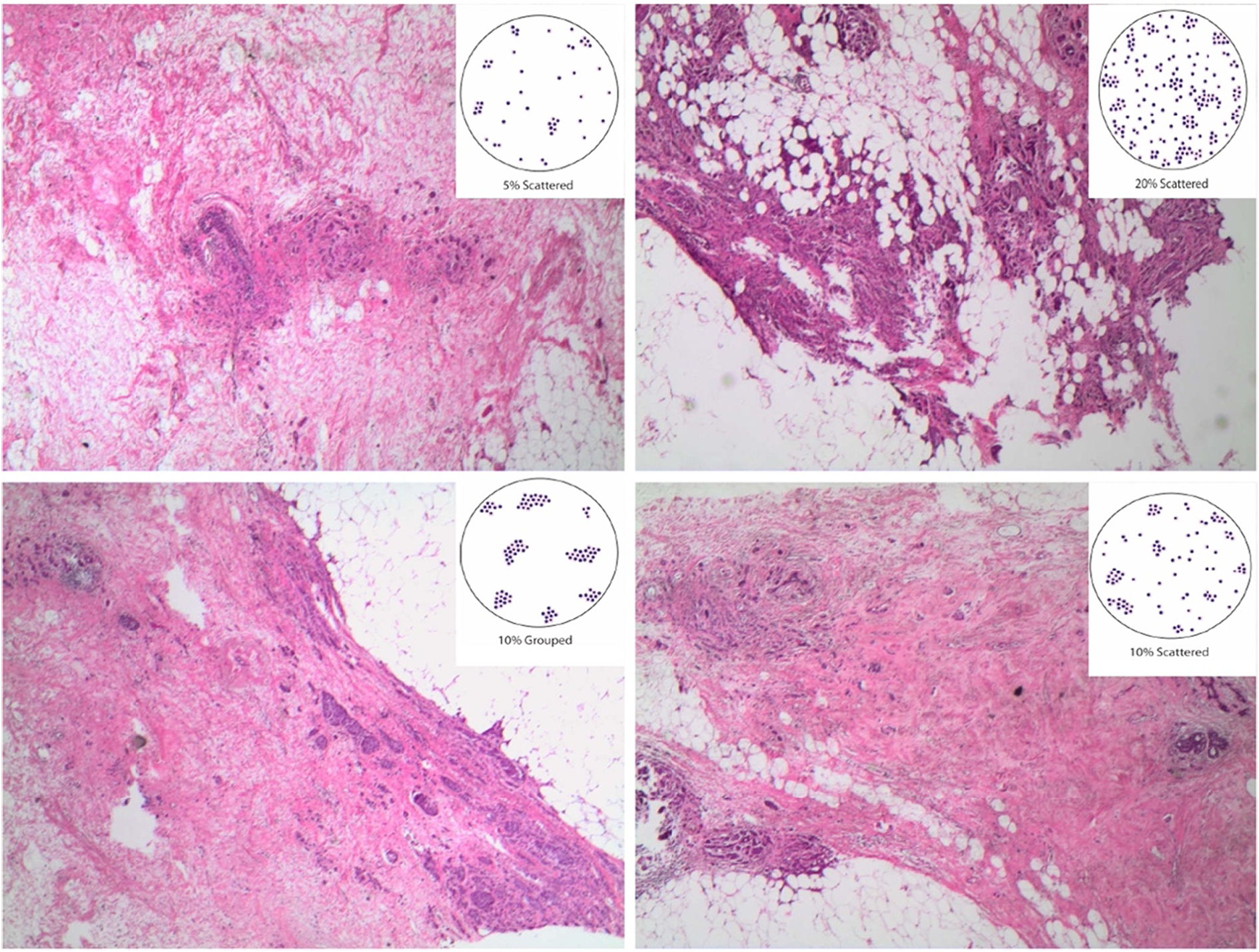
Para establecer el grado histológico se mantiene el sistema clásico de Nottingham. Las células tumorales residuales pueden presentar cambios morfológicos inducidos por el tratamiento: variación en el tamaño (generalmente aumentado), con vacuolización de los citoplasmas o incremento en la eosinofilia, y con núcleos más grandes, más hipercromáticos y más pleomórficos. Suele reducirse la actividad mitótica. El porcentaje de la celularidad tumoral residual ocupando el área tumoral, es uno de los parámetros necesarios para calcular el RCB, y en los tumores con grados variables de celularidad debe establecerse el porcentaje medio en los campos microscópicos abarcados dentro de las máximas dimensiones del tumor (fig. 6).
Los tumores múltiples con diferente tipo o grado histológico, separados por tejido normal, deben informarse de forma independiente, aunque el de mayor tamaño será el que determine la estadificación (ypT) y el RCB.
La presencia de CDIS en ausencia de un carcinoma invasivo residual se considera RPC (fig. 5), mientras que la identificación de ILV no es RPC. Por ello, en caso de dudas diagnósticas deben emplearse los marcadores inmunohistoquímicos de células mioepiteliales y/o vasculares que permitan diferenciar entre CDIS, ILV y el carcinoma invasivo.
Tumor invasivo residual tras el TNA. Para establecer el porcentaje de celularidad invasiva residual, dato necesario para calcular el RCB, se hace la media de los porcentajes de afectación que encontramos en cada uno de los campos microscópicos que representan los máximos diámetros del tumor (H&E, 4x).
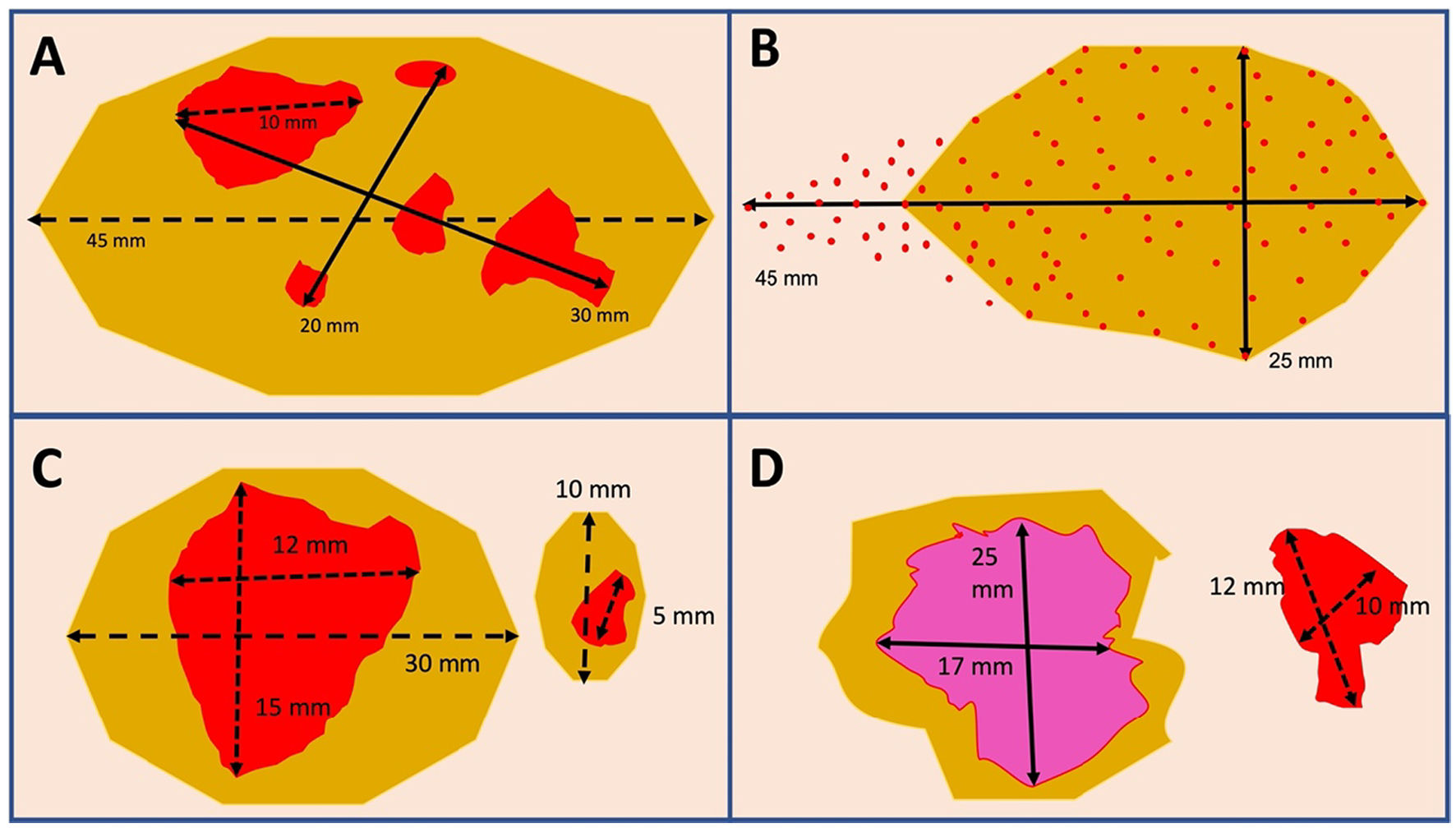
Ejemplos de determinación del tamaño tumoral (ypT) y mediciones de los máximos diámetros para establecer el RCB. A) Varios focos residuales de carcinoma invasivo, el mayor de ellos de 10 mm, que se extienden por un área con diámetros máximos de 30 x 20 mm, sobre un lecho tumoral fibroso de 45 mm en su conjunto. El tamaño del mayor foco invasivo (10 mm) se utiliza para establecer el estadio ypT, pero para RCB se utilizarán los diámetros máximos ocupados por celularidad residual (30 x 10 mm) teniendo en cuenta que habrá campos con lecho tumoral fibroso en los que el porcentaje de celularidad será de 0%. B) Celularidad tumoral residual muy dispersa que sobrepasa el límite del lecho tumoral fibroso. El máximo diámetro (incluyendo la zona por fuera del lecho) se utiliza para establecer el estadio ypT, en este caso 45 mm, y también para determinar el RCB (45 x 25 mm). C) Varios lechos tumorales fibrosos con celularidad invasiva residual con la misma morfología e inmunofenotipo, separados por tejido normal (tumor multicéntrico). El componente invasivo residual de mayor tamaño se utiliza para determinar el estadio ypTm (15 mm) y también para cuantificar el RCB (15 x 12 mm). D) Dos focos residuales separados por tejido normal y con diferente morfología y/o inmunofenotipo. El foco residual de mayor tamaño establece el estadio ypTm (25 mm) pero en este caso se recomienda determinar el RCB por separado en cada foco (25 x 17 mm en el mayor y 12 x 10 mm en el menor), pues el tumor de menor tamaño puede tener mayor porcentaje de celularidad y resultar en una categoría RCB más alta.
Imagen microscópica de un ganglio positivo con respuesta parcial a TNA, persistiendo nidos tumorales dispersos sobre áreas amplias de fibrosis. Para calcular el RCB se utiliza el número de ganglios afectos y el diámetro máximo de la metástasis de mayor tamaño. Este diámetro debe incluir la máxima longitud de tejido ganglionar (y de la extensión extracapsular si existe) que contenga celularidad invasiva residual, incluyendo las zonas de fibrosis interpuestas entre las áreas con nidos tumorales (H&E, 2x con ampliación 10x en el recuadro).
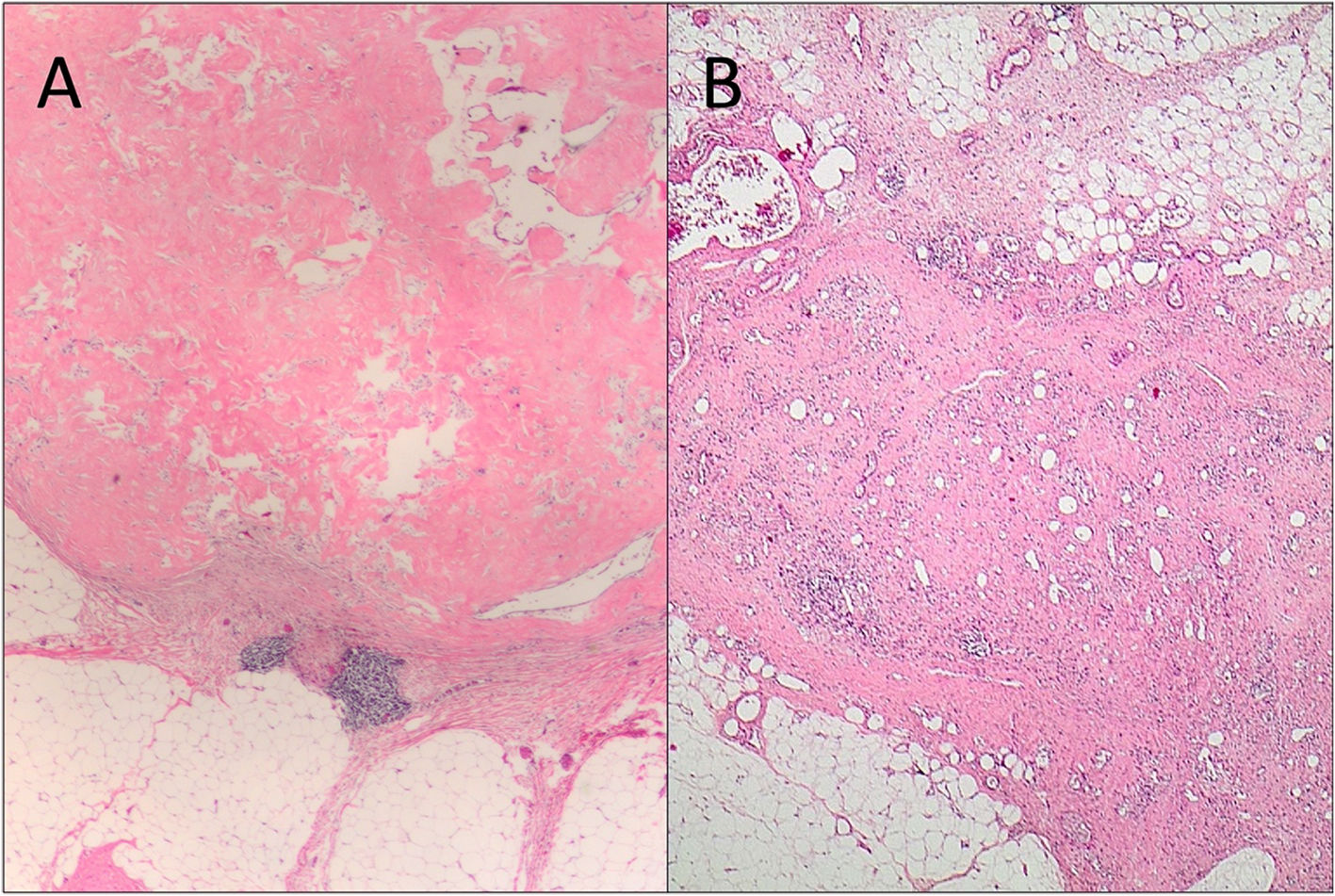
Dos ejemplos de ganglios con metástasis por carcinoma de mama al diagnóstico, y que se han negativizado tras el TNA (respuesta ganglionar completa). A) La respuesta al TNA aparece como una zona de densa esclerosis con hialinización. B) En este caso la respuesta en ganglio recuerda al lecho tumoral fibroso que aparece en la mama, con tejido fibro-desmoplásico mostrando vascularización incrementada, obliterando la arquitectura normal del ganglio (H&E, 2x).
El patrón de regresión tumoral no es homogéneo en aproximadamente la mitad de los casos, y este hecho no depende del subtipo molecular, por lo que es necesario evaluar el lecho tumoral en toda su extensión para detectar la existencia de focos invasivos residuales42. En ocasiones pueden quedar muy escasas células neoplásicas dispersas en el lecho tumoral, excluyendo una RPC, y pueden tener morfología histiocitoide, siendo necesaria la inmunohistoquímica (queratinas) para su identificación.
Los TIL en el tumor residual han demostrado tener valor pronóstico, y por ello se recomienda su evaluación43.
Para la estadificación tras el TNA, el sistema TNM (ypT) establece que debe medirse el mayor foco contiguo de tumor invasivo residual sin incluir las zonas de fibrosis presentes dentro del mismo lecho tumoral25. Sin embargo, para la determinación del RCB se consideran los diámetros máximos del área ocupada por la celularidad residual incluyendo las zonas de fibrosis entre ellas (fig. 7A). En cualquier caso, se recomienda incluir en el informe la medida del lecho tumoral (zona de tejido anormal, generalmente fibrótica, reconocible en el estudio macro y/o microscópico, en la localización del tumor al momento del diagnóstico), tenga o no celularidad invasiva residual. Evidentemente, las mediciones deben incluir las áreas con células tumorales residuales que se extiendan de forma continua más allá del estroma fibrótico (fig. 7B).
En el caso de tumores múltiples morfológicamente diferentes y separados por tejido normal, el de mayor tamaño se empleará para determinar el estadio ypT y para cuantificar RCB (fig. 7C), pero puede ser útil determinar también RCB en tumores más pequeños cuando presenten un mayor grado de celularidad (pues pueden tener un índice RCB superior), o si representan un subtipo más agresivo de CM36 (fig. 7D).
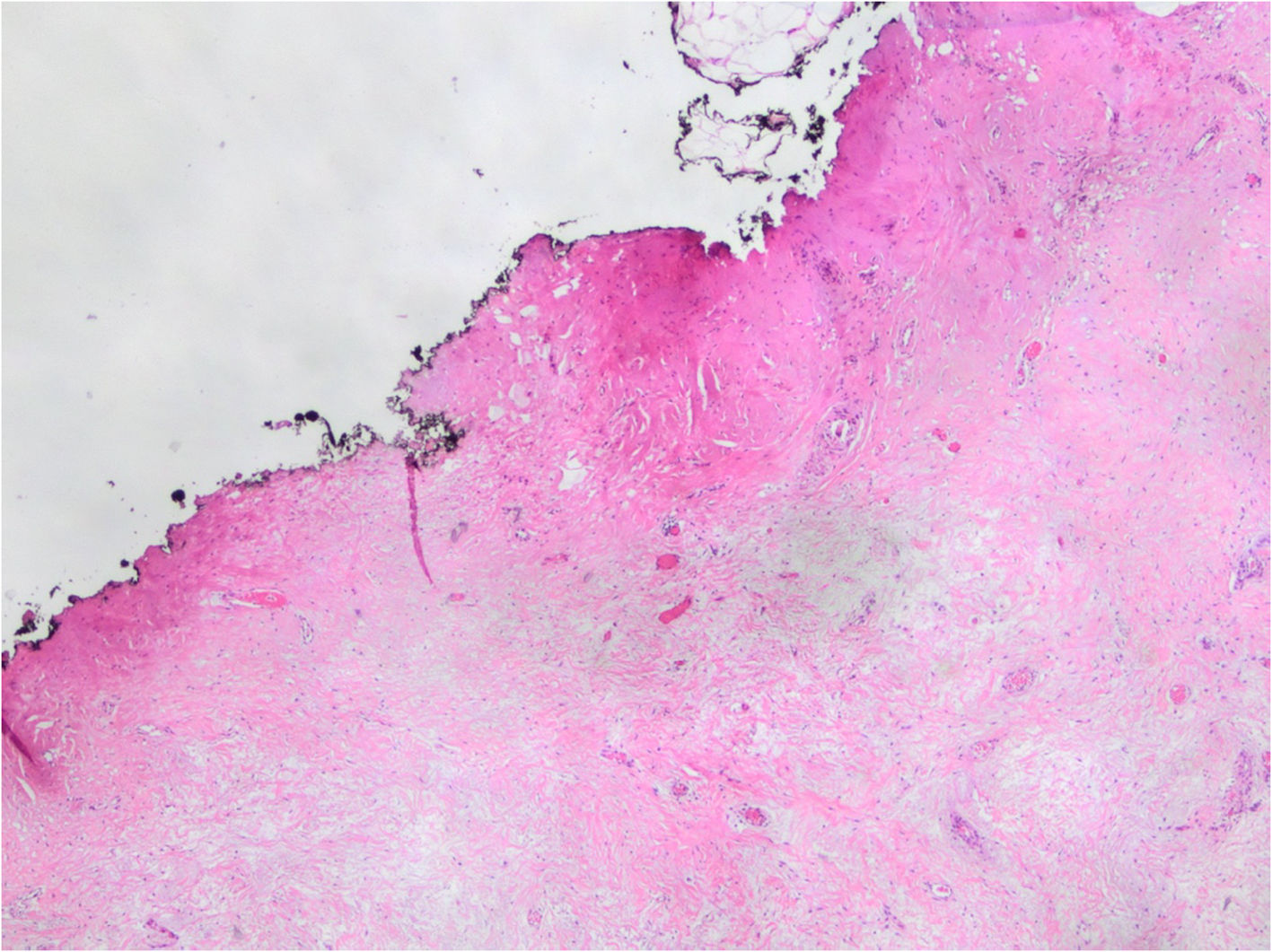
Debe informarse la afectación de márgenes quirúrgicos tanto por el carcinoma (invasivo o CDIS) como por el lecho tumoral (fig. 8). En los casos con RPC no está bien establecida la relación entre la extensión del lecho tumoral al margen y la aparición de recidivas locales, pero es probable que sean muy escasas. Sin embargo, cuando existen focos dispersos de carcinoma invasivo o de CDIS en el lecho tumoral, hay mayor riesgo de recidiva local si este lecho alcanza el margen.
En la evaluación de los ganglios linfáticos debe medirse el diámetro de la metástasis mayor, incluyendo la extensión extracapsular. Para la estadificación ypN esta medida no incluye las zonas de fibrosis entre las áreas tumorales25, mientras que para el cálculo de RCB el diámetro de la metástasis abarca toda la zona de fibrosis sobre la que se reparten las células tumorales (fig. 9). Los cambios morfológicos por el TNA en los ganglios linfáticos son similares a los que aparecen en la mama, e incluyen fibrosis, agregados de macrófagos, cristales de colesterol, granulomas y depósitos de mucina o de material hialino (fig. 10). La celularidad tumoral residual en las metástasis puede ser escasa y difícil de identificar, sobre todo si hay componente inflamatorio, haciendo necesario el empleo de inmunohistoquímica para queratinas. No está formalmente establecido el estudio de secciones seriadas ni el empleo rutinario de inmunohistoquímica para el estudio de los ganglios, sean ganglios centinelas (GC) o no44.
Para el análisis anatomopatológico del GC tras el TNA deben emplearse técnicas que permitan evaluar la respuesta en los ganglios además de la estadificación ypN y la determinación del RCB (número de ganglios afectos y diámetro de la metástasis mayor). El estudio molecular con la técnica OSNA es posible tras la neoadyuvancia y ha sido empleado en algunos estudios45, pero no está recomendado en los consensos publicados15–17,41,46 y presenta importantes limitaciones, fundamentalmente la pérdida de información pronóstica, pues no puede evaluarse la respuesta ganglionar al tratamiento, no permite cuantificar el RCB en caso de que el ganglio sea positivo (no se dispone de la medida del diámetro de la metástasis), y no pueden analizarse biomarcadores en el caso de que el GC sea el único componente tumoral residual tras el TNA. Además, aunque la técnica permite identificar celularidad tumoral residual en el ganglio, las correlaciones con el volumen tumoral que se emplean para establecer las categorías de CTA, micrometástasis o macrometástasis para la estadificación convencional (pN) con OSNA no han sido validadas en el contexto de la neoadyuvancia (ypN).
Manejo de la axila en la neoadyuvanciaSe han establecido guías para el manejo axilar en el contexto de ensayos clínicos4, que son también aplicables a la práctica de rutina46.
En las axilas clínica y radiológicamente negativas al diagnóstico (cN0), la técnica de elección para la estadificación axilar es la biopsia de ganglio centinela al finalizar el TNA, en el mismo acto quirúrgico que la resección local. La extirpación de ganglios positivos antes del tratamiento impide evaluar la respuesta ganglionar al TNA e invalida tanto la estadificación ypN (AJCC) como el cálculo de la carga tumoral residual (RCB) tras el TNA. Además, las pacientes con ganglios inicialmente positivos pueden evitar la disección axilar si hay una respuesta en los mismos y se negativizan4,15,16. El estudio de GC tras el TNA consigue tasas muy altas de identificación (> 95%) y tasas de falsos negativos comparables a las de las cirugías previas al tratamiento (< 10%)4,44.
Hay más controversias con respecto al manejo de la axila tras el TNA en las pacientes con ganglios positivos al diagnóstico (cN+), que deben haber sido confirmados mediante punción o BAG, dejando alojado un marcador radiológico4,15. Aproximadamente un 40% de estas pacientes hacen respuestas con negativización de los ganglios, y la detección como GC negativo puede evitar la disección axilar. Sin embargo, en este contexto las tasas de identificación de GC se reducen (80-95%) y se incrementan las tasas de falsos negativos (10-40%). Para hacer viable la estadificación axilar mediante el estudio de GC tras el TNA, deben seleccionarse a las pacientes con ganglios positivos al diagnóstico: la afectación ganglionar debe ser limitada (cN1), con altas posibilidades de respuesta según las características biológicas del tumor (sobre todo HER2+ y TN), y demostrando la existencia de respuesta clínica y radiológica en estos ganglios. Para mejorar las tasas de detección y reducir las tasas de falsos negativos, el estándar actual es colocar un marcador en el ganglio o ganglios positivos que hayan sido analizados en el diagnóstico, emplear sistemas de detección con doble marcaje (isótopos y tinta) y resecar un mínimo de 2 ganglios centinelas, además de asegurar la resección de los ganglios positivos marcados al diagnóstico (que hasta en 25% de los casos no son detectados como centinelas) mediante su localización quirúrgica con semillas radioactivas o con arpones4,47.
En estas pacientes con ganglios positivos al diagnóstico, la identificación de cualquier afectación ganglionar tras el TNA se considera actualmente indicación de una linfadenectomía4,48. En las pacientes que inicialmente eran cN0, la detección de 1-2 GC positivos tras el TNA plantea la posibilidad de omitir la disección axilar en las pacientes que van a recibir radioterapia adyuvante, en un escenario equivalente al de las pacientes con GC positivo que no han recibido tratamiento sistémico, pero actualmente no hay suficientes evidencias científicas que avalen la seguridad de esta práctica44.
Determinación de biomarcadores tras la neoadyuvanciaNo hay consenso sobre la necesidad de repetir la determinación de biomarcadores en el tumor residual tras el TNA, aunque se recomienda hacerlo en algunas situaciones: cuando los resultados hayan sido no concluyentes o negativos en el diagnóstico inicial, en tumores con nula o escasa respuesta al tratamiento, y cuando aparezcan tumores multifocales con diferente morfología15. El objetivo de esta repetición es tener un mejor conocimiento de la biología del tumor residual y poder abrir nuevas posibilidades para el tratamiento adyuvante posterior.
Algunos metaanálisis han encontrado resultados discordantes entre el estado de los biomarcadores antes y después del tratamiento, 13-18% para ER, 26-32% para PR y 6-9% para HER2, y pueden implicar cambios en la terapia adyuvante posterior49,50. Estas diferencias pueden obedecer tanto a problemas técnicos en las determinaciones como a heterogeneidad tumoral con la existencia de poblaciones con diferentes perfiles biológicos en el tumor primario, que pueden responder de forma diferente al tratamiento49,50.
En tumores HER2+ el empleo de agentes anti-HER2 como parte del TNA incrementa la tasa de negativización tras el tratamiento, y este cambio a HER2-negativo confiere un peor pronóstico cuando queda tumor residual51.
Perspectivas de futuroEn el escenario de la neoadyuvancia y especialmente en las mujeres jóvenes, la situación ideal sería poder evitar la cirugía en los tumores con RPC tras el TNA, pues se reducirían los costes sanitarios evitando las complicaciones posquirúrgicas y mejorando la calidad de vida de las pacientes. Son varios los motivos por los que este objetivo todavía no se ha conseguido en la práctica: aunque sabemos que los carcinomas HER2+ y TN tienen alta probabilidad de hacer RPC, no hay todavía biomarcadores capaces de predecir al 100% la respuesta y además las técnicas de imagen, a pesar de los avances, tampoco son suficientes. La concordancia entre las respuestas clínica, radiológica y patológica es baja. Solo la mitad de las respuestas radiológicas se corresponden con las respuestas patológicas, siendo la concordancia menor para los tumores luminales que para HER2+ y TN52. Las técnicas de imagen con mayor sensibilidad y especificidad para detectar RPC son la PET/TC con 18-fluorodeoxiglucosa, que permite identificar respuestas tempranas, y la resonancia magnética, más adecuada para evaluar respuestas al final del tratamiento53. Los estudios iniciales de factibilidad para evitar la cirugía tras el TNA se basan en las pacientes con CM invasivo con alta probabilidad de conseguir RPC (HER2+ y TN) y seleccionan para entrar en el grupo de desescalada aquellos tumores con evidencia de respuesta clínico-radiológica en los que no aparece celularidad neoplásica residual tras realizar un muestreo adecuado del lecho tumoral utilizando procedimientos poco invasivos. Los resultados son mejores utilizando biopsia asistida por vacío (BAV) guiada con estereoataxia frente a BAG, muestreando el lecho tumoral tanto en la zona de enclavamiento del marcador como en áreas adyacentes, y con menos falsos negativos cuantos más sean los cilindros analizados (mínimo 6-12 cilindros según estudios), en los que debe confirmarse la presencia de lecho tumoral en una revisión histopatológica adecuada54. Se consiguen tasas de falsos negativos en torno al 3% cuando se evalúan lechos tumorales pequeños (< 2 cm) realizando BAV representativa (por ejemplo, extrayendo marcadores radiológicos bien situados) y excluyendo los tumores multicéntricos o con CDIS asociado55.
Las plataformas de expresión génica han demostrado su utilidad como predictores de respuesta al TNA. Estas plataformas pueden usarse sobre las muestras obtenidas con BAG para el diagnóstico y permiten identificar subgrupos de tumores con mayor probabilidad de respuesta, como son el subtipo basal dentro de los TN, el subtipo HER2-enriquecido dentro de los tumores HER2+20 y los tumores con alto riesgo genómico dentro del grupo ER+/HER2-21. Estudios recientes han utilizado tecnologías de inteligencia artificial («deep learning») para establecer modelos predictivos de RPC a partir de imágenes histológicas de las biopsias diagnósticas, con una capacidad predictiva superior incluso a la proporcionada por los biomarcadores clásicos como el subtipo molecular o el porcentaje de TIL56. Estas nuevas aproximaciones, en combinación con los factores predictivos ya establecidos, permitirán avanzar en una mejor selección de los tumores con mayor posibilidad de responder al TNA.
ConclusionesLa neoadyuvancia es ya una práctica establecida en el manejo del CM, y los patólogos tienen una gran importancia en este contexto. Los resultados del estudio de la biopsia al diagnóstico son esenciales para seleccionar esta opción terapéutica y la evaluación de la respuesta a TNA es determinante para predecir el pronóstico y para establecer la necesidad de un tratamiento adyuvante sistémico posterior. Es para ello necesario estandarizar el manejo y la evaluación patológica de las piezas de mama y axila que han recibido el TNA, estableciendo una definición homogénea de RPC y utilizando sistemas de evaluación de respuesta que sean objetivos, reproducibles y clínicamente útiles. El sistema RCB cumple estos criterios y es el recomendado por los grupos cooperativos y paneles de expertos, y por tanto debe ser adoptado por los patólogos en su práctica de rutina.
Mensajes finales- •
El papel del patólogo es esencial para una correcta selección de las pacientes candidatas al TNA. Debe participar en los comités multidisciplinares para la toma de decisiones, y disponer de los datos del tumor primario de toda paciente que haya recibido tratamiento.
- •
Es necesario estandarizar el muestreo e informe de las piezas de CM tratadas en neoadyuvancia, garantizando el correcto diagnóstico de la RCP y la evaluación del grado de respuesta en caso de persistir tumor residual.
- •
Para la evaluación de respuesta se recomienda el sistema RCB, por lo que el estudio microscópico debe poder aportar todos los datos necesarios para su determinación.
No se ha recibido ningún fondo de financiación específico para la realización de esta revisión.
Consideraciones éticasAl tratarse de un artículo de revisión no aplica la aprobación por parte del comité de ética.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.