El cáncer de mama es una entidad heterogénea compuesta por diferentes subtipos con sus propias características clínicas y biológicas. Por este motivo, el uso de plataformas génicas se ha convertido en una herramienta cada vez más utilizada para poder realizar una correcta estratificación, pronóstico y tratamiento del cáncer de mama. Los ensayos desarrollados para apoyar la toma de decisiones terapéuticas en los cánceres de mama ER+ en la fase inicial, se basan en los análisis cuantitativos de la expresión (ARN) de genes que se expresan habitualmente en dicho grupo de tumores. Son ensayos que capturan el «transcriptoma» y que, aunque tienden a correlacionarse con otras características patológicas como el grado y la proliferación, proporcionan pruebas robustas reproducibles e información independiente. Nuestro objetivo es presentar una actualización de las 4 firmas génicas más utilizadas en la práctica clínica en nuestro entorno.
Breast cancer is a heterogeneous entity composed of different subtypes with their own clinical and biological characteristics. Therefore, gene platforms are increasingly used as a tool for the correct staging, prognosis, and treatment of breast cancer. Assays developed to support therapeutic decision-making in early-stage ER+ breast cancers are based on quantitative analysis of the expression (RNA) of genes that are commonly expressed in this group of tumors. These are assays that capture the «transcriptome» and, although they tend to correlate with other pathological features such as grade and proliferation, they provide robust reproducible evidence and independent information.
El cáncer de mama es una entidad heterogénea compuesta por diferentes subtipos con sus propias características clínicas y biológicas. Por este motivo, el uso de plataformas génicas se ha convertido en una herramienta cada vez más utilizada para poder realizar una correcta estratificación, pronóstico y tratamiento del cáncer de mama. Los ensayos desarrollados para apoyar la toma de decisiones terapéuticas en los cánceres de mama ER+ en la fase inicial se basan en los análisis cuantitativos de la expresión (ARN) de genes que se expresan habitualmente en dicho grupo de tumores. Son ensayos que capturan el «transcriptoma» y que, aunque tienden a correlacionarse con otras características patológicas como el grado y la proliferación, proporcionan pruebas robustas reproducibles e información independiente.
Casi todas las pacientes con tumores ER+ serán candidatas a la terapia endocrina adyuvante, pero la recomendación de quimioterapia (QT) así como la duración del tratamiento endocrino adyuvante pueden ser muy variables. Históricamente, se recomendaba QT adyuvante a las pacientes con tumores de más de 1 cm y/o con afectación ganglionar, basándose en los resultados de los ensayos clínicos aleatorizados. A pesar de que esta estrategia se consideró como un «sobre-tratamiento» en muchos casos, no había herramientas adecuadas, antes de la llegada de las firmas genómicas, para identificar adecuadamente a las pacientes que podían beneficiarse de la QT y a quienes no.
Actualmente, existen varios ensayos que tienden a «agrupar» los cánceres de mama ER+ en categorías de riesgo de metástasis «alto/bajo» o «luminal A/B», aunque existen diferencias entre ellos tanto en su desarrollo como en su validación técnica, clínica y las firmas moleculares que forman parte del estándar diagnóstico de los cánceres de mama ER+ en estadio 1 y 2.
Presentamos una revisión de las 4 firmas génicas más utilizadas en el entorno de nuestra práctica clínica habitual.
Test mammaprint y blueprintIntroducciónEl ensayo MammaPrint (MmP) de 70 genes, basado en la expresión génica de microarrays, fue el primer test en revelar la «anatomía genómica» del cáncer de mama, en relación con la probabilidad de metástasis1. Consta de 2 firmas genéticas, MmP propiamente dicho, de 70 genes y BluePrint, de 80 genes. A diferencia de los otros test genéticos, cuyos genes se extraen de la literatura, MmP tuvo un estudio de desarrollo, independiente de las validaciones clínicas, y se desarrolló con un enfoque no sesgado y utilizando «el genoma» completo. MmP se compone de 70 genes que forman parte de las 7 vías funcionales del proceso metastásico, seleccionados mediante un análisis exhaustivo y no sesgado de una cohorte de pacientes de cáncer de mama que no habían sido operadas ni tratadas con ningún tipo de terapia sistémica. A pesar de que todos los tumores presentaban características clínicas y morfológicas parecidas, tras un seguimiento clínico a largo plazo se observó que algunas mujeres permanecían libres de metástasis, mientras que otras presentaban metástasis en los primeros 5 años tras el diagnóstico. Se estudió el genoma completo de todos los casos y se comparó el patrón de expresión génica de ambos grupos. Se identificaron 70 genes cuyos patrones de expresión podían distinguir los cánceres de mama de «bajo riesgo» (riesgo de metástasis de aproximadamente el 10% a los 10 años y que no se hubieran beneficiado de QT adyuvante), de los cánceres de mama de «alto riesgo» (riesgo de metástasis de casi el 30% a los 10 años, que sí se hubieran beneficiado de la terapia sistémica)2,3. Posteriormente, este descubrimiento fue validado por 2 cohortes más amplias4,5. MmP es el único estudio genético que tiene aprobación de la FDA para mujeres de todas las edades6 y ha sido posteriormente validado en múltiples estudios con más de 13.000 pacientes.
El test incluye también la firma BluePrint (firma de 80 genes) que realiza una subclasificación molecular (tipo Luminal, HER2 o Basal) e identifica, junto con MmP, subpoblaciones de las pacientes con una respuesta al tratamiento potencialmente distinta a la establecida por los métodos convencionales7.
En el entorno neoadyuvante, el ensayo prospectivo fase IV «Neoadjuvant Breast Registry Symphony Trial (NBRST)» reclasificó el subtipo intrínseco en el 22% de los tumores y demostró el potencial valor añadido de MmP y BluePrint en una cohorte de más de 1.000 pacientes tras evaluar los resultados de la QT y terapia endocrina neoadyuvantes, tanto en el momento de la cirugía como a los 5 años de seguimiento8,9. Con la subtipificación BluePrint, el 18% de los pacientes clínicamente «luminales» se clasifican en un subgrupo diferente al de la evaluación convencional (HER2 o, mucho más frecuentemente, Basal), observándose en estos pacientes una tasa de respuesta a la QT neoadyuvante significativamente mayor en comparación con los pacientes BluePrint-Luminal. BluePrint evalúa la expresión de los genes reconocidos como biomarcadores e incorpora información adicional sobre los patrones de expresión en las vías biológicas subyacentes, reguladas por estas proteínas (por ejemplo, el receptor de estrógeno [RE] y las dianas del RE-aguas abajo)7.
MmP y BluePrint se realizan de manera centralizada en EE. UU., por Agendia NV, habiéndose demostrado su valor tanto en el tejido procedente de las piezas quirúrgicas como de las biopsias por aguja gruesa (BAG), punto especialmente relevante tras la experiencia de la pandemia por la COVID-19, al permitir la orientación terapéutica de la enfermedad desde el diagnóstico inicial10.
La validación clínica del test genético MmP se realizó a través del ensayo MINDACT (Microarray in Lymph Node Negative and 1–3 Lymph Node Positive Disease May Avoid Chemo- therapy)7, que fue el primer ensayo prospectivo aleatorizado que, con base en la anatomía genómica del tumor, da soporte a la toma de decisiones en relación con la terapia sistémica10,11. La capacidad de MmP para discriminar tumores hormono-dependientes en estadios iniciales de bajo riesgo versus de alto riesgo ha sido reconocida, desde la publicación en New England Journal of Medicine en 2016, en las guías ASCO, NCCN, St Gallen, AJCC y el sector de los seguros sanitarios12–16.
La pregunta del ensayo MINDACTLa pregunta base del MINDACT fue evaluar cuál era el mejor método, el clínico o el genético, para predecir el riesgo de metástasis y, por tanto, la necesidad de QT sistémica. Se estudiaron 6.693 casos procedentes de más de 110 centros de 9 países europeos entre 2007 y 2011, cuyo riesgo de metástasis fue evaluado tanto clínica (versión modificada del Adjuvant Online!, que integraba también el HER2)17 como genéticamente (MmP).
Los criterios de inclusión fueron tener un diagnóstico de cáncer de mama confirmado por anatomía patológica, un estadio tumoral T1, T2 o T3; y de 0 a 3 ganglios linfáticos metastásicos. La mayoría de los tumores fueron ER+ (88,4%). La edad de las pacientes oscilaba entre los 23 y los 71 años, siendo la mediana de 55 años. Cabe destacar que un tercio (33,2%) de las pacientes del MINDACT tenía menos de 50 años.
A los casos de riesgo bajo concordante tanto clínica como genéticamente (MmP) (clínicamente bajo/genómicamente bajo, cL/gL), no se les indicó QT, mientras que sí se indicó a todos los casos de alto riesgo concordante tanto en la evaluación clínica como en la genética (clínicamente alto/genómicamente alto, cH/gH). Para los casos discordantes entre el riesgo clínico y el genómico, se aleatorizaron las pacientes a terapia sistémica o no, y se compararon los resultados.
Para las pacientes cuya decisión de tratamiento se fundamentara en el riesgo genómico bajo (MmP), aleatorizadas a «no QT», las tasas de recidiva con metástasis a distancia debían ser, al menos, tan bajas como las de las pacientes de riesgo clínico alto que sí recibieron QT. Por lo tanto, el MINDACT fue un ensayo de «no inferioridad». También se planteó la cuestión de qué nivel de «riesgo clínico» justificaba el uso de la QT, que, necesariamente, debe tener en cuenta la opinión de las pacientes. Estudios anteriores de los EE. UU., Australia y Europa habían documentado una amplia variación en los umbrales de las pacientes para la magnitud necesaria del beneficio de la QT, que oscilaba entre el 0,5 y más del 5%18–20.
El papel de la quimioterapia en la reducción de la recidiva metastásica del cáncer de mamaLos metaanálisis del Early Breast Cancer Trialist's Collaborative Group (EBCTCG)21,22 demostraron que el efecto de la QT en la reducción de la recidiva metastásica se observa principalmente durante los primeros 5 años tras el diagnóstico. Aunque las recidivas metastásicas en el cáncer de mama RE+ siguen produciéndose más allá de los 5 años del diagnóstico, estas recidivas «tardías» se producen en la misma proporción en las mujeres que recibieron QT y en las que no. Por lo tanto, MINDACT consideró suficiente un seguimiento de 5 años para identificar a todas las pacientes que se benefician de la QT.
Principales resultados del ensayo MINDACT
Aproximadamente, la mitad de los pacientes incluidos fueron clasificados como de BR clínico y la otra mitad como de AR clínico, mientras que MmP identificó al 64% como de BR genético y al 36% como de AR genómico. Se evidenció concordancia en 2/3 (68%) de todos los pacientes, con un 41% de bajo riesgo clínico y genético (cL/gL) y un 27% de alto riesgo clínico y genómico (cH/gH). El grupo de BR fue el de mayor concordancia, aportando MmP información adicional en solo uno de cada 5 pacientes. Por el contrario, para los pacientes del MINDACT identificados como de AR clínico, solo uno de 2 tenía concordancia con el riesgo genómico.
Grupo MINDACT de AR clínico y BR MmP: incluye 1.550 pacientes aleatorizados a recibir QT o a no recibirla.
- •
Para el grupo que no recibió QT (con un 100% de cumplimiento del tratamiento «por protocolo»), la SLM a los 5 años fue del 94,7%, con un intervalo de confianza que va del 92,5 al 96,2%, muy por encima del umbral del 92% establecido por los investigadores del MINDACT. Por lo tanto, el ensayo MINDACT se considera un ensayo positivo.
- •
La SLM del grupo que recibió QT fue del 95,9%, con una diferencia que no fue estadísticamente significativa, lo cual apoyó la hipótesis de que los pacientes de BR- MmP podían evitar la QT con seguridad, incluso cuando había factores clínicos de alto riesgo.
Grupo MINDACT con ganglios linfáticos positivos: incluye casi 1.400 pacientes (21% de toda la población incluida y 48% dentro del grupo de AR clínico/BR MmP) con uno a 3 ganglios linfáticos afectados, la mayor cohorte de las pacientes con ganglios positivos de la que se tiene constancia en un ensayo controlado y aleatorizado con perfil genético del cáncer de mama. Al igual que en el grupo AR- clínico / BR- genómico, el valor p de 0,724 no indica ningún beneficio estadísticamente significativo de la adición de QT para la cohorte de las pacientes con ganglios linfáticos positivos. Las implicaciones de este hallazgo crítico son que los cánceres con capacidad biológica de metastatizar a los ganglios linfáticos regionales no siempre requieren QT, en contraste con las recomendaciones de la mayoría de las guías clínicas.
Impacto de la evaluación del riesgo genómico en el cáncer de mama en fase inicialPara las pacientes del MINDACT en las que se utilizó la evaluación del riesgo clínico para determinar la necesidad de QT, la SLM a los 5 años fue del 95%, mientras que las pacientes tratadas según la evaluación de riesgo MmP tuvieron una SLM a 5 años del 94,7%. No hubo diferencias estadísticamente significativas. Sin embargo, la evaluación del riesgo de MmP permitió que el 46% de las mujeres de AR- clínico evitaran la QT de forma segura.
Desde el punto de vista económico, varios estudios ya han documentado la rentabilidad del ensayo MmP de 70 genes23,24, aunque actualmente se están analizando los datos de rentabilidad del MINDACT.
¿Predice MammaPrint el beneficio de la QT? El VP de MmP ha sido motivo de debate. MINDACT se diseñó y dimensionó para responder a la pregunta de si MmP podía identificar a las mujeres con cáncer de mama de BR- genético susceptibles de evitar la QT de forma segura, no para responder a la pregunta de si la QT beneficiaría a las mujeres con cáncer de mama de AR genético. La respuesta merece una reflexión.
¿Cuándo es «predictiva» una prueba? La mayoría de las pruebas de diagnóstico tienen un valor predictivo significativamente diferente si la prueba es «negativa» o «positiva». Pongamos algunos ejemplos. La presencia del RE predijo una tasa de respuesta del 60% en el cáncer de mama metastásico ER+25, mientras que si RE era negativo, la tasa de respuesta era del 5–8%. Por lo tanto, el valor predictivo positivo (VPP) del test para RE era del 60%, mientras que el valor predictivo negativo (VPN) es decir, la capacidad de identificar a los no respondedores era mucho mayor (92–95%).
Los estudios originales de trastuzumab como agente único en el cáncer de mama metastásico HER2+ observaron una tasa de respuesta del 35% en las pacientes con amplificación de HER2 (FISH+), y una tasa de respuesta del 7% en las pacientes sin amplificación de HER226. Por lo tanto, el VPP de la amplificación de HER2 para predecir la respuesta al trastuzumab fue del 35%. El VPN de la ausencia de amplificación fue mucho mayor (93–99%)27.
Valor predictivo de MammaPrint: MINDACT incluyó una cohorte en la que el riesgo clínico fue bajo y el riesgo genómico alto (n= 592, 9% del total). El BR clínico era atribuible principalmente al pequeño tamaño del tumor (98% T1) y al grado intermedio (85%). Aunque la mayoría de las pacientes de esta cohorte tenían receptores de estrógenos positivos, aproximadamente el 12% eran también HER2+, y el 9% fueron clasificadas clínicamente como «triple negativo».
- •
¿Predice MmP de alto riesgo la presencia de beneficio de la QT? ¿Cuál es el VPP de MmP? Esta pregunta no pudo ser respondida por el ensayo MINDACT, ya que no fue diseñado para determinar el beneficio a la QT en las pacientes de AR-MmP. La respuesta habría requerido que todas lass pacientes de AR-MmP fueran aleatorizadas a QT versus no, incluso aquellos con AR- clínico concordante, el diseño que habría sido poco ético según los estándares de los ensayos clínicos del siglo XXI.
- •
¿Predice MmP de bajo riesgo la ausencia de beneficio de la QT? La respuesta del ensayo MINDACT fue «sí», ya que la administración de QT a las pacientes con BR-MmP no produjo una diferencia estadísticamente significativa en cuanto a la ausencia de metástasis. MmP identificó correctamente el 98,5% de las pacientes con ER+ de AR- clínico, que no se beneficiarían de la QT (VPN del 98,5%). El VPN de MmP para predecir la ausencia de beneficio a la QT es igual al VPN del RE o del HER2 para predecir la ausencia de beneficio del tamoxifeno o del trastuzumab, respectivamente.
ASCO: los resultados del ensayo MINDACT fueron revisados por el Panel de Expertos de la Guía de Práctica Clínica de la Sociedad Americana de Oncología Clínica (ASCO) en una actualización de 201713, estableciendo que MmP puede utilizarse en el cáncer de mama RE+/HER2- de AR-clínico tanto con ganglios linfáticos negativos como con uno a 3 ganglios linfáticos positivos para «informar las decisiones acerca de QT sistémica adyuvante». MmP fue el primer ensayo genómico en demostrar su utilidad en el grupo de las pacientes con uno a 3 ganglios metastásicos.
NCCN: en 2018, la actualización de la guía NCCN consideró, basándonos enel ensayo MINDACT, que MmP era el único ensayo genético con un nivel de evidencia 1 tanto en el cáncer de mama con ganglios linfáticos negativos como en el positivo28. El ensayo TAILORx no aportó información acerca de las pacientes con ganglios positivos29,30, ya que no incluyó pacientes con ganglios linfáticos positivos ni se aleatorizaron las pacientes ya que las cohortes asignadas al azar para recibir QT más tratamiento endocrino o solo tratamiento endocrino, solamente se limitaron a aquellos con RS 11-25 (no para RS 0–10 ni RS 26 o más). La baja tasa de eventos en este estudio planteó la cuestión de si el predominio de las pacientes de BR- clínico permite obtener conclusiones definitivas sobre la utilidad de un RS intermedio para determinar la necesidad de QT31.
Direcciones futuras para MmP en el cáncer de mama:
- •
Ultra-low risk: una de las críticas que se asocian a los programas de cribado de cáncer de mama es el «sobre-diagnóstico» debido, en parte, a la detección de cánceres de crecimiento lento que hubieran pasado desapercibidos en ausencia de cribado y se ha sugerido que las firmas genéticas pueden contribuir a identificar los cánceres «indolentes». El ensayo, el Stockholm Tamoxifen Trial (STO-3) aleatorizó a las pacientes posmenopáusicas con ganglios negativos y RE+, de 3 cm o menos, a 2 o 5 años de tamoxifeno, o a ninguna terapia sistémica. Se realizó MmP a los casos de archivo y se identificó un grupo de tumores de riesgo de recidiva extremadamente bajo («ultra-low risk»), con o sin 5 años de terapia endocrina, durante más de 20 años de seguimiento desde el diagnóstico32. Se observó que la BCSS de las pacientes no tratadas con índices MammaPrint comprendidos entre > 0,355 y + 1 fue del 94% a los 20 años, en comparación con el 97% de las que recibieron 2 o más años de tamoxifeno. El grupo de tumores de «ultra-low risk» constituyen entre el 10 y el 15% de todos los cánceres32–34. Ni las características morfológicas ni inmunohistoquímicas (como el grado y el Ki67) pudieron identificar estos subconjuntos35. En cohortes de validación independientes, se observó una supervivencia específica por cáncer de mama del 100% a 15 años,lo que permitió acuñar el término de «carcinoma indolente»36, aunque el número de las pacientes incluidas en estos estudios fue demasiado pequeño para extraer conclusiones definitivas. Posteriormente, el análisis prospectivo exploratorio del subgrupo de pacientes incluido en el ensayo MINDACT, con un seguimiento medio de 8,7 años, demostró que las pacientes con MmP «ultra-low risk» (84%), tratadas con hormonoterapia (HT) solo o sin tratamiento sistémico, tuvieron un «intervalo libre de metástasis» del 97,4 y 97,8%, respectivamente, independientemente del riesgo clínico, tras 8 años de seguimiento. Las características morfológicas e inmunohistoquímicas de los tumores de MmP «ultra-low risk» difieren de la de otros tipos de tumor en que tienden a ser de menor diámetro (pT ≤ 20 mm) y de menor grado, mayor porcentaje de RP-positividad, HER2-negatividad y Ki67 bajo (< 15%). Además, la expresión de «hallmarks» de los tumores de «ultra-low risk» difieren también de la del resto de tumores en que muestran alta expresión de ESR137 y baja expresión de los genes implicados en la vía PI3K/Akt/mTOR, relacionados con la sensibilidad a HT y la supervivencia por cáncer de mama37,38. Dado que las recidivas en el grupo de tumores RE+ pueden ser tardías y que se necesitan más años de seguimiento para establecer definitivamente la supervivencia específica por cáncer de mama, el «intervalo libre de metástasis» fue considerado en este estudio como un «indicador temprano de supervivencia»39. Los resultados de todos los estudios disponibles actualmente parecen demostrar que la firma genética MmP es capaz de identificar un subgrupo de las pacientes con «ultra-low risk» de metástasis a distancia33. A pesar de los esfuerzos realizados para desescalar el tratamiento tanto quirúrgico como sistémico en el cáncer de mama, no conocemos actualmente ningún ensayo dirigido a investigar el desescalado de la H en las pacientes de bajo riesgo, a pesar de sus numerosos efectos secundarios y de las tasas de adherencia al tratamiento en la práctica clínica.
- •
I-SPY 2: por otra parte, los datos del ensayo neoadyuvante I-SPY 2 (Investigation of Serial Studies to Predict Your Therapeutic Response With Imaging And molecular Analysis 2) han identificado una respuesta diferencial a la QT y a las terapias dirigidas para los cánceres con índices MmP de AR en la parte inferior del rango (High 1) en comparación con los de la parte superior del rango (High 2)40,41. Cánceres con un índice MmP High 2 tenían una alta probabilidad de obtener una remisión patológica completa (pCR) con el inhibidor de PARP veliparib combinado con carboplatino42, así como a la inmunoterapia con el pembrolizumab combinado con paclitaxel42,43. MmP High 2 identificó cánceres de mama ER+ con probabilidad de responder a pembrolizumab, una terapia con poca actividad en cánceres de mama ER+ no seleccionados.
- •
Mammaprint en el sexo masculino: el cáncer de mama en el varón es raro (1–2% de todos los cánceres de mama), lo cual dificulta la realización de ensayos clínicos en este grupo de pacientes. Estudios recientes no encuentran diferencias en el índice MmP atribuibles al sexo. Los datos disponibles sugieren la existencia de distintas vías entre el cáncer de mama masculino y el femenino, y se ha sugerido sobre-regulación de la respuesta estrogénica y MTORC1 en el varón, lo que puede contribuir a la resistencia endocrina43. Son necesarios estudios adicionales para determinar el seguimiento de estos pacientes; sin embargo, los resultados iniciales confirman el rendimiento de MmP también en el cáncer de mama masculino y proporcionan una nueva visión de los mecanismos subyacentes al cáncer de mama en este grupo de pacientes44.
- •
FLEX: el ensayo MINDACT proporcionó los primeros datos aleatorizados prospectivos que respaldan la utilidad clínica del ensayo genético MmP en el cáncer de mama en fase inicial y proporcionará una rica fuente de datos adicionales en los próximos años a medida que se realicen otros sub-estudios y un seguimiento adicional. El perfil de expresión genética con MmP tiene la capacidad de identificar el riesgo de metástasis temprana, la probabilidad de supervivencia específica de la enfermedad a largo plazo sin tratamiento y la probabilidad de respuesta a terapias dirigidas. Actualmente, se está recopilando el análisis del transcriptoma completo a través del ensayo FLEX (Full-genome Data Linked with Clinical Data to Evaluate New Gene Expression Profiles, patrocinado por Agendia), en el que los datos obtenidos del transcriptoma completo se correlacionarán con los datos clínicos.
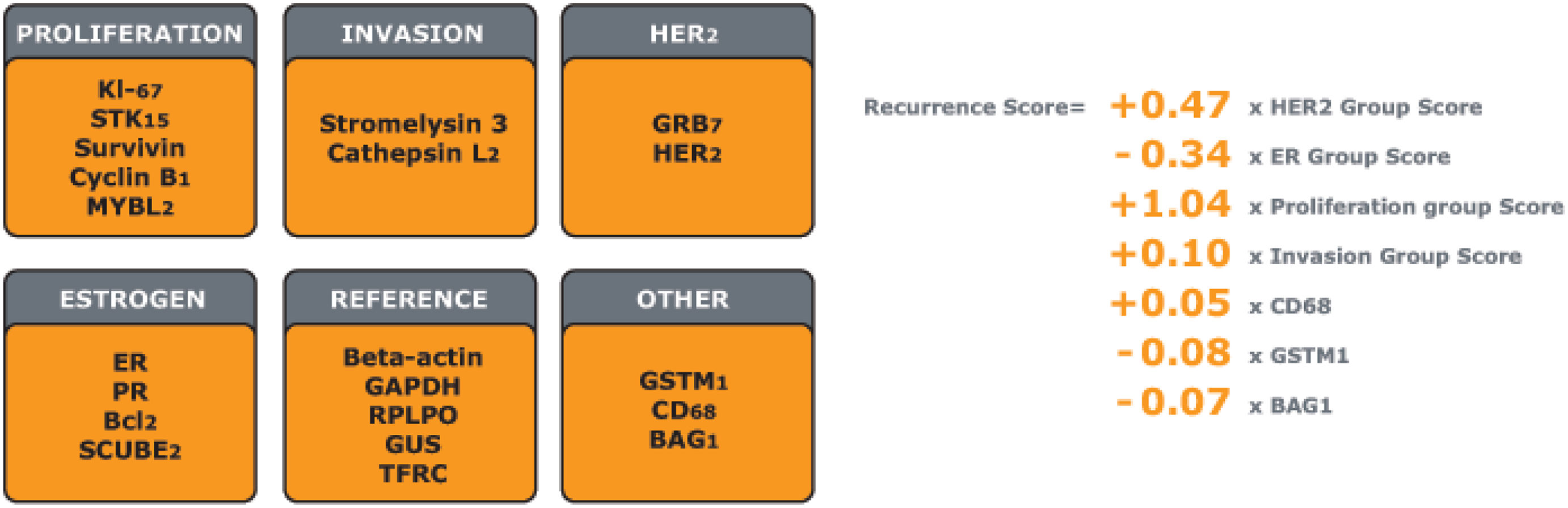
El test Oncotype DX® fue desarrollado por la compañía Genomic Health Inc., actualmente es propiedad de Exact Sciences Corp. Fue el primer test validado clínicamente y es probablemente la plataforma con mayor cuerpo de evidencia científica. El test Oncotype DX® cuantifica la expresión de 21 genes (16 genes tumorales +5 genes de referencia) en muestras de cáncer de mama en estadio temprano mediante la técnica de reacción en cadena de la polimerasa con transcriptasa inversa en tiempo real (RT-PCR). La prueba se realiza en muestras de tejido tumoral fijado en formaldehído e incrustado en parafina. Las muestras se procesan en un laboratorio central regulado por la Ley de Mejora de los Laboratorios Clinicos (CLIA) americana y por el Colegio de Patólogos Americanos (CAP). El test Oncotype DX® asocia un algoritmo que calcula un resultado Recurrence Score® (RS),con base en la expresión de los 21 genes analizados, con un valor entre 0 y 100 (fig. 1). Este resultado permite identificar de forma individual qué pacientes con tumores HR+ y HER2- necesitan recibir QT como parte de su tratamiento adyuvante.
Panel de 21 genes y algoritmo de cálculo del resultado de Recurrence Score®. Adaptado de Paik et al.45.
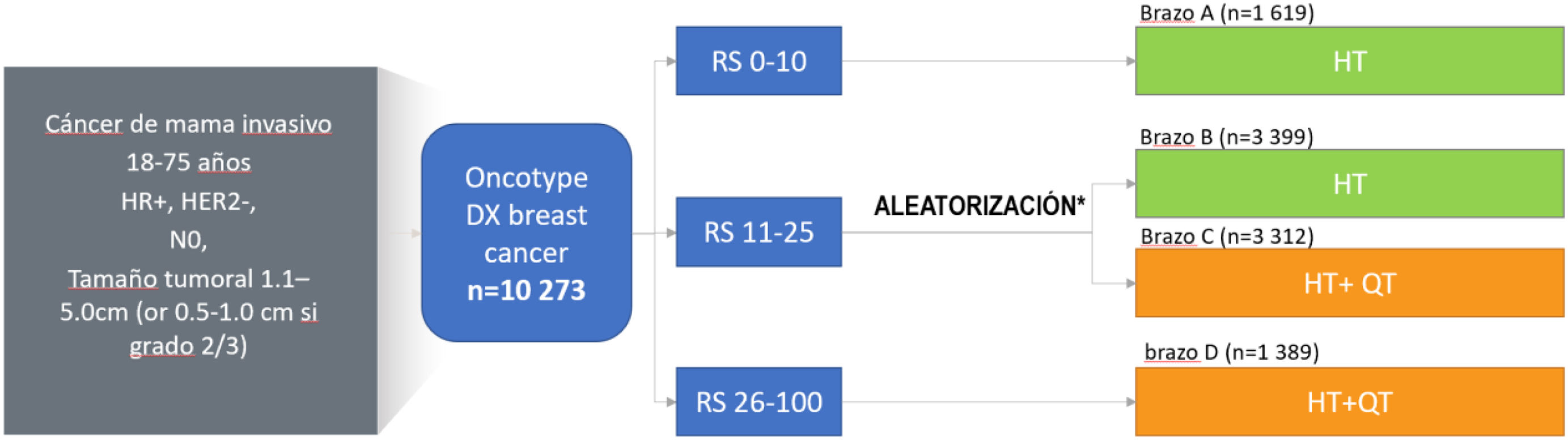
El test Oncotype DX fue específicamente validado para predecir el riesgo de recidiva (pronóstico) y el beneficio de la QT adyuvante a 10 años (predicción) a través de 2 estudios aleatorizados (NSABP B-20 y TAILORx). En ellos se comparó directamente el uso de HT versus quimiohormonoterapia (HT + QT). En el estudio NSABP B-2045, se incluyeron 651 pacientes N0, demostrándose el valor predictivo del RS a través de un resultado de interacción clínicamente significativo (p = 0,038). El análisis de los resultados pudo determinar que las pacientes con un RS > 30 mostraban un claro beneficio derivado del uso de HT + QT (28% reducción absoluta de la recurrencia a distancia a 10 años), mientras que en aquellas con un RS < 18 el beneficio de este mismo tratamiento resultó mínimo. En el estudio no pudo determinarse la posibilidad de un beneficio clínicamente significativo en las pacientes con resultado RS intermedio (RS 18–30). A esta cuestión le dio una respuesta definitiva el estudio TAILORx46, un estudio prospectivo, randomizado, con seguimiento a 9 años y realizado en más de 10.000 pacientes (fig. 2), que demostró la ausencia de beneficio de la QT para todas las pacientes con un RS ≤ 25. El estudio TAILORx permitió además ajustar estos resultados y determinar el potencial beneficio de la QT según la edad de las pacientes (< 50 versus > 50 años) (tabla 1). Las conclusiones del TAILORx han sido respaldadas por estudios en mundo real con más de 80.000 pacientes47.
Diseño del estudio TAILORx. Adaptado de Sparano et al.29.
El estudio TAILORx permitió refinar los resultados del estudio NASBP B20 y analizar los resultados en función de la edad de las pacientes
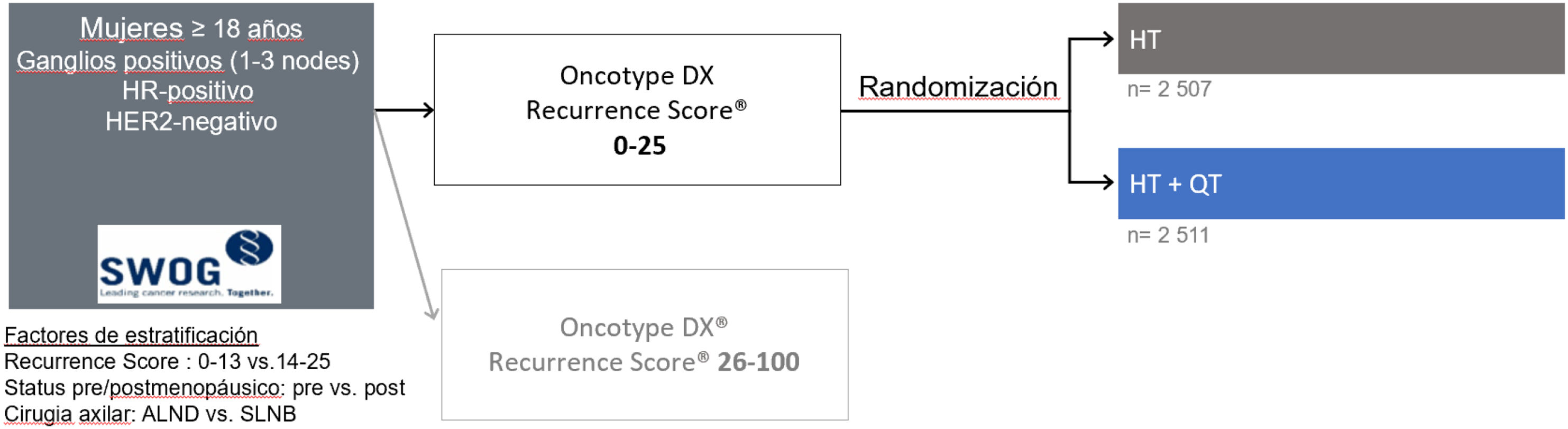
El valor pronóstico y predictivo del RS en las pacientes N1 fue demostrado a través de los estudios randomizados SWOG 8814 y RxPONDER de una manera semejante a las pacientes N0. El análisis de las 367 pacientes incluidas en el estudio SWOG 881448 demostró el valor predictivo del RS a los 5 años (p = 0,029) y permitió establecer la existencia de un claro beneficio de la QT + HT (19% beneficio absoluto) para las pacientes con un RS > 30. Por el contrario, las pacientes con un RS < 18 asociaron un beneficio mínimo o nulo. Tal y como ocurrió en el NSABP B20, tampoco en el estudio SWOG 8814 se pudo determinar la posibilidad de que algunas pacientes con resultados RS intermedio (RS 18–30) pudiesen obtener un beneficio clínicamente significativo del uso de QT + HT. El estudio RxPONDER49, aún en marcha, es un estudio prospectivo, randomizado (fig. 3), realizado en > 5.000 pacientes con afectación de 1–3 ganglios (incluyendo micrometástasis). Sus primeros datos han demostrado tanto la ausencia de beneficio de la QT + HT a 5 años para las pacientes posmenopáusicas con un RS ≤ 25, como el beneficio de este mismo tratamiento para las pacientes premenopáusicas con RS ≤ 25 (tabla 2).
Diseño del estudio RxPONDER. Adaptado de Kalinsky et al.49.
El análisis preplanificado del estudio RxPONDER permitió refinar los resultados del estudio SWOG 8814 y demostró que las pacientes posmenopáusicas N1 con RS ≤ 25 no reciben un beneficio significativo de la adición de quimioterapia a su tratamiento. Por el contrario, las pacientes premenopáusicas dentro de ese mismo intervalo sí obtienen una mejora en sus resultados clínicos (beneficio en términos de intervalo libre de recurrencia a distancia)
| Total pacientesN = 5.018 | RS 0–25 | RS 26–100 |
|---|---|---|
| PostmenopáusicasN = 3.350 | Sin beneficio QT | Claro beneficio QT |
| PremenopáusicasN = 1.665 | Beneficio QT ≈ 2,9% * | Claro beneficio QT |
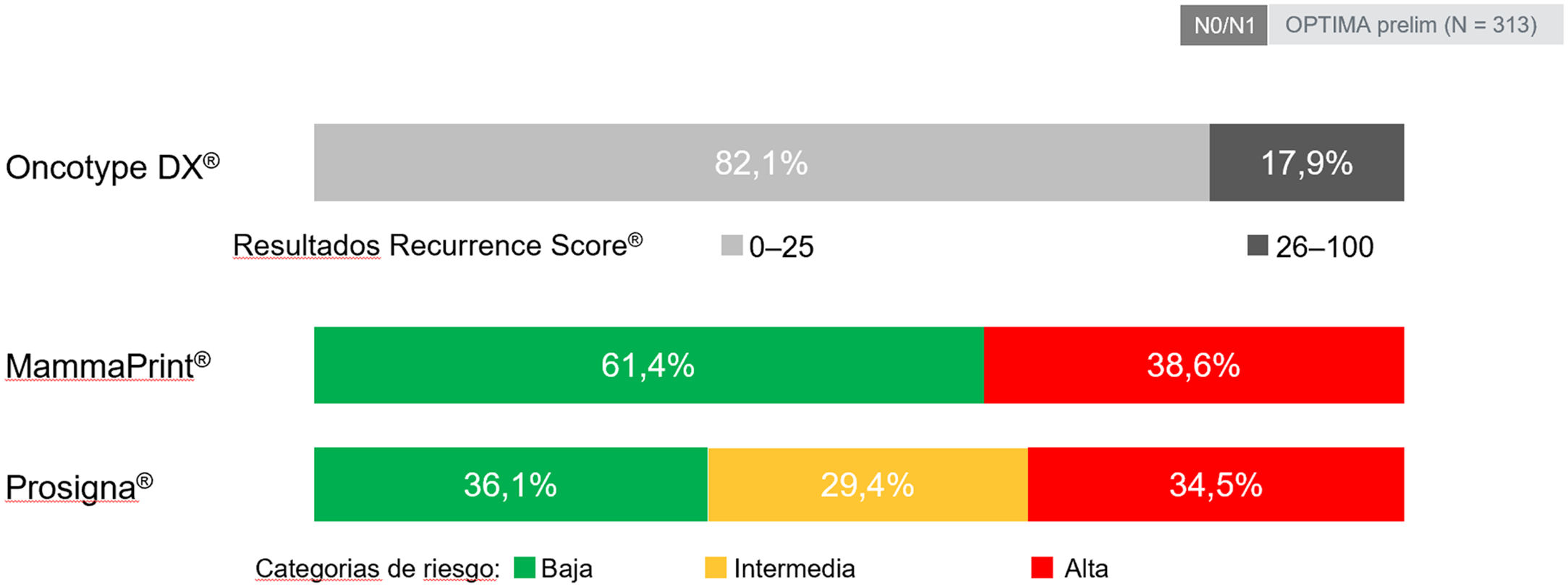
Varios estudios, incluyendo revisiones sistemáticas y metaanálisis comparativos en > 12.000 pacientes, señalan a Oncotype DX® como la plataforma que clasifica un menor número de pacientes como de alto riesgo50,51 (fig. 4), que asigna un menor porcentaje de QT y que al mismo tiempo asocia un menor número de recurrencias52. Múltiples estudios de impacto de decisión demuestran > 30% de cambio en las recomendaciones de tratamiento en pacientes N053,54 y estudios recientes muestran > 60% de reducción en el uso de QT adyuvante en pacientes N155–57. Por otra parte, estudios de costo-efectividad, tanto internacionales como estudios realizados en el entorno santitario español, han demostrado que el uso de Oncotype DX conduce a un ahorro de costes, incluso con respecto a otras plataformas58,59.
Resultados de la fase preliminar del estudio OPTIMA, realizado por el NIHR UK, y en el que se compararon los resultados agrupados según la clasificación de riesgo de distntas plataformas tomando como referencia a Oncotype DX. Adaptado de Bartlett et al.105.
Estudios de validación y evidencia clínica en neoadyuvancia
Diferentes estudios demostraron la viabilidad de realizar la prueba Recurrence Score en muestras de biopsia-core. Aproximadamente, el 13% de las muestras recibidas en el laboratorio de Genomic Health (N = 972.673), fueron muestras de biopsia-core. Se obtuvo una tasa de éxito del 94,5%, demostrándose además unos perfiles de expresión génica prácticamente idénticos entre las muestras de biopsia-core y las muestras procedentes de piezas quirúrgicas. El análisis de las 131.275 muestras de biopsia disponibles en el laboratorio central de Genomic Health es el de mayor tamaño realizado hasta la fecha en muestras de este tipo60.
Por otra parte, múltiples estudios han señalado que existe una asociación entre el resultado Recurrence Score y el grado de respuesta al tratamiento con quimioterapia neoadyuvante, especialmente en cuanto a la obtención de mayores tasas de respuestas patológicas completas en las pacientes con valores Recurrence Score altos61–68. Resulta además destacable el hecho de que prácticamente la mitad de las pacientes candidatas a recibir QT neoadyuvante según criterios clinicopatológicos clásicos, podrían evitar la QT, y al mismo tiempo que se mejoraría la selección de aquellas pacientes que se beneficiarán clínicamente de este tratamiento69,70,79. Esto ha sido estudiado de manera más específica en cohortes de pacientes jóvenes (≤ 40 años) habiéndose observado resultados similares71. El estudio TransNEOS fue diseñado para determinar el valor predictivo del RS sobre la respuesta a la HT neoadyuvante72. Se incluyeron un total de 295 pacientes, encontrándose una asociación clínicamente significativa entre el grupo de Recurrence Score (RS 0–17 versus RS 31–100) con la tasa de respuesta clínica (prueba χ2, p < 0,001).
Guías clínicas e instituciones de evaluación de tecnologías sanitariasOncotype DX es la plataforma que cuenta con mayor de consenso respecto a su capacidad predictiva en las guías de manejo terapéutico tanto nacionales como internacionales (tabla 3): European Society for Medical Oncology (ESMO)73, American Society of Clinical Oncology (ASCO)74, St. Gallen75, Sociedad Española de Oncología Médica (SEOM)76, guía de consenso SEOM-Sociedad Española de Anatomía Patológica (SEAP)77. Oncotype Dx ha sido además referenciada de forma explícita como opción de preferencia y como el único test con capacidad predictiva tanto en las pacientes posmenopáusicas como premenopáusicas en la última versión de las guías de la National Comprehensive Cancer Network (NCCN)78, y es la única plataforma con capacidad de re-estadificación según las actuales guías del American Joint Committee on Cancer (AJCC)79. Oncotype DX® cuenta con la aprobación de agencias oficiales como el National Institute for Health and Care (NICE)80 y ha sido el único test comercial aprobado por la Agencia Alemana de Evaluación de Tecnologías Sanitarias (IQWIG)81.
Resumen de recomendaciones por parte de guías clínicas y organismos oficiales de evaluación de tecnologías sanitarias
| Organo de recomendación | Fecha | Oncotype Dx |
|---|---|---|
| NCCN versus 32021 | 2021 | Única plataforma reconocida por las guías NCCN como predictiva del beneficio de la quimioterapia adyuvante y único test considerado como «opción de preferencia»” en las pacientes N0 y posmenopáusicas N1. Nivel de evidencia IA |
| ESMO | 2019 | Puede ser usado para obtener información predictiva y/o pronóstica adicional con nivel de evidencia IA, así como para complementar el análisis patológico y predecir el beneficio de la quimioterapia adyuvante |
| ASCO | 2019 | Puede utilizarse para guiar las decisiones sobre el uso de quimioterapia sistémica adyuvante basándose en los puntos de corte del estudio TAILORx en las pacientes con ganglios negativos |
| St Gallen | 2019 | Plataforma sólidamente respaldada para la amplia mayoría de las pacientes con cáncer de mama en fase inicial N0 y N1. Los puntos de corte de los estudios TAILORx y RxPONDER pueden ser usados para guiar las decisiones de tratamiento |
| SEOM 2018 | 2018 | Única plataforma con capacidad de predicción de beneficio de la quimioterapia. Nivel de evidencia IA |
| NICE | 2018 | Única prueba considerada como predictiva del beneficio de la quimioterapia, por lo que proporciona una opción costo-efectiva en las pacientes con cáncer de mama en estadio temprano, con ganglios negativos y micrometástasis |
| IQWIG | 2018 | Único test con demostración de beneficio con base en su superior nivel de evidencia y única plataforma considerada para reembolso público. Una de las principales conclusiones de IQWIG fue la no equiparabilidad de Oncotype DX con otros test genómicos |
| SEOM-SEAP 2017 | 2017 | Única plataforma con capacidad predictiva y nivel de evidencia IA |
| AJCC 8th edition | 2016 | Único test incorporado en el proceso de estadificiación en base a su superior nivel de evidencia |
EndoPredict® (EP) es un perfil de expresión génica de segunda generación diseñado para determinar el riesgo de recaída temprana y tardía en las pacientes diagnosticadas de carcinoma de mama RE+ /HER2- con hasta 3 ganglios linfáticos axilares positivos tratadas únicamente con terapia endocrina. El test mide los niveles de expresión de ARNm de 12 genes mediante un proceso de reacción en cadena de polimerasa reversa (RT-PCR) cuantitativa a partir de tejido fijado en formol e incluido en parafina. A partir de estos genes, el test proporciona un índice molecular denominado EP (actualmente denominado índice molecular de 12 genes). La puntuación EP tiene un rango de valores entre 0 y 15, siendo el 5 el punto de corte que discrimina dicotómicamente entre las categorías de bajo y alto riesgo de metástasis a distancia. Adicionalmente, mediante la combinación de la información molecular del índice EP y 2 variables clínico-patológicas (tamaño tumoral y número de ganglios linfáticos afectos) se elabora un índice denominado EPClin, que clasifica a las pacientes en alto o bajo riesgo de recaída de forma más precisa que EP. En este caso, el punto de corte se establece en 3,3, que corresponde a un riesgo de recaída a 10 años del 10%82 (EPClin de bajo riesgo < 3,3; EPClin de alto riesgo ≥ 3,3). El índice EPClin ha demostrado su utilidad en la predicción del riesgo de recidiva temprana y tardía de la enfermedad, de forma que se emplea en clínica con el objetivo de administrar tratamiento quimioterápico adyuvante únicamente a las pacientes con un alto riesgo de recidiva asociado2. Estos 2 índices pronósticos han sido validados en diferentes ensayos clínicos aleatorizados en fase III (ABCSG-6 y ABCSG-8), tanto en las pacientes premenopáusicas como posmenopáusicas82–84. Además, se trata de un test descentralizado que puede realizarse a nivel local en la práctica clínica diaria85,86. Estudios recientes han demostrado que EP y EPClin tienen una mayor capacidad de predicción pronóstica que los índices pronósticos clínico-patológicos tradicionales87,88. El test ha sido validado tanto en las piezas quirúrgicas de resección como en las BAG89. En este último caso, la cantidad de ARN que se obtiene a partir de la muestra es considerablemente más reducida que la obtenida a partir de la pieza quirúrgica, pero, aun así, es suficiente para poder realizar el test de forma fiable.
Desarrollo de test y justificación científica de los genes incluidos en el panelEndoPredict® se desarrolló el año 2011 a partir de muestras de 964 pacientes con cáncer de mama RE+ /HER2- tratadas con cirugía seguida de HT adyuvante con tamoxifeno 1. La mediana de edad de las pacientes de esta cohorte fue de 65,8 años (rango, 40,0 a 93,5 años). Para la selección de los genes incluidos en el test se realizó un análisis exhaustivo de los datos de expresión génica obtenidos mediante microarrays en las pacientes de cáncer de mama RE+/HER2–82–90. Así, se determinó que el panel final con mayor capacidad pronóstica y fiabilidad mediante RT-qPCR estaba formado por 8 genes diana, 3 de ellos relacionados con la regulación de la proliferación celular (BIRC5, UBE2C, DHCR7) y los 5 restantes involucrados en mecanismos de señalización hormonal (RBBP8, IL6ST, AZGP1, MGP y STC2), 3 genes de referencia (CALM2, OAZ1, RPL37A) y un gen de control para detectar posible contaminación en los ácidos nucleicos (HBB). Por tanto, los 8 genes que conforman la parte nuclear del test están implicados en procesos de proliferación celular, apoptosis, reparación del ADN y adhesión celular y, a su vez, están co-regulados por genes involucrados en 2 procesos biológicos que contribuyen al riesgo de recidiva en el cáncer de mama: la proliferación y la señalización mediada por el receptor de estrógeno91.
Validación técnica y validación clínica del testPara la validación técnica de EndoPredict® se realizaron tanto análisis de reproducibilidad del test como de los posibles factores que pudiesen alterar los resultados del mismo: los límites de detección, el rango lineal entre la concentración de la muestra y los valores obtenidos de EP y el rango de ARN necesario para el análisis92. La reproducibilidad y fiabilidad del test se demostró en un estudio comparativo entre 7 laboratorios diferentes utilizando la misma instrumentación y reactivos tanto para la extracción de ARN como para la RT-qPCR; se obtuvo una concordancia del 100% en relación con las categorías de riesgo (alto y bajo riesgo) en los 10 tumores estudiados con diferencias en los valores de EP inferiores a uno respecto al valor de referencia predefinido93. Para determinar cómo las condiciones preanalíticas pueden alterar los resultados se analizaron parámetros que pueden afectar a la calidad del ARN, como el tiempo o la temperatura de almacenamiento de la muestra hasta su fijación, el tiempo de fijación, el contenido tumoral de la muestra o el tiempo de almacenamiento del ARN extraído91.
La validación clínica de EndoPredict® se realizó de forma retrospectiva utilizando una cohorte de 1.702 pacientes posmenopáusicas con cáncer de mama RE+/HER2-, con ganglios negativos o positivos, tratadas con terapia endocrina, incluidas en los ensayos ABCSG-6 (estudio realizado en mujeres posmenopáusicas con cáncer de mama RE+ en estadios tempranos con el fin de valorar si el tratamiento combinado durante 2 años de tamoxifeo con aminoglutetimida 500 mg, seguido de 3 años con solo tamoxifeno presentaba mejores resultados que un tratamiento de 5 años con solo tamoxifeno) (n = 378) y ABCSG-8 (mujeres posmenopáusicas con cáncer de mama ER+ en estadios tempranos con el objetivo de comparar si 2 años de tratamiento con tamoxifeno seguidos de 3 años con anastrozol mejoraban los resultados de supervivencia frente a continuar esos 3 años con tamoxifeno) (n = 1.324)82. EP clasificó aproximadamente a la mitad de las pacientes como de bajo riesgo, con un riesgo de recidiva a los 10 años del 8% en el ensayo ABCSG-6 y del 6% en el ensayo ABCSG-8, que excluyó a las pacientes con carcinomas grado 3 de acuerdo al diseño original del estudio. El riesgo de recidiva a 10 años para las pacientes clasificadas como de alto riesgo por la puntuación EP fue del 22 y del 15%, respectivamente. EPClin clasificó a más de la mitad de las pacientes (55–60%) como de riesgo bajo, con un riesgo de recaída a los 10 años del 4% en los 2 ensayos. En el caso de los tumores categorizados como de alto riesgo mediante EPClin, el riesgo de recaída se estimó entre el 22% (ensayo ABCSG-6) y el 28% (ensayo ABCSG-8). Además, en estos estudios se demostró el valor discriminatorio de la puntuación EPClin cuando se analizó el valor pronóstico en diferentes subgrupos de alto y bajo riesgo definidos por características clínico-patológicas (el tamaño tumoral, el grado histológico, el estadio ganglionar, Ki67 y las categoría de riesgos por Adjuvant!Online). De acuerdo a los criterios SIGN (Scottish Intercollegiate Guidelines Network) estos estudios presentan un nivel de evidencia 2+ (estudio de cohortes bien realizado con bajo riesgo de sesgos)94. Los datos de estos ensayos se han actualizado tras un seguimiento de 16 años y confirman la validez pronóstica de EPClin para recaídas tardías (5–15 años). Así, el 95,7% de las 1.386 pacientes con un EPClin de bajo riesgo continuaban libres de recaída a los 5 años del diagnóstico inicial frente al 84,1% de las pacientes con EPClin de alto riesgo (HR 4,52; 95% CI 2,65-7,22, p < 0,0001)95. La conclusión de este estudio es que EndoPredict® permite evitar la administración prolongada de HT adyuvante en las pacientes con cáncer de mama y EPClin de bajo riesgo.
En los últimos años, se ha explorado la utilidad de EndoPredict® en los diferentes escenarios clínicos, como son su uso en las pacientes premenopáusicas o en el contexto de la terapia neoadyuvante (tanto QT como HT neoadyuvante). En este sentido, Martin et al., analizaron una serie de pacientes tanto premenopáusicas como posmenopáusicas con cáncer de mama RE+/HER2- y metástasis en al menos 1 ganglio linfático tratadas con 2 regímenes de QT (subestudio dentro del ensayo GEICAM/9906)96. Este estudio incluyó 555 pacientes (250 pacientes < 50 años y 305 pacientes ≥ 50 años) que fueron randomizadas para recibir 6 ciclos de fluoracilo, epirrubicina y ciclofosmamida (FEC) o 4 ciclos de FEC y, a continuación, 8 ciclos semanales de paclitaxel (FEC-P). El intervalo libre de metástasis a 10 años en el subgrupo de las pacientes < 50 años (premenopáusicas) fue de 93% para las categorizadas como de bajo riesgo frente al 67% para las pacientes de alto riesgo (p < 0,0001). La información pronóstica proporcionada por EndoPredict® fue independiente de la edad (< 50 versus ≥ 50 años), tamaño y grado tumoral, estado de los ganglios linfáticos axilares e índice de proliferación (Ki67). Por otro lado, el valor predictivo de EndoPredict® en relación con la respuesta patológica completa (pCR) en las pacientes con cáncer de mama RE+/HER2- tratadas con QT neoadyuvante fue estudiado por primera vez en una serie de 553 pacientes97. Al valorar la pCR en los 2 grupos de riesgo establecidos por el índice EP se observó una correlación entre el índice EP y la respuesta al tratamiento, siendo esta inferior en el grupo de bajo riesgo (7%, 19/283 pacientes) comparado con el grupo de alto riesgo (17%, 45/270) (p < 0,001). Más recientemente, Dubsky et al., observaron resultados similares en un estudio que incluyó 134 pacientes con cáncer de mama RE+ tratado con QT/HT neoadyuvante en el ensayo ABCSG-34. Ninguna de las 9 pacientes de bajo riesgo mostró una clase de respuesta RCB 0-I (valor predictivo negativo 100%; 95% IC 66,4%–100%), mientras que 33 de 125 pacientes de alto riesgo presentaron una clase de respuesta RCB 0-I después de QT neoadyuvante (valor predictivo positivo 26,4%; 95% IC 18,9%-35,0%). En el mismo estudio, 83 pacientes fueron tratadas con HT neoadyuvante. En este caso, se observó mayor tasa de respuesta RCB 0-I en las pacientes con enfermedad de bajo riesgo (12/44; 27,3%) en comparación con aquellas con enfermedad de alto riesgo (3/39; 7,7%). De acuerdo a este estudio, EndoPredict® parece ser útil para predecir la respuesta patológica en el contexto de la QT/HT neoadyuvante en las pacientes con cáncer de mama RE+/HER2- siendo poco probable que los tumores clasificados como de bajo riesgo se beneficien de la QT neoadyuvante, mientras que una categoría de alto riesgo parece predecir resistencia a HT neoadyuvante98.
Impacto de EndoPredict® en la toma decisiones clínicasMüller et al., analizaron el impacto de EndoPredict® en la toma de decisiones clínicas en una serie de 167 carcinomas de mama, aunque únicamente se dispuso de la información completa del tratamiento en 130 casos (77,8%)4. Antes de la realización del test, 47 pacientes (36,2%) se consideraron para tratamiento hormonal adyuvante. En las restantes 83 pacientes (63,8%) se propuso un tratamiento combinado (QT y HT). Tras conocer el resultado de EndoPredict®, el número de pacientes propuestas para HT subió a 67 (51,5%) mientras que el número de pacientes asignadas para un tratamiento combinado descendió a 62 (47,7%). Por tanto, EndoPredict® supuso una modificación en la opción terapéutica en el 37,7% de las pacientes, con una reducción en el número de pacientes tratadas con QT adyuvante85. Estudios recientes han reportado resultados similares, con una reducción significativa de la indicación de QT adyuvante tras el uso de EndoPredict® (entre el 9–33%), incluyendo también pacientes premenopáusicas99–100. Sin embargo, otros estudios sugieren que EPClin puede apoyar cambios en las recomendaciones terapéuticas, favoreciendo el empleo de QT adyuvante en un amplio rango de pacientes (19–80%)101,102.
Indicaciones de Endopredict®En los últimos años, se han publicado numerosos estudios que analizan la validez clínica de este test genómico y que indican que en cáncer de mama RE+/HER2- EndoPredict®:
- •
Clasifica a las pacientes en 2 grupos (alto y bajo riesgo) de recaída a distancia a 5 y 10 años en mujeres pre y posmenopáusicas con o sin afectación ganglionar.
- •
Identifica carcinomas que no precisan de QT adyuvante debido a su baja probabilidad de recaída a 10 años.
- •
Identifica carcinomas que no precisan de HT extendida más allá de 5 años por su baja probabilidad de recaída tardía.
EndoPredict® ha sido clasificado con un nivel de evidencia I para la evaluación de biomarcadores pronósticos y predictivos103 y se ha incorporado en las guías internacionales de manejo del cáncer de mama precoz para valorar el beneficio de la QT adyuvante en las pacientes pre y posmenopáusicas con cáncer de mama RE+/HER2- con ganglios linfáticos axilares negativos (ASCO, ESMO, St. Gallen, AGO, etc-)104. Sin embargo, EndoPredict® todavía no se recomienda en las guías clínicas en el caso de los tumores con ganglios linfáticos axilares positivos.
Perspectivas de futuroEl mayor conocimiento sobre el diagnóstico y el tratamiento en cáncer de mama ha impulsado el desarrollo de nuevas herramientas genómicas con valor pronóstico y predictivo. Estos perfiles génicos clasifican de forma similar a las pacientes con cáncer de mama en relación a las categorías de riesgo, aunque existen diferencias importantes entre los diferentes ensayos a nivel individual105–107. Estudios más recientes indican que la inclusión de variables clínico-patológicas, como el tamaño tumoral y el estado de los ganglios linfáticos, tal y como ocurre en el índice EPclin, mejora la capacidad pronóstica de estos perfiles96. Todavía está por determinar el valor clínico real de EndoPredict® en el escenario de la neoadyuvancia, incluyendo tanto la QT como la HT neoadyuvante.
PAM50IntroducciónA lo largo de los últimos años, las plataformas de expresión génica se están convirtiendo una herramienta cada vez más utilizada para poder realizar una correcta estratificación, pronóstico y tratamiento del cáncer de mama.
Perou, en el año 2000, fue el primero en clasificar molecularmente el cáncer de mama. La hipótesis de este trabajo era que la diversidad fenotípica del cáncer de mama era el resultado de la diversidad en los patrones de expresión génica que podían ser estudiados por cada uno de los subtipos. Identificaron un conjunto de 496 genes que presentaban una mayor variabilidad en cuanto a su expresión entre los distintos grupos de tumores, pero mínimamente variables entre las muestras de una misma paciente108,109. Según el nivel de expresión de estos genes, se clasificaron los tumores de cáncer de mama en 4 diferentes subtipos (denominados los subtipos intrínsecos del cáncer de mama): Luminal A, Luminal B, HER2-enriched (HER2-E) y seudobasal. En 2009, a partir de los 496 genes seleccionados inicialmente en el estudio de Perou, Parker et al., simplificaron la firma a 50 genes clasificadores y 5 genes de control. Esta firma, denominada PAM50, permite identificar, a día de hoy, los diferentes subtipos intrínsecos y medir el riesgo de recidiva (ROR) que aporta la supervivencia libre de recaída para los pacientes con tumores ganglios negativos110.
Mediante la determinación de la expresión de diversos genes y de variables clínicas, el test Prosigna, permite identificar los diferentes subtipos intrínsecos de cáncer de mama (Luminal A, Luminal B, HER2E y seudobasal) que han demostrado tener diferencias en cuanto a la incidencia, la prevalencia, el pronóstico y la sensibilidad a los tratamientos, además de determinar el riesgo de recurrencia (ROR, un score del 0–100) a 10 años. Hoy en día, se puede utilizar el Test Prosigna para guiar el tratamiento adyuvante en las pacientes con cáncer de mama precoz.
Subtipos intrínsecos del cáncer de mamaSegún el nivel de expresión de los genes incluidos en el PAM50, se pueden agrupar los tumores de cáncer de mama en 4 diferentes subtipos: Luminal A, Luminal B, HER2-E y seudobasal. Conocidos como los subtipos intrínsecos del cáncer de mama, estas entidades han demostrado diferencias significativas en cuando a su incidencia, los factores de riesgo, el pronóstico y la sensibilidad al tratamiento110–115. Lo que es más relevante, es que la evidencia acumulada sugiere que estas entidades moleculares proporcionan información pronóstica más allá de las clasificaciones estándar basadas en inmunohistoquímica (IHQ)116.
Subtipos luminales A y BLos subtipos uminales corresponden a los tumores que presentan una expresión de receptores hormonales (receptor de estrógeno +/− receptor de progesterona) positivos. Además, tienen un patrón de expresión propio del epitelio luminal que incluye citoqueratinas (CK) de bajo peso molecular 8 y 18, RE y genes relacionados con la activación de RE como LIV1, CCDN1 y GATA 3. En general, es un subtipo donde los tumores son de bajo grado y menos del 20% presentan mutaciones en p53. Cuando nos referimos al subtipo luminal podemos dividirlo en 2 subtipos: el luminal A y el luminal B108,117.
El subtipo luminal A tiene una alta expresión de RE y de genes relacionados con RE, una baja expresión de genes HER2 y una menor expresión de genes de proliferación, incluido Ki67109,118. A pesar de las diferencias en el número y la selección de los genes analizados en los distintos perfiles de expresión, en todos ellos se ha demostrado que el subtipo luminal A representa el fenotipo de mejor pronóstico119, así como el más sensible a tratamientos hormonales13.
El subtipo luminal B presenta una moderada expresión de RE y una menor expresión de genes relacionados con RE, variable expresión de los genes HER2, alta expresión de los genes de proliferación y más frecuencia de mutaciones en p53. Implica peor pronóstico que el subtipo luminal A, ya que este subtipo implica un mayor riesgo de recurrencia local y a distancia120.
Respecto al pronóstico, en el cáncer de mama temprano, la enfermedad Luminal B tiene un peor resultado en supervivencia libre de eventos (SLE) a 5 y 10 años, independientemente de la terapia sistémica adyuvante en comparación con la enfermedad de luminal A121,122. En la gran mayoría de los estudios, las 3 variables principales para predecir los resultados en el cáncer de mama son el estado ganglionar, el tamaño del tumor y el subtipo intrínseco. Es de destacar, que la gran mayoría de estos estudios con seguimiento a largo plazo muestran que las curvas de SLE de los tumores Luminal B cruzan las curvas de supervivencia de la enfermedad Basal-like112. Además, el valor pronóstico de los subtipos intrínsecos se ha evaluado retrospectivamente en al menos 3 estudios de enfermedad metastásica RH-positiva/HER2-negativa123–125. Consistentemente en los 3 estudios, la enfermedad de luminal B se asoció de forma independiente con una menor supervivencia libre de progresión en comparación con el resto de los tumores de luminal A.
Subtipo HER2-ENRICHEDRepresenta el 10–-15% de los tumores de mama y se caracteriza por la alta expresión de los genes relacionados con el receptor del factor de crecimiento, como ERBB2 y/o FGFR4, y de los genes relacionados con el ciclo celular, y la baja expresión de los genes relacionados con los receptores hormonales, así como la baja expresión de genes relacionados con la biología basal (por ejemplo, CK 5 y FOXC1)111. A nivel de DNA, estos tumores muestran el mayor número de mutaciones en todo el genoma, y el 72 y el 39% de los tumores HER2-E están mutados por TP53 y PIK3CA, respectivamente126. Curiosamente, el subtipo HER2-E se ha encontrado enriquecido de forma única para tumores con alta frecuencia de mutaciones asociadas a APOBEC3B. APOBEC3B es una subclase de APOBEC citidina desaminasas, que convierten la citosina en uracilo y se ha relacionado como una fuente de mutaciones en muchos tipos de cáncer127. Diferentes datos publicados han observado que tumores con este subtipo son más sensibles a terapias anti-HER2114,128.
Subtipo seudobasalRepresenta el 15% de los tumores de mama y se caracteriza por la escasa expresión de genes luminales y genes relacionados con la vía de HER2. Representan la mayor parte de tumores con ausencia de expresión del RE, RP y HER2 determinado por IHQ, los denominados triples negativos. Una característica relevante de este subtipo, es que se ha relacionado con la mutación del gen de BRCA1 observándose que más del 80% de los tumores diagnosticados en las pacientes portadoras de la mutación de BRCA1 son seudobbasal129. Sin embargo, la mayoría de los tumores seudobasales son esporádicos y el gen y la proteína BRCA1 son normales.
Se caracterizan por un alto índice de mutaciones en p53, sobre expresar CK de alto peso molecular como la CK 5, 14 y 17, así como laminina, la p-cadherina, caveolinas 1 y 2, nestina, cd44, cKIT y EGFR. Como cabe esperar su ausencia de expresión de RE y su alta capacidad de replicación, este subtipo de cáncer de mama conlleva el peor pronóstico111,118,130.
Para concluir este apartado, un dato que destaca la importancia de los subtipos intrínsecos en el cáncer de mama proviene de uno de los estudios de caracterización molecular más completos que se hayan realizado en el cáncer de mama. En este estudio, liderado por TCGA, más de 500 cánceres de mama primarios se caracterizaron a nivel de DNA (metilación, cambios en el número de copias cromosómicas y mutaciones somáticas y de la línea germinal), RNA (es decir, de microRNAs [miRNA] y mRNA) y proteico (expresión de proteínas y de fosfo-proteínas). En un análisis particular de más de 300 tumores primarios, los 5 tipos diferentes de datos (todos excepto las mutaciones del ADN) se combinaron en un cluster para identificar cuántos grupos de tumores biológicamente homogéneos se podían identificar en el cáncer de mama. Los resultados de la agrupación mostraron la presencia de 4 entidades principales del cáncer de mama, pero, lo que es más importante, estas 4 entidades se encontraron muy bien recapituladas por los 4 subtipos intrínsecos principales (luminal A, luminal B, HER2-E y seudobasal) como se define solo por la expresión de mRNA. En general, estos resultados sugieren que los subtipos intrínsecos capturan la gran mayoría de la diversidad biológica que ocurre en el cáncer de mama (tabla 4)126.
Subtipos intrínsecos y alteraciones genómicas asociadas126
| Subtipo intrínseco | Luminal A | Luminal B | Seudobasal | HER2-enriched |
|---|---|---|---|---|
| Vía TP53 | TP53 mut (12%); amplificación de MDM2 (14%) | TP53 mut (32%); amplificación de MDM2 (31%) | TP53 mut (84%); amplificación de MDM2 (14%) | TP53 mut (75%); amplificación de MDM2 (30%) |
| PIK3CA/PTEN | PIK3CA mut (49%); PTEN mut/deleción (13%); INPP4B deleción (9%) | PIK3CA mut (32%); PTEN mut/deleción (24%); INPP4B pérdida (16%) | PIK3CA mut (7%); PTEN mut/deleción (35%); INPP4B deleción (30%) | PIK3CA mut (42%); PTEN mut/deleción(19%); INPP4B deleción (30%) |
| Vía RB1 | Amp. Ciclina D1 (29%); amplificación CDK4 (14%) | Amp. Ciclina D1 (58%); amplificación CDK4 (25%) | RB1 mut/deleción (20%); Ampl. Cilcina E1 (9%) | Ampl ciclina D1 (38%); Amplificación CDK4 (24%). |
| Expresión mRNA | Alta expresión de RB1;alta expresión del clúster RE; baja proliferación | Baja expresión del clúster de RE; alta proliferación | Alta expresión RB1; Firma seudobasal; alta proliferación | Firma HER2 sobreexpresada; alta proliferación |
| Número de copias | Mayoría diploide | Mayoría aneuploide | Mayoría aneuploide; alta inestabilidad genómica | Mayoría aneuploide; alta inestabilidad genómica |
| MutacionesDNA | PIK3CA (49%); TP53 (12%); GATA3 (14%); MAP3K1(14%) | TP53(32%); PIK3CA (32%); MAP3K1(5%) | TP53 (84%); PIK3CA (7%) | ERBB2 amp (71%); TP53 (74%); PIK3CA (42%); PIK3R1 (8%) |
Hoy en día, se sigue utilizando la clasificación basada en la expresión de los receptores hormonales (RE y RP) así como la expresión de la proteína HER2 mediante IHQ para estratificar pacientes en la predicción del pronóstico o para seleccionar los tratamientos (tabla 5). Sin embargo, sabemos que esta clasificación no refleja la complejidad de la heterogeneidad biológica del cáncer de mama131.
Clasificación inmunohistoquimica del cáncer de mama según los criterios de Sant Gallen 2013
| Subtipo inmunohistoquímico | Características | Subtipo IHC | Características |
|---|---|---|---|
| Seudo luminal A | RE y RP positivosHER2 negativoKi67 bajo (< 20%) | HER2 positivo | RE y RP positivos/negativosHER2 amplificadoCualquier Ki67 |
| Seudo luminal B | RE positivoHER2 negativoKi67 alto (> 20%)RP negativo o bajo | Triple negativo | RE y RP negativosHER2 negativoCualquier Ki67 |
Existen múltiples estudios que han realizado comparaciones de la clasificación de tumores basados en el predictor de expresión génica PAM50 con la clasificación basada en marcadores por IHQ. En estos estudios se observan grandes discrepancias (aproximadamente del 20%) entre la determinación local y central de RE, PR, Ki67 y HER2. La capacidad de PAM50 para identificar los distintos subtipos intrínsecos se ha mostrado superior a la IHQ132, mostrado que PAM50 es un predictor de supervivencia en cáncer de mama independiente de otras variables clínicas conocidas como el estado ganglionar, el grado o la expresión del RE116.
En un análisis combinado donde se correlacionó la clasificación IHQ con la del PAM50 en más de 5.994 muestras de pacientes diagnosticadas de cáncer de mama incluidas en diferentes estudios clínicos observó que la tasa de discordancia entre ambas clasificaciones estaba presente en casi uno de cada 3 pacientes. Estos resultados sugieren claramente que los 2 métodos para identificar la biología intrínseca no deben ser considerados iguales133.
Los estudios basados en datos de expresión génica han proporcionado importantes avances en el conocimiento de la biología del cáncer de mama. Aunque los perfiles moleculares del cáncer de mama no han sustituido a los métodos diagnósticos convencionales, sí que han contribuido a complementar y expandir la información proporcionada por los marcadores clásicos clínico-patológicos134 con una implicación clara en el diseño de ensayos clínicos y en la toma de decisiones de tratamiento. Esta información ha sido ampliamente estudiada y validada en el contexto neo/adyuvante y empezamos a tener datos de su implicación pronóstica en cáncer de mama metastásico.
De este modo, se ha observado que los subtipos intrínsecos pueden añadir una información extra para la estratificación de las pacientes. El estudio BOLERO-2, estudio fase 2 donde se incluyeron las pacientes diagnosticadas de cáncer de mama metastásico RE+/HER2-negativas randomizadas a recibir tratamiento con exemestano +/− everolimus. De las pacientes incluidas en el estudio, de un 23,4% de tumores eran no luminales (es decir, pertenecían al grupo de HER2-enriched o seudobasal). Se observó que los tumores luminales por PAM50 presentaban una mejor supervivencia libre de progresión y una supervivencia global respecto a los no luminales125.
Recientemente, se ha publicado un análisis con las pacientes incluidas en los ensayos clínicos MONALEESA −2, −3 y − 7. Se tratan diferentes estudios fase 3, donde se incluyan las pacientes con diagnóstico de cáncer de mama localmente avanzado o metastásico y se randomizaban a recibir como primera línea de tratamieto: HT asociada o no a ribociclib. De los 1.160 tumores que se incluyeron en el análisis,el 15,3% fueron no luminales por PAM50. Se observó que el subtipo seudobasal no presentó beneficio al tratamiento con ribociclib y que los subtipos no luminales presentan un peor pronóstico respecto a los luminales123.
En general, existe un gran valor en estratificar la expresión génica de las pacientes afectas con cáncer de mama, ya que proporciona una herramienta más para poder plantear un tratamiento y evaluar el pronóstico131.
Test prosignaEl test PAM50, denominado Test Prosigna en su forma comercial, es un test que utiliza un algoritmo con la combinación de datos genómicos basados en el subtipo intrínseco del tumor (el conjunto de los 50 genes anteriormente descritos) y cierta información clínica que incluye: el tamaño tumoral, la afectación ganglionar y la proliferación. Este algoritmo, además de proporcionar el subtipo intrínseco, indica también un índice ROR (Risk of Recurrence) score, un valor que va de 0 a 100, y permite asignar una categoría de riesgo: riesgo bajo, riesgo intermedio o riesgo alto, que se correlaciona con la probabilidad de riesgo de recaída a distancia en los próximos 10 años.
El Test Prosigna se realiza mediante la tecnología nCounter® a través del RNA que se aísla del tejido parafinado del tumor. Se trata de un método de hibridación para el estudio de RNA que permite cuantificar varios cientos de genes de manera simultánea. La tecnología nCounter® requiere de 2 sondas específicas para cada gen, una sonda de captura y una sonda señalizadora, marcadas con códigos de barras fluorescentes. Tras la hibridación las moléculas de RNA y sus sondas son literalmente contadas.
Brevemente, la metodología nCounter® no requiere amplificación ni reacción enzimática ni manipulación, las sondas son contadas digitalmente. Se trata de una metodología totalmente automatizada y altamente reproducible, permitiendo el análisis de hasta 800 genes. Además, ofrece un sistema que permite el análisis de datos sin necesidad de programas bioinformáticos específicos.
Se determinó el test PAM50 en las muestras de las pacientes incluidas en el estudio ATAC, donde se incluyeron 1.017 pacientes diagnosticadas de cáncer de mama precoz RE-positivo y N0 (sin afectación ganglionar). Se observó que la identificación de pacientes de alto riesgo era más precisa con el ROR score obtenido por PAM50 que mediante el Recurrence Score (RS) obtenido por el Test Oncotype Dx135. También se determinó el PAM50 en las muestras de las pacientes que participaron en el estudio ABCSG-8. Se trata de un estudio donde se incluyeron 1.478 pacientes menopáusicas diagnosticadas de cáncer de mama precoz RE-positivo que se aleatorizaron a recibir tratamiento adyuvante con tamoxifeno versus tamoxifeno seguido de anastrozol. Se observó que el riesgo de recaída de las pacientes cuyos tumores tenían un ROR score bajo era inferior al 3,5%136. En este estudio y en un estudio posterior que analizó los 2 estudios previos, se observó que el ROR score tenía mayor capacidad de predicción pronóstica que los diferentes factores clínicos utilizados en la práctica clínica habitual137.
En 2015, el Grupo de Estudio Danés de Cáncer de Mama (DBCG) presentó los resultados del estudio retrospectivo-prospectivo, donde analizaron por PAM50 un total de 2.749 muestras de las pacientes diagnosticadas de cáncer de mama precoz entre 2000 y 2003. Se realizó un análisis muy completo donde se pudieron obtener conclusiones en una población real. Se observó que en aquellos tumores donde no se presentaba afectación ganglionar y que eran clasificados como alto riesgo, presentaron un riesgo de recidiva a distancia del 17,8% a 10 años, comparado con el 5,0% de los pacientes con tumores de bajo riesgo. Además, se observó que el subtipo luminal A presentó un mejor pronóstico que el subtipo luminal B o HER2-E, corroborando así que la determinación de los subtipos es importante para establecer un pronóstico a 10 años (riesgo 7,6% en luminal A versus 18,4% luminal B y 26,0% en HER2-E) independientemente de la afectación ganglionar122. En cuanto se determinaba en función de la afectación ganglionar, se observó que existía un grupo de pacientes que a pesar de presentar afectación ganglionar presentaban excelente pronóstico122,138, poniendo en duda la necesidad de QT adyuvante en esta población. En este estudio también se valoró el riesgo de recurrencia tardía, pudiendo seleccionar con precisión aquellos pacientes que necesitaran realizar terapia hormonal extendida. Se realizó un análisis de aquellas pacientes que se encontraron libres de enfermedad a 5 años y se observó que, con un seguimiento a 4,58 años, las pacientes de alto riesgo tuvieron un riesgo tardío de recidiva del 10,2% frente al 6,1% para el intermedio y el 2,4% para pacientes de bajo riesgo139.
Finalmente, hay que destacar el OPTIMA trial, este estudio se encuentra todavía abierto para reclutamiento y tendremos los resultados en los próximos años. Se trata de un estudio académico prospectivo, parcialmente ciego, que incluirá aproximadamente 4.500 pacientes. Se incluirán pacientes (tanto hombres como mujeres ≥ 40 años) diagnosticadas de cáncer de mama con receptor hormonal positivo, HER2- que hayan sido intervenidas de cáncer de mama con afectación axilar pN1 o pN2, pN1 mic con pT ≥ 20 mm o pN0 con pT ≥ 30 mm. Estas se aleatorizán a 2 grupos: Grupo 1 se incluirán pacientes donde no se realizará el test Prosigna y realizarán tratamiento estándar, por práctica clínica habitual (QT adyuvante seguido de tratamiento hormonal); Grupo 2 donde se aleatorizarán a recibir un tratamiento u otro en función del resultado del test Prosigna. En aquellos tumores que presenten alto riesgo (ROR > 60) se realizará tratamiento con QT de forma estándar, mientras que en aquellos tumores que tengan bajo riesgo recibirán tratamiento con HT un mínimo de 5 años140.
El objetivo de este estudio es poder validar de forma prospectiva el papel del Prosigna en las pacientes con afectación ganglionar y si es posible disminuir el uso QT adyuvante en esta población.
Actualmente, las recomendaciones de la ASCO aconsejan el uso del Prosigna (entre las diferentes plataformas génicas disponibles) en las pacientes con tumores RE+ junto con otras variables clínico-patológicas para guiar decisiones sobre QT adyuvante en base a su capacidad pronóstica141.
Mensajes finalesTest Mammaprint y Blueprint- •
La firma de 70 genes MmP discrimina de forma dicotómica las pacientes de AR o BR de recidiva a 5 y 10 años.
- •
MmP es el único test genético que tiene aprobación por la FDA.
- •
Es la única firma genética que tiene un estudio de desarrollo independiente de la validación técnica y clínica.
- •
Validada tanto en pieza quirúrgica como en BAG.
- •
El ensayo prospectivo MINDACT demostró la ausencia de beneficio a la QT en pacientes de AR clínico y BR genético. Estos datos han sido validados en cohortes aleatorizadas de más de 13.000 pacientes
- •
MmP tiene un nivel de evidencia 1A tanto en el cáncer de mama con ganglios linfáticos negativos como en el positivo (pN1).
- •
MmP tiene alto VPN de beneficio a la QT.
- •
BluePrint (firma de 80 genes) realiza una subclasificación molecular (tipo luminal, HER2 o Basal) e identifica, junto con MmP, subpoblaciones de pacientes con una respuesta al tratamiento potencialmente distinta a la establecida por los métodos convencionales.
- •
Los datos disponibles no muestran diferencias en los resultados de MmP en relación al sexo (femenino versus masculino).
- •
MmP identifica un subgrupo de pacientes con riesgo de recidiva extremadamente bajo («ultra-low risk») tras 20 años de seguimiento.
- •
El ensayo neoadyuvante I-SPY 2 identifica una respuesta diferencial a la QT y a las terapias dirigidas para los cánceres con índices MmP de AR en la parte inferior del rango («High 1») en comparación con los de la parte superior del rango («High2»).
- •
Oncotype DX® fue el primer test validado para su uso clínico en pacientes con cáncer de mama HR+ y HER2- en estadio temprano.
- •
Es un test con un importante cuerpo de evidencia, soportado por 4 estudios aleatorizados, 2 de ellos con un nivel de evidencia 1A, con un total de más de 11.000 pacientes randomizados.
- •
Es un test con reconocida capacidad pronóstica y predictiva, tanto en pacientes N0 como N1, ya sean pre- o posmenopáusicas.
- •
Su uso en pacientes N0 y N1 es una opción costo-efectiva, que asocia una reducción significativa y superior a otras plataformas en el uso de QT adyuvante.
- •
El test se puede realizar en muestras de biopsia-core y puede ser considerado una herramienta útil a la hora de reducir el uso de QT neoadyuvante e identificar a aquellas pacientes que puedan recibir un mayor beneficio clínico.
- •
Es el test con mayor consenso respecto a capacidad predictiva tanto a nivel de guías clínicas como de organismos de evaluación de tecnologías sanitarias.
- •
El test EndoPredict proporciona un índice molecular de 12 genes que discrimina dicotómicamente entre las categorías de bajo y alto riesgo de metástasis a distancia. El índice EPClin clasifica a las pacientes en AR o BR de forma más precisa que EP y ha sido validado en ensayos aleatorizados fase III, tanto en las pacientes pre- como posmenopáusicas.
- •
Validación clínica de EndoPredict® retrospectiva utilizando una cohorte de 1.702 pacientes posmenopáusicas con cáncer de mama RE+/HER2, con ganglios negativos o positivos, tratadas con terapia endocrina.
- •
Test validado tanto en pieza quirúrgica como en BAG.
- •
EndoPredict® parece ser útil para predecir la respuesta patológica en el contexto de la QT/HT neoadyuvante en las pacientes con cáncer de mama RE+/HER2-.
- •
Identifica carcinomas que no precisan de QT adyuvante debido a su baja probabilidad de recaída a 10 años.
- •
Identifica carcinomas que no precisan de HT extendida más allá de 5 años por su baja probabilidad de recaída tardía.
- •
El cáncer de mama es un grupo heterogéneo de diferentes subtipos de enfermedades, cada uno con sus propias características biológicas y clínicas.
- •
Los subtipos intrínsecos del cáncer de mama determinados por PAM50 son: luminal A, luminal B, HER2E y seudobasal.
- •
Los subtipos intrínsecos del cáncer de mama tienen diferencias en cuanto a incidencia, prevalencia, pronóstico y diferente sensibilidad a tratamientos.
- •
El test Prosinga identifica los subtipos intrínsecos y además el ROR score, que ofrece un score del 0–100 que se correlaciona con el riesgo de recurrencia a 10 años.
- •
La utilización del test Prosigna puede ser útil para guiar la terapia adyuvante en pacientes diagnosticadas de cáncer de mama estadio precoz receptor hormonal positivo, HER2-negativo, sin afectación ganglionar.
No se ha recibido ningún fondo de financiación para llevar a cabo esta revisión.
Consideraciones éticasAl tratarse de un artículo de revisión no aplica la aprobación por parte del comité de ética.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.