El objetivo de este estudio es determinar si la p53, así como otros factores, pueden ayudar a definir de manera más precisa la carga tumoral axilar de forma global o en los distintos inmunofenotipos del cáncer de mama.
Materiales y métodosSe realizó un estudio retrospectivo de las neoplasias infiltrantes de mama del ámbito del Hospital del Mar de Barcelona del año 2000 al 2014. Se analizaron los factores predictores de la carga tumoral axilar de todas ellas, así como en los diferentes inmunofenotipos.
ResultadosUn total de 1.762 casos fueron los sujetos de estudio. Hubo un 18,7% de tumores con p53+. La p53+ resultó un factor predictor de baja carga axilar en el análisis multivariado global, así como concretamente en los subtipos Luminal B-HER2− (p=0,025) en el estudio estadístico univariado. Otros factores como la invasión linfovascular o el Ki67 elevado también se asociaron fuertemente a alta carga tumoral axilar.
ConclusionesLa p53 puede contribuir a definir un perfil específico de neoplasia de mama y de afectación axilar. En la era de la cirugía personalizada, este y otros factores pueden ayudar en un futuro a seleccionar el abordaje terapéutico axilar de manera más precisa en los diferentes inmunofenotipos.
The aim of this study was to determine whether p53, as well as other factors, can help to more precisely define axillary tumour load overall or in the distinct breast cancer phenotypes.
Materials and methodsWe conducted a retrospective study of infiltrating breast tumours in Hospital del Mar, Barcelona, from 2000 to 2014. We analysed the factors predictive of axillary tumour load in all cases, as well as in the distinct immunophenotypes.
ResultsWe studied 1762 cases. A total of 18.7% of tumours were p53+. Positivity for p53 was a predictive factor for low axillary tumour load in the overall multivariate analysis as well as in luminal B-HER2− subtypes (p=0.025) in the univariate analysis. Other factors such as lymphovascular infiltration and elevated Ki67 were also strongly associated with axillary tumour load.
Conclusionsp53 can help to define specific breast tumour profile and axillary involvement. In the era of personalized surgery, this and other factors could, in the future, help to select the therapeutic axillary approach more precisely in distinct phenotypes.
El cáncer de mama es una enfermedad compleja y heterogénea. En el 2017 la incidencia en España fue de 26.370 mujeres1, suponiendo actualmente un 28% de los cánceres en la mujer2. En nuestro centro, el Hospital del Mar de Barcelona, nuestra Unidad Funcional de Patología Mamaria diagnostica y trata cada año más de 250 mujeres con neoplasia de mama3.
Su morbimortalidad está relacionada con múltiples factores biológicos conocidos como el tamaño tumoral, el subtipo histológico, el número de focos, la presencia o ausencia de adenopatías regionales afectas, o la existencia de metástasis a distancia. En las últimas décadas, se identifican otros factores bioquímicos como los receptores de estrógeno (RE), los receptores de progesterona (RP), la proteína HER2 (HER2), o el índice de proliferación tumoral (Ki67), que se consideran determinantes para distinguir los distintos tipos de tumores en la práctica clínica. En este sentido, Perou describe en el año 2000 distintos subtipos moleculares intrínsecos en relación con el perfil genético de cada tumor4. La dificultad y el coste de caracterizar genéticamente cada tumor en la clínica diaria ha hecho que se estableciesen equivalentes subrogados según la expresión molecular detectada en el estudio inmunohistoquímico. En el consenso de Sant Gallen de 2013, y posteriormente en los sucesivos consensos, se establecieron 4 inmunofenotipos5.
El gen supresor de tumores TP53, conocido como «el Guardián del Genoma», es un factor de transcripción que una vez activado participa en el ciclo celular y la apoptosis. Cuando aparecen mutaciones en este gen se pierde su función oncosupresora. La mayoría de mutaciones de TP53 producen una proteína, conocida universalmente con el mismo nombre, que puede ser leída con técnicas de inmunohistoquímica. La mutación de TP53 es la más frecuente en los diferentes cánceres, y se detecta específicamente en un 23% de los cánceres de mama6. p53+, definida universalmente como ≥10% en el estudio inmunohistoquímico, se asocia habitualmente a mal pronóstico7 y a peor supervivencia en todos los inmunofenotipos8–10. Mientras que las mutaciones de la p53 se encuentran en el 12-29% de los tipos Luminales, suceden en el 60-88% de los Triple negativos11.
Históricamente, la cirugía del cáncer de mama ha evolucionado a paradigmas más conservadores. En la axila, el gran avance histórico aparece en los años 90 y 2000 cuando se instaura la estadificación axilar con biopsia selectiva del ganglio centinela en pacientes con axila clínicamente negativa, obteniendo la misma supervivencia y control locorregional que la linfadenectomía12,13. En la era actual, la personalización de los distintos tratamientos del cáncer de mama según el inmunofenotipo se evidencia sobre todo en aquellos de abordaje sistémico. Sin embargo, en el ámbito quirúrgico, como ya apunta la Dra. M. Morrow entre otros autores, también tendría sentido individualizar cada caso según su perfil molecular, al tener cada inmunofenotipo distintos comportamientos y riesgos de recidiva locorregional14. En el tratamiento axilar del cáncer de mama muchos cambios han acontecido en los últimos años en su abordaje. En 2011, con la aparición de los resultados del ensayo clínico aleatorizado Z0011 del Dr. A. Giuliano15, muchas Unidades han dejado de realizar la linfadenectomía en aquellos casos de cirugía conservadora y baja carga axilar, realizando únicamente irradiación axilar directa o indirecta con el objetivo de reducir la morbilidad locorregional. Desde entonces, cada vez es más relevante conocer antes de la cirugía la carga axilar de la paciente16, así como conocer aquellos factores predictores de alta carga, como determinados inmunofenotipos como los Luminal B-HER2+ y los HER2+ puros17,18. En los últimos años varios grupos han intentado idear nomogramas predictivos de la carga axilar según distintos factores19.
Considerando la p53 como un marcador molecular más a la hora de definir la carga axilar, existe controversia en la literatura sobre su asociación. Mientras algunos estudios no han podido establecer una relación significativa20–22, nuestro grupo ha encontrado en estudios previos que la sobreexpresión de la p53 en el cáncer de mama se asocia a una menor afectación axilar23,24. El objetivo de este estudio es determinar si la p53, así como otros factores, pueden ayudar a definir de manera más precisa la carga tumoral axilar de manera global o en los distintos inmunofenotipos del cáncer de mama en nuestra población.
Material y métodosLa población del estudio fueron todas las pacientes del área de referencia del Parc de Salut Mar de Barcelona, diagnosticadas y tratadas de cáncer de mama primario en la Unidad de Patología Mamaria entre el 1 de enero de 2000 y el 30 de septiembre de 2014, con posterior seguimiento en nuestro centro. Los datos fueron recogidos a través del registro de tumores de la institución. Se completaron los datos de forma individualizada, se analizaron parámetros sociodemográficos, anatómicos-patológicos, inmunohistoquímicos, el estadio tumoral y la afectación axilar, los tratamientos realizados, así como el seguimiento de todas estas pacientes.
Como criterios de exclusión se consideraron pacientes no tratadas en el Hospital del Mar, pacientes con carcinoma in-situ, pacientes que recibieron tratamientos neoadyuvantes, y pacientes de las cuales no se disponía del informe patológico completo del tumor primario o de los ganglios regionales.
En nuestro estudio, se consideró baja carga tumoral axilar (BCA) cuando había 0, 1 o 2 ganglios axilares positivos, y alta carga axilar (ACA) cuando había 3 o más ganglios positivos, teniendo en cuenta tanto los ganglios centinela como los procedentes de la linfadenectomía si esta se había llevado a cabo. Este valor umbral de discriminación tuvo en cuenta las nuevas aportaciones a partir del estudio Z001115, así como muchas de las recomendaciones internacionales adoptadas por Unidades de Patología Mamaria como la nuestra desde entonces.
Los inmunofenotipos, subrogados de los subtipos intrínsecos en nuestra práctica clínica, se definieron de la siguiente manera: triple negativas (RE− y RP−, HER2 negativo), neoplasias HER2 positivas (HER2 sobreexpresado, RH negativos), y dos tipos de neoplasias luminales; Luminal A (RE+, RP≥20%, HER2 negativo, Ki<14%) y Luminal B (RE+, RP<20% y/o HER2+ y/o Ki≥14%)5. Entre los tumores Luminal B, en la práctica asistencial, y por lo tanto también en este trabajo, se distinguieron los Luminal B-HER2− de los Luminal B-HER2+.
Se trató de un estudio retrospectivo con datos del registro de tumores, que se realizó de acuerdo con las directivas nacionales e internacionales (Código Deontológico, Declaración de Helsinki, y Fortaleza, Brasil 2013), y las regulaciones legales sobre confidencialidad de los datos (Reglamento de la UE núm. 2016/679 del Parlamento Europeo). Los datos personales se procesaron con una numeración con un identificador de estudio, por lo que no fue posible identificar a la paciente.
Se llevó a cabo un análisis estadístico de los datos recopilados para responder al objetivo general y a los objetivos específicos. Se presentaron intervalos de confianza del 95% para estos resultados, teniendo en cuenta los valores p significativos cuando eran inferiores a 0,05. El análisis univariado de variables cualitativas se realizó a través del χ2. El análisis univariado de variables cuantitativas se realizó con la prueba Kruskall-Wallis o Rho de Spearman cuando se consideró adecuado. Para la evaluación del objetivo principal de estudiar si la positividad de p53 era un factor independiente para la afectación axilar, se realizó un análisis multivariado (regresión lineal múltiple). Se hicieron modelos de regresión-Cox para estimar las hazard ratios. El software utilizado fue SPSS Stata SE v 15.1 (Texas, EE.UU.).
Se estimó que la muestra necesaria para determinar las diferencias en la afectación locorregional de la p53+ respecto de la p53− era de 120 sujetos, aceptando un riesgo alfa de 0,95 para una precisión de±0,05 en un contraste bilateral. Esta cifra se consideró porque al utilizar una prueba de χ2 para comparar 80 pacientes con p53− como predictor de positividad en ganglios axilares en comparación con 40 pacientes p53+, se encontraron diferencias significativas (p≤0,05) en el 25% de los casos.
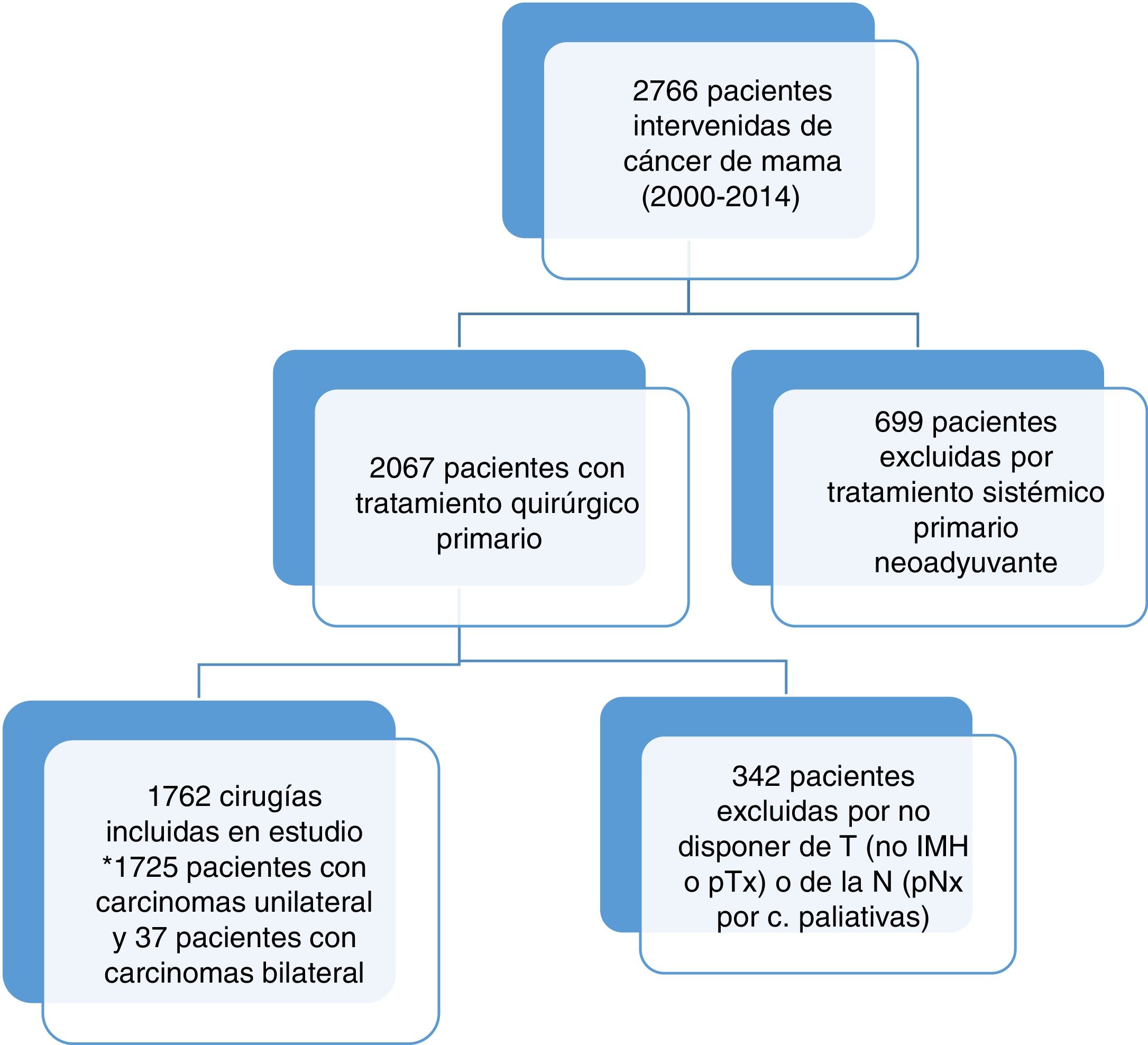
ResultadosDurante el período de estudio, 2.766 pacientes fueron intervenidas por cirugía de cáncer de mama infiltrante en el Hospital del Mar. Finalmente, 1.725 pacientes con 1.762 cirugías (37 casos de carcinomas bilaterales) fueron consideradas sujetos del estudio (fig. 1).
La edad media de las mujeres fue de 61,32años [23-94]. El tamaño medio tumoral fue de 18,91mm [1-162mm]. La media de focos fue de 1,2 [1-15]. En cuanto al subtipo histológico, hubo 1.422 (80,7%) carcinomas de tipo no especial, 174 (9,9%) carcinomas lobulillares, 21 (1,2%) carcinomas tubulares, y 145 (8,2%) de otros tipos de carcinomas infiltrantes. Respecto a los inmunofenotipos, 1.506 (84,5%) fueron subtipos Luminal, 79 (4,5%) HER2+, y 177 (10,0%) Triples negativo. Entre las neoplasias luminales, hubo 362 (20,5%) Luminal A, 569 (32,3%) Luminal B-HER2−, 137 (7,8%) Luminal B-HER2+, y 438 (24,9%) Luminal (HER2−) indeterminado al no disponer del Ki67 antes de 2007. Dentro de los inmunofenotipos, se observó ACA con mayor frecuencia en tumores HER2+ (15,2%), y con menor frecuencia en los Luminal A (15,2% vs. 5,2% respectivamente, p=0,007) (tabla 1).
El promedio de ganglios afectados fue de 0,93 [0-30, desviación 2,73], con 1.586 casos (90%) de BCA con 0, 1 o 2 ganglios positivos, y 176 casos (10%) de ACA con 3 o más ganglios positivos. El resto de las características descriptivas de la población se resumen en la tabla 2.
Características descriptivas de la población
| Subtipo histológico | . Tipo no especial. Tipo lobulillar. Tipo tubular. Otros tipos | 1.422 (80,7%)174 (9,9%)21 (1,2%)145 (8,2%) |
| Inmunofenotipos | . Luminal A. Luminal B-HER2−. Luminal B-HER2+. HER2+. Triple negativo. Luminal indeterminado | 362 (20,5%)569 (32,3%)137 (7,8%)79 (4,5%)177 (10,0%)438 (24,9%) |
| Grado histológico | . Grado I. Grado II. Grado III | 600 (38,7%)563 (36,3%)388 (25,0%) |
| Invasiónlinfovascular | . No. Sí | 1.218 (80%)304 (20%) |
| Número de focos | . Unifocales. Multifocales/multicéntricos | 1.507 (85,5%)254 (14,5%) |
| Estadio tumoral | . IA. IB. IIA. IIB. IIIA. IIIB. IIIC | 983 (56,4%)29 (1,7%)433 (24,9%)185 (10,6%)84 (4,8%)13 (0,7%)16 (0,9%) |
| P53 | . Negativa. Positiva | 1.433 (81,3%)329 (18,7%) |
| Carga tumoral axilar | . BCA. ACA | 1.586 (90%)176 (10%) |
En cuanto a la expresión de p53, hubo 1.433 casos (81,3%) con tumores p53− y 329 casos (18,7%) p53+. En cuanto a la expresión de p53 según el inmunofenotipo, hubo un 5,2% de Luminal A con p53+, 15,6% de Luminal B-HER2− con p53+, 29,9% de Luminal B-HER2+ con p53+, 60,8% de HER2+ con p53+, y 49,7% de Triples negativo con p53+.
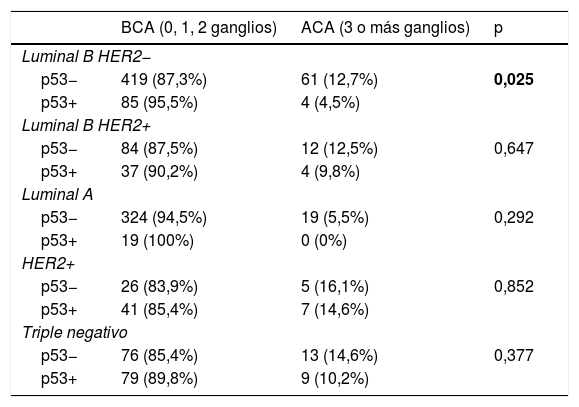
Teniendo en cuenta todas las neoplasias globalmente, se observó una tendencia inversa de la p53 con respecto a la carga axilar, siendo más frecuentemente positiva en aquellas neoplasias con baja carga, a pesar de no obtener una significación estadística en el análisis univariado (19,1% vs. 14,8%, p=0,162). En cuanto a los diferentes inmunofenotipos, hubo diferencias significativas en la carga axilar en función de la p53 en los subtipos Luminales en su conjunto, siendo más frecuentemente positiva cuando había BCA que cuando había ACA (13,4% vs. 7,0%, p=0,031), también en los Luminales (A y B) HER2− (11,7% vs. 4,8%, p=0,017), así como específicamente en los Luminal B-HER2− (16,9% vs. 6,2%, p=0,025). En los Luminal B-HER2−, cuando la p53 era positiva había un 95,5% de los casos con BCA y un 4,5% de los casos con ACA (p=0,025). No se observaron diferencias en la carga axilar en los subtipos Luminal A, Luminal B-HER2+, HER2+ o Triple negativo en función de la p53 (tabla 3).
p53 y carga axilar en los diferentes inmunofenotipos
| BCA (0, 1, 2 ganglios) | ACA (3 o más ganglios) | p | |
|---|---|---|---|
| Luminal B HER2− | |||
| p53− | 419 (87,3%) | 61 (12,7%) | 0,025 |
| p53+ | 85 (95,5%) | 4 (4,5%) | |
| Luminal B HER2+ | |||
| p53− | 84 (87,5%) | 12 (12,5%) | 0,647 |
| p53+ | 37 (90,2%) | 4 (9,8%) | |
| Luminal A | |||
| p53− | 324 (94,5%) | 19 (5,5%) | 0,292 |
| p53+ | 19 (100%) | 0 (0%) | |
| HER2+ | |||
| p53− | 26 (83,9%) | 5 (16,1%) | 0,852 |
| p53+ | 41 (85,4%) | 7 (14,6%) | |
| Triple negativo | |||
| p53− | 76 (85,4%) | 13 (14,6%) | 0,377 |
| p53+ | 79 (89,8%) | 9 (10,2%) | |
En negrita, p<0.05.
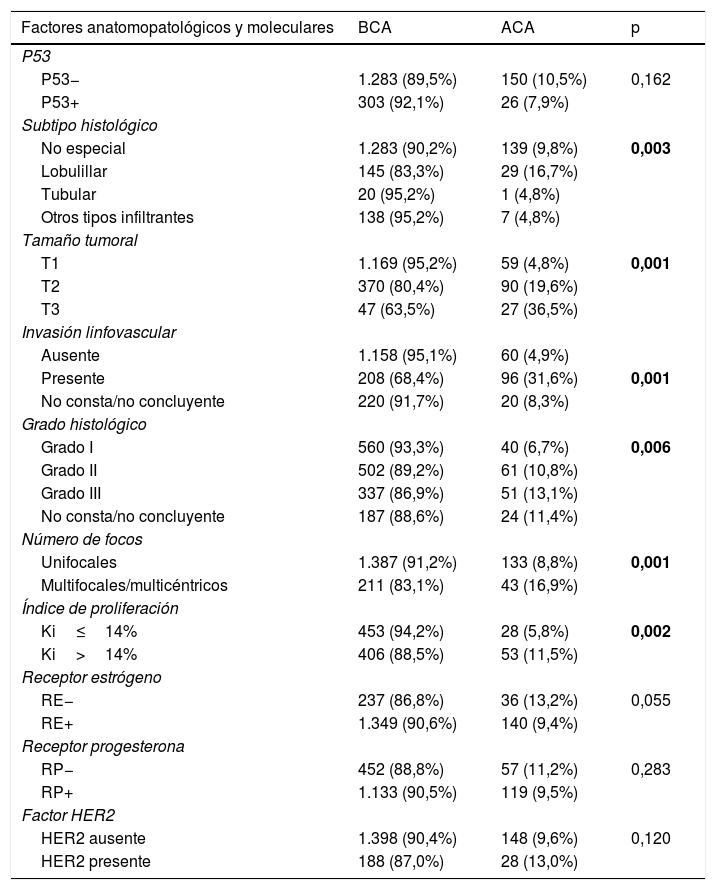
Al valorar otros factores anatomopatológicos y moleculares en todos los tumores globalmente, se observó una asociación significativa con ACA en el estudio univariado cuando el subtipo histológico era lobulillar, a mayor tamaño, cuando existía invasión linfovascular, cuando el ki67 era >14%, a más grado histológico y en los tumores multifocales/multicéntricos (tabla 4).
Análisis univariado de factores asociados con carga tumoral axilar de manera global
| Factores anatomopatológicos y moleculares | BCA | ACA | p |
|---|---|---|---|
| P53 | |||
| P53− | 1.283 (89,5%) | 150 (10,5%) | 0,162 |
| P53+ | 303 (92,1%) | 26 (7,9%) | |
| Subtipo histológico | |||
| No especial | 1.283 (90,2%) | 139 (9,8%) | 0,003 |
| Lobulillar | 145 (83,3%) | 29 (16,7%) | |
| Tubular | 20 (95,2%) | 1 (4,8%) | |
| Otros tipos infiltrantes | 138 (95,2%) | 7 (4,8%) | |
| Tamaño tumoral | |||
| T1 | 1.169 (95,2%) | 59 (4,8%) | 0,001 |
| T2 | 370 (80,4%) | 90 (19,6%) | |
| T3 | 47 (63,5%) | 27 (36,5%) | |
| Invasión linfovascular | |||
| Ausente | 1.158 (95,1%) | 60 (4,9%) | |
| Presente | 208 (68,4%) | 96 (31,6%) | 0,001 |
| No consta/no concluyente | 220 (91,7%) | 20 (8,3%) | |
| Grado histológico | |||
| Grado I | 560 (93,3%) | 40 (6,7%) | 0,006 |
| Grado II | 502 (89,2%) | 61 (10,8%) | |
| Grado III | 337 (86,9%) | 51 (13,1%) | |
| No consta/no concluyente | 187 (88,6%) | 24 (11,4%) | |
| Número de focos | |||
| Unifocales | 1.387 (91,2%) | 133 (8,8%) | 0,001 |
| Multifocales/multicéntricos | 211 (83,1%) | 43 (16,9%) | |
| Índice de proliferación | |||
| Ki≤14% | 453 (94,2%) | 28 (5,8%) | 0,002 |
| Ki>14% | 406 (88,5%) | 53 (11,5%) | |
| Receptor estrógeno | |||
| RE− | 237 (86,8%) | 36 (13,2%) | 0,055 |
| RE+ | 1.349 (90,6%) | 140 (9,4%) | |
| Receptor progesterona | |||
| RP− | 452 (88,8%) | 57 (11,2%) | 0,283 |
| RP+ | 1.133 (90,5%) | 119 (9,5%) | |
| Factor HER2 | |||
| HER2 ausente | 1.398 (90,4%) | 148 (9,6%) | 0,120 |
| HER2 presente | 188 (87,0%) | 28 (13,0%) | |
En negrita, p<0.05.
Al realizar el análisis multivariado, solo permanecían como factores asociados a ACA el Ki67>14% (p=0,04) y la invasión linfovascular (p=0,001), además de aparecer como nuevo factor la p53− (p=0,029).
En relación con los análisis multivariados para cada inmunofenotipo, en los Luminal A se mantuvo la invasión linfovascular como un factor predictivo de ACA (p=0,01), pero no el tamaño ni la multifocalidad/multicentricidad como se observaba en el análisis univariado. En los Luminal B-HER2−, se mantuvo la invasión linfovascular (p=0,001), T2 y T3 (p=0,001 y 0,005), y grado nuclear II (p=0,025) como factores asociados significativamente a ACA, y perdió la significación p53 y la multifocalidad/multicentricidad. En los Luminal B-HER2+, se repetía la invasión linfovascular (p=0,022) y algún tamaño como T2 (p=0,026) como los factores predictivos de ACA. En los tumores HER2+, la invasión linfovascular (p=0,005) fue el único factor asociado significativamente a la alta carga axilar. En los Triples negativos, la invasión linfovascular (p=0,001) y el tamaño (T2 p=0,041 y T3 p=0,009) fueron los factores que predijeron una ACA. Otros factores predictivos de la carga axilar, como el subtipo histológico, Ki67, RE, RP o la presencia de HER2, no pudieron ser analizados en los distintos análisis multivariados al no disponer de suficientes pacientes en los diversos inmunofenotipos.
DiscusiónEl cáncer de mama es una enfermedad heterogénea con un comportamiento locorregional y una capacidad de diseminación variables. Actualmente, se considera que la importancia de la carga tumoral locorregional y sistémica pueden divergir según cada tumor, y que el tratamiento locorregional no solamente cura la enfermedad local y disminuye las recidivas, sino que también impacta en la supervivencia25.
En cuanto al campo quirúrgico, en la era de la medicina personalizada toma cada vez más importancia conocer antes de la cirugía los factores que pueden predecir la extensión locorregional, específicamente la carga axilar. Sin embargo, no hay un consenso claro al definir cuáles de estos factores predictivos son los más adecuados para generalizarlos cuando se intentan validar en nomogramas con poblaciones distintas de las de origen. Nuestro trabajo pretende ayudar a definir mejor los distintos comportamientos axilares de cada inmunofenotipo según diversos factores predictivos como la p53, de cara a individualizar de forma más óptima la cirugía axilar en un futuro con la biopsia del ganglio centinela26, la linfadenectomía clásica, linfadenectomías parciales adaptadas27, o incluso sin abordaje axilar en los casos de mejor pronóstico28.
La p53 en el cáncer de mama puede ser otro factor más a la hora de determinar su diagnóstico, pronóstico y enfoque terapéutico. En nuestro trabajo, se observa como la mutación en este gen, con la consiguiente sobreexpresión de su proteína, puede ayudar a definir un perfil específico de neoplasia de mama con un comportamiento locorregional variable. Por lo que se refiere a la hipótesis y objetivos principales, se observa la p53+ en un 18,7% de los casos intervenidos. Este porcentaje, así como las proporciones de p53+ en los distintos inmunofenotipos, son análogos a los descritos en la literatura11, y permiten la comparación de resultados.
En nuestro estudio, de manera global la p53+ no está asociada con BCA en el análisis univariado de una manera significativa, sino en el multivariado (p=0,029), considerándose un fenómeno estadístico conocido como la paradoja de Simpson29. Esta asociación aporta nuevos conocimientos a la literatura, pues se trata de uno de los trabajos científicos clínicos con un número de pacientes p53+ más elevado, con 329 pacientes p53+ en comparación con otros trabajos con muestras únicamente de 130 pacientes21 o 114 pacientes22.
Otro punto fuerte del trabajo es la asociación significativa de la p53 con la carga tumoral axilar en un inmunofenotipo como el Luminal B-HER2 negativo, un subtipo tumoral frecuentemente difícil de caracterizar en la práctica clínica. En estos casos, cuando la p53 es positiva, se observa alrededor del 95% de los casos con BCA y solo un 5% de casos con ACA, unas diferencias importantes no solo a nivel estadístico sino también clínico. Así pues, la p53− conjuntamente con otros factores como la invasión linfovascular o el Ki67 elevado puede contribuir a predecir mejor la carga axilar en nuestra población, y quizás a optar por cirugías distintas en un futuro.
Como limitaciones, destaca que se trata de un trabajo retrospectivo de una única institución donde solo se han considerado los casos de cáncer de mama con cirugía inicial para evitar los posibles cambios con la p5330, o la propia carga axilar, después de tratamientos neoadyuvantes, con lo que puede disminuir la potencia predictiva en poblaciones más extensas, o ser un sesgo de selección de casos más agresivos tributarios de tratamientos sistémicos primarios. Otra limitación es que, a pesar de la importante muestra de sujetos estudiados, al realizar los distintos análisis estratificados no se observan diferencias significativas en la carga axilar según la p53 en otros inmunofenotipos diferentes a los Luminal B-HER2 negativos, así como en algunos de los otros factores predictivos estudiados.
En conclusión pues, en la era de la cirugía oncológica cada vez más personalizada, este trabajo puede contribuir a definir mejor la carga axilar en los distintos inmunofenotipos del cáncer de mama, para seleccionar el abordaje terapéutico axilar en un futuro de manera más precisa.
Consideraciones éticasFue solicitado, y aceptado, el certificado del Comité Ético de Investigaciones Clínicas de nuestro centro, con el número 2015/6282/I.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNo existen conflictos de interés de ninguno de los autores.
El autor principal quiere agradecer a M.D. Sabadell Mercadal todas las enseñanzas recibidas en el campo de la Senología y Patología Mamaria, así como el ejemplo de cómo trabajar en equipo y cuidar a las pacientes a lo largo de todo el proceso del diagnóstico y tratamiento del cáncer de mama.