Presentamos nuestros resultados con el uso de mallas biológicas para la cobertura de los implantes en la reconstrucción mamaria posmastectomía.
Pacientes y métodosSe intervino a 40 pacientes consecutivas. La indicación fue de cáncer de mama en 29 casos y de forma profiláctica en 11. Se administró neoadyuvancia en 12 pacientes.
ResultadosHubo 8 necrosis cutánea, 8 seroma-derrames periprotésicos, 5 hematomas, 3 abscesos, 2 con dolor y 1 extrusión. Se reintervino a 12 pacientes (30%), y en 8 casos (20%) se llevó a cabo la retirada de malla y prótesis/expansor. La radioterapia previa tras una cirugía conservadora de inicio obligó a retirar la malla y la prótesis en todos los casos.
ConclusiónLa radioterapia y el volumen del implante son factores importantes para la aparición de complicaciones.
This study describes the use of biological mesh in breast reconstruction and its results.
Patients and methodsA study was conducted on 40 consecutive patients with mastectomy and immediate reconstruction with biological mesh and implants. The indication was breast cancer in 29 cases, and prophylactic in 11 patients. Neoadjuvant treatment was administered to 12 patients.
ResultsThere were 8 skin necrosis, 8 perigraft seroma, 5 haematomas, 3 abscesses, 2 with pain and 1 extrusion. Twelve patients underwent surgery (30%) with removal of the mesh and implant /expander in 8 cases (20%). The mesh and the implant had to be removed in all cases were there had been conservative surgery followed by radiotherapy.
ConclusionsRadiotherapy and implant volume are important factors for failed reconstruction.
Hoy día la mastectomía continúa siendo una técnica quirúrgica habitual en las unidades de cirugía mamaria. Es una técnica que, junto a la afectación estética de las pacientes, en el 28% de los casos produce ansiedad y en el 6%, depresión1. En los últimos años, la reconstrucción inmediata posmastectomía se ha convertido en una herramienta quirúrgica habitual y demandada por nuestras pacientes, sin que por ello aumente el riesgo de recaída, ni la dificultad en su diagnóstico2.
La reconstrucción inmediata puede llevarse a cabo mediante tejido autólogo o utilizando implantes protésicos. La reconstrucción mediante implantes requiere de dos procedimientos quirúrgicos: a) uno para realizar la mastectomía y la colocación del expansor tisular, y b) una segunda intervención para realizar el cambio del expansor por la prótesis definitiva. A partir del trabajo de Breuing y Warren3, el empleo de mallas biológicas en la reconstrucción inmediata facilita la cobertura tisular del expansor o la prótesis definitiva. Incluso permite planificar la reconstrucción en un tiempo, al poder emplear prótesis de mayor tamaño de inicio.
El propósito de este estudio es presentar nuestra experiencia con el empleo de estos materiales en la reconstrucción inmediata tras mastectomía y evaluar sus resultados a corto plazo.
Material y métodoEstudio prospectivo no aleatorizado, en el que se incluye a 40 pacientes intervenidas en la Fundación Instituto Valenciano de Oncología entre mayo de 2010 y junio de 2011, en las que se realizó mastectomía y reconstrucción inmediata con malla biológica y expansor/prótesis. Se informó a todas las pacientes de la técnica y firmaron el consentimiento informado para la intervención. Se administró profilaxis antibiótica y antitrombótica según el protocolo del centro.
Indicación de mastectomíaEn 11 casos (27,5%), por mala relación entre el volumen del tumor/volumen de la mama; en 9 (22,5%), por multicentricidad/ multifocalidad; en 7 (17,5%), por recidiva tras cirugía conservadora, y en 2 (5%), por límites afectados. En 11 (27,5%) fueron profilácticas. La técnica quirúrgica fue: mastectomía simple en el 57,5% de los casos y mastectomía radical modificada en el 42,5%. Doce pacientes (30%) recibieron quimioterapia neoadyuvante y 3 de ellas asociaron radioterapia previa después de una primera cirugía conservadora.
En la reconstrucción inmediata se emplearon prótesis directas en 25 casos (62,5%) y expansor en 15 (37,5%), con un volumen medio de 410cm3 (rango de 250–840cm3). Las mallas fueron de dermis porcina en 23 casos y de pericardio bovino en 17.
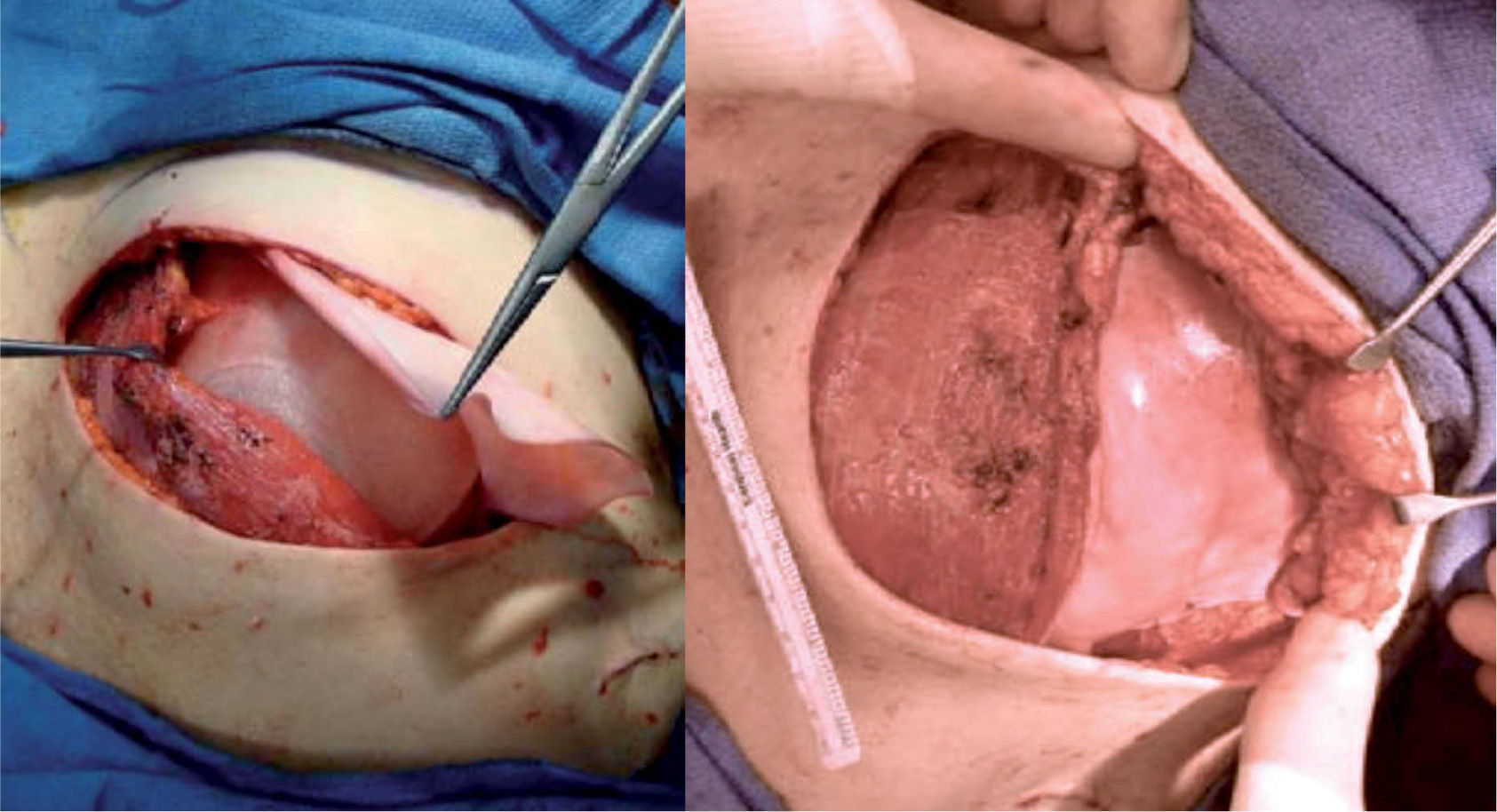
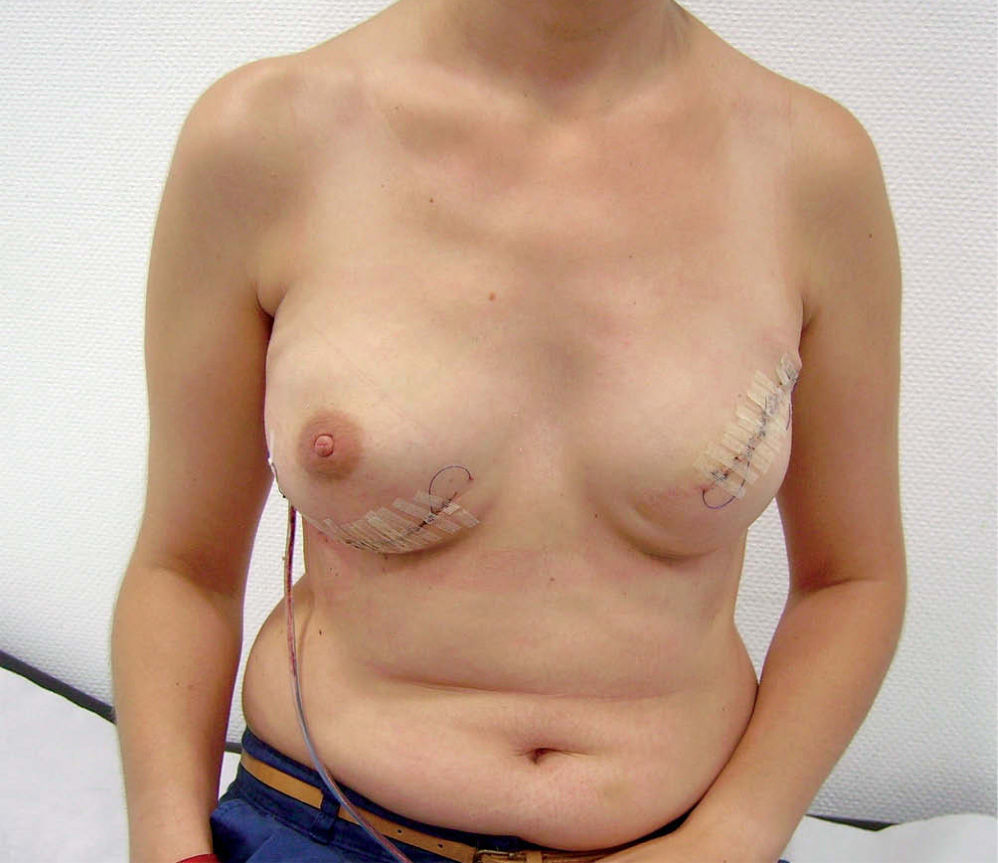
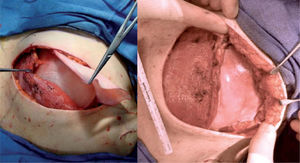
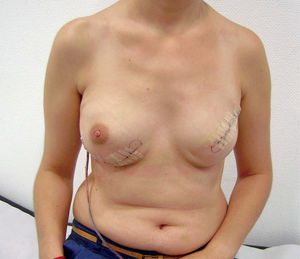
Técnica quirúrgicaSe realiza la extirpación de la mama y, posteriormente, se accede al espacio retropectoral desinsertando el músculo pectoral mayor de su borde inferolateral. Posteriormente, se libera el músculo serrato anterior que nos servirá para cubrir el borde lateral de la prótesis. La malla se ancla en el nuevo surco submamario trazado de forma simétrica al de la segunda mama. Tras colocar la prótesis o el expansor, se procede a su cobertura tisular mediante la sutura de la malla al borde libre pectoral, y lateralmente al borde del músculo serrato anterior (fig. 1). Tras un control exhaustivo de la hemostasia, dejamos tres drenajes (axilar, periprotésico y subcutáneo). Realizamos un cierre subcutáneo y de la piel con una sutura intradérmica con monofilamento irreabsorbible (fig. 2). En los casos de expansor, se rellenó en la misma cirugía con el volumen que permite aproximar sin tensión los colgajos cutáneos.
El control postoperatorio se realizó en la sala de hospitalización. En los casos en que es posible, se procede a alta hospitalaria temprana con los drenajes, seguido del posterior control por la Unidad de Hospitalización Domiciliaria y seguimiento en consultas del Servicio de Cirugía. Se han considerado las complicaciones posoperaorias en los primeros 30 días de seguimiento.
Estudio estadísticoSe ha empleado el programa SPSS versión 15.0 con la aplicación de estadísticos descriptivos, tablas de contingencia χ2 y prueba t para muestras independientes. Se consideran significativos valores de p <0,05.
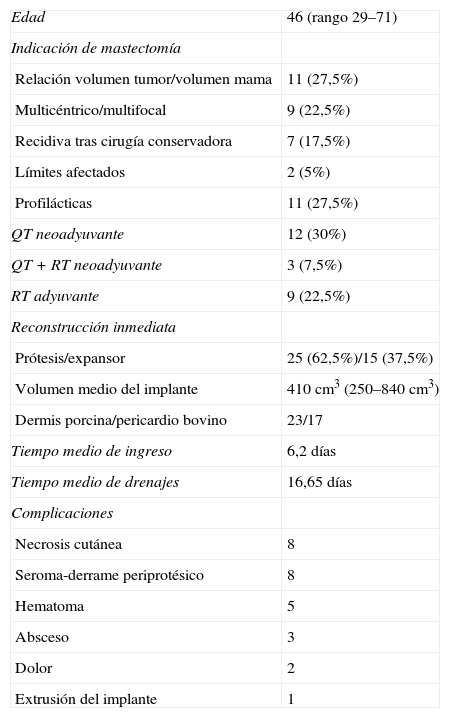
ResultadosEn la tabla 1 se recogen las características de la serie. La mediana de edad fue de 46 años, con un rango de 29–71 años.
Características generales de la serie
| Edad | 46 (rango 29–71) |
| Indicación de mastectomía | |
| Relación volumen tumor/volumen mama | 11 (27,5%) |
| Multicéntrico/multifocal | 9 (22,5%) |
| Recidiva tras cirugía conservadora | 7 (17,5%) |
| Límites afectados | 2 (5%) |
| Profilácticas | 11 (27,5%) |
| QT neoadyuvante | 12 (30%) |
| QT + RT neoadyuvante | 3 (7,5%) |
| RT adyuvante | 9 (22,5%) |
| Reconstrucción inmediata | |
| Prótesis/expansor | 25 (62,5%)/15 (37,5%) |
| Volumen medio del implante | 410cm3 (250–840cm3) |
| Dermis porcina/pericardio bovino | 23/17 |
| Tiempo medio de ingreso | 6,2 días |
| Tiempo medio de drenajes | 16,65 días |
| Complicaciones | |
| Necrosis cutánea | 8 |
| Seroma-derrame periprotésico | 8 |
| Hematoma | 5 |
| Absceso | 3 |
| Dolor | 2 |
| Extrusión del implante | 1 |
QT: quimioterapia; RT: radioterapia.
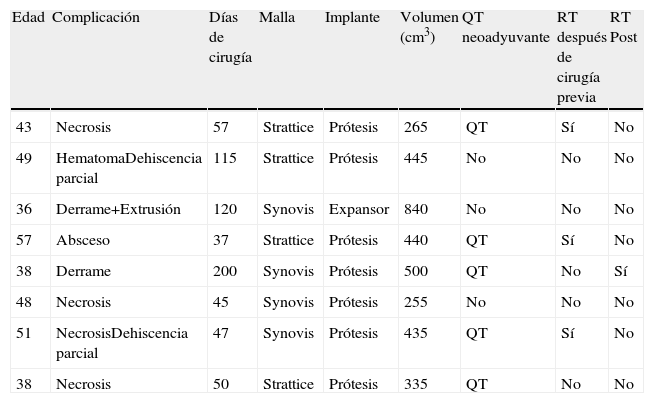
El tiempo medio de ingreso fue de 6,2 días y el de drenajes, de 16,6 días. Más del 50% de pacientes presentó complicaciones. Las más frecuentes fueron: 8 necrosis cutáneas, 8 seroma-derrames periprotésicos, 5 hematomas, 3 abscesos, 2 dolor y 1 extrusión. Se reintervino a 12 pacientes (30%); en 8 casos (20%) se llevó a cabo la retirada de malla y prótesis/expansor; en 2, drenaje de derrame periprotésico, y en 2, Friedrich y sutura. En la tabla 2 se recogen las características de las pacientes en las que hubo que retirar el implante.
Características de las pacientes en las que hubo que retirar el implante
| Edad | Complicación | Días de cirugía | Malla | Implante | Volumen (cm3) | QT neoadyuvante | RT después de cirugía previa | RT Post |
| 43 | Necrosis | 57 | Strattice | Prótesis | 265 | QT | Sí | No |
| 49 | HematomaDehiscencia parcial | 115 | Strattice | Prótesis | 445 | No | No | No |
| 36 | Derrame+Extrusión | 120 | Synovis | Expansor | 840 | No | No | No |
| 57 | Absceso | 37 | Strattice | Prótesis | 440 | QT | Sí | No |
| 38 | Derrame | 200 | Synovis | Prótesis | 500 | QT | No | Sí |
| 48 | Necrosis | 45 | Synovis | Prótesis | 255 | No | No | No |
| 51 | NecrosisDehiscencia parcial | 47 | Synovis | Prótesis | 435 | QT | Sí | No |
| 38 | Necrosis | 50 | Strattice | Prótesis | 335 | QT | No | No |
Post: posterior; QT: quimioterapia; RT: radioterapia.
La radioterapia previa después de una cirugía conservadora de inicio obligó a retirar la malla y la prótesis en todos los casos, con una diferencia estadísticamente significativa (p <0,005), en comparación con las pacientes no irradiadas de inicio. Se aplicó radioterapia adyuvante en 9 pacientes, con un tiempo medio desde la cirugía de 4,3 meses. Una de las pacientes necesitó la retirada de la malla y la prótesis, a causa de un importante derrame periprotésico, y otra paciente presentó una contractura capsular leve que no precisó reparación. No hubo diferencias significativas en la aparición de complicaciones en cuanto al tipo de malla o el empleo de expansor o prótesis.
Con la hipótesis de que a mayores volúmenes de los implantes encontrábamos más complicaciones o reintervenciones, la serie se dividió en dos grupos, con punto de corte en un volumen de 350cm3 (20 pacientes con volúmenes de implante de menos de 350cm3 y 20 pacientes con implantes mayores de 350cm3). Se eligió este punto de corte porque permitía dividir la serie en dos grupos con el mismo número de casos. Las pacientes con un volumen menor presentan 7 complicaciones y 5 reintervenciones, mientras que en las pacientes con volumen mayor de 350cm3 presentaron 13 complicaciones y 7 reintervenciones. Aunque en números absolutos las complicaciones y la posibilidad de reintervención fue mayor en el grupo de más volumen, la diferencia no fue estadísticamente significativa.
DiscusiónEl empleo de mallas para la reconstrucción de defectos tisulares en las distintas especialidades quirúrgicas no es nuevo. Así, en cirugía general y digestiva, el empleo de mallas en los defectos de la pared abdominal está ampliamente aceptado. Sin embargo, desde los trabajos de Breuing y Warren en 20053, su uso en cirugía de la mama es relativamente reciente. En la actualidad hay numerosas publicaciones acerca de su uso en la reconstrucción inmediata tras mastectomía, sobre todo por parte de cirujanos plásticos y empleando mallas de dermis cadavérica, las cuales, según la legislación vigente en España, no se comercializan en España.
La experiencia con mallas biológicas en la reconstrucción mamaria es más limitada. De hecho, la serie que presentamos es la más amplia publicada hasta la fecha. Disponemos de varios tipos de mallas: mallas de dermis porcina (Strattice™), mallas de pericardio bovino (Synovis™) y dermis cadavérica (Alloderm). Son matrices de tejido estéril que favorecen la regeneración tisular y reducen de manera significativa la respuesta de rechazo.
La técnica clásica de reconstrucción inmediata tras mastectomía mediante implantes protésicos requiere de dos procedimientos quirúrgicos: a) uno para la mastectomía y colocación del expansor tisular, y b) una segunda intervención para el cambio del expansor por la prótesis definitiva. Según esta técnica, el expansor se coloca subpectoral junto con el serrato anterior en la vertiente inferolateral. Esta cobertura muscular no es a menudo completa, con un riesgo de exposición mayor del implante y de un mal resultado estético. La sutura de estas mallas al borde inferior del pectoral tras su desinserción, y lateralmente al músculo serrato anterior, permite una cobertura tisular mayor. Asimismo, en experiencias posteriores se observó que el empleo de mallas permitía una colocación del implante en una posición más anatómica y una mayor definición del surco submamario con el consiguiente mejor resultado estético3,4. Al no realizar un bolsillo subpectoral a tensión, podemos rellenar los expansores con volúmenes mayores de inicio y llegar antes al llenado óptimo, mediante la reducción del tiempo para el recambio del expansor por la prótesis. Pero la mayor ventaja sería la posibilidad de realizar la reconstrucción inmediata en un tiempo al poder emplear prótesis de mayor tamaño de inicio. Incluso se ha indicado que el empleo de esta técnica produce menos dolor que la clásica5.
La mayoría de los estudios hasta la fecha subrayan la seguridad en el empleo de mallas, con complicaciones similares a la cirugía en dos tiempos sin malla4,6,7. En un trabajo reciente de Liu et al8, la tasa de infecciones global en las pacientes en las que se empleó malla de dermis cadavérica fue del 6,8%, en comparación con el 2,5% en las que no se empleaba. Sin embargo, en el estudio multivariante, el uso de malla no fue un factor de riesgo de infección postoperatoria. La aparición de seroma fue del 7,1%; la de necrosis fue del 14%, y la de hematoma, del 0,4%, sin diferencia significativa con el grupo control. En nuestra serie, la tasa de infecciones fue del 7,5% y la de necrosis, del 20%. Sin embargo, en el estudio de Liu et al8, el porcentaje de pacientes irradiadas fue del 9,8% en el grupo de malla, frente al 22% de nuestra serie. En cuanto a otros factores que incrementaban la aparición de complicaciones, aunque no fueron significativos, se encuentran el índice de masa corporal, el volumen elevado del implante y ser fumadora. Por lo tanto, se concluye que el uso de mallas es seguro, pero la indicación debe individualizarse teniendo en cuenta estos factores.
Hasta la fecha sólo hay cuatro estudios prospectivos en los que se analizan los resultados y las complicaciones con el empleo de mallas de dermis cadavérica en la reconstrucción inmediata posmastectomía. En el estudio de Spear et al9, se presenta una serie de 58 reconstrucciones con tasas de radioterapia preoperatoria del 5% y postoperatoria del 13%. La tasa de infecciones es similar a la presentada en nuestra serie, en torno al 7%; sin embargo, la necrosis y la pérdida del implante se sitúan entre el 2 y el 5%. El trabajo de Topol et al5 presenta una serie de 35 reconstrucciones en las que no tenemos datos de irradación, con tasa de infecciones nula y pérdida del 8% de los implantes. En una serie de 30 reconstrucciones, también sin datos de irradación, Zienowicz y Karacaoglu10 presentan un 25% de necrosis y ninguna pérdida del implante. Por último, Salzberg et al11 publican una serie más numerosa de 466 reconstrucciones, pero sólo un 32% de ellas son por afección oncológica y sólo el 4,5% recibió radioterapia. Su tasa de infección es menor del 1%; la de necrosis, del 2% y la de pérdida del implante, del 2,7% de los pacientes.
Las complicaciones globales de nuestra serie son mayores; sin embargo, el porcentaje de pacientes que han recibido neoadyuvancia y/o adyuvancia después de la reconstrucción es mucho más elevado. Así, de las 40 pacientes, sólo 11 han sido mastectomías profilácticas. De las 29 pacientes con diagnóstico de neoplasia, 12 han llevado tratamiento neoadyuvante (41,3%). En este subgrupo de pacientes ha sido donde hemos encontrado más complicaciones graves, incluso el 41,6% de ellas (5/12) han necesitado retirar la prótesis y la malla. El tratamiento neoadyuvante y adyuvante, sobre todo después de la radioterapia, aumenta el número de complicaciones y la pérdida de implantes. Así, Krueger et al12 observan un 68% de complicaciones en las pacientes irradiadas frente al 31% de las pacientes no irradiadas, con un mayor porcentaje de pérdida del implante del 15%. Cordeiro y McCarthy13 también presentan un número mayor de complicaciones absolutas en las pacientes irradiadas frente a las no irradiadas (el 11,7 frente al 5,6%), con un porcentaje mayor de infecciones, pérdida del implante, necrosis y seroma. Por lo tanto, la experiencia del empleo de mallas para la reconstrucción en pacientes irradiadas es escasa. Las series son pequeñas y, en las que se han empleado, incluida la de esta publicación, sus resultados no son muy alentadores.
En cuanto al tamaño del implante, también se ha demostrado que desempeña un papel importante como factor de riesgo de complicaciones8. Así, en nuestra serie, volúmenes de implante superiores a 350cm3 se relacionaban con un número mayor de complicaciones en números absolutos, sin llegar a la significación estadística.
El presente trabajo presenta la limitación de no ser comparativo con un grupo de pacientes reconstruidas sin malla y el pequeño volumen de la serie. Sin embargo, estos resultados nos han llevado a ser más restrictivos en el empleo de mallas para la reconstrucción inmediata tras mastectomía, individualizando mucho los casos para obtener los mejores resultados a corto y medio plazo. La candidata ideal sería una paciente joven que no necesitara implantes mayores de 350cm3 en la reconstrucción tras mastectomía profiláctica, o en caso de ser de etiología tumoral, que no vaya a recibir radioterapia.
En conclusión, el empleo de mallas biológicas en la reconstrucción inmediata no está exenta de complicaciones. Consideramos la radioterapia preoperatoria y postoperatoria como una contraindicación de este tipo de reconstrucción. Asimismo, no deben emplearse con volumen de implante superior a 350mm3.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.