En los últimos años, ha cambiado la indicación de la linfadenectomía axilar como gesto integrante del manejo del cáncer de mama, sobre todo desde la introducción de la biopsia del ganglio centinela. El objetivo es conocer la actitud actual en función de los hallazgos de enfermedad en éste.
Pacientes y métodosSe realizó un estudio descriptivo a partir de datos obtenidos de una encuesta, dirigida específicamente a unidades de mama españolas, sobre las consideraciones que, en el tratamiento quirúrgico y adyuvante, supone el hallazgo de metástasis en el ganglio centinela dependiendo de su carga tumoral.
ResultadosSe recibieron un total de 66 encuestas cumplimentadas de 110 solicitadas (60%). El estudio del ganglio centinela se hace mayoritariamente de forma intraoperatoria (84,8%) y mediante la técnica de OSNA (69,7%). El hallazgo de células tumorales aisladas no conlleva linfadenectomía, aunque hay más variabilidad ante el hallazgo de macrometástasis y, sobre todo, de micrometástasis (en las que se realiza en un 86,3 y un 33,3%, respectivamente). En este sentido resulta llamativa la falta de uniformidad en los criterios para indicar o no la linfadenectomía y la asociación de tratamientos adyuvantes.
ConclusionesEn la actualidad existe una gran variabilidad en la actitud ante el hallazgo de enfermedad ganglionar en el ganglio centinela en el cáncer de mama, especialmente en el caso de enfermedad considerada de baja carga tumoral (micrometástasis). Esta variabilidad se refiere tanto a la indicación de completar la linfadenectomía, como a la indicación de tratamientos adyuvantes en esos casos concretos.
The indication for axillary lymphadenectomy has changed as a main aspect in the management of breast cancer in the last few years, overall since the introduction of sentinel node biopsy. The objective of this study was to find out the current attitude as regards the involvement of the sentinel node.
Patients and methodsA descriptive study was performed using the data obtained from a survey aimed specifically at Spanish Breast Units as regards the surgical and adjuvant treatment decisions made when sentinel node metastases were found.
ResultsSixty-six (60%) of the 110 questionnaires sent out were completed. Sentinel node analysis is mainly performed during surgery (84.8%) and by using the one-step nucleic acid amplification assay (OSNA) (69.7%). The diagnosis of isolated tumour cells does not lead to a lymphadenectomy, although there was a wide variation when macrometastases or micrometastases were found (axillary dissection was performed in 86.3% and 33.3%, respectively). There was notable lack of uniformity in the criteria to indicate whether or not to perform a lymphadenectomy, as well as in the adjuvant therapy combination to use.
ConclusionsThere is currently a wide variation in the attitudes of different Breast Units toward the finding of disease in the sentinel node, particularly when there is a low tumour load (micrometastases). This variability was seen in the indication of axillary lymphadenectomy as well as in the indication of adjuvant therapies in these cases.
El tratamiento del cáncer de mama ha experimentado importantes cambios en las últimas décadas, en que se ha pasado de tratamientos inespecíficos y agresivos —que incluían sobre todo la cirugía radical de la mama y la linfadenectomía axilar—, a considerar la cirugía conservadora de la mama junto a radioterapia y, posteriormente, la linfadenectomía electiva en función del diagnóstico de la biopsia selectiva del ganglio centinela (BSGC). A esto se fue añadiendo el uso de tratamientos adyuvantes y neoadyuvantes (quimioterapia y hormonoterapia) que mejoraron de forma sustancial la supervivencia y la posibilidad de intervenciones conservadoras.
A la vez, los avances en el conocimiento de la biología tumoral, así como sus repercusiones pronósticas y predictivas para la indicación de determinados tratamientos, han llevado a cambiar el concepto y a considerar un abordaje cada vez más personalizado, dirigido a adaptar los distintos tratamientos, sistémicos o locorregionales, a las características concretas de cada paciente y cada tumor.
Desde la década de 1990 hay estudios que inciden en la importancia que sobre la supervivencia global y libre de enfermedad tiene un adecuado tratamiento locorregional axilar en el cáncer de mama1–5. Es evidente que la mayor morbilidad asociada a este tipo de tratamientos cuando se aplican —tanto de la radioterapia como, sobre todo, de la cirugía— hace necesario una selección mejor y más específica de los casos en los que se deban realizar. En este sentido, la introducción de la BSGC en el árbol de decisiones clínico ha proporcionado una herramienta vital en la disminución de la morbilidad generada por la linfadenectomía axilar clásica y en la posibilidad de una mejor estadificación locorregional. Sin embargo, con el paso de los años también ha generado nuevas inquietudes y aspectos controvertidos.
En trabajos recientes, tanto retrospectivos6 como prospectivos7,8, se plantea la posibilidad de no realizar la linfadenectomía si el diagnóstico del ganglio centinela (GC) es de micrometástasis, especialmente en determinados subgrupos de buen pronóstico9, e incluso ante enfermedad ganglionar macroscópica limitada10. Aunque el nivel de evidencia actual no permite ofrecer una recomendación taxativa, ni se han definidos los criterios con los que establecerla, hay una clara tendencia hacia actitudes más conservadoras.
Todo lo anterior exige saber cuál es la situación práctica actual en nuestro medio. El objetivo de este trabajo es conocer el grado de homogeneidad en el tratamiento de las pacientes con cáncer de mama y enfermedad localizada en las distintas unidades hospitalarias, y, en concreto, en relación con las pacientes que presentan micrometástasis en la BSGC axilar.
Material y métodosDesde el Grupo de Estudios Senológicos (GES) de la Sociedad Española de Senología y Patología Mamaria (SESPM), se realizó una encuesta sobre los aspectos metodológicos y de actitud frente a los distintos diagnósticos posibles en la BSGC (Anexo 1). Se distribuyó a través de correo electrónico desde la Secretaría de la SESPM a 110 unidades de mama del ámbito nacional. Las preguntas se refirieron específicamente al estudio de pacientes con cáncer de mama invasivo tratadas en las citadas unidades, y se solicitó la respuesta basada en el criterio de la unidad como tal, y no por los servicios implicados.
Encuesta remitida para realizar el estudio
| Centro: | Fecha: | |
| 1. Estadificación mediante biopsia selectiva del ganglio centinela | Sí No (no continúe la encuesta) | |
| 2. Método habitual de evaluación del/los ganglio(s) centinela(s) sobre el que se toma la decisión de linfadenectomía: | ||
| Citología intraoperatoria | Congelación | |
| H&E (n.° de cortes:…………) | IHQ (n.° de cortes: ………………….) | OSNA |
| 3. Momento del análisis del/los ganglio(s) centinela(s): | ||
| Intraoperatorio | Diferido | |
| 4. Actitud ante hallazgo de células tumorales aisladas (menos de 0,2mm de diámetro en la evaluación histológica o menos de 250 copias [y >100 copias] con OSNA): | ||
| No se realiza linfadenectomía axilar | ||
| Siempre se realiza linfadenectomía axilar | ||
| Sólo se realiza linfadenectomía si se cumple que (especificar criterios): | ||
| 5. Actitud ante hallazgo de micrometástasis (de 0,2mm a 2mm de diámetro en la evaluación histológica o menos de 250 a 5.000 copias con OSNA): | ||
| No se realiza linfadenectomía axilar | ||
| Siempre se realiza linfadenectomía axilar | ||
| Sólo se realiza linfadenectomía si se cumple que (especificar criterios): | ||
| 6. Actitud ante hallazgo de macrometástasis (más 2mm de diámetro en la evaluación histológica o más de 5.000 copias con OSNA): | ||
| No se realiza linfadenectomía axilar | ||
| Siempre se realiza linfadenectomía axilar | ||
| Sólo se realiza linfadenectomía si se cumple que (especificar criterios): | ||
| 7. En caso de no realizar linfadenectomía y a igualdad en el resto de variables (datos del tumor primario, tipo de cirugía realizada): | ||
| La existencia de micrometástasis condiciona que: | ||
| Se añada quimioterapia: siempre, nunca o depende de los casos | ||
| Se añada radioterapia axilar: siempre, nunca, depende de los casos | ||
| La existencia de macrometástasis condiciona que: | ||
| Se añada quimioterapia: siempre, nunca o depende de los casos | ||
| Se añada radioterapia axilar: siempre, nunca, depende de los casos | ||
| 8. En caso de hallar micrometástasis, ¿cómo modifica la actitud de adyuvancia a igualdad en el resto de variables del tumor primario y cirugía realizada? | ||
| No la modifica en absoluto | ||
| Plantea la posibilidad de quimioterapia si no estaba indicada | ||
| Plantea la posibilidad de radioterapia si no estaba indicada | ||
Se realizó un análisis estadístico descriptivo de las respuestas a cada ítem mediante un cálculo de proporciones de éstas.
ResultadosSe recibió contestación de 66 centros (60%) (fig. 1, Anexo 2). La totalidad de estas unidades (100%) realizan BSGC como parte del tratamiento de las pacientes con cáncer de mama invasivo.
Relación de centros que han participado contestando a la encuesta
| Andalucía |
| Hospital de Jerez (Cádiz) |
| Hospital Universitario Reina Sofía (Córdoba) |
| Hospital San Agustín Linares (Jaén) |
| Hospital Virgen del Rocío (Sevilla) |
| Hospital Valme (Sevilla) |
| Hospital Comarcal de Osuna (Sevilla) |
| Aragón |
| Hospital Universitario Miguel Servet (Zaragoza) |
| Principado de Asturias |
| Hospital de Mieres |
| Castilla-La Mancha |
| Hospital General Universitario de Ciudad Real |
| Hospital Santa Bárbara de Puertollano (Ciudad Real) |
| Hospital Virgen de la Luz (Cuenca) |
| Hospital de la Misericordia (Toledo) |
| Castilla y León |
| Hospital Nuestra Señora de Sonsoles (Ávila) |
| Complejo Asistencial Universitario de Burgos |
| Hospital Universitario de Salamanca |
| Hospital General de Segovia |
| Hospital General de Soria |
| Cataluña |
| Hospital Universitario de Bellvitge (Barcelona) |
| Hospital Clínic i Universitari (Barcelona) |
| Hospital Universitari Germans Trias i Pujol de Badalona (Barcelona) |
| Hospital de Granollers (Barcelona) |
| Institut Universitari Dexeus (Barcelona) |
| Clínica Teknon (Barcelona) |
| Hospital de Mataró (Barcelona) |
| Hospital Santa Coloma (Barcelona) |
| Centro Sanitario Garraf Sant Camil (Barcelona) |
| Hospital Santa Caterina Salt (Gerona) |
| Hospital Arnau de Vilanova (Lleida) |
| Hospital Universitario de Reus (Tarragona) |
| Hospital Verge de la Cinta de Tortosa (Tarragona) |
| Comunidad Valenciana |
| Hospital Vinalopó-Salud de Elche (Alicante) |
| Hospital General de Castellón |
| Fundación Instituto Valenciano de Oncología |
| Hospital Universitario La Fe (Valencia) |
| Hospital General Universitario (Valencia) |
| Hospital Universitario Dr. Peset (Valencia) |
| Hospital Universitario de la Ribera de Alzira (Valencia) |
| Hospital Lluis Alcanyís de Xátiva (Valencia) |
| Hospital de Sagunto (Valencia) |
| Extremadura |
| Complejo Hospitalario Infanta Cristina (Badajoz) |
| Galicia |
| Complejo Hospitalario Universitario de Santiago de |
| Compostela (La Coruña) |
| Hospital Abente y Lago (La Coruña) |
| Hospital Universitario Lucus Augusti (Lugo) |
| Hospital Arquitecto Marcide (Ferrol) |
| Hospital General de Vigo |
| Islas Baleares |
| Hospital Son Espases (Palma de Mallorca) |
| Islas Canarias |
| Hospital Dr. Negrín (Gran Canaria) |
| Hospital Insular (Gran Canaria) |
| Hospital Materno-Infantil (Gran Canaria) |
| Hospital Universitario de Tenerife |
| Hospital Virgen de la Candelaria (Tenerife) |
| Madrid |
| Fundación Jiménez Díaz |
| Hospital General Universitario Gregorio Marañón |
| Hospital Clínico San Carlos |
| Hospital Universitario La Paz |
| Hospital Universitario Doce de Octubre |
| Hospital Universitario Puerta de Hierro |
| Hospital Universitario Severo Ochoa |
| Hospital del Sureste |
| Murcia |
| Hospital Universitario Virgen de la Arrixaca |
| Hospital Universitario J.M. Morales Meseguer |
| Hospital Universitario Reina Sofía |
| Navarra |
| Complejo Hospitalario de Navarra (Hospital A; Antiguo Hospital de Navarra) |
| Complejo Hospitalario de Navarra (Hospital B; Antiguo Virgen del Camino) |
| País Vasco |
| Hospital Universitario Cruces (Bilbao) |
| Hospital de Galdakao-Usansolo (Bilbao) |
En 56 casos (84,4%), el estudio del GC se realiza habitualmente de forma intraoperatoria y en los 10 restantes este estudio se realiza en dos tiempos: a) citología intraoperatoria, y b) estudio histológico diferido, después. En relación con los métodos más utilizados, 46 centros (69,7%) lo hacen mediante OSNA; 10 (15,1%) asocian estudio inmunohistoquímico diferido a la citología intraoperatoria, y 5 (7,5%) realizan un estudio intraoperatorio por congelación; el resto de centros usan otros métodos combinados (citología intraoperatoria más OSNA en 2 [3,0%], citología intraoperatoria más Giemsa en 1 [1,5%], inmunohistoquímica intraoperatoria en 1 [1,5%], y exclusivamente citología intraoperatoria en 1 caso [1,5%]).
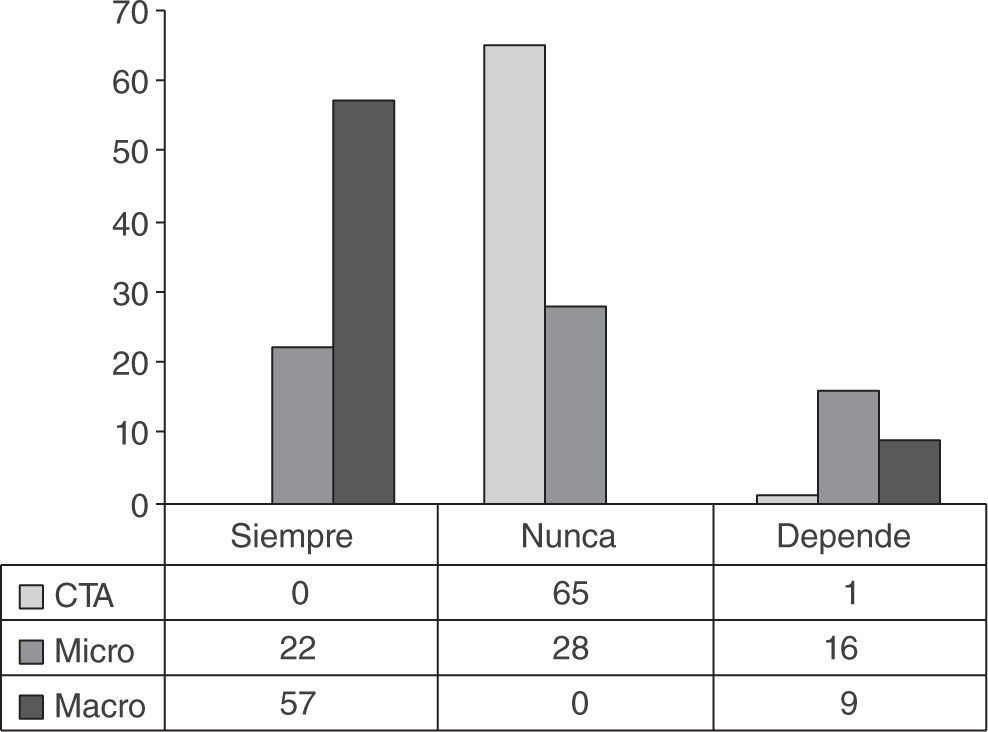
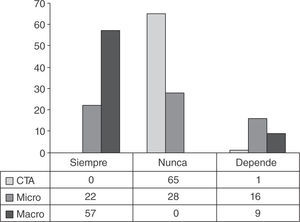
Como se muestra en la figura 2, la actitud ante el hallazgo de células tumorales aisladas no suele conllevar lin fadenectomía axilar. Sólo un centro, en función del fenotipo tumoral, considera realizarla. También es mayoritaria la indicación de linfadenectomía ante el hallazgo de macrometástasis, que se da en 57 centros (86,3%). Los 9 centros en los que no se indica de forma sistemática refieren diferentes criterios para no hacerlo: en un caso, utilizan el hallazgo de más de 3,5 en la puntuación del nomograma de Tenon; en otro caso, siguen los criterios del estudio ACOSOG Z0011, mientras los otros 7 modifican estos últimos añadiendo diferentes criterios derivados del perfil inmunohistoquímico o la morfología del tumor primario, como encontrar infiltración linfovascular, a los utilizados en este estudio10.
Menos definidas están las actitudes ante el hallazgo de micrometástasis. Como se ve en la figura 2, en 28 centros (42,4%) no se realiza la linfadenectomía en estos casos; en 22 centros (33,3%) la realizan siempre, y hasta 16 centros (24,2%) supeditan su decisión a criterios absolutamente va riados y heterogéneos: 5 utilizan nomogramas (2 de ellos especifican que el del MSKCC) y los otros 9 refieren criterios diferentes, que pueden consultarse en la tabla 1.
Criterios referidos para decidir la realización de linfadenectomía axilar en caso de encontrar micrometástasis en el ganglio centinela
| Criterios utilizados | Centros |
| Nomogramas (MSKCC en 2; no especificado en 3) | 5 |
| >T2 + IHQ adversa + no RT | 1 |
| T >2cm + GIII | 1 |
| > T2 + GIII + RRHHneg + Her2neu positivo | 1 |
| > T2 + RRHHneg | 1 |
| T2 + GIII + >50 años + multifocal | 1 |
| No RT ± BRCA positivo | 1 |
| Mastectomía | 1 |
| Dos micrometástasis | 1 |
| Fenotipo tumoral | 1 |
| Invasión linfovascular + GIII + RRHHneg | 1 |
| Según criterio del cirujano | 1 |
GIII: grado III; IHQ: inmunohistoquímica; MSKCC: Memorial Sloan Kettering Cancer Center; RRHHneg: receptores hormonales negativos; RT: radioterapia.
Cuando se analizan las respuestas referentes a los cambios de actitud que implica el hallazgo de micrometástasis en el GC, de nuevo, se encuentra que hasta en 47 casos (71,2%) esta actitud cambia en lo referente a la administración de tratamientos adyuvantes que, de otra manera, no se considerarían. Así, en 24 casos (36,3%) se plantea añadir quimioterapia adyuvante; en 3 casos (4,5%), radioterapia, y hasta en 20 casos (30,3%), ambas.
Al profundizar algo más en este aspecto, se preguntó cómo cambiaría la actitud ante el hecho de encontrar micrometástasis o macrometástasis en pacientes a los que no se les hubiese hecho linfadenectomía. Estas preguntas se contestaron sólo en unos casos, ya que algunos no plantearon esta posibilidad. Para las micrometástasis, 12 de 56 centros (21,4%) siempre añadirían quimioterapia en estos casos, y otros 37 (66,0%), dependiendo de variables para las que no se aportan criterios concretos ni homogéneos (dependiendo de la histología, de la inmunohistoquímica, etc.). En 12 de 58 centros (20,7%) se plantea añadir radioterapia adyuvante axilar siempre, y hasta 21 (36,2%), dependiendo de otras variables del tumor primario. Para el hallazgo de macrometástasis, en todos los casos sin linfadenectomía se considera añadir quimioterapia, aunque en la mitad de ellos se hace siempre, y en la otra mitad dependiendo de variables, de nuevo, poco definidas y muy inespecíficas (características inmunohistoquímicas [Her2neu, Ki67]). La radioterapia se añadiría siempre en 19 de 55 centros (34,5%) y hasta en 35 casos (63,6%) en función de criterios poco o nada definidos (un ganglio positivo en premenopausia y 4 o más en posmenopausia; existencia de extensión extraganglionar, y otros no especificados en la encuesta).
DiscusiónComo resultado del análisis de la encuesta, es destacable la gran variabilidad, el grado de discordancia y la falta de uniformidad en los criterios entre centros a la hora de manejar los casos de cáncer de mama con micrometástasis y, en menor medida aunque de forma más acusada desde la publicación del estudio ACOSOG Z001110, de las macrometástasis.
Es indudable que, considerando la experiencia de las series con casos de enfermedad ganglionar de baja carga —es decir, células tumorales aisladas y micrometástasis—, la tendencia debe ser la de evitar la linfadenectomía axilar en todos los casos que no impliquen alguna ventaja en el control local de la enfermedad y, de forma consecuente, pueda influir en su pronóstico.
Las variables incluidas de forma más común en los diferentes nomogramas diseñados para la predicción de metástasis en la linfadenectomía axilar son edad, diámetro tumoral, tipo histológico de tumor, grado tumoral, receptores hormonales, HER2, invasión linfovascular y número de GC metastásicos. Recientemente, se ha incluido como variable pronóstica el diámetro de la metástasis11, con lo que se ha obtenido un incremento significativo del valor predictivo positivo del nomograma. La inclusión de otras variables, como el porcentaje de células-madre tumorales en la metástasis identificadas por la expresión de CD44, CD24 y ALDH, y su relación con el subtipo molecular de tumor, probablemente podrían contribuir de manera significativa a mejorar para cada tumor individual los criterios de alto y bajo riesgo de metástasis.
El hecho de diseñar un estudio prospectivo y aleatorizado no conlleva una evidencia suficiente si el desarrollo del estudio y el análisis y seguimiento de los datos no se ajustan a unos mínimos requerimientos metodológicos. Este podría ser el caso del tan esperado estudio ACOSOG Z001110, en el que se trataba de estudiar de forma prospectiva la supervivencia en casos de cáncer de mama con afectación de uno o dos ganglios centinelas con o sin linfadenectomía. Se han realizado numerosas e importante críticas metodológicas al citado estudio12–18, por lo que éste debería destacar no tanto por refrendar un cambio en la práctica clínica, sino por apuntar el inicio de una línea de estudios consistentes en analizar, precisamente, qué subgrupos de pacientes podrían beneficiarse de esta actitud y qué variables pueden definir estos subgrupos.
En los hallazgos de la presente encuesta, podemos observar que, aunque se han producido cambios en la indicación de la linfadenectomía ante el hallazgo de macrometástasis en el GC, los criterios que se siguen para llevarlos a cabo no son homogéneos y mezclan criterios epidemiológicos, morfológicos e inmunohistoquímicos que, probablemente se basan en los resultados de estudios cuyo diseño no sea extrapolable al fin que nos ocupa.
Concretamente, el hecho de que el criterio principal de indicación de la linfadenectomía en la mayor parte de los casos se base en la existencia de afectación en uno o dos ganglios, cuando la BSGC suele ser de uno o dos en la mayoría de los casos, va a impedir conocer, sobre todo ante el hallazgo de macrometástasis, si hay más ganglios afectados y cuántos son. Al menos desde un punto de vista de control locorregional, pero también en lo referente a pronóstico, la importancia de la afectación de más de tres ganglios es relevante19–21 y precisaría de un manejo adecuado, independientemente de la modalidad terapéutica utilizada, cirugía o radioterapia, para evitar la recidiva y su eventual influencia en la sobrevida global de los casos. Así, reconociendo la importancia del tratamiento locorregional, debemos esperar el resultado de estudios como el AMAROS, que puedan proporcionar datos objetivos sobre la importancia de la radioterapia y la posibilidad de sustituir, definitivamente, la linfadenectomía por ésta, en caso de necesidad de tratamiento regional.
En relación con lo anterior, un aspecto que debería ser más estudiado es la repercusión que tiene la cantidad de enfermedad axilar en la evolución. En la actualidad, es posible determinar de una forma cuantitativa y con alta sensibilidad la enfermedad ganglionar mediante métodos de biología molecular (OSNA) y, muy probablemente, el estudio de esta carga en el GC puede ayudar, por un lado, a saber realmente la importancia pronóstica de esta variable de una forma objetiva, así como a conocer la probabilidad de afectación en otros ganglios y, por tanto, aquilatar de forma más precisa los casos en los que podría evitarse la linfadenectomía.
Posiblemente sea difícil diseñar y llevar a cabo desde un punto de vista ético y práctico un estudio de las características del mencionado, pero sí se podrían plantear estudios al modo de los estudios postautorización con fármacos en los que, de forma muy controlada y con un seguimiento atento, se registren nuevos protocolos asistenciales basados en diferentes criterios de selección para dejar de realizar la linfadenectomía axilar y evitar su morbilidad sin afectar al pronóstico de los pacientes. Estos criterios de selección deben considerar los apuntados por los estudios ya realizados y progresar en su ampliación o restricción, dependiendo de los resultados de análisis interinos.
En este sentido, desde el GES de la SESPM se propone realizar un registro nacional mediante el cual llevar a cabo este objetivo. Este registro incluiría los casos en los que, dependiendo de los protocolos específicos de cada unidad de mama, se haya decidido evitar la linfadenectomía en casos de enfermedad limitada en GC. Del mismo modo, debería establecerse un protocolo común de seguimiento que incluyese, por ejemplo, no sólo la exploración clínica axilar, sino también métodos de imagen, como la ecografía axilar, más sensible que aquella para la detección temprana de una recidiva eventual.
Como conclusión, en la actualidad en nuestro medio, hay una gran variabilidad en la actitud ante el hallazgo de enfermedad ganglionar en el GC en el cáncer de mama, especialmente en el caso de enfermedad considerada de baja carga tumoral (micrometástasis). Esta variabilidad se refiere tanto a la indicación de completar la linfadenectomía, como a la indicación de tratamientos adyuvantes en esos casos concretos: es muy común la indicación de quimioterapia, siendo más variable la de radioterapia. Además, la aparición de trabajos que apoyan la posibilidad de evitar la linfadenectomía, incluso con afectación macrometastásica, hacen preceptivo plantear estudios para definir, de una forma precisa, los criterios que permitan seleccionar a los pacientes que se beneficiarían de este manejo más conservador sin empeorar el pronóstico de su enfermedad a largo plazo.
AgradecimientosA todos los profesionales que han contribuido con su información a hacer posible este trabajo, así como a Teresa Martí, secretaria del Grupo Técnico de la SESPM, y a Ana Turanzo, gerente de la SESPM, por su labor de coordinación con las distintas unidades de mama.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.