El cáncer de mama metastásico de novo es una entidad poco frecuente, presentada del 3 al 10% de los casos. El tratamiento más habitual de estas pacientes es el tratamiento sistémico (quimioterapia, tratamiento hormonal, terapias dirigidas y combinaciones de estas). El subgrupo de pacientes oligometastásicas y con baja carga de enfermedad sistémica podrían tener mayor beneficio al añadir un tratamiento locorregional. Esta revisión bibliográfica tiene como objetivo analizar los beneficios y desventajas del tratamiento locorregional en pacientes con cáncer de mama oligometastásico de novo. Las series retrospectivas mencionan que este subgrupo de pacientes se podría beneficiar de un tratamiento locorregional, a pesar de presentar afectación metastásica, mejorando la supervivencia global y el control local. Adicionalmente, en varias series retrospectivas se ha observado que el tratamiento locorregional con cirugía, cirugía y radioterapia adyuvante o radioterapia exclusiva, presentan similares resultados de control local. Por ende, la radioterapia exclusiva puede ser una alternativa viable en estas pacientes. En los últimos años, se ha intentado demostrar la tendencia de las series retrospectivas en ensayos prospectivos. En estos estudios se evidencia una gran heterogeneidad. Algunos con resultados positivos en la mejoría de la supervivencia global y otros con resultados negativos, pero no estadísticamente significativos. La principal limitación de las series retrospectivas es el sesgo de selección, esto podría explicar las diferencias en los resultados obtenidos. Por este motivo, el tratamiento locorregional en estas pacientes debe abordarse en equipos multidisciplinares y de forma individualizada, siendo una opción de mayor peso en el caso de las pacientes oligometastásicas.
De-novo metastatic breast cancer is a rare entity, occurring in 3–10% of cases. The most common treatment for these patients is systemic therapy (chemotherapy, hormonal therapy, targeted therapies, and combinations of these). The subgroup of patients with oligometastatic disease and low systemic disease burden may benefit more from adding a locoregional treatment. This literature review aims to analyze the benefits and disadvantages of locoregional treatment in patients with de-novo oligometastatic breast cancer. Retrospective series report that this subgroup of patients may benefit from locoregional treatment, despite presenting with metastatic disease, by improving overall survival and local control. Additionally, several retrospective series have shown that locoregional treatment with surgery, surgery and adjuvant radiotherapy, or exclusive radiotherapy present similar results in local control. Therefore, exclusive radiotherapy may be a viable alternative in these patients. In recent years, attempts have been made to demonstrate the trend of retrospective series in prospective trials. These studies have shown great heterogeneity. Some with positive results in improving overall survival and others with negative results, but not statistically significant. The main limitation of retrospective series is the selection bias, which could explain the differences in the results obtained. For this reason, locoregional treatment in these patients should be approached by multidisciplinary teams on an individualized basis, with greater consideration for oligometastatic patients.
El cáncer de mama es la enfermedad oncológica más frecuente en la mujer y la primera causa de muerte por cáncer en este grupo1. Aproximadamente de un 3 a 10% de las pacientes se presenta con el diagnóstico inicial de cáncer de mama metastásico, denominado cáncer de mama metastásico de novo2.
La supervivencia de las pacientes con cáncer metastásico de novo es muy heterogénea, lo que sugiere la existencia de distintos grupos pronósticos. Hellman y Weichselbaum plantearon la hipótesis de una nueva entidad: el cáncer oligometastásico, una forma de neoplasia intermedia e indolente asociado con un número limitado de sitios metastásicos (clásicamente menos de 5) y con un crecimiento lento3.
El pilar fundamental del tratamiento es el tratamiento sistémico (TS), que incluye quimioterapia (QT), hormonoterapia (HT) y fármacos dirigidos4. Históricamente, el tratamiento locorregional (TLR) de estas pacientes ha tenido un carácter puramente paliativo, dirigido al control sintomático y mejoría de la calidad de vida. Afortunadamente, el desarrollo de las terapias dirigidas y una mejor comprensión de la biología del tumor ha mejorado la supervivencia de estas pacientes, siendo posible la valoración de un tratamiento local con intención radical3,5–7.
Por ello se realiza una revisión de la bibliografía sobre el TLR en las pacientes con diagnóstico de cáncer de mama metastásico de novo, analizando el posible impacto en la supervivencia global (SG) y control local que dicho tratamiento puede aportar.
Tratamiento locorregionalBases biológicasSe ha demostrado que el TLR del tumor primario mejora la supervivencia en la enfermedad metastásica de otros tipos de cáncer, como en el melanoma metastásico, carcinoma de células renales, cáncer colorrectal, cáncer de pulmón, cáncer de próstata y cáncer gástrico8. Existen diversas hipótesis sobre el efecto que produce el TLR del tumor primario, por una parte, se cree que la eliminación del tumor primario puede tener un efecto inmunomodulador, disminuir la carga tumoral general, eliminar una «fuente de semillas» para posibles nuevas metástasis y eliminar las células madre de la localización primaria que limita la conversión de clones quimiorresistentes6,7,9,10. Al contrario, se ha planteado la hipótesis de que el TLR con cirugía en pacientes con enfermedad metastásica de novo puede inducir la progresión de la enfermedad al aumentar los factores de crecimiento circulantes y por la posible inmunosupresión que produce el mismo acto quirúrgico7,10–12.
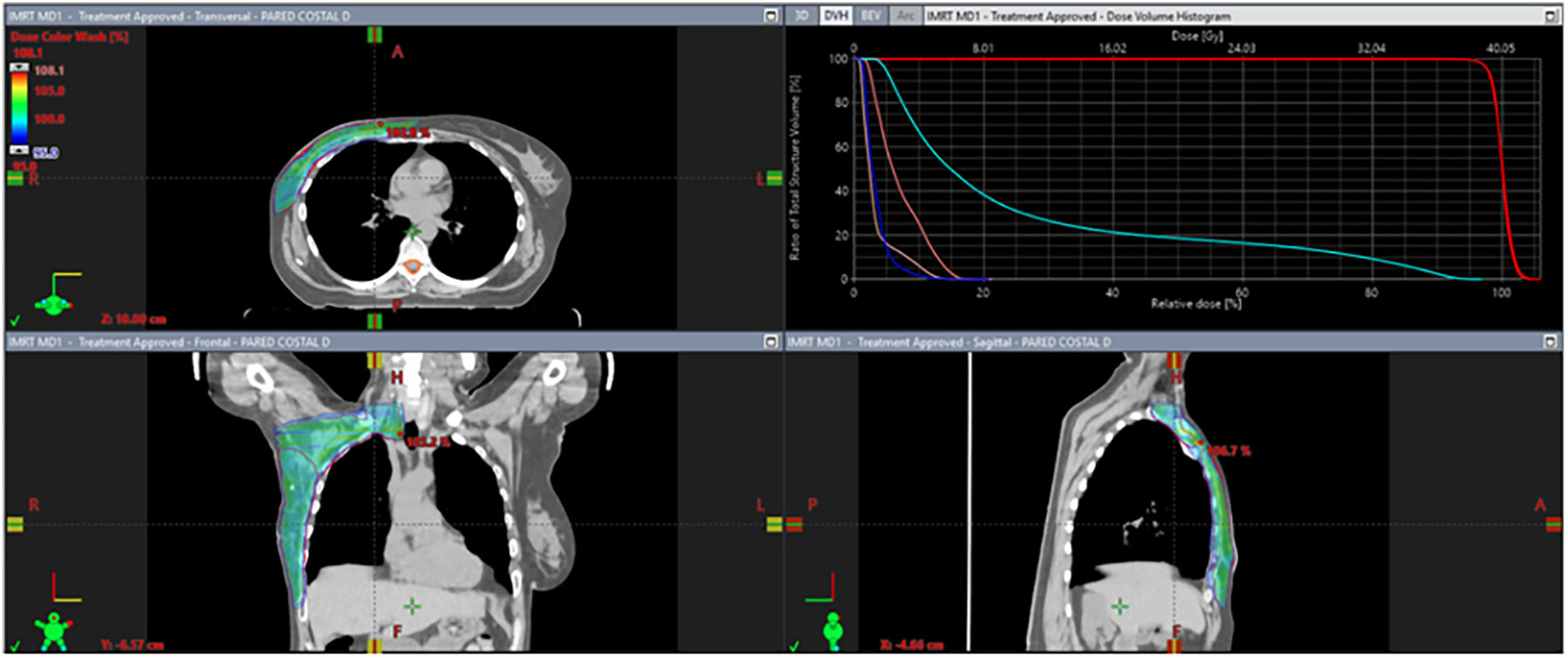
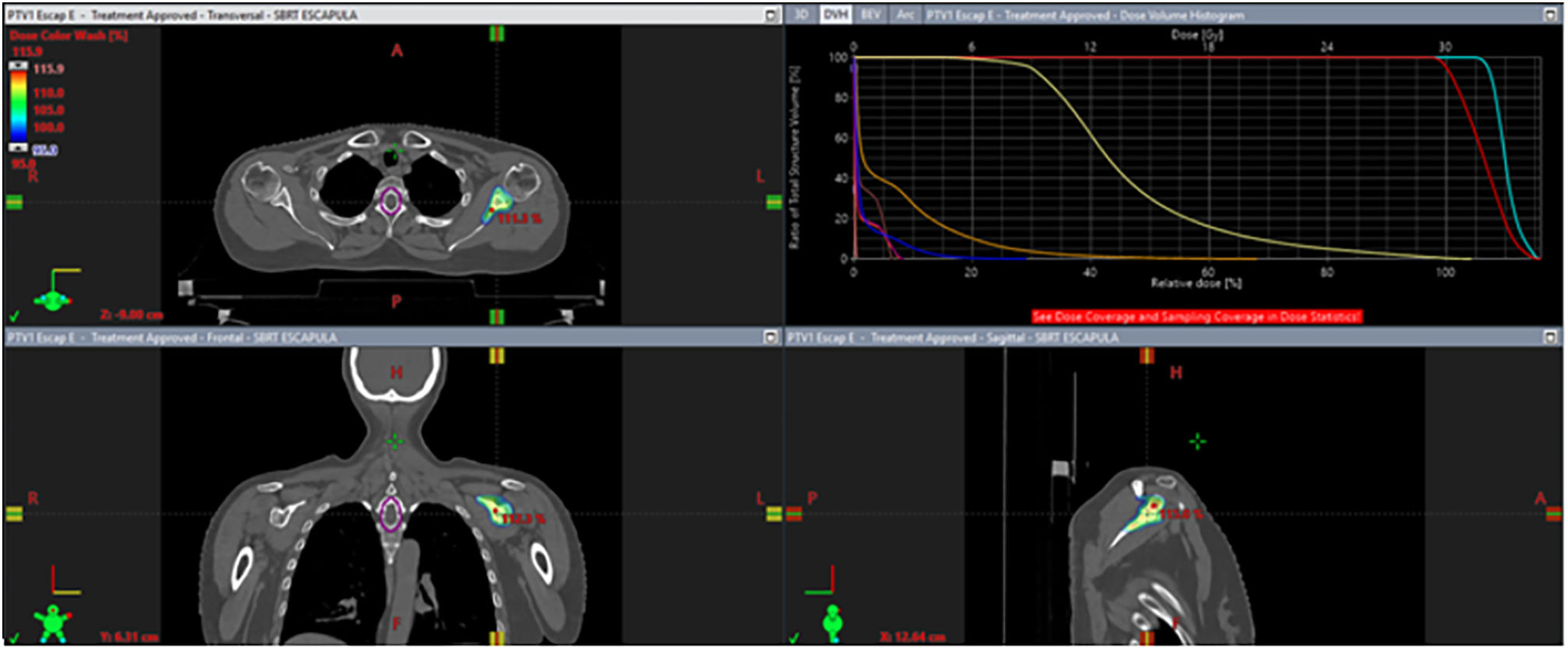
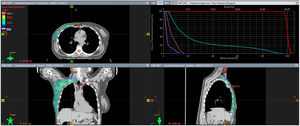
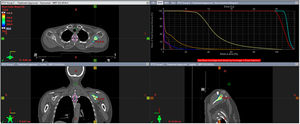
Para el cáncer de mama oligometastásico de novo, la idea de combinar el TS con el tratamiento ablativo de metástasis y el TLR del primario podría ser una estrategia interesante. El número de metástasis en el momento del diagnóstico parece ser un parámetro importante para la selección de pacientes. La estadificación mediante la tomografía por emisión de positrones (PET) muestra rendimientos superiores que las imágenes convencionales. Permite definir las pacientes en situación oligometastásica, que parecen ser las mejores candidatas a la intensificación del TLR3. Como ejemplo de dicho tratamiento, presentamos en las figuras 1 y 2 la radioterapia sobre el tumor primario y sobre una única metástasis ósea en una paciente con cáncer de mama oligometastásico de novo.
Tratamiento locorregional. Se trata del tratamiento con radioterapia adyuvante en una paciente que tras recibir 6 meses de tratamiento sistémico y presentar una respuesta parcial es intervenida de una mastectomía total simple y una linfadenectomía, seguida de radioterapia adyuvante sobre la pared costal y las cadenas ganglionares axilar y supraclavicular homolateral (niveles axilares I-IV), con un esquema de hipofraccionamiento moderado (40,05 Gy en 15 fracciones). Corte de la planificación en axial, coronal y sagital. Adicionalmente el histograma dosis/volumen de la dosimetría.
Radioterapia estereotáxica extracraneal (SBRT) ósea. Se trata del tratamiento con SBRT de la misma paciente, sobre la metástasis ósea única en escápula izquierda, la cual presentó al diagnóstico con una respuesta parcial al tratamiento sistémico. Se administraron 30 Gy en 3 sesiones. Corte de la planificación en axial, coronal y sagital. Adicionalmente el histograma dosis/volumen de la dosimetría.
En general, el concepto de la radioterapia sobre el tumor primario en el estadio IV del cáncer de mama se debe basar en la selección adecuada de las pacientes. Tanto en las series retrospectivas como en los estudios prospectivos disponibles en la literatura, se describen los principales factores pronósticos que podrían ser de gran utilidad para la identificación de las pacientes, basado en múltiples análisis por subgrupo. Algunos de estos factores son: estado funcional, edad, comorbilidades, localización de la enfermedad metastásica (metástasis única u oligometástasis), intervalo libre de enfermedad prolongado, factibilidad y probabilidad de resección completa con márgenes negativos, biología tumoral (debe conocerse siempre que sea posible, tanto a nivel local como a nivel de las metástasis debido a la posibilidad de heterogeneidad de biomarcadores entre los diferentes sitios) y el uso de HT3,4,7,9,13.
Cirugía y radioterapia adyuvanteNumerosos estudios retrospectivos han demostrado el papel del TLR del tumor primario en relación al incremento de la SG y del control local en las pacientes con cáncer de mama metastásico de novo. Sin embargo, en los estudios prospectivos disponibles no se ha podido demostrar consistentemente una mejoría en la supervivencia, y a su vez presentan una serie de sesgos que nos obligan a interpretar cautelosamente los resultados6,9.
Intentando dar luz a este aspecto, en el año 2020 se publicó un metaanálisis por Gera et al., incluyendo publicaciones desde 2015 hasta 2019. Este metaanálisis consta de 42 estudios retrospectivos en pacientes con cáncer de mama oligometastásico tratadas locorregionalmente, de los cuales 37 evalúan el papel de la cirugía. Adicionalmente, fueron incluidos 3 estudios prospectivos. La población analizada es de 216.066 pacientes que fueron tratadas entre 2002 y 2019. Los autores destacan la gran heterogeneidad de las series y estudios incluidos, por lo que se puede generar un importante sesgo en los resultados. El objetivo principal es la SG de las pacientes que reciben TLR. Los resultados muestran que el TLR produce una reducción significativa de la mortalidad (31,8%, HR = 0,6823 [95%; CI 0,6365; 0,7314]). Si se analizan solamente los estudios que incluyeron la cirugía se obtiene 36,2% de reducción de mortalidad (HR = 0,6379 [95%; CI 0,5974; 0,6811]). En cambio, al tener en cuenta solo los estudios prospectivos, se observa el 19,32% de reducción de mortalidad, siendo esta no significativa (HR = 0,8077 [95%; CI 0,5704; 1,1438]). Esta discrepancia podría explicarse por el sesgo de selección y el sesgo de publicación. Los autores concluyen que el TLR del tumor primario parece mejorar la SG en cáncer de mama estadio IV de novo. Por tanto, esta opción terapéutica debe ser considerada en las pacientes seleccionados después de una valoración por un equipo multidisciplinar7.
De los estudios prospectivos disponibles en la literatura, analizaremos los resultados obtenidos de algunos de ellos. El primer estudio de King et al., publicado en el año 2016, se trata de un estudio multicéntrico prospectivo que evalúa el papel de la cirugía del tumor primario en las pacientes con cáncer de mama estadio IV de novo. Se incluyeron 128 pacientes. Como resultado, la cirugía no impactó en la SG, independientemente del fenotipo del cáncer de mama. Aunque este estudio concluyó que la terapia local no afectó la SG en toda la cohorte, la terapia local sí demostró una diferencia en el subgrupo de cáncer de mama HER2 positivo. Al observar este análisis por subgrupos, se podría demostrar que tener un tamaño muestral mayor podría haber demostrado un beneficio estadísticamente significativo en la SG con terapia local, especialmente en el subgrupo HER2 positivo9,14.
El segundo estudio prospectivo de Badwe et al. es un ensayo aleatorizado indio publicado en el año 2017 que analizó el TLR basado en la cirugía y la radioterapia (con las mismas indicaciones que en la paciente no metastásica), versus no tratamiento del tumor primario. No se demostró beneficio con el TLR en término de SG. Además, no se evidenció beneficio en el análisis por subgrupo (estado de menopausia, carga de enfermedad, receptores de estrógenos o progesterona, receptor HER2 positivo). La SG registrada en ambos grupos fue inferior a las cifras reportadas en países desarrollados. Esta discrepancia podría deberse a un diagnóstico tardío en el curso natural de la enfermedad metastásica de novo de la población. Además, la mayoría de las pacientes HER2 positivo, no recibieron tratamiento dirigido debido a restricciones financieras. Solo algunas pacientes recibieron quimioterapia basada en taxanos, por lo que no se pudo estudiar la asociación de estos factores y la SG3,15.
El tercer estudio es un ensayo clínico aleatorizado multicéntrico fase III realizado en Turquía por Soran et al., publicado en el año 2018, que comparó el TLR con la cirugía y la radioterapia (según las indicaciones de cada centro) seguido de TS versus solo TS. Con un seguimiento medio de 36 meses, no hubo diferencias en la SG; sin embargo, se observó una diferencia estadísticamente significativa en la SG a favor del grupo que recibió TLR al ampliar el seguimiento a 40 meses de media. Es importante destacar que este estudio incluyó un mayor número de pacientes con factores de buen pronóstico y poca carga metastásica en el grupo del TLR que podría conllevar a un sesgo de selección5,9.
El cuarto estudio es un ensayo prospectivo aleatorizado fase III de Fitzal et al., que finalizó de manera precoz debido a un escaso reclutamiento. En total, se incluyeron 90 pacientes con un seguimiento medio de 37,5 meses. Las pacientes fueron asignadas al azar a la resección quirúrgica seguida de TS versus solo TS. El estudio no mostró un beneficio en la SG en el caso de la resección quirúrgica. Cabe destacar que el estudio no alcanzó el tamaño de muestra previsto, es decir, los 254 pacientes que se requerían para detectar un efecto de tratamiento clínicamente relevante. Por lo tanto, los resultados no deben interpretarse como concluyentes9,11.
El quinto estudio es un ensayo clínico multicéntrico realizado en Estados Unidos por Khan et al., publicado en el año 2020, en el que todas las pacientes que recibieron TS con buena respuesta (no progresión de enfermedad) se aleatorizaron a recibir TLR con cirugía y radioterapia (según los estándares de enfermedad no metastásica) versus continuar con el TS. Como resultado no se evidenció mejoría en la SG, pero sí se observó mejoría en el control locorregional16.
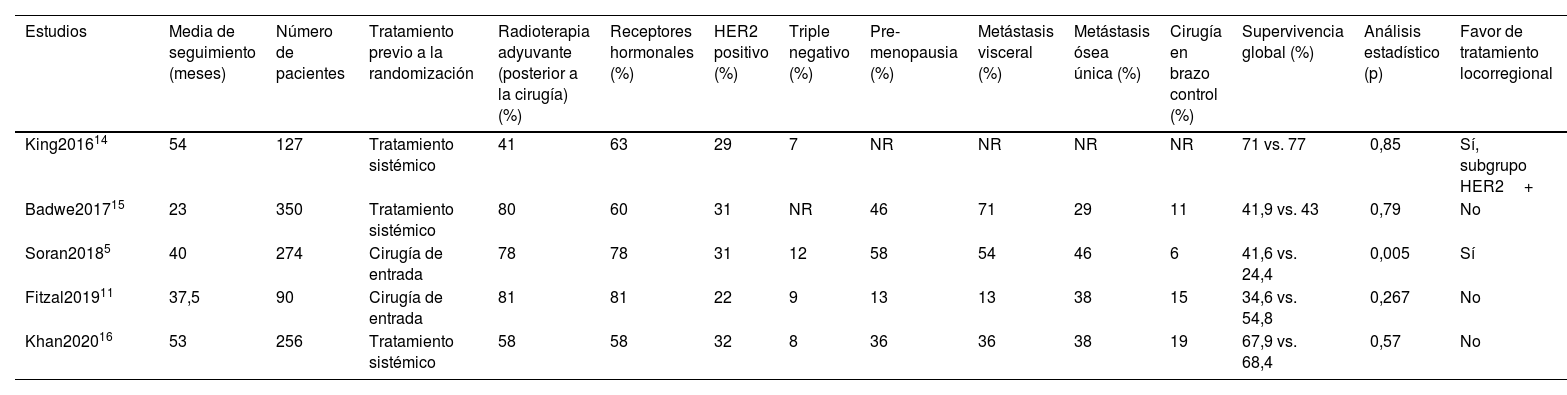
A continuación, se muestran los estudios prospectivos que evalúan el beneficio del TLR (tabla 1).
Estudios prospectivos
| Estudios | Media de seguimiento (meses) | Número de pacientes | Tratamiento previo a la randomización | Radioterapia adyuvante (posterior a la cirugía) (%) | Receptores hormonales (%) | HER2 positivo (%) | Triple negativo (%) | Pre-menopausia (%) | Metástasis visceral (%) | Metástasis ósea única (%) | Cirugía en brazo control (%) | Supervivencia global (%) | Análisis estadístico (p) | Favor de tratamiento locorregional |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| King201614 | 54 | 127 | Tratamiento sistémico | 41 | 63 | 29 | 7 | NR | NR | NR | NR | 71 vs. 77 | 0,85 | Sí, subgrupo HER2+ |
| Badwe201715 | 23 | 350 | Tratamiento sistémico | 80 | 60 | 31 | NR | 46 | 71 | 29 | 11 | 41,9 vs. 43 | 0,79 | No |
| Soran20185 | 40 | 274 | Cirugía de entrada | 78 | 78 | 31 | 12 | 58 | 54 | 46 | 6 | 41,6 vs. 24,4 | 0,005 | Sí |
| Fitzal201911 | 37,5 | 90 | Cirugía de entrada | 81 | 81 | 22 | 9 | 13 | 13 | 38 | 15 | 34,6 vs. 54,8 | 0,267 | No |
| Khan202016 | 53 | 256 | Tratamiento sistémico | 58 | 58 | 32 | 8 | 36 | 36 | 38 | 19 | 67,9 vs. 68,4 | 0,57 | No |
Resumen de los principales estudios prospectivos incluidos en la revision.
En el año 2021 se publicó un metaanálisis que incluye los últimos 4 ensayos mencionados, analizando un total de 970 pacientes. En el análisis no se evidenció aumento de la SG, pero sí se observó un aumento del intervalo libre de progresión local. También se observó un menor tiempo a la progresión a distancia en el grupo de TLR (este último parámetro con limitaciones, ya que solo estaba incluido en 2 de los ensayos). Tampoco se observó beneficio en la SG según el subtipo tumoral, ni en aquellas pacientes con enfermedad ósea única o visceral (esta última consideración solo está reflejada en 2 estudios, por lo que la evidencia es limitada). Cabe destacar, que el análisis de estos factores presentó mejores resultados de SG en las series retrospectivas17.
La principal limitación de las series retrospectivas es el sesgo de selección, ya que se ha podido observar que aquellas pacientes con mejor pronóstico son las que reciben TLR. De igual forma, los ensayos prospectivos no están carentes de sesgos. Por un lado, la heterogeneidad de estos ensayos hace difícil el análisis conjunto de los datos. Referente al análisis por subgrupos, presentan un pequeño tamaño muestral por lo que los resultados son de interpretación limitada.
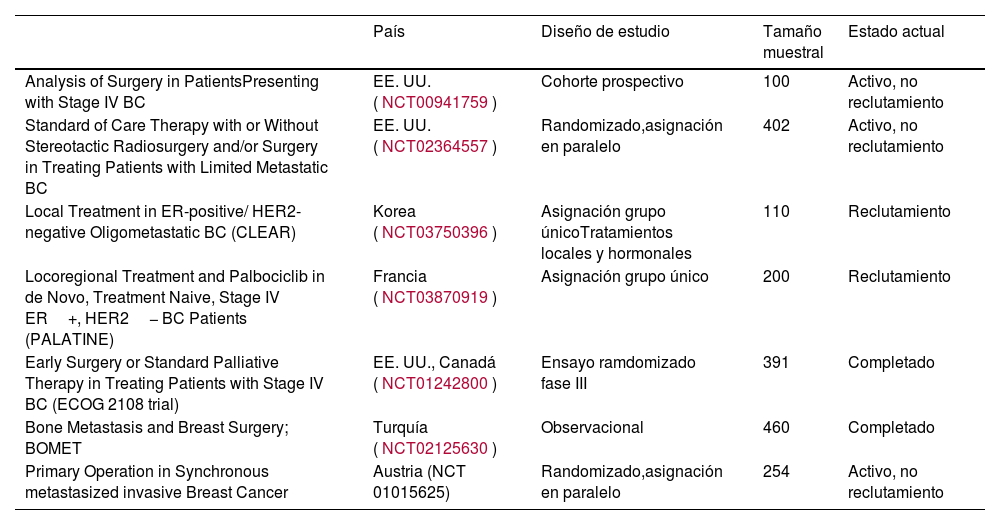
Actualmente, están en curso diferentes ensayos clínicos y estudios observacionales prospectivos con el objetivo de resolver dichas controversias (tabla 2)9,18.
Estudios prospectivos abiertos
| País | Diseño de estudio | Tamaño muestral | Estado actual | |
|---|---|---|---|---|
| Analysis of Surgery in PatientsPresenting with Stage IV BC | EE. UU.(NCT00941759) | Cohorte prospectivo | 100 | Activo, no reclutamiento |
| Standard of Care Therapy with or Without Stereotactic Radiosurgery and/or Surgery in Treating Patients with Limited Metastatic BC | EE. UU. (NCT02364557) | Randomizado,asignación en paralelo | 402 | Activo, no reclutamiento |
| Local Treatment in ER-positive/ HER2-negative Oligometastatic BC (CLEAR) | Korea (NCT03750396) | Asignación grupo únicoTratamientos locales y hormonales | 110 | Reclutamiento |
| Locoregional Treatment and Palbociclib in de Novo, Treatment Naive, Stage IV ER+, HER2− BC Patients (PALATINE) | Francia (NCT03870919) | Asignación grupo único | 200 | Reclutamiento |
| Early Surgery or Standard Palliative Therapy in Treating Patients with Stage IV BC (ECOG 2108 trial) | EE. UU., Canadá (NCT01242800) | Ensayo ramdomizado fase III | 391 | Completado |
| Bone Metastasis and Breast Surgery; BOMET | Turquía (NCT02125630) | Observacional | 460 | Completado |
| Primary Operation in Synchronous metastasized invasive Breast Cancer | Austria (NCT 01015625) | Randomizado,asignación en paralelo | 254 | Activo, no reclutamiento |
Resumen esquemático de los principales ensayos abiertos en el momento de la revisión sobre el tratamiento locorregional en las pacientes con cáncer de mama metastásico de novo.
Con respecto a la evidencia científica disponible del TLR con radioterapia exclusiva, las publicaciones se basan en estudios retrospectivos, siendo la evidencia muy limitada debido a su asociación con la cirugía en la mayoría de los estudios, por ello es difícil valorar el beneficio individual de la radioterapia. Las series retrospectivas publicadas parecen orientar que el TLR con cirugía y radioterapia o con radioterapia exclusiva pueden ser alternativas con similares resultados en control local6,12.
Pasamos a mencionar algunos estudios. Un primer estudio francés realizado en el Centre René Huguenin demostró en un análisis multivariable que la radioterapia locorregional está asociada con un aumento de la SG. En los estudios analizados, la cirugía del tumor primario se usó raramente, en cambio la radioterapia locorregional con intención radical fue la modalidad de tratamiento más frecuente. Esto sugiere que la radioterapia puede ser una alternativa aceptable a la cirugía, con el beneficio añadido de presentar menor morbilidad. Otro resultado del análisis realizado es que incluso en pacientes con enfermedad metastásica avanzada y con datos desfavorables al diagnóstico (afectación visceral o múltiples lesiones), se podrían beneficiar de la radioterapia locorregional19,20.
El segundo estudio a mencionar también es un estudio retrospectivo francés realizado en el Institut Gustave-Roussy que analizó el papel del TLR, ya sea con radioterapia sola o con cirugía y radioterapia adyuvante. El estudio no observó diferencias entre ambas ramas de tratamiento, sugiriendo que la radioterapia exclusiva sin la cirugía puede ser un TLR adecuado para las pacientes con cáncer de mama metastásico19–21.
Scodan et al. publicaron una cohorte retrospectiva de 581 pacientes con cáncer de mama metastásico, en las que se comparó administrar un TLR respecto a no administrarlo. En la rama del TLR hasta el 78% de las pacientes recibieron exclusivamente radioterapia en la mama y las cadenas ganglionares. En el análisis multivariante, el TLR se asoció a un aumento de la SG. La combinación de cirugía y radioterapia, aunque minoritaria en su rama, se mostró como la opción con mejor SG6,21.
El mayor y más reciente de los estudios que evalúan el papel de la radioterapia como tratamiento radical exclusivo en cáncer de mama metastásico es un estudio multicéntrico publicado en el año 2020 que incluyó a 1.965 pacientes. Se analizó el impacto del TLR (891 pacientes), diferenciando las pacientes que recibieron radioterapia, cirugía o la combinación de ambas. El estudio multivariante asoció el TLR a una mejor supervivencia libre de progresión. Además, en este análisis, la radioterapia exclusiva y la combinación de cirugía y radioterapia también se asociaron a una reducción del riesgo de mortalidad22,23.
Una serie retrospectiva publicada en 2020 por Wang et al. analizó las diferentes modalidades de TLR recibido. Como conclusión destaca que añadir la radioterapia a la cirugía (conservadora o mastectomía) mejora la supervivencia cáncer específica. También observó que la supervivencia no es inferior en aquellas pacientes con cirugía conservadora y radioterapia versus a la mastectomía y radioterapia, por lo que la mejor opción para el TLR sería la cirugía conservadora y radioterapia, al tratarse de las técnicas menos agresivas y con mejores resultados estéticos, así como mejor calidad de vida para las pacientes24.
De estos estudios se concluye que la radioterapia exclusiva supone una alternativa viable en las pacientes seleccionadas para el TLR. Por tanto, el tratamiento con radioterapia exclusiva posterior al TS es una buena opción de tratamiento, ya que permite aumentar las respuestas clínicas completas y es una alternativa a la resección quirúrgica. Estos datos otorgan a la radioterapia un aumento significativo en SG y control local frente a no recibir TLR6,12.
A continuación, se muestran las principales series retrospectivas que evalúan el papel de la radioterapia exclusiva (tabla 3)20,21,23.
Series retrospectivas sobre radioterapia exclusiva
| Año de publicación/ Autor principal | Muestra | Seguimiento(años) | Supervivencia global | Limitaciones | Conclusión |
|---|---|---|---|---|---|
| 2009Scodan et al.21 | Total: 581 pacientes320: tratamiento locorregional- 249 Radioterapia exclusiva- 41 Cirugía y radioterapia- 30 Cirugía exclusiva | 3,25 | A 3 años 43,4% con tratamiento locorregional frente a 26,7% sin tratamiento locorregional (p = 0,00002) | La radioterapia exclusiva es una alternativa como modalidad de tratamiento locorregional en pacientes con cáncer de mama metastásico de novo | |
| 2010Bourgier et al.20 | Total: 239 pacientes- 147 Radioterapia exclusiva- 92 Cirugía +/− radioterapia (30% no radioterapia) | 6,5 | Mayor supervivencia libre de progresión (20% vs. 39%) y supervivencia global (39% vs. 57%) con tratamiento locorregional | Gran variabilidad en los volúmenes, dosis y tiempos de radioterapia | Posible papel del tratamiento locorregional, especialmente de la radioterapia exclusiva en el control de la enfermedad local en pacientes metastásicas de novo seleccionadas |
| 2020Pons-Tostivint et al.22 | Total: 1.965 pacientes891: tratamiento locorregional- 41,1% radioterapia exclusiva- 13,7% cirugía exclusiva- 45,2% cirugía y radioterapia | 3,8 | Radioterapia exclusiva: HR = 0,63, IC del 95% (0,49; 0,80) p < 0,001Cirugía y radioterapia: HR = 0,61, IC del 95% (0,47; 0,78)p < 0,001Cirugía exclusiva: HR = 0,87, 95% IC (0,61; 1,26)p = 0,466 | Grupo que recibe radioterapia exclusiva tumor más grande (p < 0,0001) y mayor carga tumoral (p = 0,0004) | La radioterapia exclusiva se asocia a una mayor supervivencia global de manera estadísticamente significativa |
Resumen de las series retrospectivas más destacadas, donde se analiza la supervivencia global en las pacientes con cáncer de mama metastásico de novo que reciben tratamiento locorregional con radioterapia exclusiva, frente a otras modalidades de tratamiento locorregional.
La modalidad y técnica de radioterapia más idónea no está claramente definida. En las series retrospectivas publicadas existen múltiples limitaciones, debido a la poca disponibilidad de la información sobre la dosis, el volumen y el fraccionamiento utilizado. Tampoco se dispone de información sobre la secuencia temporal de radioterapia respecto al TS. Una opción razonable podría ser administrar esquemas habituales de enfermedad no metastásica: esquemas de normofraccionamiento (dosis total 50 Gy administradas durante 25 sesiones a 2 Gy/fracción, 5 días por semana) o bien hipofraccionamiento moderado (dosis total 40,05 Gy administradas durante 15 sesiones a 2,67 Gy/sesión, 5 días por semana). Posteriormente, es recomendable administrar una sobreimpresión de la enfermedad macroscópica, respetando la dosis de tolerancia en los órganos de riesgo. Aún hay menos consenso sobre la dosis y el fraccionamiento de la sobreimpresión, la dosis oscila entre 16 y 20 Gy para el tumor primario y de 10 a 16 Gy para la enfermedad ganglionar a una dosis equivalente de 2 Gy/sesión6,23,25.
Las recomendaciones de las guías actuales reconocen la necesidad de realizar más ensayos clínicos aleatorizados, que evalúen los riesgos y beneficios de la TLR en el cáncer de mama estadio IV y que eliminen los sesgos de selección encontrados en los estudios disponibles. Aunque los datos disponibles no respaldan ampliamente la consideración de la terapia local con cirugía y/o radioterapia, se podría considerar en pacientes seleccionadas con respuesta a la TS inicial, individualizando las decisiones en comités oncológicos multidisciplinares26.
ConclusionesLas series retrospectivas presentan resultados variables en relación al beneficio de TLR en pacientes con cáncer de mama metastásico, pero en la mayoría de ellos los resultados son positivos en mejorar la SG y el control local. Sin embargo, es importante tener en cuenta que debido a las características heterogéneas de los estudios retrospectivos podemos encontrarnos con múltiples sesgos, debiendo ser analizados los resultados con cautela.
Con respecto a los estudios prospectivos, se evidencia una gran heterogeneidad también entre ellos. Algunos con resultados positivos en la mejoría de la SG y otros con resultados negativos, pero no estadísticamente significativos.
Entre los diferentes análisis por subgrupos realizados, se puede inferir la importancia de los principales factores pronósticos en la selección de las pacientes que podrían beneficiarse del TLR y a su vez de una intensificación del tratamiento. Los avances en la biología molecular podrían ayudar a seleccionar mejor estos subgrupos de pacientes.
En cuanto al papel de la radioterapia, la adyuvancia tras la resección quirúrgica con intención radical es una opción a considerar para mejorar el control local y SG, según diversas series retrospectivas. En ese escenario, la mayoría de los estudios utilizaron dosis y fraccionamientos de radioterapia similares a los esquemas de pacientes no metastásicas. En casos seleccionados no candidatos a cirugía, la radioterapia exclusiva también puede ser una alternativa a considerar con el beneficio añadido de menor morbilidad.
Por tanto, ante la evidencia científica disponible, podemos concluir que el TLR en las pacientes con cáncer de mama metastásico de novo debe ser consensuado de forma multidisciplinar e individualizada en cada caso y a su vez promover la participación activa de las pacientes en la toma de decisiones.
Es importante la realización de un esfuerzo a nivel global para intentar resolver estas preguntas con potencial relevancia en el tratamiento del cáncer de mama metastásico.
Responsabilidades éticasEn esta revisión bibliográfica se siguieron todos los protocolos éticos relevantes para garantizar la integridad y la ética de la revisión bibliográfica y se protegió adecuadamente la privacidad y la confidencialidad de los participantes en los estudios incluidos.
FinanciaciónNinguno de los autores ha recibido honorarios o financiación de ninguna organización o empresa que pudiera tener un interés financiero en los resultados de este estudio.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses en relación con los resultados presentados en esta revisión.