Evaluar la utilidad de la resonancia magnética con microbobina en el estudio del complejo aréola/pezón y su lugar en el algoritmo de exámenes en derrames de significación clínica (telorragia).
Pacientes y métodoEstudio descriptivo de pacientes con derrames uniporos por pezón utilizando microbobinas disponibles comercialmente en secuencias con y sin contraste en resonador magnético, presentando los hallazgos en reconstrucción tridimensional compartidos con el cirujano y analizando con el patólogo las resecciones quirúrgicas cuando fueron indicadas, en el periodo comprendido entre noviembre de 2013 y marzo de 2015.
ResultadosSe estudiaron 25 pacientes. En 15 se encontraron lesiones benignas (6 papilomas centrales, 4 galactoceles, 2 proliferaciones papilares sin atipia, una mastopatía quística, un absceso, un fibroadenoma), y en 9 pacientes (36%), carcinomas en su mayoría con patrones micropapilar y cribiforme. La mayoría de lesiones benignas (papilomas) se asociaron con conductos dilatados con señal hemática o serosa y el defecto de relleno por la proliferación y realzado con el gadolinio. La mayoría de las lesiones malignas presentaron ductos no tan dilatados, con señal hemática principalmente y realces no-masa de anillos conglomerados cuyas reconstrucciones volumétricas los presentaron como «esponjas/corales».
ConclusionesEl método se presenta eficaz y efectivo e impulsa a considerarlo como indicación primaria, simple y sencilla, en el estudio de las telorragias y en el examen global del complejo aréola/pezón.
To evaluate the use of magnetic resonance imaging (MRI) with microcoils in the study of the nipple-areolar complex and its importance in the examination algorithm in cases of clinically significant discharge (thelorrhagia).
Patients and methodDescriptive study of a group of patients with single-pore nipple discharge by using commercially available microcoils, with and without contrast, in a magnetic resonator. Three-dimensional reconstruction of the findings, with the very high resolution provided by microcoils, was shared with the surgeon, and surgical resections were analysed with the pathologist, when indicated, from November 2013 to March 2015.
ResultsTwenty-five patients were included. Of these, benign lesions were found in 15 patients (6 central papillary tumors, 4 galactoceles, 2 papillary proliferations without atypia, 1 cystic mastopathy, 1 abscess, and 1 fibroadenoma). Carcinomas were found in 9 patients (36%), mostly with micro papillary and cribriform patterns. Most nonmalignant lesions (papillary tumours) were associated with dilated ducts, with haematogenous or serous signs and filling defect due to proliferation and gadolinium enhancement. Most malignant lesions showed less dilated vessels, mainly with haematogenous signs and non-mass enhancement of clustered rings whose volume reconstructions showed them as «sponge or corals».
ConclusionsThe method is simple and effective and could be used as a first line indication for the treatment of thelorrhagia and in the global examination of the nipple-areolar complex.
El derrame por pezón, tercer motivo de consulta, es a menudo irrelevante desde el punto de vista clínico. Para ser significativo debe ser: uniporo, verdadero, espontáneo, persistente y sin relación con la lactancia, seroso o serohemático1. La gran mayoría son de causas benignas, pero no obstante predisponen al cirujano a actuar más directamente, por la demanda de paciente (ansiedad, temores, invalidez) y por la carencia de estudios confiables, y con la cirugía como único método diagnóstico y terapéutico1-4. Los test diagnósticos en uso y de primera línea (clínico, mamografía, ecografía y citología) a menudo no son concluyentes. En una segunda línea se agrega la galactografía, y algunos centros proponen la ductoscopia, que se presenta como una sofisticada modalidad exploratoria y terapéutica. Ambos test presentan dificultad técnica y disponibilidad4,5. En consecuencia, parece que los test convencionales han agotado sus aportes en el estudio de los derrames por pezón. La resonancia magnética (RM) convencional —con sus atributos comprobados en el estudio global de la mama, cuyas competencias en este segmento han sido analizadas por la Sociedad Europea de Especialistas en Cáncer de Mama (EUSOMA) en el ítem 10 de su publicación— puede ser una herramienta de gran utilidad en el estudio de los derrames por pezón6.
A partir de sus recomendaciones de líneas a desarrollar hemos tomado la idea de valorizar técnicas para ductografía indirecta utilizando microbobinas disponibles comercialmente que en un principio fueron destinadas a áreas osteoarticulares, lesiones periféricas de dedos y pequeñas estructuras, y recientemente al estudio de lesiones cutáneas7,8. En el tema que nos incumbe existen publicaciones previas acerca de la eficiencia de las mencionadas microbobinas en el estudio con alta resolución de distintos tipos de lesiones mamarias9. El objetivo de este estudio fue analizar en uso de la RM con microbobina como alternativa primaria en el contexto clínico de derrame por pezón, presentando los hallazgos en reconstrucciones tridimensionales demostrativas de la lesión o lesiones y su disposición lobar.
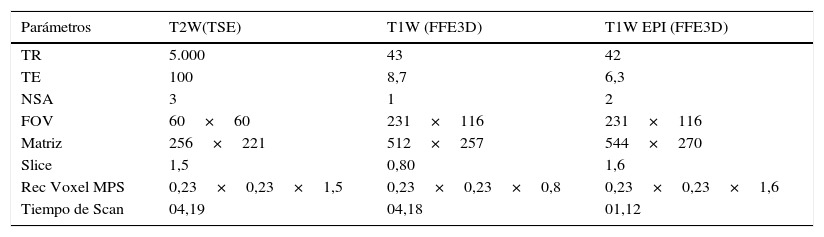
Material y métodoEste estudio contó con la aprobación del Comité de Ética y de Docencia e Investigación del Centro de Imágenes Médicas. Entre noviembre de 2013 y febrero de 2015 hemos estudiado derrames serosos o serosanguinolentos y uniporos por pezón a 25 pacientes, cuyas edades oscilan entre 35 y 80años, con RM en un equipo 1,5-T Intera (Philips Medical Systems) con bobina microscópica de superficie de 4,7cm de diámetro, centrada en la aréola, según se ha publicado9. Por su diseño y sus dimensiones la bobina permite la exploración en los decúbitos, ventral o laterales según el hábito de la paciente, desplegando la mama para evitar el colapso de sus lóbulos. El alto rédito que produce la bobina en su entorno penaliza la cobertura del campo, requiriendo correcciones para uniformar la señal. Esta solución está prevista aplicando el algoritmo CLEAR (Constant Level Appearence, Philips Medical Systems) para recuperar profundidad y señal uniforme en la zona de interés, permitiendo estudiar la aréola y el parénquima subyacente hasta una distancia no menor a 6cm desde la base del pezón, abarcando divisiones de los conductos hasta el 4.o grado. Los parámetros empleados se muestran en la tabla 1. El software, según el FOV, ajusta la matriz proporcionando píxeles de 0,23×0,23mm con slices de 1,5mm en el T2 (TSE) y de 0,8mm en el T1 (FF3D), construyendo vóxeles no isotrópicos pero que, por sus dimensiones, permiten reconstruir máxima intensidad (MIP) y 3D Volumen Render en distintos planos. Las secuencias son obtenidas solo en plano axial: T2 (TSE) de 4,19min y 4 secuencias T1 (FF3D): una previa y 3 tras la inyección de gadolinio, una precoz T1 EPI (FF3D) de 1,12min y otras 2 consecutivas de 4,18min, que en total suman 17,85min. Es un estudio fundamentalmente morfológico, sin curvas de realce por las gestiones exclusivas de la microbobina que provee imágenes de alta resolución pero con tiempos de adquisición de 4min de promedio. La jerarquía del realce se puede estimar visualmente.
Secuencias y parámetros de resonancia magnética con microbobina (Philips)
| Parámetros | T2W(TSE) | T1W (FFE3D) | T1W EPI (FFE3D) |
|---|---|---|---|
| TR | 5.000 | 43 | 42 |
| TE | 100 | 8,7 | 6,3 |
| NSA | 3 | 1 | 2 |
| FOV | 60×60 | 231×116 | 231×116 |
| Matriz | 256×221 | 512×257 | 544×270 |
| Slice | 1,5 | 0,80 | 1,6 |
| Rec Voxel MPS | 0,23×0,23×1,5 | 0,23×0,23×0,8 | 0,23×0,23×1,6 |
| Tiempo de Scan | 04,19 | 04,18 | 01,12 |
En el análisis pre y poscontraste de los conductos considerados patológicos (dilatados y de señal de contenido hemático o sus derivados en las secuencias T2 Fat Sat y T1 FFE previas a la inyección) las lesiones fueron rutinariamente ostensibles por la presencia de defectos de relleno en los ductos centrales, del realce periductal y en su extensión distal como nódulos y/o parches de realces no-masa.
Del análisis global de las imágenes por RM se describieron los siguientes hallazgos relevantes por la conducta a seguir:
- 1)
Conductos centrales dilatados globalmente con señal líquida o serohemática con o sin pequeños defectos de relleno submilimétricos, sin disposición lobar, como indicativos de proceso inflamatorio crónico.
- 2)
Conductos centrales dilatados globalmente, con señal líquida o serohemática, sin disposición lobar, manifestación de proceso inflamatorio crónico, pero con alguna saculación más prominente o quiste asociado y que puede alojar un papiloma.
- 3)
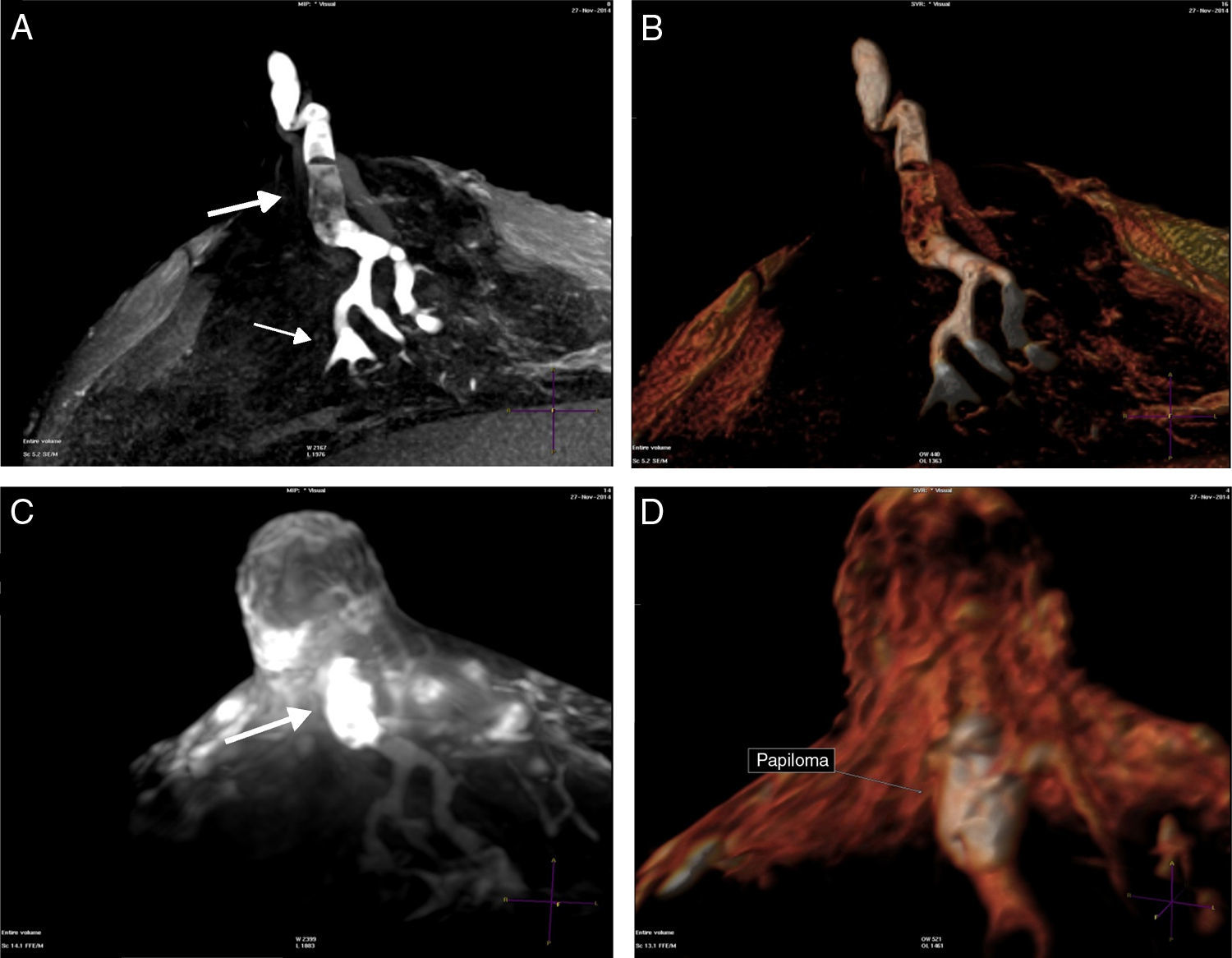
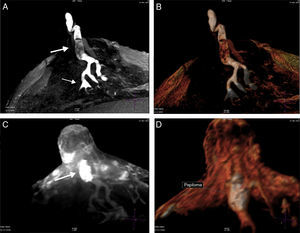
Conducto central dilatado, con señal líquida o hemática, con defecto de relleno sólido, mensurable, con o mínimo realce con el gadolinio, con la dilatación más prominente en el sector proximal al poro galactóforo del pezón, fueron interpretados como papilomas. Se consignaron sus dimensiones y la distancia hasta la base del pezón.
- 4)
Conducto/s central/es escasamente o no dilatados, con señal francamente hemática, sistematizado/s en algún lóbulo con realces lineales y paralelos en su contorno, en «vía de tren» y asociados a realces no-masa focales o segmentarios de pequeños nódulos y/o anillos conglomerados como manifestación de proliferaciones intraductales7,8. La reconstrucción volumétrica los presenta como esponjas/corales arborescentes en el tallo del conducto. Los realces no-masa pueden ser mejor analizados y caracterizados en las secuencias más tardías.
- 5)
Conductos centrales con o sin dilatación asociados a un nódulo o distorsión con efecto de masa.
En todos los casos se consignó su extensión en los 3 planos y topografía en cuadrantes y radios. Los hallazgos 1, 2 y 3 fueron considerados benignos o muy probablemente benignos, y los hallazgos 4 y 5 fueron considerados sospechosos de malignidad. Se invitó al cirujano a compartir los hallazgos y para comentar personalmente el caso, concluyendo con la impresión diagnóstica acompañada de la localización anatómica del lóbulo afecto, con sus dimensiones y distancia a la base del pezón. Se recurrió a ecografía en segunda mirada ante una lesión focal para determinar la factibilidad de su biopsia. Con las lesiones no-masa no se indicó la ecografía por su limitado aporte10,11.
En los casos que se indicó la resección quirúrgica no se recurrió a la localización preoperatoria con arpón u otro elemento por la información de las imágenes analizadas conjuntamente en la consola y por la restricción propia del diseño de la microbobina.
Los hallazgos de las pacientes operadas se correlacionaron con las imágenes, la microscopia y la histología de las piezas quirúrgicas. El diagnóstico histopatológico se obtuvo por resecciones efectuadas por 8 cirujanos que compartieron en la estación de trabajo los hallazgos y reconstrucciones 3D. Se contactó a los médicos patólogos, algunos pre y poscirugía, para comentar la impresión diagnóstica y analizar las imágenes más demostrativas. Todos los pacientes fueron estudiados con el mismo set de secuencias de resonancia (tabla 1).
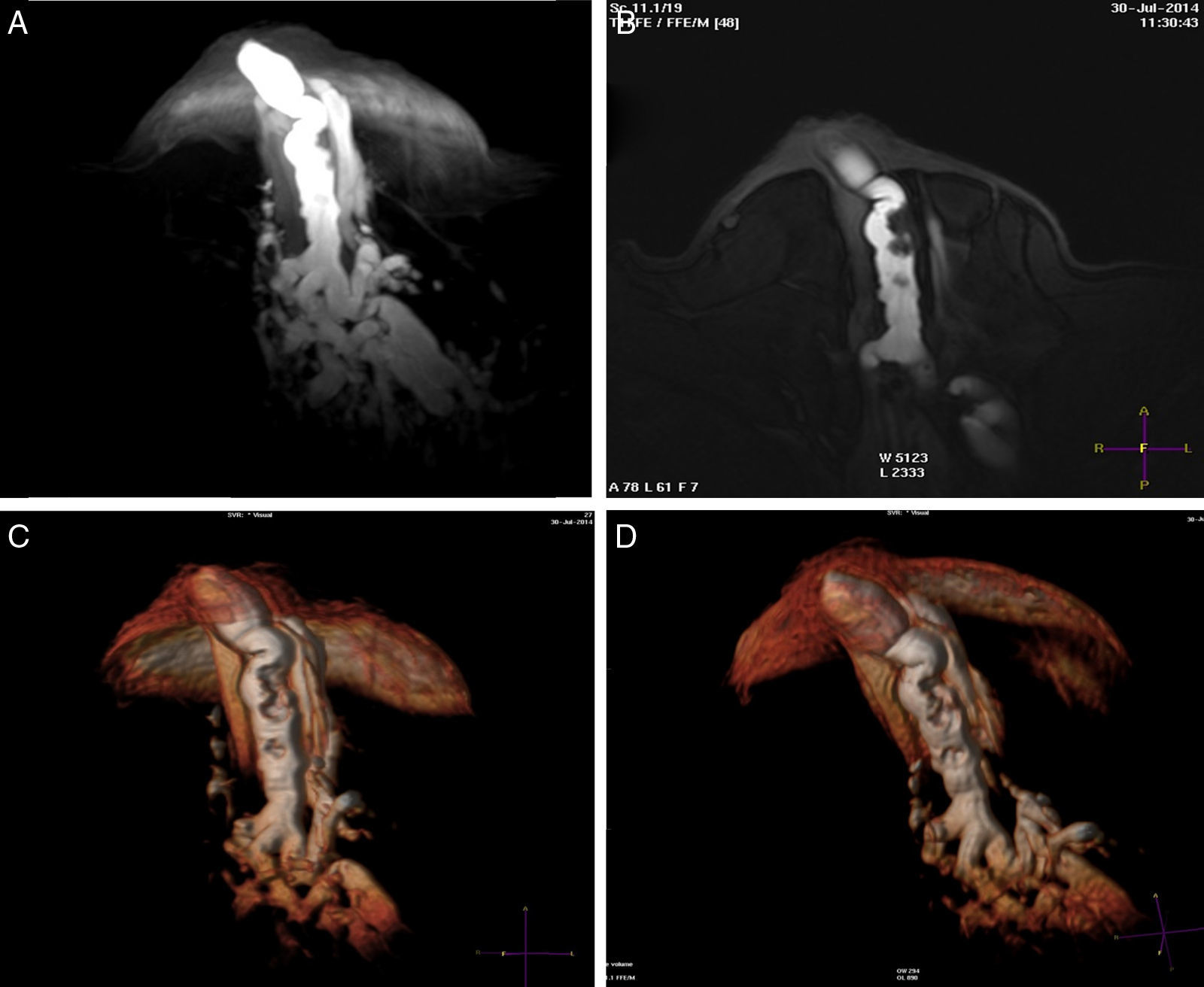
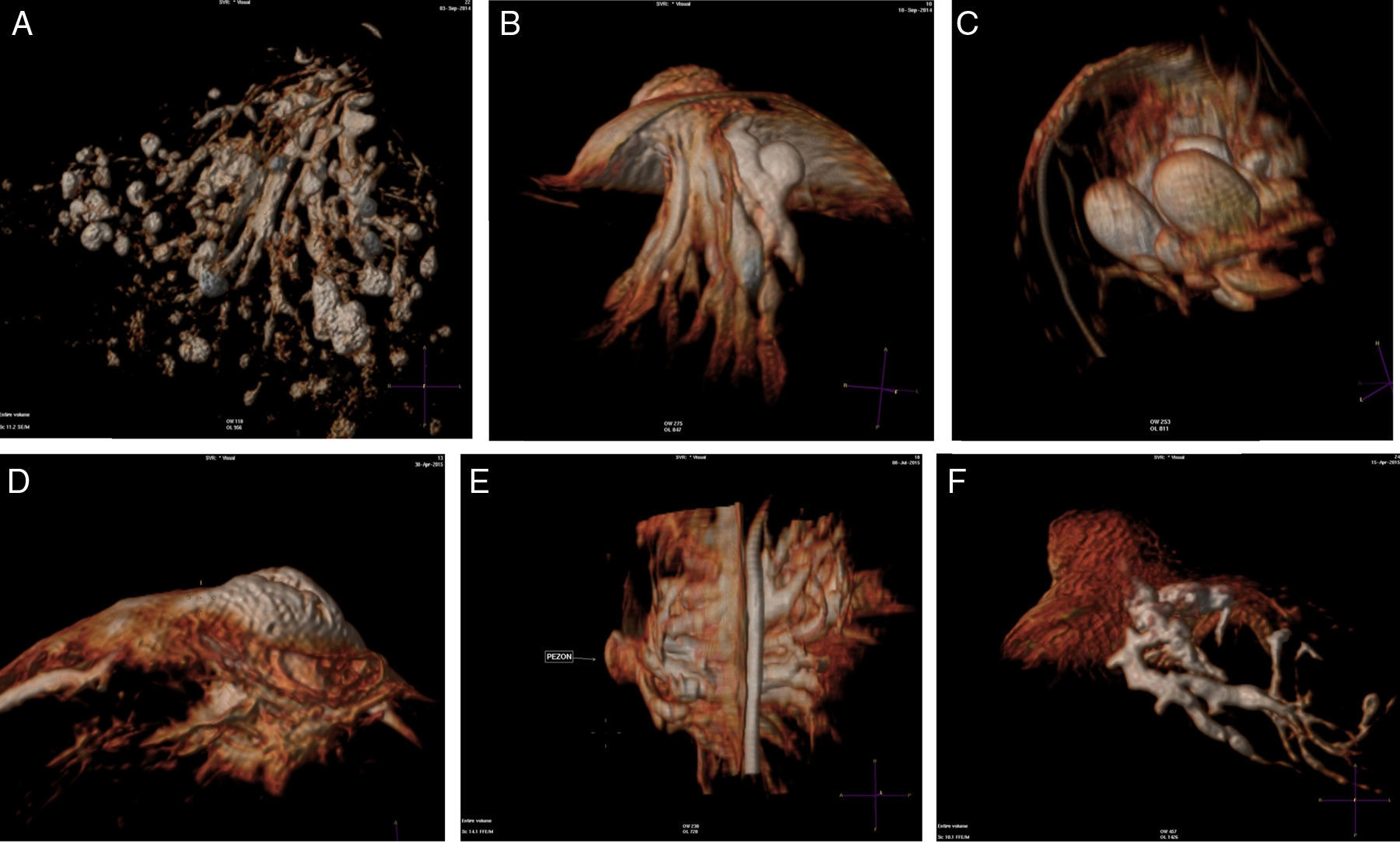
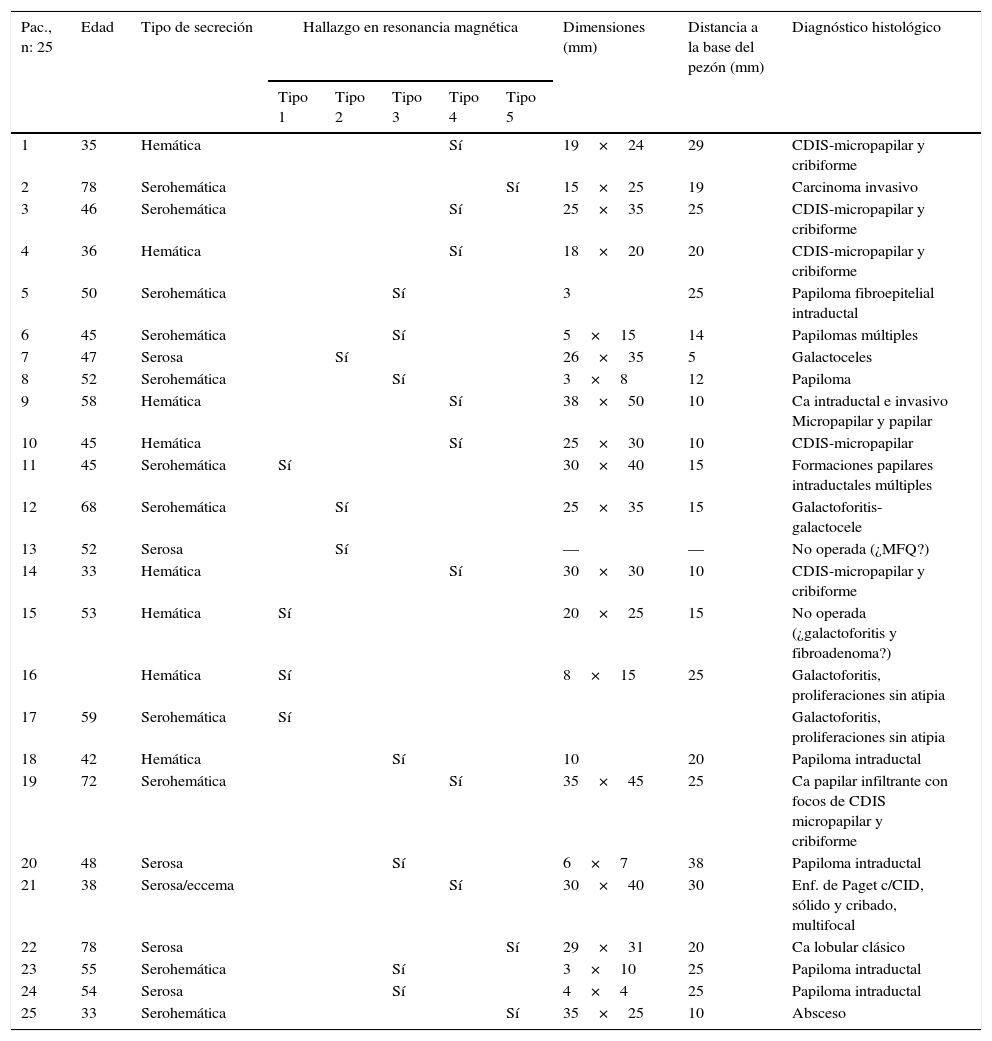
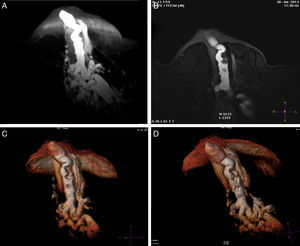
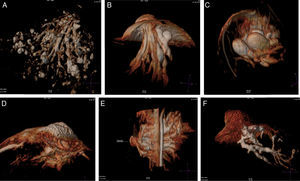
ResultadosEl detalle de los hallazgos, dimensiones e histología de las pacientes incluidos en el estudio se presentan en la tabla 2. Dos pacientes no fueron operadas: una por la presencia de múltiples quistes dispuestos sin ninguna sistematización, y otra con un nódulo con aspecto de fibroadenoma también evidente con ecografía, adyacente al galactóforo sangrante sin otros hallazgos y porque la misma paciente postergó la intervención. En 15 pacientes (60%) se encontraron lesiones benignas. En las figuras 1-2 se muestran papilomas centrales que midieron entre 3 y 7mm, y en la figura 3 se presentan ejemplos de lesiones benignas. La anatomía patológica resultante mostró carcinomas en 9 pacientes (39%), 4 presentaron CDIS (3 de bajo grado y uno de grado intermedio) y 4 carcinomas con algún componente invasivo y uno con enfermedad de Paget. Los 4 pacientes con CDIS y 3 de los carcinomas invasores mostraron patrones micropapilar y cribiforme en correlación con los realces no-masa de conglomerados de pequeños nódulos y anillos, que representaron «esponjas/corales» en 3D (MIP y Volumen Render. (figs. 4 y 5). De la población de 23 pacientes, en 17 el derrame fue francamente hemático. En 7 (41%) de los 17 pacientes con derrame francamente hemático se encontró cáncer. A su vez, 7 (77%) de los 9 cánceres se presentaron con derrame francamente hemático.
Pacientes, hallazgos en RM, dimensiones de las lesiones y diagnóstico histológico
| Pac., n: 25 | Edad | Tipo de secreción | Hallazgo en resonancia magnética | Dimensiones (mm) | Distancia a la base del pezón (mm) | Diagnóstico histológico | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| Tipo 1 | Tipo 2 | Tipo 3 | Tipo 4 | Tipo 5 | ||||||
| 1 | 35 | Hemática | Sí | 19×24 | 29 | CDIS-micropapilar y cribiforme | ||||
| 2 | 78 | Serohemática | Sí | 15×25 | 19 | Carcinoma invasivo | ||||
| 3 | 46 | Serohemática | Sí | 25×35 | 25 | CDIS-micropapilar y cribiforme | ||||
| 4 | 36 | Hemática | Sí | 18×20 | 20 | CDIS-micropapilar y cribiforme | ||||
| 5 | 50 | Serohemática | Sí | 3 | 25 | Papiloma fibroepitelial intraductal | ||||
| 6 | 45 | Serohemática | Sí | 5×15 | 14 | Papilomas múltiples | ||||
| 7 | 47 | Serosa | Sí | 26×35 | 5 | Galactoceles | ||||
| 8 | 52 | Serohemática | Sí | 3×8 | 12 | Papiloma | ||||
| 9 | 58 | Hemática | Sí | 38×50 | 10 | Ca intraductal e invasivo Micropapilar y papilar | ||||
| 10 | 45 | Hemática | Sí | 25×30 | 10 | CDIS-micropapilar | ||||
| 11 | 45 | Serohemática | Sí | 30×40 | 15 | Formaciones papilares intraductales múltiples | ||||
| 12 | 68 | Serohemática | Sí | 25×35 | 15 | Galactoforitis-galactocele | ||||
| 13 | 52 | Serosa | Sí | — | — | No operada (¿MFQ?) | ||||
| 14 | 33 | Hemática | Sí | 30×30 | 10 | CDIS-micropapilar y cribiforme | ||||
| 15 | 53 | Hemática | Sí | 20×25 | 15 | No operada (¿galactoforitis y fibroadenoma?) | ||||
| 16 | Hemática | Sí | 8×15 | 25 | Galactoforitis, proliferaciones sin atipia | |||||
| 17 | 59 | Serohemática | Sí | Galactoforitis, proliferaciones sin atipia | ||||||
| 18 | 42 | Hemática | Sí | 10 | 20 | Papiloma intraductal | ||||
| 19 | 72 | Serohemática | Sí | 35×45 | 25 | Ca papilar infiltrante con focos de CDIS micropapilar y cribiforme | ||||
| 20 | 48 | Serosa | Sí | 6×7 | 38 | Papiloma intraductal | ||||
| 21 | 38 | Serosa/eccema | Sí | 30×40 | 30 | Enf. de Paget c/CID, sólido y cribado, multifocal | ||||
| 22 | 78 | Serosa | Sí | 29×31 | 20 | Ca lobular clásico | ||||
| 23 | 55 | Serohemática | Sí | 3×10 | 25 | Papiloma intraductal | ||||
| 24 | 54 | Serosa | Sí | 4×4 | 25 | Papiloma intraductal | ||||
| 25 | 33 | Serohemática | Sí | 35×25 | 10 | Absceso | ||||
CDIS: carcinoma ductal in situ; MFQ: mastopatía fibroquística.
A) T1 sin contraste con galactóforo con señal hemática hasta su división de 4.o grado (flecha pequeña) y defecto de relleno (flecha grande). B) Volumen Render. C) T1 con contraste realzando un papiloma central originado en conductos mayores (flecha). D) Volumen Render del papiloma.
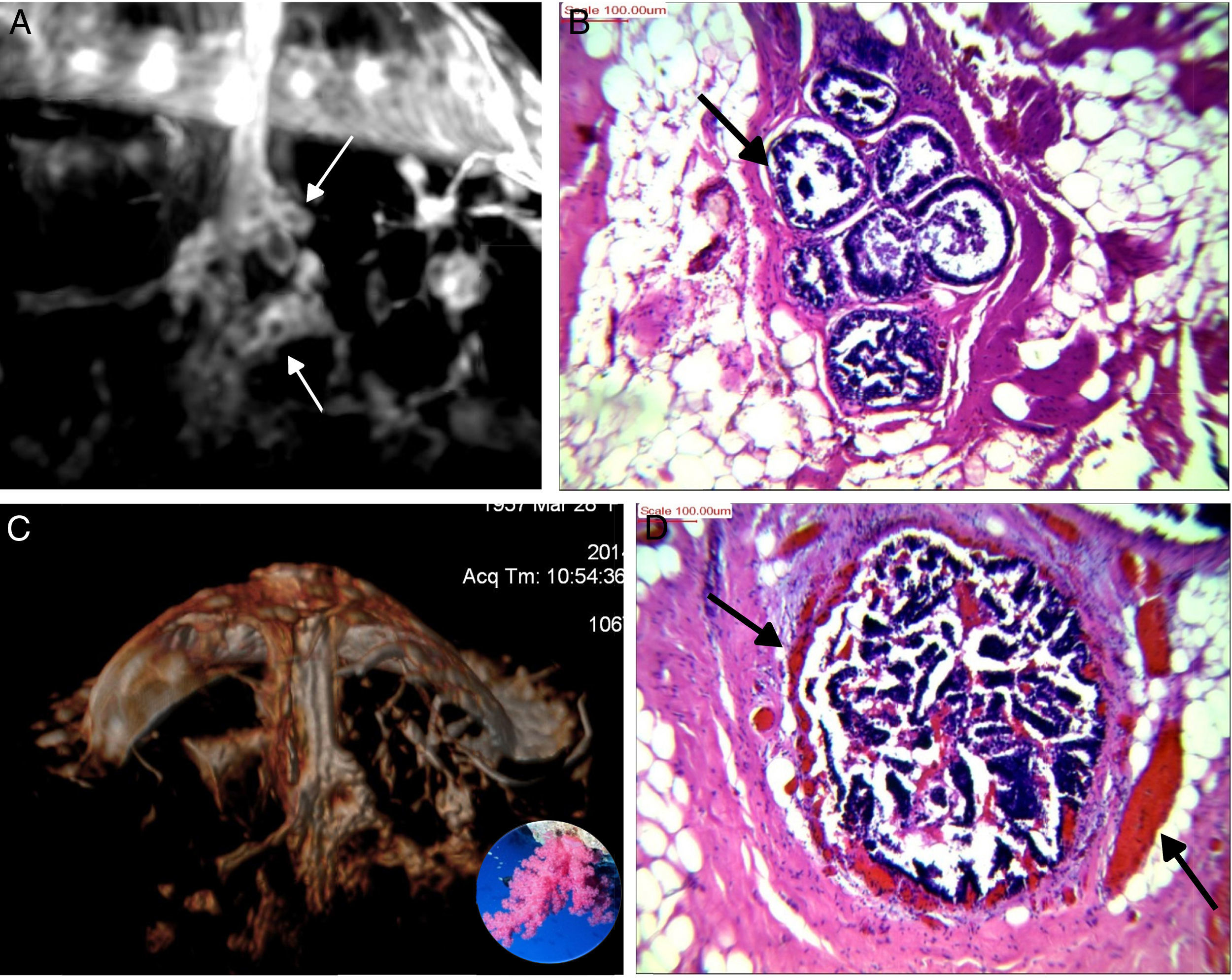
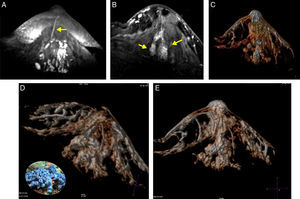
A) T1 s/contraste, galactóforo no dilatado, central (flecha) en un segmento con múltiples conductos con señal hemática. B) T1 c/gado. anillos conglomerados, segmentarios (flechas). C-E) Reconstrucción de volumen presentando los anillos conglomerados como «esponjas/corales» de carcinoma micropapilar y cribiforme.
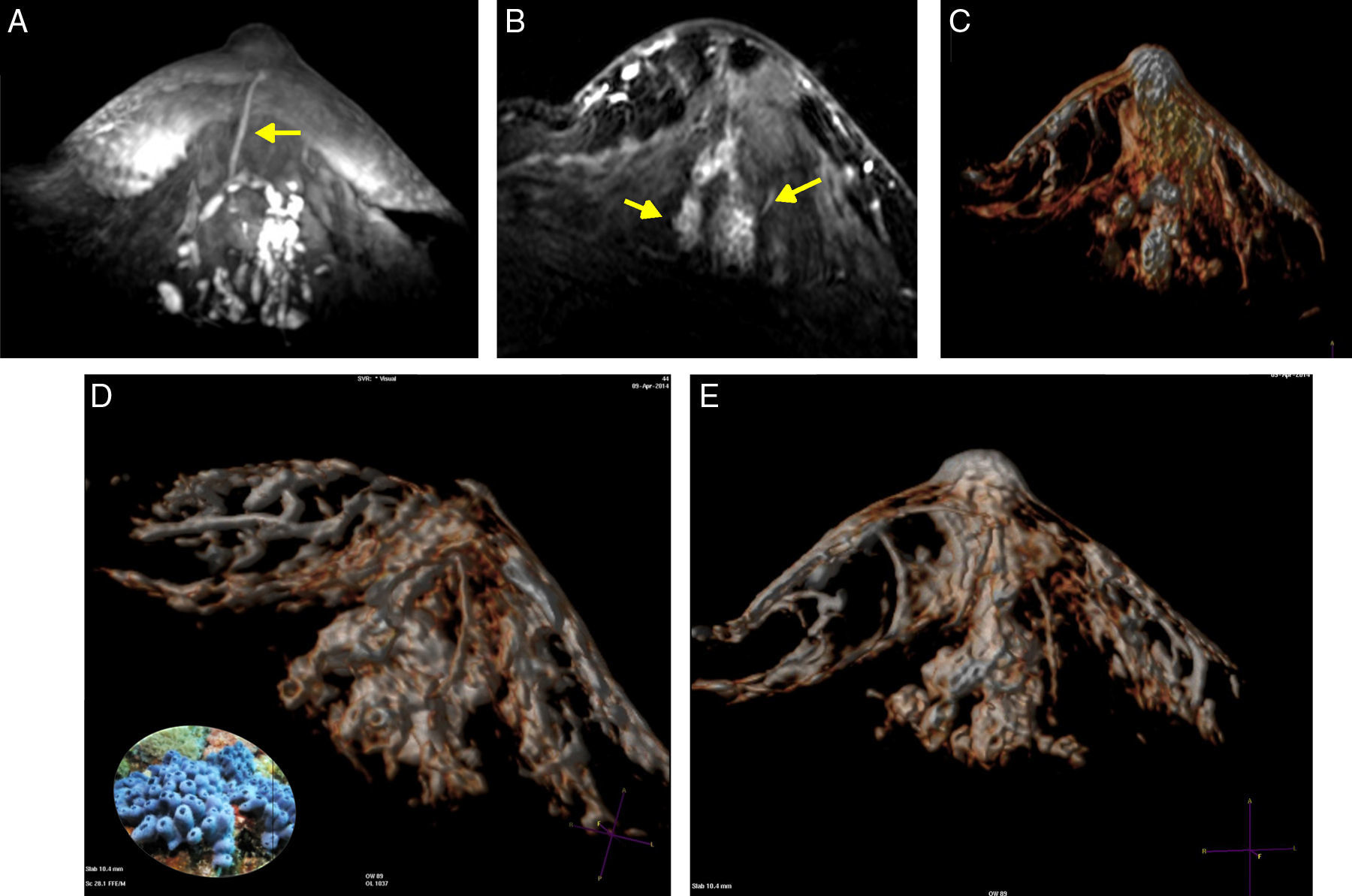
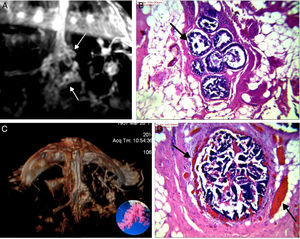
A) Anillos conglomerados; los centros hipointensos (flechas chicas) corresponden a ductos dilatados por proliferaciones y el anillo blanco, a los vasos de angiogénesis en el estroma realzados por el gadolinio (flechas grandes en D). B, D) Estroma expandido con estructuras vasculares y ductos rellenos por focos de carcinoma intraductal de patrón micropapilar y cribiforme de bajo grado nuclear con contenido hemático endoluminal. C) Reconstrucción de volumen presentando los anillos conglomerados como «esponjas /corales» de carcinoma micropapilar y cribiforme.
Los carcinomas micropapilares y cribiformes fueron reconocidos por su vínculo con conducto/s central/es más frecuentemente no dilatados, con señal hemática o serohemática en T2 y T1 precontraste, asociados a realces no-masa en conglomerados de pequeños nódulos y minúsculos anillos alojando estructuras hipointensas. Su correlación con la anatomía patológica corroboró que corresponden a pequeños ductos periféricos, ocupados por proliferaciones benignas o malignas, algunas más compactas que otras, sin o con escasa necrosis, con el estroma periductal expandido y alojando a los vasos responsables del realce anular (fig. 5).
DiscusiónEl derrame por pezón significativo está expuesto a un conjunto de test que en sí mismos constituyen un dilema, por sus indicaciones y resultados y por la falta de una secuencia de exámenes estandarizada que no postergue conductas ni conclusiones2,4,5,7,12. En casos de derrame serohemático la decisión quirúrgica es más inmediata por cuanto la escisión ductal está justificada ante el riesgo de una lesión maligna asociada. Se efectúa a menudo sin información acerca de la existencia, localización precisa y extensión de la lesión o lesiones responsables, aun complicando la labor del patólogo10,13.
Con la RM aplicando secuencias en microbobinas se obtienen imágenes de muy alta resolución que permiten localizar precisamente el segmento y/o galactóforo sangrante en una extensión suficiente para abarcar el conjunto de los «conductos mayores», como fueron denominados por Ohuchi et al.14. En esta serie, el 60% de las pacientes presentaron lesiones benignas, en su mayoría con ductos dilatados, con papiloma/s central/es, mensurable/s, con la mayor expansión en el segmento proximal del galactóforo y que realzaron con el gadolinio. Hemos encontrado una alta asociación de derrames hemáticos con cáncer (41%) drenando por un conducto no tan dilatado y referenciado a realce/s no-masa de anillos conglomerados (hallazgos tipo 4) (tabla 3).
Entre los cánceres, el 77% se presentaron como carcinomas intraductales de bajo grado e intermedio, con patrones micropapilar y cribiforme, silentes como los describe Tot y desarrollados en la periferia, a nivel subsegmentario, donde se instalan las unidades terminales ducto-lobulillares y donde también coexisten papilomatosis múltiple y proliferaciones con distintos grados de atipias14,15.
Un comentario especial merecen estos tipos de cáncer, que se presentan en parches discontinuos, orientados hacia el pezón, y las reconstrucciones 3D los mostraron como un conjunto de «esponjas» o «corales» en formaciones arborescentes centradas en un conducto o conductos principales, no tan dilatados, con señal de contenido hemático, algunos con realces lineales en sus paredes, representando la extensión macroscópica y topográfica en el lóbulo enfermo y en conformación piramidal (triangular en 2 planos con MIP) corroborando los datos publicados por Tokuda et al.16 y reafirmando el alto valor predictivo positivo de la asociación del patrón de realces anulares (esponjas/corales en 3D) junto a la disposición «segmentaria» (fig. 4).
En la RM con microbobina, las secuencias más demostrativas y elocuentes en las reconstrucciones volumétricas fueron la primera y la segunda (1 y 5min). En las secuencias más tardías (10min) se mantuvo en general el patrón con los anillos de realce en algunos casos, menos definidos tal vez por el equilibrio y la redistribución del gadolinio que podría estar ingresando al interior de los ductos patológicos que alojan el cáncer y carentes de vasos en su interior17,18. La reconstrucción de máxima intensidad (MIP), que se utiliza de rutina en la TAC y en la RM convencionales, es una presentación bidimensional, por lo que hemos recurrido a las reconstrucciones de Volumen Rendering. Existen numerosas publicaciones con los más diversos intentos de reproducir la disposición de los conductos en el contexto de la anatomía lobular, con las conclusiones más variadas acerca del número de poros, conductos de drenaje, algunos no canalizados, su segmentación y divisiones, y concluyen en la falta de un único modelo sistematizado como existe en otros sectores (árbol bronquial, segmentación hepática)19-22. La anatomía 3D es un aporte a la hipótesis del lóbulo enfermo y al concepto del carcinoma de mama como enfermedad lobar, habiendo encontrado lóbulos que soportan quistes pequeños y segmentos comprometidos con focos de carcinoma micropapilar y cribiformes15,19,23-28.
Las reconstrucciones volumétricas presentan virtualmente la lesión en sus 3 dimensiones, imaginadas pero no tan evidentes para el cirujano y el patólogo.
El elevado porcentaje (39%) de lesiones malignas encontradas podría atribuirse a la remoción selectiva orientada por las imágenes 3D de los lóbulos alojando los hallazgos tipo 4, como se ha descrito.
La resección exploratoria necesita establecer previamente por lo menos la topografía y la extensión del segmento comprometido, y el patólogo precisa esa información para identificar la lesión o las lesiones responsables, principalmente cuando se presentan como proliferaciones papilares y que plantean aun dificultades con la biopsia pequeña13.
La citología y la ecografía solo tienen valor en la etapa previa cuando son positivas10. La ecografía se puede aplicar como segunda opinión y como guía de biopsia en casos puntuales en los que no se resuelva la resección quirúrgica ni la exploración del lóbulo enfermo.
Nuestro estudio presenta entre sus limitaciones el bajo número de casos incluidos, que no aporta parámetros sobre la efectividad del método, la aplicación selectiva de solo 2 signos sospechosos de malignidad (la señal hemática en los conductos como guía y el realce focal o no-masa), la falta de estudios controles/evolutivos y comparativos con otras modalidades (ecografía, galactografía, RM con bobina convencional), además del análisis de coste-efectividad dedicado a solo un sector de la mama. Los resultados de este estudio descriptivo son prometedores e incitan a ser corroborados por oros estudios que incluyan un mayor número de casos y experiencia que permitan demostrar nuestra hipótesis que ante un derrame de las características enunciadas figure la RM con microbobina como una primera instancia, sencilla y simple, ahorrando tiempos en exámenes de aportes inciertos, y reconsiderar su lugar en el algoritmo diagnóstico frente a los test tradicionales.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Alfonso Benítez Gil, Lisandro Benítez Gil, Gonzalo Tabares, Alejandro Alvarez Gardiol, Eduardo Alvarado, por el Grupo CEMA (Centro Mastológico-Rosario).