INTRODUCCION
El tumor phyllodes (TPH) es una lesión infrecuente que constituye tan solo el 2,5 % de todas las lesiones fibroepiteliales mamarias1, cuya inmensa mayoría corresponden a fibroadenomas (FAD), representando menos del 1 % de todos los tumores de la glándula mamaria2.
Distintas clasificaciones se han señalado acerca de este tumor, diferenciando entre TPH benignos, malignos y borderline, o bien entre formas benignas y malignas, de bajo o alto grado de malignidad, basándose en distintos parámetros morfológicos (hipercelularidad, atipia, actividad divisional, nidos de sobrecrecimiento estromal, borde tumoral), referidos generalmente a las características citohistológicas del estroma y a la propia arquitectura tumoral1,3,4.
A pesar de todo ello, existe una notable y mantenida controversia acerca de cual es el peso y significado pronóstico de cada uno de estos parámetros morfológicos, de forma que existe una correlación muy imperfecta entre la morfología y la clínica en los TPH, que se manifiesta a la hora de establecer una predicción pronóstica, referida a la aparición de recidivas o metástasis5.
En el presente trabajo se analizan retrospectivamente la expresión inmunohistoquímica de la proteína p53, producto proteico del gen supresor tumoral más frecuentemente mutado en las neoplasias humanas6; y de Ki-67, un marcador de la fracción celular proliferante7,8, en relación a distintos tipos de TPH, valorando el probable valor de diagnóstico diferencial de estos dos marcadores en relación a la benignidad o malignidad histológica de los TPH. Para ello se ha estudiado un grupo de 26 TPH calificados morfológicamente como benignos, malignos y borderline, enfrentando los resultados obtenidos con un segundo grupo de 11 FAD, seleccionados como grupo comparativo de tumores fibroepiteliales mamarios definitivamente benignos.
MATERIAL Y MÉTODOS
En el presente trabajo se consideró en primer lugar un grupo de 26 TPH diagnosticados todos ellos en el servicio de Anatomía Patológica del Hospital Universitario La Fe de Valencia en un periodo de 4 años (1997-2001). En segundo lugar se estudiaron un total de 11 FAD como grupo comparativo de tumores fibroepiteliales mamarios definitivamente benignos.
En todos los casos tras revisar todas las preparaciones histológicas originales, se eligió una sección representativa de la lesión valorando sobre todo el criterio de la hipercelularidad estromal. Se recopiló asimismo el informe biópsico emitido y una información clínica básica de cada una de las pacientes referida a edad, tamaño del tumor, recurrencia y supervivencia global.
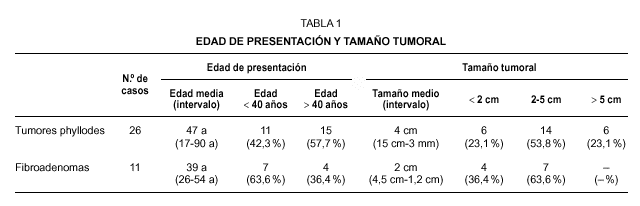
El grupo de 26 TPH correspondió a pacientes de edades comprendidas entre 17 y 90 años, con una edad media de 47 años. Los 11 FAD por su parte correspondieron a pacientes con edades entre 26 y 54 años, siendo la edad media de 40 años.
Según el informe histopatológico de los 26 casos de TPH, 22 fueron considerados como benignos (grado I); 3 como malignos (grado III); y tan solo 1 como tumor borderline (grado II), utilizando la nomenclatura de la OMS9. Cuatro de los TPH estudiados correspondían a recidivas de tumores previos, uno de ellos recidiva maligna de un TPH catalogado previamente como maligno, y los 3 restantes recidivas benignas sucesivas de un TPH benigno previo, en la misma paciente, asociado en la última recidiva a un carcinoma lobulillar in situ.
Tan solo una de las muestras estudiadas correspondió a un cilindro biópsico, siendo todas las restantes tumorectomías o mastectomías simples. Las muestras en el grupo de los 11 FAD, correspondieron todas a piezas de tumorectomía. Como lesiones asociadas a los TPH y FAD aparecieron cuadros lesionales diversos de mastopatia fibroquística, existiendo en un caso de TPH un carcinoma lobulillar in situ asociado.
En una primera fase del estudio se consideraron los diagnósticos originalmente emitidos acerca del carácter benigno, maligno o borderline de los THP del grupo de estudio. Más tarde cada caso fue analizado retrospectivamente analizando de forma homogénea en todos los casos los siguientes datos macro-microscópicos:
1. Tamaño de la lesión tumoral en cms, estableciendo tres categorías, una menor de 2 cms, otra entre 2 y 5 cms, y una tercera de más de 5 cms. Esta variable se valoró a partir de la descripción macroscópica del informe anatomopatológico o a partir de la medición directa de las laminillas histológicas.
2. Naturaleza del margen tumoral predominante, valorando este como compresivo/circunscrito, infiltrativo, o indeterminado (cuando el margen tumoral mostraba caracteristicas intermedias o mixtas, con zonas periféricas expansivas junto a zonas de carácter infiltrativo).
3. Celularidad estromal, con tres posibles grados de celularidad: + (leve); + + (moderada); y + + + (intensa), valorando las áreas tumorales de mayor densidad celular.
4. Pleomorfismo nuclear de las células estromales estimado como: + (leve); + + (moderado); y + + + (intenso), valorando sobre todo las áreas tumorales adyacentes a los ductos.
5. Actividad mitótica, considerando el número de figuras divisionales en 10 campos a gran aumento a 400x (CGA), dentro del área de mayor actividad mitótica, considerando tres categorías, tomando como punto de corte las 5 mitosis/10 CGA (0 mitosis; < 5 mitosis; y > 5 mitosis/ 10 CGA).
Con las últimas cuatro variables, y según los criterios de Millar et al10, los TPH fueron reclasificados como malignos, cuando mostraron: margen tumoral infiltrativo; celularidad estromal + +/+ + + (moderada/severa); pleomorfismo nuclear + +/+ + + ; y $ 5 mitosis/10 CGA. Los tumores que mostraron un margen compresivo; celularidad estromal +/+ +(leve/moderada); y un pleomorfismo nuclear +/+ +(leve/moderado); con índice mitótico de < 1 mitosis/10 CGA, fueron clasificados como benignos; y finalmente los TPH fueron considerados como borderline, si mostraban varias ($ 3) pero no todas las características de los tumores malignos, y tuvieran no más de 2-5 mitosis/10 CGA. Tras evaluar retrospectivamente los 26 casos de tumores phyllodes según estos criterios10, tan solo uno de los casos previamente calificado como benigno paso a ser considerado como borderline, de forma que 21 casos (82,3 %) fueron etiquetados como benignos, 3 (11,5 %) como malignos y 2 (7,6 %) como borderline.
Tras realizar la evaluación morfológica retrospectiva todos los casos fueron procesados para analizar la expresión inmunohistoquímica de la oncoproteina p53 y el marcador de ciclo celular Ki-67, mediante un método estándar de streptavidin-biotin peroxidasa utilizando un inmunoteñidor automático Techmate-500®, empleando los anticuerpos primarios p53 (clon D07, Novocastra dilución 1/50) y Ki-67 (clon B126.1, Biomeda, dilución 1/50).
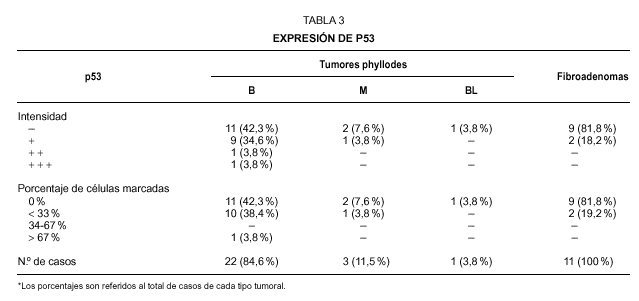
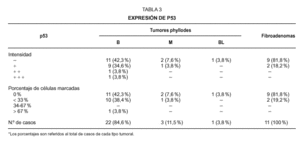
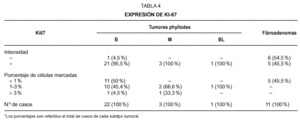
La positividad nuclear de p53 en las células estromales fué valorada con arreglo a la intensidad de la inmunotinción y al porcentaje de núcleos marcados. Con respecto a la intensidad fué graduada, de acuerdo con Feakins et al11, como , o no teñida; + , teñida con leve intensidad, solo visible con aumentos de 400x; + + , intensidad moderada, visible a un aumento de 100x; y + + + , intensamente teñida, cuando ya es visible con un aumento de 25x. Por la proporción de células marcadas, los tumores fueron considerados de acuerdo con Millar et al10, como (no expresión de p53); + cuando menos del 33 % de los núcleos celulares estromales se teñían; + + cuando se teñían del 34-67 % de los núcleos estromales; y + + + cuando más del 67 % de las células estromales, mostraban expresión nuclear de p53. Con respecto a Ki-67, fue asimismo valorado en términos de positividad o negatividad nuclear, así como mediante el % de células estromales marcadas, considerando tres categorías según presentaran un porcentaje inferior al 1 %; entre el 1-3 %; y superior al 3 %. Para valorar la probable correlación entre las distintas variables, se empleo un estudio de contingencia, utilizando el test de la Chi cuadrado.
RESULTADOS
Los resultados se muestran, de forma comparativa a los TPH y a los FAD, en las tablas 1-4. Con respecto a la edad de las pacientes (tabla 1), los TPH mostraron una edad media de 47 años, siendo el 57,7 % de edad superior a 40 años; por el contrario las pacientes con FAD presentaron una edad media de 39 años, ocho años menor, siendo tan solo el 36,4 % mayores de 40 años. El tamaño tumoral (tabla 1) fue mayor en el caso de los TPH con un tamaño medio de 4 cms, mientras que en la serie de FAD el tamaño medio fue de 2 cms. En los TPH un 23,1 % de las pacientes presentaba tumores mayores de 5 cms, mientras que no se observó ninguno FAD de más de 5 cms de diámetro.
Con respecto al margen tumoral (tabla 2), todos los FAD mostraron bordes expansivos, mientras que el 65,4 % del TPH mostraron un márgen expansivo, siendo en el 19,2 % de limites infiltrativos y en un 15,4 % de limites indeterminados. La celularidad estromal en los TPH fué en general acusada, siendo evaluada como intensa en el 42,3 % de los casos, moderada en el 30,8 %, y leve en el 26,9 %. Los 3 TPH malignos, así como el considerado borderline, presentaron una celularidad estromal intensa o acusada. Los FAD mostraron una distribución regular con respecto a la celularidad estromal, con 4 casos dotados de una leve celularidad; 3 con moderada, y 4 casos con celularidad intensa. Igualmente los TPH calificados como benignos mostraron una amplia variabilidad, en las distintas categorías de celularidad estromal consideradas. El pleomorfismo nuclear fue leve en la mayoría de los TPH (80,8 %), detectando un pleomorfismo moderado en el 19,2 % de los casos, observándose en los TPH malignos, una clara tendencia a presentar pleomorfismo elevado. En el caso de los FAD la gran mayoría (80,8 %) no mostraron ningún rasgo de pleomorfismo y tan solo dos casos (18,2 %), mostraron un leve pleomorfismo a nivel de los núcleos estromales.
La evaluación del índice divisional en tres categorías reveló la existencia de correlación entre el número de estas y el diagnóstico dado a los TPH. Así, el 42,3 % de los TPH y el 100 % de los FAD, no mostraron ninguna mitosis en 10 CGA; el 34,6 % de los TPH presentaron menos de 5 mitosis/10 CGA, y en un 23,15 TPH el número de mitosis fue mayor de 5. Los tres TPH diagnosticados como malignos, se encontraron dentro de esta última categoría, presentando 8, 18 y 25 mitosis/10 CGA respectivamente. El TPH borderline, presentó un recuento mitósico aunque positivo, inferior al punto de corte establecido, con 3 mitosis/10 CGA. En el estudio de contingencia tan solo se observó significación con una p = 0,01 al correlacionar el indice mitótico con el diagnóstico emitido de benignidad o malignidad, referido a los TPH.
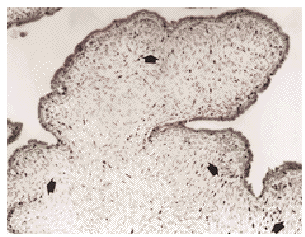
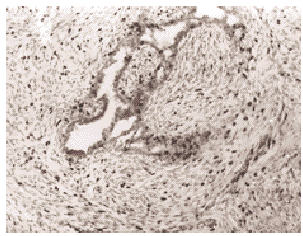
La expresión de p53 (tabla 3) mostró en general un patrón de débil positividad (fig. 1) en los TPH y en los FAD, si bien este hecho fué sobre todo acentuado en el caso de los FAD donde solo el 18,2 % mostraron una leve tinción nuclear, siempre en menos del 33 % de las células estromales. Con respecto a los TPH se observó expresión de p53 en 12 casos (46,1 %), predominando los casos con leve inmunotinción con una proporción de marcas nucleares inferior al 33 %, existiendo tan solo un caso con intensa positividad, marcando más del 67 % de las células estromales. No se observó correlación entre la intensidad o el porcentaje de células con expresión de p53 con respecto al diagnóstico de benignidad o malignidad histológica. Así la mitad de los TPH catalogados como benignos resultaron negativos para p53 y la otra mitad positivos para p53. Los TPH calificados como malignos mostraron positividad en uno de ellos y negatividad en los otros dos. El TPH borderline resultó asimismo negativo para p53. No se observó tampoco relación alguna entre la expresión de p53 y el grado de celularidad estromal, siendo muy similares el número de casos p53 positivos y negativos dentro de cada categoría de la celularidad estromal.
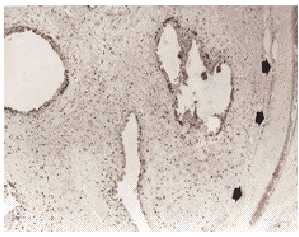
Fig.1. Expresión de p53 en un tumor phyllodes benigno. Existen una ocasional expresión a nivel de los núcleos de las células estromales, con una ligera tendencia a ser más frecuentes en las zonas de condensación estromal (flechas), vecinas a las hendiduras epiteliales (p53, x200).
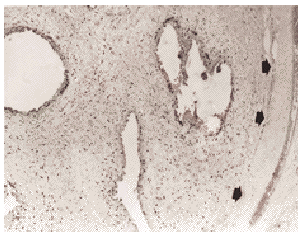
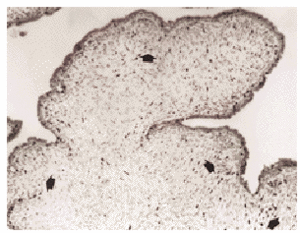
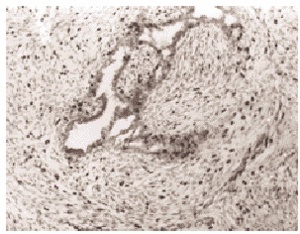
Fig. 2. Tumor phyllodes con áreas glandulares microquísticas y borde periférico expansivo (flechas). Acusada expresión de Ki-67 afectando al 20-25 % de los núcleos de las células estromales (Ki-67, x120).
Fig. 3. Detalle de la expresión nuclear de Ki-67 en un tumor phyllodes, apreciándose frecuente positividad en los núcleos de las células estromales, así como también de forma ocasional en alguna célula de las hendiduras epiteliales (Ki-67, x400).
Con respecto a Ki-67 (tabla 4) (figs. 2 y 3) el 96,15 % de los TPH y tan solo el 45,5 % de los FAD mostraron positividad frente a este marcador de proliferación celular, siendo además en los FAD el índice de proliferación siempre inferior al 1 %. En los TPH la expresión de Ki-67 mostró una asociación significativa (p = 0,01) con la celularidad estromal. Así los TPH con acusada celularidad estromal mostraron en su mayoría índices de proliferación elevados (> 3 %), mientras que los TPH con celularidad escasa o moderada mostraron a su vez porcentajes de Ki-67 bajos o moderados. Igualmente se observó una asociación significativa (p = 0,00072) entre el porcentaje de células Ki-67 + y el número de mitosis/10 CGA, de forma que todos los TPH con más de 5 mitosis/10 CGA se encontraban en la máxima categoría para Ki-67 (> 3 %). Asimismo se observó una clara tendencia a la asociación entre los índices de proliferación elevados y el pleomorfismo nuclear acusado, mientras que los TPH con pleomorfismo más discreto presentaron índices de Ki-67 más uniformes, a lo largo de todas las categorías de este. Por el contrario el caso con negatividad para Ki-67 mostró pleomorfismo nuclear leve.
Por último al analizar los resultados de p53 y Ki 67 no pudimos detectar ningún tipo de relación entre la expresión inmunohistoquímica de ambos marcadores, al estar distribuidos con uniformidad entre las distintas categorías de expresión de Ki-67 todos los casos, tanto positivos como negativos para p53.
DISCUSION
Dentro de los lesiones mamarias fibroepiteliales los TPH conforman una forma tumoral infrecuente que muestran un variado espectro morfológico y evolutivo, en el que a menudo predominan los fenómenos de recurrencia local y más raramente, la diseminación metastásica y el comportamiento clínico claramente maligno.
El diagnóstico morfológico de los TPH a menudo no esta bien delimitado, así en la vertiente considerada como benigna en ocasiones no aparece una clara delimitación con los FAD, sobre todo si consideramos la llamada variedad celular de los FAD, de la que a menudo tan solo difiere por la riqueza de celularidad estromal y por el índice divisional12. En el otro extremo del espectro, el diagnóstico de los TPH malignos se basa en criterios morfológicos no siempre homogéneos10,13, basados fundamentalmente en la riqueza de celularidad estromal, margen tumoral, pleomorfismo y mitosis10, poniendo todo ello de manifiesto la imperfecta correlación existente en estos tumores entre la morfología y el pronóstico, lo que justifica la obligada recomendación de una exeresis tumoral ampliada, incluso en TPH etiquetados como benignos14, dada la alta frecuencia de recurrencia local, y la necesaria búsqueda de nuevos marcadores pronósticos en estos tumores.
En este sentido en el presente estudio nos planteamos analizar de forma comparativa las características clinicopatológicas de dos grupos de tumores fibroepiteliales (TPH y FAD) analizando asímismo la expresión inmunohistoquímica de los marcadores p53 y Ki-67, en relación a los diagnósticos morfológicos emitidos.
En nuestro estudio, destaca en primer lugar como los TPH son un grupo de tumores de mayor tamaño que los FAD, afectando generalmente a pacientes de mayor edad. Ambos datos, a pesar de ser constantes en todas las series12,16, no constituyen rasgos diferenciadores definitivos frente a los FAD e incluso el dato de un mayor tamaño de los TPH ha sido origen de confusión, en relación a la nomenclatura, al considerar en ocasiones el término FAD gigante como sinónimo de TPH15.
Al analizar comparativamente las características morfológicas de los TPH frente a los FAD, se observa que de forma global el estroma de los TPH es más celular, presenta mayor actividad mitótica y puede mostrar un mayor pleomorfismo celular así como la presencia de unos márgenes tumorales infiltrativos. El valor diagnóstico y el significado pronóstico de cada uno de estos datos en los TPH es sin embargo considerado de forma no homogénea por distintos autores. Así se ha señalado que la riqueza celular (> 125 células/CGA) es el rasgo más certero para diferenciar entre un FAD convencional y un FAD celular, pero sin embargo es la actividad mitótica12,13, la que establece la distinción entre FAD celular y TPH, así como el pronóstico de los TPH, señalándose que los FAD celulares usualmente tienen entre 1-3 mitosis/10CGA, los TPH benignos entre 4-5 mitosis/10 CGA, las formas bordeline entre 6-9 mitosis /10 CGA y los TPH malignos 10 o más mitosis /10 CGA12. Otros autores sin embargo consideran el índice mitósico con puntos de corte diferente a los indicados, en relación a las formas benignas, borderline y malignas de los TPH (< 1M/10 CGA, 1-5 M/10 CGA, y > 10 M/10 CGA)16 (< 1M/10 CGA, 2-5 M/10 CGA, > 10M /CGA)10, sumando a la categorización de los TPH otros aspectos, tales como el sobrecrecimiento estromal17 y el llamado grado tumoral, gradación compuesto por una combinación de datos que analizan índice mitótico, margen tumoral y pleomorfismo nuclear10,11,14. Esta diversidad de criterios dificulta la comparación de los resultados y la extrapolación de datos entre distintas series, poniendo de manifiesto una vez más la imperfección de los criterios morfológicos como predictores de la evolución de los TPH.
En nuestro estudio a más del estudio histopatológico convencional hemos analizado la expresión inmunohistoquímica del gen supresor tumoral p53 y de Ki-67, un marcador de proliferación celular, en un intento de considerar si estos dos marcadores pueden ser de utilidad a la hora de diagnosticar los TPH, analizando si su expresión se asocia o relaciona con alguno de los datos morfológicos utilizados hasta ahora, en la tipificación histopatológica de estos tumores.
La expresión de p53 en nuestro estudio se mostró en general reducida en los dos grupos de tumores fibroepiteliales y su determinación no parece arrojar información valida acerca del carácter de benignidad o malignidad de los TPH, al igual que en otros estudios11,16, si bien algunos autores11 encuentran asociación entre la expresión de p53 y los datos morfológicos indicativos de malignidad. Es posible que las diferencias se deban al tipo de anticuerpo utilizado, siendo al parecer mas reducidos los resultados inmunohistoquímicos obtenidos al utilizar el anticuerpo D072, anticuerpo empleado en nuestro estudio.
A pesar de todo ello el hecho de que p53 prácticamente no se detecte nunca, o lo sea de forma muy débil, en los FAD parece indicar que la expresión de esta oncoproteína podría ser un factor de discriminación, aunque no absoluto, entre FAD y TPH que ayudaría a establecer la distinción entre ambos tipos de tumores fibroepiteliales, en los casos de difícil delimitación morfológica. Este último aspecto aparece reforzado además por los datos referidos en los FAD de tipo celular12 donde la expresión de p53 se hace similar a la de los TPH, habiéndose postulado que estas formas de FAD celular podrían tratarse de formas transicionales12 entre los FAD y los TPH, con un comportamiento clínico similar al de los TPH benignos. Es probable en este sentido que p53 sea un factor en la progresión de los tumores fibroepiteliales12 y en la propia malignidad de los TPH10, si bien este ultimo aspecto no ha podido ser confirmado en nuestro estudio.
Por el contrario los resultados encontrados con respecto a Ki-67 si que revelan una evidente relación entre la expresión de Ki-67 y el grado de malignidad de los TPH, observándose asimismo una relación entre la expresión de Ki-67 y los parámetros morfológicos utilizados convencionalmente para categorizar los TPH, tales como grado de celularidad estromal, índice mitósico y polimorfismo nuclear, si bien en el caso de este último parámetro la relación en nuestro estudio no tuvo carácter significativo. Nuestros resultados son concordantes con estudios previos16,18,19,20 mostrando que la determinación del índice de proliferación estromal detectado con Ki-67 puede ser de utilidad en la categorización de los TPH de difícil tipificación morfológica, al igual que en muestras tumorales de reducidas dimensiones (cilindros biópsicos). Al mismo tiempo la significativa asociación encontrada (p = 0,01) entre la expresión de Ki 67 y el grado de celularidad estromal concuerda con los datos previamente obtenidos en los FAD y en los FAD celulares12, que señalan una correlación entre la actividad proliferativa y la angiogénesis intratumoral en relación al grado de celularidad estromal y a la propia progresión tumoral de los FAD a FAD celulares y a TPH, si bien la posible relación entre proliferación celular y angiogénesis es negada por otros autores20 en el caso de los TPH.