Describir nuestra casuística de los últimos 13 años de acuerdo con un manejo clínico-quirúrgico y control local del tumor phyllodes según el grado tumoral.
Material y métodoEstudio descriptivo retrospectivo de todos los casos diagnosticados de tumor phyllodes mamario (N=34) procedentes del Servicio de Anatomía Patológica del Hospital Clínico San Carlos de Madrid entre 1997-2010. Se realizó un análisis de los factores clínico-patológicos que pueden influir en la recidiva y en el intervalo libre de enfermedad.
ResultadosLa media de edad de las pacientes al diagnóstico fue de 41 años (±13,3). Se realizó una primera cirugía conservadora en todas las pacientes (N=34), y en 17 casos, segundas cirugías (50,0%). En 7 casos fueron mastectomías: 5 mastectomías simples y 2 mastectomías con linfadenectomía axilar. Tres casos de mastectomía se realizaron en tumor phyllodes benigno y tamaño tumoral voluminoso (12%) para lograr un buen resultado estético y en 2 pacientes con tumores phyllodes maligno (33,3%). En los otros 2 casos, además de la mastectomía se realizó una linfadenectomía axilar, en un caso por tumor phyllodes maligno con histología agresiva y en otro por recidiva voluminosa de tumor phyllodes benigno, sin evidencia de enfermedad en ambos vaciamientos axilares. En el análisis univariante hubo diferencias significativas en la necrosis histológica encontrada en los tumores phyllodes malignos. Las recidivas locales aparecieron en 8 pacientes (23,5%), principalmente durante los 2 primeros años de seguimiento.
ConclusiónEl principal objetivo fue conseguir mediante la cirugía (conservadora o mastectomía) márgenes de seguridad mayores de 1cm, motivo por el que se sometió a algunas pacientes a reintervenciones posteriores. La histología agresiva en los tumores phyllodes malignos determinó en algunos casos la necesidad de realizar una mastectomía y la aplicación de radioterapia adyuvante posterior con el fin de lograr un mejor control local de la enfermedad.
To describe the clinical and surgical management of phyllodes tumors in our center in the last 13 years, as well as local tumor control, according to tumoral grade.
Material and methodWe performed a retrospective study of all patients with a diagnosis of phyllodes tumor (N=34) in the Pathology Department of Hospital Clínico San Carlos in Madrid between 1997 and 2010. The clinical and pathological factors that could influence recurrence and disease-free survival were analyzed.
ResultsThe mean age of the patients at diagnosis was 41 years (±13.3). Conservative surgery was initially performed in all patients (N=34) and reoperation in 17 (50.0%). Mastectomies were performed in 7 patients: 5 simple mastectomies and 2 mastectomies with axillary lymphadenectomy. Three mastectomies were performed for benign phyllodes tumor and large tumor size (12%), with good cosmetic outcome, and 2 mastectomies were performed for malignant phyllodes tumors (33.3%). In the remaining 2 patients, mastectomy plus axillary lymphadenectomy was performed for a malignant phyllodes tumor with aggressive histology in one patient and for a recurrent, bulky, benign phyllodes tumor in the other. There was no evidence of disease in either of the 2 axillary dissections. In the univariate analysis, significant differences in histological necrosis were found in malignant phyllodes tumors. Local recurrences occurred in 8 patients (23.5%) mainly during the first 2 years of follow up.
ConclusionOur main objective was to achieve larger safety margins (of at least 1cm) through surgery (mastectomy or conservative surgery), leading to reoperation in some patients. In histologically-aggressive malignant phyllodes tumors, mastectomy and adjuvant radiotherapy were required to achieve better disease control.
El tumor phyllodes representa menos del 0,5% de todas las neoplasias mamarias1. La edad de aparición oscila entre 35-45 años. Desde el punto de vista histopatológico se caracteriza por presentar un componente epitelial y otro estromal, con hipercelularidad estromal. El tumor phyllodes se clasifica desde 1982, según la World Health Organization, en benigno, borderline y maligno o cistosarcoma phyllodes2.
Clínicamente se presenta como un tumor duro, multinodular, bien definido, móvil y doloroso. El tamaño suele ser voluminoso, de crecimiento rápido y con protusión a piel. Menos frecuentemente se puede observar retracción del pezón, ulceración, fijación a la pared torácica, enfermedad bilateral y afectación axilar2. El diagnóstico diferencial debe establecerse con el fibroadenoma mediante criterios morfológicos. El tumor phyllodes benigno se caracteriza por una marcada hipercelularidad estromal y el maligno por una malignización del estroma con cambios metaplásicos3,4.
El tratamiento es la cirugía, la escisión local ampliada con márgenes libres histológicos mayores de 1cm o la mastectomía simple en caso de tumor phyllodes maligno o de gran tamaño que no permite una resección amplia con resultado estético adecuado. La mayor parte de los tumores phyllodes benignos y borderline se curan con cirugía, aunque pueden recidivar en cualquiera de sus formas. El tratamiento adyuvante para el control local de la enfermedad es la radioterapia, aunque no tiene impacto sobre la supervivencia global5. No existen estudios prospectivos al respecto (categoría 2B en la National Comprehensive Cancer Network [NCCN] de 2012) y su uso podría considerarse siguiendo el protocolo del tratamiento del sarcoma de tejidos blandos en casos seleccionados. Entre el 13-40% desarrollan metástasis a distancia, principalmente pulmonar. La hormonoterapia no ha resultado efectiva en el tratamiento del tumor phyllodes. No existe evidencia del beneficio de la quimioterapia en la disminución de las recidivas y el evento muerte, pero podría tener indicación para el grupo de pacientes con recidiva sistémica (NCCN de 2012). El régimen utilizado contiene ifosfamida y doxirrubicina6 (categoría 1A).
El objetivo de este estudio es describir nuestra casuística de los últimos 13 años de acuerdo con un manejo clínico-quirúrgico y el control local de la enfermedad según el grado tumoral. Así mismo hemos analizado la repercusión de algunos factores pronósticos en la recidiva y el tiempo libre de supervivencia.
Material y métodoSe presenta un estudio retrospectivo de una serie de 34 casos procedentes del Servicio de Anatomía Patológica del Hospital Clínico San Carlos de Madrid diagnosticados de tumor phyllodes.
Las variables clínicas analizadas fueron: edad, año de las cirugías, estado menstrual, paridad, diagnóstico por imagen (mamografía y ecografía mamaria), biopsia con aguja gruesa y punción aspiración con aguja fina, número y tipo de cirugías, y seguimiento.
Las variables histopatológicas analizadas fueron: tamaño tumoral, características de los componentes epitelial y estromal (atipia nuclear estromal, número de imágenes mitóticas en 10 campos de gran aumento [CGA], presencia o no de contorno infiltrante, presencia/ausencia de elementos heterólogos estromales, necrosis y/o hemorragia).
El componente epitelial suele ser benigno la gran mayoría de las veces. Existen casos con hiperplasia epitelial acompañada con frecuencia de hiperplasia de células mioepiteliales y atipias precisando descartar en estos casos un carcinoma intraductal. El componente mesenquimal se origina en el estroma periductal estromal y, en la mayor parte de los casos, permitió establecer el grado de benignidad o malignidad de la neoplasia, considerando principalmente su celularidad, atipia o pleomorfismo y actividad proliferativa o mitótica, estimada por el número de imágenes mitóticas en 10 CGA microscópicos: los tumores phyllodes benignos presentan muy escasas mitosis, hasta 2 mitosis×10CGA, los tumores phyllodes borderline, 2-5 mitosis×10CGA, y los tumores phyllodes malignos, más de 5 mitosis×10CGA. La clasificación en los subgrupos benigno, borderline y maligno se basó en las características histológicas del tumor, teniendo en cuenta la celularidad, las características del componente estromal, en especial atipia y actividad mitótica, y la ausencia o infiltración de márgenes; todo ello de acuerdo con los criterios de la World Health Organization3,4. Los márgenes se consideraron libres por encima de 1cm.
El seguimiento de las pacientes se realizó en las consultas externas de la Unidad de Patología Mamaria del Departamento de Obstetricia y Ginecología del Hospital Clínico San Carlos de Madrid, con controles posquirúrgicos, a los 6 meses y posteriormente anuales mediante exploración física y pruebas complementarias (mamográficas y ecográficas mamarias±punción radioguiada) realizadas por el Servicio de Radiodiagnóstico del mismo hospital.
Análisis estadísticoLas variables cualitativas se presentan con su distribución de frecuencias. Las variables cuantitativas se resumieron con su media y desviación estándar (±DE).
Se evaluó la asociación entre variables cualitativas con el test de χ2 o la prueba exacta de Fisher, en el caso de que más de un 25% de los esperados fueran menores de 5.
Se estimaron las funciones de tiempo libre de enfermedad por el método Kaplan-Meier. En todos los contrastes de hipótesis se rechazó la hipótesis nula con un error de tipo i o error α menor a 0,05. El paquete informático utilizado para el análisis fue SPSS® para Windows versión 15.0.
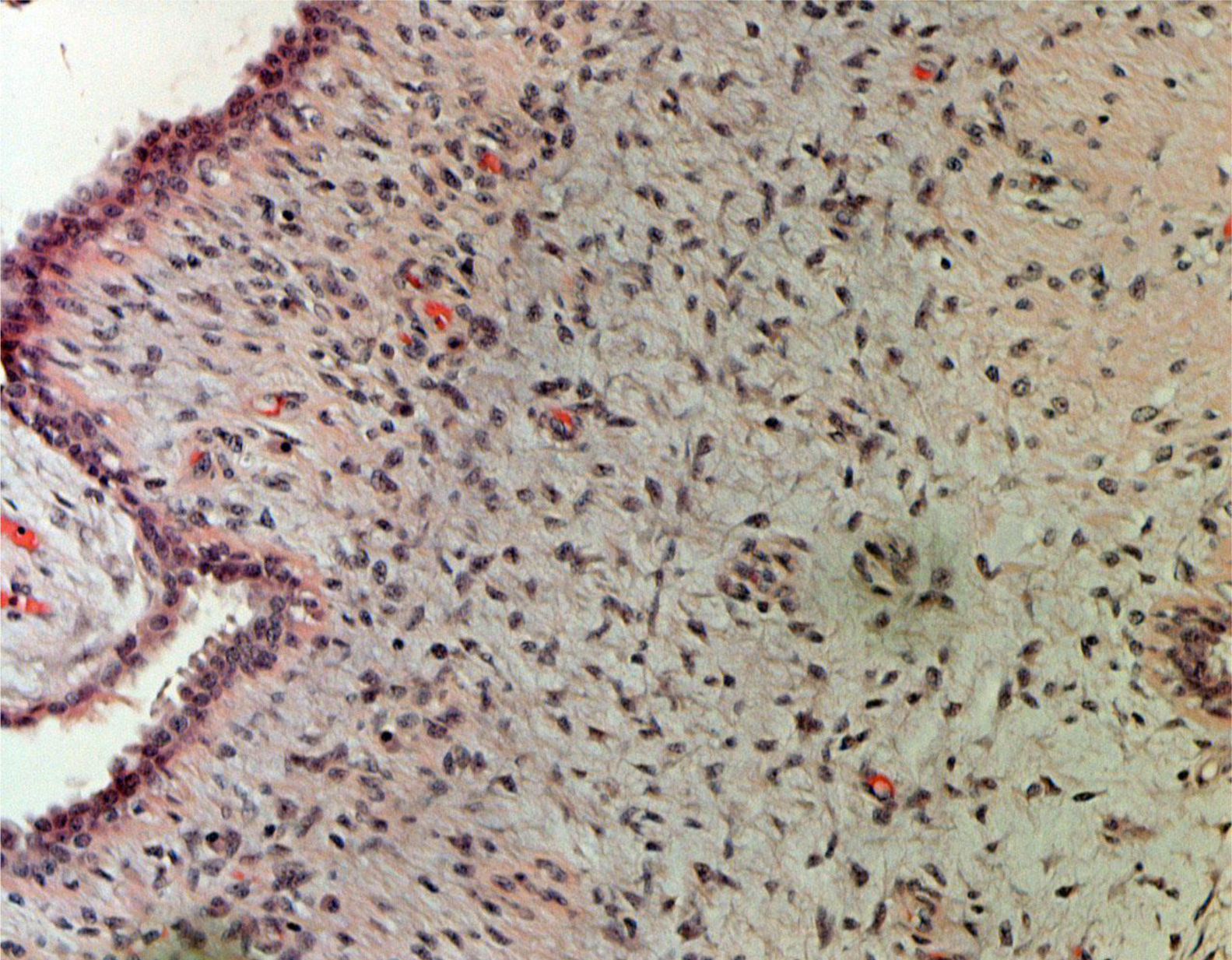
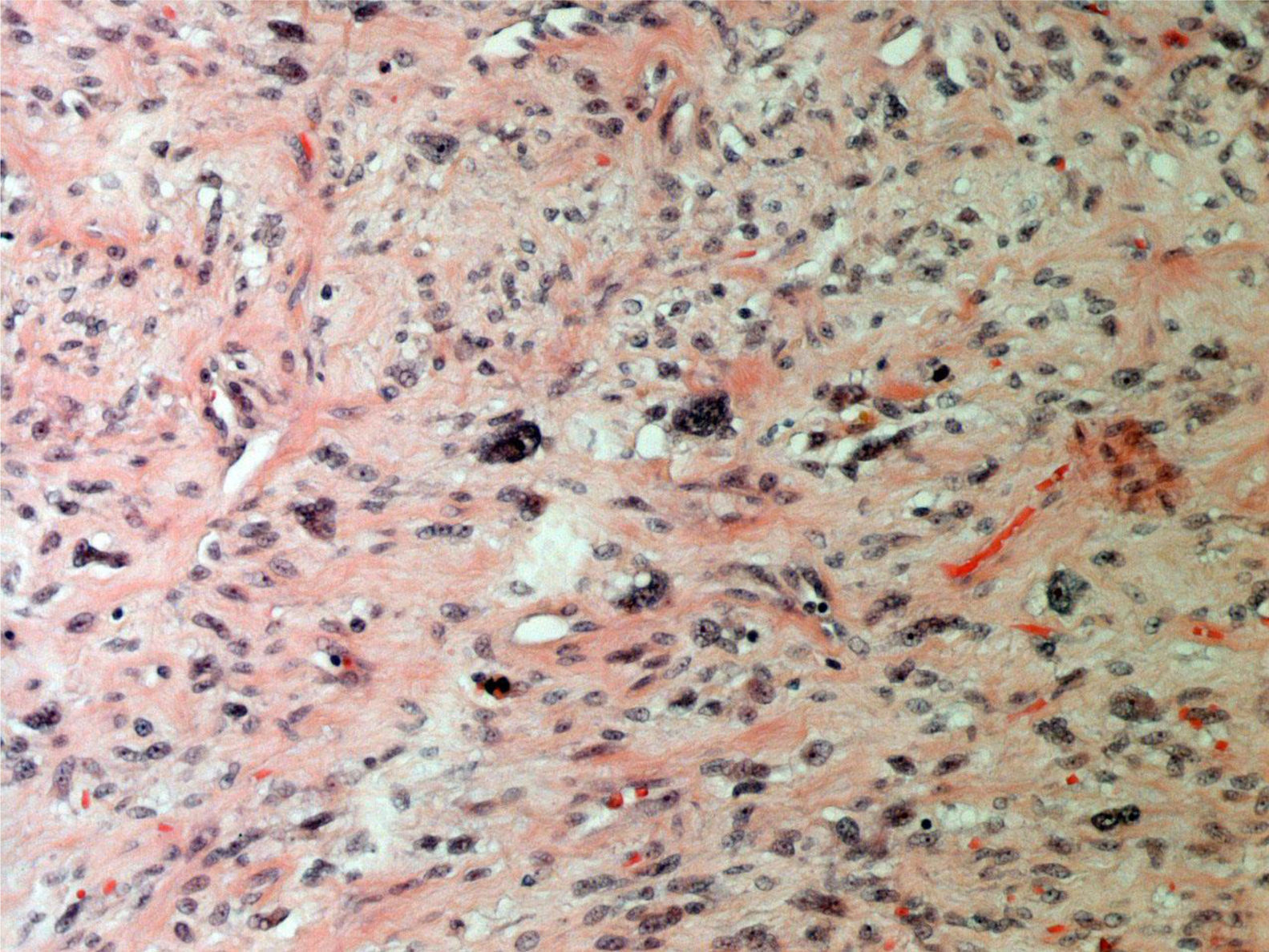
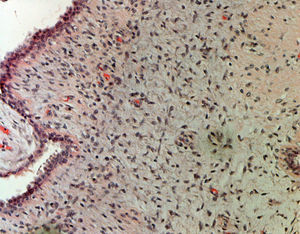
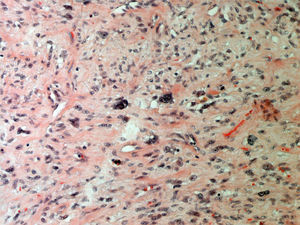
ResultadosEn la tabla 1 se describen las características clínicas de la muestra. La primera cirugía realizada en las 34 pacientes fue conservadora tanto en tumores phyllodes benignos (fig. 1), como en borderline o malignos (fig. 2). En 17 casos fue necesaria una segunda cirugía (50,0%). Precisaron tratamiento adyuvante con radioterapia 2 casos de tumor phyllodes maligno (5,9%) y un caso con quimioterapia (2,9%).
Tumor phyllodes. Características clínicas
| Características clínicas | N (%) |
| Edad (años) | 41 (±13,3)a |
| (25-81)b | |
| Estado menstrual | |
| Premenopáusicas≤50 años | 27 (79,4) |
| Posmenopáusicas>50 años | 7 (20,6) |
| Paridad | |
| Primíparas | 16 (47,1) |
| Multíparas | 18 (52,9) |
| Localización | |
| Mama derecha | 14 (41,2) |
| Mama izquierda | 20 (58,8) |
| Tamaño tumoral | |
| <2cm | 2 (5,9) |
| 2-5cm | 14 (41,2) |
| 5-10cm | 17 (50,0) |
| >10cm | 1 (2,9) |
| Grado tumoral | |
| Benigno | 25 (73,5) |
| Borderline | 3 (8,8) |
| Maligno | 6 (17,6) |
| Cirugías | |
| Segunda cirugía | 17 (50,0%) |
| Tercera cirugía | 2 (5,9) |
| Seguimiento | |
| <5 años | 18 (52,9) |
| 5-10 años | 14 (41,2) |
| >10 años | 2 (5,9) |
| Recidiva | 8 (23,5) |
| Metástasis | 1 (2,9) |
| Tratamiento adyuvante | |
| Radioterapia | 2 (5,9) |
| Radioterapia+quimioterapia | 1 (2,9) |
| Mortalidad | 1 (2,9) |
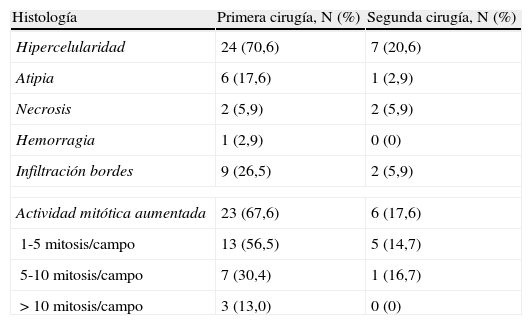
En la tabla 2 se muestra la histopatología tras la primera y la segunda cirugía. Se registraron un total de 33 casos con cambios epiteliales (97,1%) y 30 casos con cambios estromales (88,2%). Se observó un aumento de la actividad mitótica en 23 casos (67,6%), en 3 (13,0%) de ellos con más de 10 mitosis×10CGA. Los márgenes estaban afectados en 9 casos (26,5%) en la primera cirugía y en 2 casos (5,9%) en la segunda cirugía. Las atipias histológicas se registraron en 6 casos en la primera cirugía (17,6%). La necrosis histológica se observó en 2 muestras en la primera y la segunda cirugía (5,9%). En un caso (2,9%) se diagnosticó de hemorragia histológica.
Histopatología tras la primera y la segunda cirugía
| Histología | Primera cirugía, N (%) | Segunda cirugía, N (%) |
| Hipercelularidad | 24 (70,6) | 7 (20,6) |
| Atipia | 6 (17,6) | 1 (2,9) |
| Necrosis | 2 (5,9) | 2 (5,9) |
| Hemorragia | 1 (2,9) | 0 (0) |
| Infiltración bordes | 9 (26,5) | 2 (5,9) |
| Actividad mitótica aumentada | 23 (67,6) | 6 (17,6) |
| 1-5 mitosis/campo | 13 (56,5) | 5 (14,7) |
| 5-10 mitosis/campo | 7 (30,4) | 1 (16,7) |
| >10 mitosis/campo | 3 (13,0) | 0 (0) |
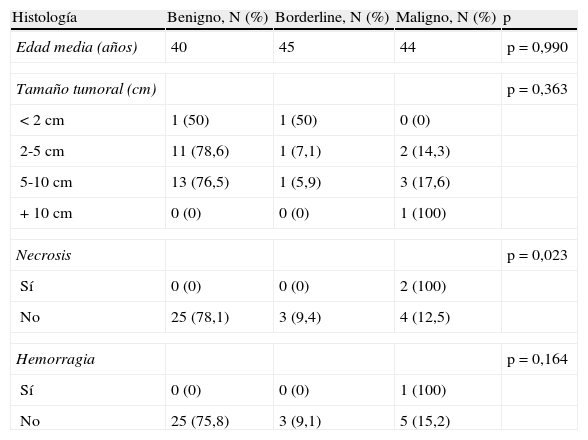
En el análisis univariante hubo diferencias significativas en la necrosis histológica en los tumores phyllodes malignos respecto a los benignos y borderline. La hemorragia histológica se constató en un caso de tumor phyllodes maligno (tabla 3). En 3 de los tumores phyllodes malignos se detectaron elementos heterólogos, un caso de metaplasia adiposa y 2 casos con elementos mioepiteliales estromales.
Características clínico-patológicas. Estudio univariante
| Histología | Benigno, N (%) | Borderline, N (%) | Maligno, N (%) | p |
| Edad media (años) | 40 | 45 | 44 | p=0,990 |
| Tamaño tumoral (cm) | p=0,363 | |||
| <2cm | 1 (50) | 1 (50) | 0 (0) | |
| 2-5cm | 11 (78,6) | 1 (7,1) | 2 (14,3) | |
| 5-10cm | 13 (76,5) | 1 (5,9) | 3 (17,6) | |
| +10cm | 0 (0) | 0 (0) | 1 (100) | |
| Necrosis | p=0,023 | |||
| Sí | 0 (0) | 0 (0) | 2 (100) | |
| No | 25 (78,1) | 3 (9,4) | 4 (12,5) | |
| Hemorragia | p=0,164 | |||
| Sí | 0 (0) | 0 (0) | 1 (100) | |
| No | 25 (75,8) | 3 (9,1) | 5 (15,2) | |
De las 17 segundas cirugías realizadas, 7 fueron mastectomías (tabla 4). En 3 casos por tumor benigno con tamaño tumoral voluminoso (12%), para lograr buen resultado estético, y en 2 pacientes con tumores phyllodes malignos (33,3%). En los otros 2 casos, además de la mastectomía se realizó una linfadenectomía axilar en un caso de tumor phyllodes maligno con presencia de elementos heterólogos estromales y en un caso de recidiva voluminosa de tumor phyllodes benigno en los 2 primeros años de seguimiento, no hallando ganglios afectados en ninguno de los casos. Las 10 segundas cirugías restantes fueron ampliaciones de márgenes.
Se realizó una tercera cirugía debido a una deformidad de la mama en un intento de cirugía conservadora en recidiva por tumor phyllodes y se optó por una mastectomía simple con reconstrucción inmediata. También se realizó una linfadenectomía como tercera cirugía en una de las pacientes operada con mastectomía simple por tumor phyllodes maligno, por una probable recidiva axilar clínica con el resultado de anatomía patológica de metástasis ganglionar en 8/11 ganglios axilares, GIII, tipo carcinoma ductal inespecífico con afectación extracapsular focal. En este caso apareció un carcinoma ductal infiltrante concomitante al tumor phyllodes maligno operado, siendo diagnosticada la paciente de enfermedad diseminada de ambos tumores.
Las recidivas aparecieron en 8 pacientes (23,5%) con tumor phyllodes durante los 2 primeros años de seguimiento. Las recidivas locales en 5 pacientes (20%) se debieron a phyllodes benignos, en un paciente a phyllodes borderline (33%) y en 2 pacientes a phyllodes malignos (33,3%), sin que las diferencias fueran significativas (tabla 5). Ninguna de las características histopatológicas analizadas se asoció significativamente con la aparición o no de recidiva. La enfermedad diseminada se registró en una paciente (16,7%) diagnosticada de tumor phyllodes maligno y carcinoma ductal infiltrante concomitante, con afectación de ganglios, pulmón, cerebro, hígado y hueso. El tratamiento fue la exéresis de una nueva recidiva axilar, en este caso con histopatología de sarcoma, y se realizó punción radioguiada hepática con resultado de adenocarcinoma mamario. Se pautó tratamiento durante la enfermedad con hormonoterapia (goserelina, tamoxifeno), quimioterapia 6 ciclos de taxotere/TDM1+ácido zoledrónico y posteriormente con TDM1 en monoterapia, recibiendo un total de 18 ciclos y radioterapia paliativa por progresión extracerebral. Se inició nueva línea de tratamiento quimioterápico con lapatinib+doxorrubicina+metotrexato, con progresión de la enfermedad y éxitus.
DiscusiónEl porcentaje de tumores benignos, borderline y malignos de la muestra estudiada fue de 73,5, 8,8, y 17,6%, respectivamente, y la edad media de las pacientes de 41 años (±13,3). Cheng et al.7 muestran una distribución en benignos, borderline y malignos similar. Sin embargo, Tan et al.8, en un estudio muy reciente sobre 605 pacientes, muestran una distribución diferente en los tumores borderline (18,4%) y malignos (8,9%) en comparación con nuestra serie, pero similar en cuanto al porcentaje de tumores benignos (72,7%) y edad media al diagnóstico (42 años). En la serie estudiada no se aprecian diferencias en relación con la edad media al diagnóstico y el grado tumoral, 44 años en los tumores phyllodes malignos frente a 40 años en los tumores phyllodes benignos.
Karim et al.9 correlacionaron la edad media al diagnóstico del tumor phyllodes con el grado tumoral, y Tan et al.8 encontraron una relación estadísticamente significativa entre pacientes añosas y tumores phyllodes malignos (p<0,001), probablemente por lo amplio de su tamaño muestral.
Los tumores phyllodes malignos alcazaron mayor tamaño tumoral que los benignos y borderline en la serie analizada. No se registraron tumores phyllodes malignos menores de 2cm y no se registraron tumores phyllodes benignos por encima de los 10cm. Tampoco en la serie amplia de Tan et al.8 encontraron una relación significativa entre el tamaño y el grado tumoral.
El primer paso en el tratamiento del tumor phyllodes es la cirugía y ha sido objeto de debate. La práctica en nuestras pacientes de una escisión local ampliada con márgenes de seguridad superiores a 1cm en lugar de mastectomías ha sido apoyada por diferentes autores1,10,11. Se realizaron mastectomías en pacientes con tumores phyllodes benignos voluminosos, recidivas locales voluminosas, mujeres añosas con tumores phyllodes malignos y normalmente voluminosos, y presencia de elementos heterólogos estromales de mal pronóstico (necrosis y hemorragia).
Un punto controvertido en esta enfermedad es el estado de los márgenes en la cirugía conservadora para evitar la recidiva local. En las pacientes analizadas la recidiva local se ha relacionado principalmente con el grado tumoral. La mayor parte de las recidivas locales se presentaron en tumores borderline y malignos (33,3%) frente a un 20% en los benignos, aunque en cifras absolutas el mayor número de recidivas se registró en los tumores phyllodes benignos (5 recidivas).
A pesar de no relacionarse de forma dependiente el estado de los márgenes con la recidiva local en diferentes series analizadas, en nuestro estudio se ha sometido a las pacientes a reintervenciones para evitar una probable recidiva local y lograr márgenes de seguridad. En esta línea un gran número de estudios concluyen que una escisión local de márgenes incompleta pudiera ser un factor predisponente a la recidiva local, conllevando una reescisión y por tanto una segunda cirugía en una gran proporción de casos5,7,12–14. La escisión local ampliada, junto a parámetros histológicos como la atipia, la mitosis y el crecimiento estromal, parecen ser factores pronósticos para el control local de la enfermedad15. En otro estudio de Tan et al.13 se observa una diferencia significativa en la aparición de recidiva local en relación con el estado de los márgenes menor de 1cm.
La disección axilar en los tumores phyllodes tiene un papel limitado, y no se encontró enfermedad en los vaciamientos axilares realizados en la serie presentada, en 2 casos de segundas cirugías: uno de ellos, un tumor phyllodes maligno con presencia de elementos heterólogos estromales, y el otro, un caso de recidiva voluminosa de un tumor phyllodes benigno. A pesar de que los ganglios linfáticos pudieran estar afectados en menos de un 5% de las pacientes16,17, no estaría indicado un vaciamiento axilar de forma electiva y según las guías actuales NCCN de 2012 no son necesarias las linfadenectomías axilares regladas debido a la rara afectación axilar del tumor phyllodes, a menos que se tenga sospecha en la exploración clínica. En nuestra serie, como tercera cirugía se realizó una linfadenectomía axilar en una paciente con probable recidiva axilar que resultó afectada por un carcinoma ductal infiltrante concomitante, y en la progresión de la enfermedad desarrolló una nueva afectación axilar, en este caso sarcomatosa, con enfermedad diseminada por ambos tumores.
Otro punto importante en el manejo de la paciente con tumor phyllodes es el tratamiento adyuvante con radioterapia. En las pacientes presentadas la radioterapia se aplicó a 2 de ellas con tumores malignos voluminosos, edades extremas y presencia de elementos heterólogos estromales histológicos y enfermedad diseminada. Varios autores5,15,18 estudiaron el papel de la radioterapia adyuvante en el tumor phyllodes borderline y maligno, consiguiendo un mejor control local de la enfermedad, pero no observaron una mejoría significativa en la supervivencia global. Algunos autores5,16, pese a no llegar a conclusiones definitivas al respecto, trataron con radioterapia adyuvante a pacientes con tumores voluminosos o con signos histológicos ominosos.
En nuestra unidad, el tratamiento del tumor phyllodes ha sido la cirugía (conservadora o mastectomía) con el fin de conseguir márgenes de seguridad mayores de 1cm, motivo por el que se sometió a algunas pacientes a reintervenciones posteriores. La histología agresiva en los tumores phyllodes malignos determinó en algunos casos la necesidad de realizar una mastectomía y la aplicación de radioterapia adyuvante posterior con el fin de lograr un mejor control local de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.