La importancia de obtener márgenes libres en la cirugía conservadora de mama es conocida. Sin embargo, no existe uniformidad a la hora de plantear una reescisión, por ello desde el Grupo de Estudios Senológicos decidimos conocer la realidad de nuestro país mediante una encuesta
Material y métodoSe elaboró una encuesta en línea que constaba de 28 ítems distribuidos en 4 apartados: generalidades, información y decisión peroperatoria, información y decisión postoperatoria, y otros. Se envió a 87 centros de los que contestaron 55 (63,2%).
ResultadosEn el 60% de los casos los márgenes se examinan de forma intraoperatoria siempre y en el 22% de forma ocasional. El 58% entiende por margen próximo el margen inferior a 1mm. Cuando la información de margen afecto, focalmente afecto o próximo a tumor es intraoperatoria, en la mayoría de los centros se opta por la ampliación quirúrgica. Si la información es postoperatoria, en caso de margen afecto o focalmente afecto se realiza una reescisión en una amplio porcentaje de pacientes (70-100%) y si son próximos solo en el 18-29%. En caso de afectación de márgenes y no reescisión quirúrgica en el 50% de los casos se aumenta la dosis de radiación.
ConclusiónActualmente en nuestro medio, ante la afectación de los márgenes quirúrgicos la decisión mayoritaria es la reescisión. Sin embargo, existe una variabilidad no despreciable en esta decisión cuando la información es de proximidad del margen quirúrgico.
The importance of obtaining free margins in breast-conserving surgery is well known. However, there are no uniform criteria on when to perform a reexcision. Therefore, the Breast Study Group decided to identify current practice in Spain through a survey.
Materials and methodAn online survey was developed consisting of 28 items divided into the following 4 data sections: General information, perioperative information and decisions, postoperative information and decisions, and other factors. Questionnaires were sent to 87 centers, and responses were obtained from 55 (63.2%).
ResultsMargins were always examined intraoperatively in 60% of the centers and occasionally in 22%. Close margins were defined as those 1mm away from the margin by 58% of participants. Most centers opted for reexcision when information on involved margins or close margins was obtained intraoperatively. If the information was obtained postoperatively, reexcision was performed in 70-100% of cases of involved margins but in only 18-29% of cases of close margins. In cases of involved margins without reexcision, 50% of respondents increased the radiation dose.
ConclusionIn Spain, reexcision is usually performed in cases of involved margins. However, there is an appreciable variation in this decision in cases of close margins.
El manejo del cáncer de mama ha sufrido importantes cambios en las últimas décadas habiéndose pasado del máximo tratamiento tolerable al mínimo tratamiento eficaz1. Así, actualmente el tratamiento más utilizado es la cirugía conservadora seguida de radioterapia que obtiene los mismos resultados que la mastectomía2,3. En un intento de disminuir la agresividad quirúrgica, la cirugía moderna va dirigida a extraer el menor volumen posible con la idea de preservar la estética. En estos casos, la finalidad del cirujano es extirpar el tumor en bloque junto con un margen de tejido sano, actuación que garantiza la extracción completa del tumor4.
El objetivo del estudio patológico del margen quirúrgico, ya sea intraoperatorio o diferido, es informar de la presencia o no de células tumorales en el borde de la pieza o en su proximidad, dado que existe una relación directa entre margen positivo y recidiva5. Sin embargo, ante la afectación de los márgenes o proximidad de las células tumorales a los mismos, no existe una actuación uniforme por parte de los equipos médicos, planteándose diversas actitudes como la reescisión, la mastectomía, aumentar la dosis de radiación o no hacer nada6,7.
El concepto de margen afecto implica la presencia de células tumorales en la tinta china con la que el patólogo marca el borde de la pieza. Sin embargo, no existe unanimidad de criterio para los conceptos de «margen negativo»8,9, ni «margen próximo», concepto que se ha excluido recientemente en las guías de las Sociedades de Cirugía Oncológica y de Oncología Radioterápica americanas10, en las que se proponen únicamente los términos de margen positivo y margen libre.
El Grupo de Estudios Senológicos (GES) decidió conocer la situación práctica actual en nuestro país respecto a la actitud terapéutica de márgenes afectos. El objetivo del presente estudio es conocer la variabilidad en la actitud de las diversas unidades de mama del territorio nacional en el manejo de los márgenes de resección de la cirugía de mama.
Material y métodoSe elaboró una encuesta para conocer la actitud ante la afectación o proximidad de los márgenes de resección quirúrgicos por células tumorales. Esta encuesta constaba de 28 ítems distribuidos en 4 apartados: generalidades, información y decisión peroperatoria, información y decisión postoperatoria, y otros (tablas 1–4).Las preguntas se refirieron tanto a carcinomas infiltrantes como in situ y se solicitó la respuesta basada en el criterio de la unidad como tal, no por los servicios o por la persona que contestó.
Preguntas sobre generalidades
| n | % | |
| ¿Cuántos cánceres de mama se intervienen al año? | ||
| <50 | 2 | 4 |
| 50-100 | 11 | 20 |
| 100-200 | 23 | 42 |
| >200 | 19 | 34 |
| ¿Se discuten los casos en comité multidisciplinar? | ||
| Siempre | 51 | 93 |
| Nunca | 0 | 0 |
| A veces | 4 | 7 |
| Al comité, ¿acude algún/a patólogo/a? | ||
| Siempre | 53 | 96 |
| Nunca | 0 | 0 |
| A veces | 2 | 4 |
| ¿Existe un patólogo/a con dedicación exclusiva a mama? | ||
| Solo hace mama | 11 | 20 |
| De forma preferente | 33 | 60 |
| No | 11 | 20 |
| ¿Se examinan de forma peroperatoria los márgenes? | ||
| Siempre | 33 | 60 |
| Nunca | 10 | 18 |
| A veces | 12 | 22 |
| Los márgenes, ¿se examinan con tinta china? | ||
| Sí | 44 | 80 |
| No | 11 | 20 |
| La pieza operatoria, ¿se orienta de alguna forma? | ||
| Siempre | 52 | 95 |
| Nunca | 0 | 0 |
| A veces | 3 | 5 |
| ¿Qué se entiende por margen próximo? | ||
| Inferior a 1mm | 32 | 58 |
| Inferior a 3mm | 13 | 24 |
| Inferior a 5mm | 5 | 9 |
| Inferior a 10mm | 5 | 9 |
| Al comité, ¿acude algún/a oncólogo/a radioterápico/a? | ||
| Siempre | 44 | 80 |
| Nunca | 5 | 9 |
| A veces | 6 | 11 |
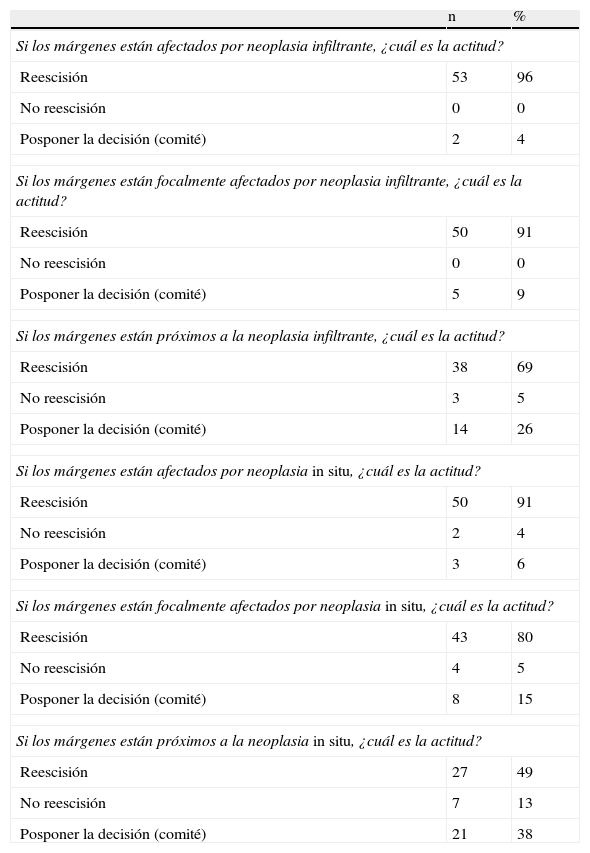
Información y decisión peroperatoria
| n | % | |
| Si los márgenes están afectados por neoplasia infiltrante, ¿cuál es la actitud? | ||
| Reescisión | 53 | 96 |
| No reescisión | 0 | 0 |
| Posponer la decisión (comité) | 2 | 4 |
| Si los márgenes están focalmente afectados por neoplasia infiltrante, ¿cuál es la actitud? | ||
| Reescisión | 50 | 91 |
| No reescisión | 0 | 0 |
| Posponer la decisión (comité) | 5 | 9 |
| Si los márgenes están próximos a la neoplasia infiltrante, ¿cuál es la actitud? | ||
| Reescisión | 38 | 69 |
| No reescisión | 3 | 5 |
| Posponer la decisión (comité) | 14 | 26 |
| Si los márgenes están afectados por neoplasia in situ, ¿cuál es la actitud? | ||
| Reescisión | 50 | 91 |
| No reescisión | 2 | 4 |
| Posponer la decisión (comité) | 3 | 6 |
| Si los márgenes están focalmente afectados por neoplasia in situ, ¿cuál es la actitud? | ||
| Reescisión | 43 | 80 |
| No reescisión | 4 | 5 |
| Posponer la decisión (comité) | 8 | 15 |
| Si los márgenes están próximos a la neoplasia in situ, ¿cuál es la actitud? | ||
| Reescisión | 27 | 49 |
| No reescisión | 7 | 13 |
| Posponer la decisión (comité) | 21 | 38 |
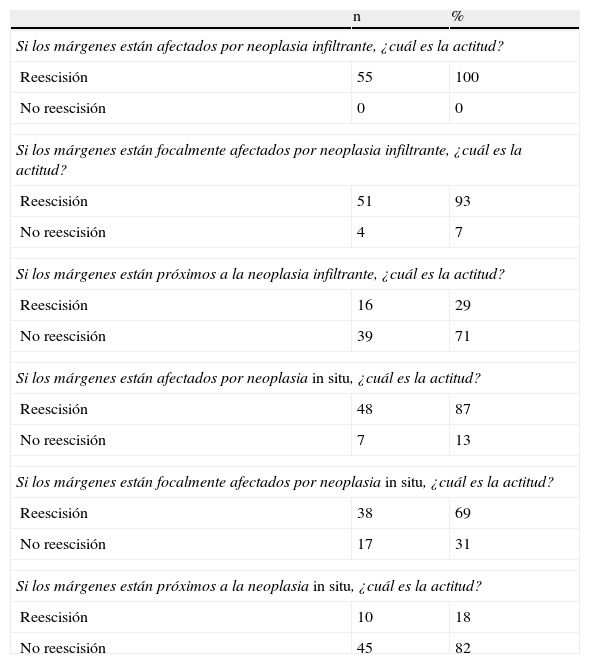
Información y decisión postoperatoria
| n | % | |
| Si los márgenes están afectados por neoplasia infiltrante, ¿cuál es la actitud? | ||
| Reescisión | 55 | 100 |
| No reescisión | 0 | 0 |
| Si los márgenes están focalmente afectados por neoplasia infiltrante, ¿cuál es la actitud? | ||
| Reescisión | 51 | 93 |
| No reescisión | 4 | 7 |
| Si los márgenes están próximos a la neoplasia infiltrante, ¿cuál es la actitud? | ||
| Reescisión | 16 | 29 |
| No reescisión | 39 | 71 |
| Si los márgenes están afectados por neoplasia in situ, ¿cuál es la actitud? | ||
| Reescisión | 48 | 87 |
| No reescisión | 7 | 13 |
| Si los márgenes están focalmente afectados por neoplasia in situ, ¿cuál es la actitud? | ||
| Reescisión | 38 | 69 |
| No reescisión | 17 | 31 |
| Si los márgenes están próximos a la neoplasia in situ, ¿cuál es la actitud? | ||
| Reescisión | 10 | 18 |
| No reescisión | 45 | 82 |
Otras preguntas
| n | % | |
| ¿Contabilizáis o habéis contabilizado la positividad de las reescisiones? | ||
| Sí | 27 | 49 |
| No | 28 | 51 |
| En caso de márgenes afectados y no reescisión quirúrgica, la dosis de radiación ¿aumenta? | ||
| Siempre | 28 | 51 |
| Nunca | 4 | 7 |
| En función de factores de riesgo | 23 | 42 |
| En caso de márgenes focalmente afectados y no reescisión quirúrgica, la dosis de radiación ¿aumenta? | ||
| Siempre | 23 | 42 |
| Nunca | 3 | 5 |
| En función de factores de riesgo | 29 | 53 |
| En caso de márgenes próximos afectados y no reescisión quirúrgica, la dosis de radiación ¿aumenta? | ||
| Siempre | 11 | 20 |
| Nunca | 5 | 9 |
| En función de factores de riesgo | 39 | 71 |
La encuesta se realizó en línea. Para ello, el cuestionario se puso en la red y se envió un enlace de la misma mediante correo electrónico, desde la secretaría de la Sociedad Española de Senología y Patología Mamaria (SESPM) a 87 centros pertenecientes a 13 comunidades autónomas en los que existe una unidad funcional de mama.
Posteriormente se realizó un análisis descriptivo de las respuestas a cada ítem mediante un cálculo de proporciones de las mismas. También se llevó a cabo un análisis comparativo entre grupos dependiendo del manejo intraoperatorio y la consideración de la decisión del respectivo Comité, de algunas de las variables mediante una comparación de proporciones y un test de análisis de tablas de contingencia mediante el test de la chi-cuadrado de Pearson, considerando significativo un valor de p<0,05.
ResultadosDe los centros encuestados, contestaron 55, lo que representa el 63,2%. La lista de centros participantes está en el anexo 2. Tal como se observa en la tabla 1, en el 76% de estos se intervienen más de 100 casos de cáncer de mama al año, en el 93% se discuten todos los casos en comité al que en el 96% de las ocasiones acude un patólogo y en el 80% un oncólogo radioterápico.
El 60% de los encuestados realiza el estudio de márgenes de forma intraoperatoria siempre y el 22% de ellos lo hace ocasionalmente. El 80% de los encuestados marca los bordes con tinta china, el 95% orientan los márgenes de alguna forma ya sea con clips quirúrgicos o con la ayuda directa del cirujano. En cuanto al concepto de «margen próximo», el 58% entiende por margen próximo el que es inferior a 1mm, el 24% el que es inferior a 3mm, el 9% el que es inferior a 5mm y existe un 9% que también considera próximo un margen inferior a 10mm.
Respecto a la actitud terapéutica frente a un margen quirúrgico afecto o próximo (tabla 2), varía en función de que el informe del margen sea intraoperatorio o postoperatorio. En la mayoría de los centros se opta por la ampliación quirúrgica, tanto si el diagnóstico es de carcinoma infiltrante (96%) como de neoplasia in situ (91%), cuando el informe es intraoperatorio. En caso de afectación focal, los porcentajes de reescisión disminuyen al 91 y 80% respectivamente. En el caso de márgenes próximos, los porcentajes de reescisión disminuyen al 69%para el carcinoma infiltrante y al 50% para el carcinoma intraductal. En los casos de no reescisión, la última decisión acerca de la actitud a seguir se toma en comité muldicisciplinar, de forma mayoritaria.
Si la información es postoperatoria (tabla 3), en caso de margen afecto o focalmente afecto por carcinoma infiltrante o in situ se realiza la reescisión en un amplio porcentaje de pacientes (69-100%). Por el contrario, si son próximos, no se reintervienen en una amplia mayoría de ocasiones (71-82%).
Otro punto encuestado contempla el porcentaje de afectación en los especímenes de reescisión. Únicamente un 49% de los centros han contabilizado en alguna ocasión la afectación de las reescisiones (tabla 4) y los porcentajes de afectación de las reescisiones oscilan entre el 2% y el 50%.
En cuanto a la radioterapia, el 51% de los encuestados aumenta la dosis de radiación siempre en caso de afectación de los márgenes, el 42% cuando la afectación es focal y el 20% en caso de proximidad al tumor. El resto de los encuestados condiciona el aumento de la dosis a la coexistencia de otros factores.
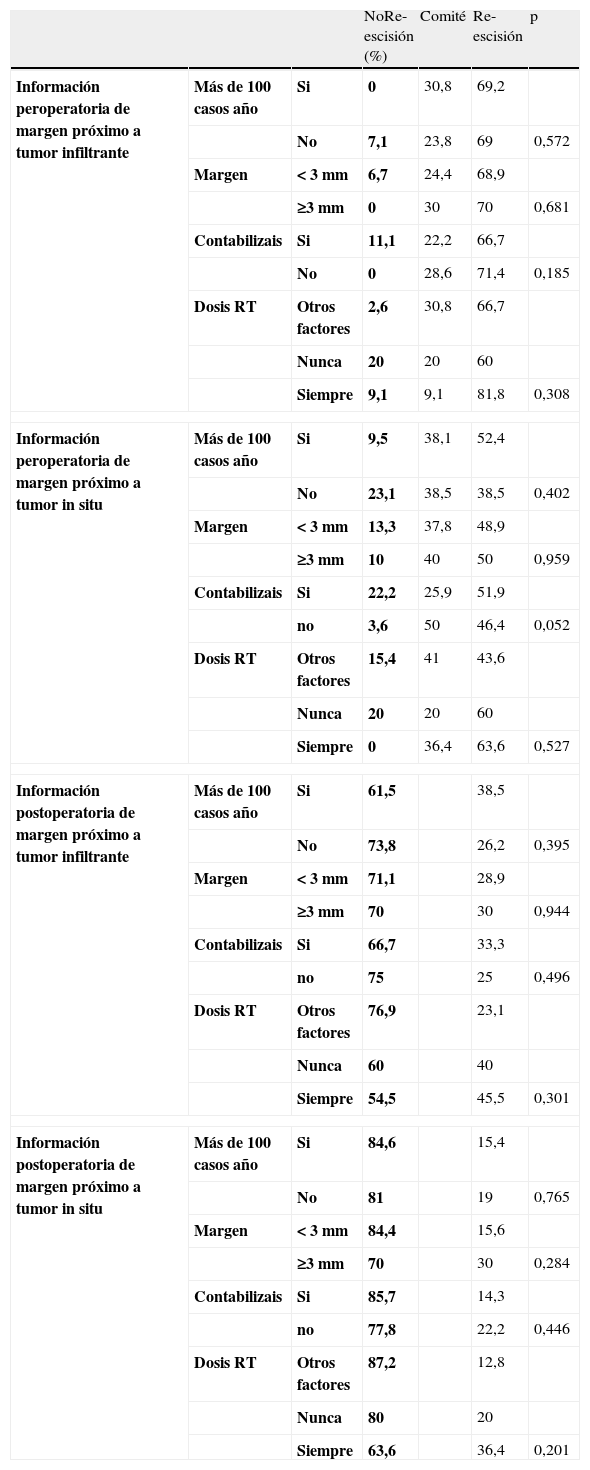
Como las mayores diferencias en los resultados se producen en la decisión de los márgenes próximos al tumor (tablas 2 y 3), se intentó comprobar si existía alguna asociación entre la toma de decisiones y variables dependientes del centro como el número de casos intervenidos al año, el criterio utilizado para la definición de margen próximo, el hecho de contabilizar la positividad de la reescisión y el aumento de dosis de radioterapia en función del estado de los márgenes. Únicamente se encontraron diferencias estadísticamente significativas entre los centros que han contabilizado la afectación de los márgenes frente a los que no lo han hecho y solo para los márgenes próximos al tumor in situ (tabla 5).
Comparación entre información de margen próximo y decisión en función de variables de centro
| NoRe-escisión (%) | Comité | Re-escisión | p | |||
| Información peroperatoria de margen próximo a tumor infiltrante | Más de 100 casos año | Si | 0 | 30,8 | 69,2 | |
| No | 7,1 | 23,8 | 69 | 0,572 | ||
| Margen | < 3 mm | 6,7 | 24,4 | 68,9 | ||
| ≥3 mm | 0 | 30 | 70 | 0,681 | ||
| Contabilizais | Si | 11,1 | 22,2 | 66,7 | ||
| No | 0 | 28,6 | 71,4 | 0,185 | ||
| Dosis RT | Otros factores | 2,6 | 30,8 | 66,7 | ||
| Nunca | 20 | 20 | 60 | |||
| Siempre | 9,1 | 9,1 | 81,8 | 0,308 | ||
| Información peroperatoria de margen próximo a tumor in situ | Más de 100 casos año | Si | 9,5 | 38,1 | 52,4 | |
| No | 23,1 | 38,5 | 38,5 | 0,402 | ||
| Margen | < 3 mm | 13,3 | 37,8 | 48,9 | ||
| ≥3 mm | 10 | 40 | 50 | 0,959 | ||
| Contabilizais | Si | 22,2 | 25,9 | 51,9 | ||
| no | 3,6 | 50 | 46,4 | 0,052 | ||
| Dosis RT | Otros factores | 15,4 | 41 | 43,6 | ||
| Nunca | 20 | 20 | 60 | |||
| Siempre | 0 | 36,4 | 63,6 | 0,527 | ||
| Información postoperatoria de margen próximo a tumor infiltrante | Más de 100 casos año | Si | 61,5 | 38,5 | ||
| No | 73,8 | 26,2 | 0,395 | |||
| Margen | < 3 mm | 71,1 | 28,9 | |||
| ≥3 mm | 70 | 30 | 0,944 | |||
| Contabilizais | Si | 66,7 | 33,3 | |||
| no | 75 | 25 | 0,496 | |||
| Dosis RT | Otros factores | 76,9 | 23,1 | |||
| Nunca | 60 | 40 | ||||
| Siempre | 54,5 | 45,5 | 0,301 | |||
| Información postoperatoria de margen próximo a tumor in situ | Más de 100 casos año | Si | 84,6 | 15,4 | ||
| No | 81 | 19 | 0,765 | |||
| Margen | < 3 mm | 84,4 | 15,6 | |||
| ≥3 mm | 70 | 30 | 0,284 | |||
| Contabilizais | Si | 85,7 | 14,3 | |||
| no | 77,8 | 22,2 | 0,446 | |||
| Dosis RT | Otros factores | 87,2 | 12,8 | |||
| Nunca | 80 | 20 | ||||
| Siempre | 63,6 | 36,4 | 0,201 | |||
La participación de los centros ha sido del 62%, lo que consideramos satisfactorio si se tiene en cuenta que en este tipo de encuestas la participación suele ser menor. Saini et al.11, en una encuesta sobre tratamiento de cáncer de mama realizada en 39 países, obtuvieron respuesta de un 17% de los encuestados.
Aunque los resultados demuestran que, en la mayoría de los centros, los casos se discuten en un comité multidisciplinar y que a este asisten, además del equipo quirúrgico, los patólogos y los oncólogos radioterápicos de forma mayoritaria (tabla 1), las discrepancias ocurren cuando el informe histológico es de proximidad de los márgenes (tablas 2 y 3), tal y como ocurre en la encuesta realizada por Azu et al.8 a más de 300 cirujanos norteamericanos. Probablemente estas diferencias de criterio se deban, al menos en parte, a la falta de homogeneidad en la definición de margen próximo12–14. A pesar de los numerosos estudios existentes para intentar demostrar cuál debe ser el margen quirúrgico mínimo para disminuir la recidiva local todavía no existe una definición unánime9,15. Es frecuente pensar erróneamente que cuanto más amplio sea el margen, menor será el riesgo de recidiva local16; la proximidad de las células tumorales a los márgenes quirúrgicos no ha demostrado ser factor de riesgo17 habiéndose demostrado que el porcentaje de recidiva local de las pacientes con márgenes de 1, 3, 5 o más mm son similares18. La reescisión quirúrgica, especialmente cuando es diferida, es un procedimiento que aumenta la morbilidad y los costes6,7,19por lo que es necesario aplicar criterios de selección consistentes, aún más teniendo en cuenta que, en la mitad de los casos, es negativa16, como evidencia el presente trabajo, donde los encuestados describen unos porcentajes de positividad que oscilan entre el 3% y el 50% de las ocasiones. Para disminuir las tasas de reescisiones, diversos autores proponen el estudio de los márgenes de la tumorectomía por separado20–23.
Uno de los objetivos del estudio era ver si las variaciones en la decisión de reintervenir estaban influidas por variables dependientes del centro como el número de casos operados al año, la definición de margen próximo, centro que contabiliza la positividad de las reintervenciones o variación de las dosis de radioterapia en función de márgenes. En este sentido no existe ninguna diferencia estadísticamente significativa; sin embargo, los centros que contabilizan la positividad de las reescisiones posponen menos la decisión al comité y, se decantan en mayor proporción por la decisión intraoperatoria de reescisión o no reescisión.
La corriente actual de minimizar al máximo la cirugía, incluso de la axila24, parece estar contrapuesta a la decisión de reescisión ante unos márgenes próximos al tumor o incluso focalmente afectos. En ese sentido, debemos recordar que, salvo raras contraindicaciones, la totalidad de las pacientes recibirán irradiación mamaria y en muchas ocasiones una sobreimpresión sobre el lecho quirúrgico que contribuye a disminuir el porcentaje de recidiva local25,26. Asimismo, muchas de estas pacientes también recibirán tratamiento sistémico. La mejora en los resultados por medio de estas estrategias ha sido demostrada en los estudios del NSABP de los años 9027 en los que el porcentaje global de recidiva local disminuyó al 3-6,5%. La tendencia imperante en el manejo quirúrgico es la de abandonar la reescisión en los casos de márgenes próximos28, lo que sin duda contribuirá a la disminución de los costes y morbilidad sin afectar al resultado oncológico. Tal como proponen Morrow et al.16, se debería adoptar el criterio de no etiquetar al margen de «próximo» sino reflejar los milímetros, especialmente en los estudios y ensayos clínicos, y considerar el índice de reescisión como un indicador de calidad del equipo médico. Intentar un estudio aleatorizado para comprobar si es útil la reescisión en estos casos es muy complicado y los mismos autores16 proponen, como una opción para lograr más información en el futuro, que en los estudios de adyuvancia se incluya de rutina el estado de los márgenes y los milímetros.
Existen varios estudios que cuestionan la importancia de la distancia del tumor al margen de resección en la recidiva local29,30. El metanálisis de Housami et al.18 de 2010 demostró que no existe evidencia de la influencia de la distancia al margen de resección sobre la recidiva local, considerando innecesaria la reescisión por márgenes próximos en cirugía conservadora por cáncer de mama. La actualización de este metanálisis31 reafirma el hecho de que la distancia al margen de resección no tiene importancia en la recidiva local. Estos resultados han conducido a que las Sociedades de Cirugía y de Radioterapia americanas establezcan un consenso en el que no se hable de margen próximo10.
Con relación a los márgenes afectos, algunos estudios32,33 consiguen disminuir la importancia de la positividad del margen en la recidiva local, especialmente en los que tienen una afectación focal28.
Se puede concluir que, en la actualidad y en nuestro medio, ante la afectación de los márgenes quirúrgicos la decisión mayoritaria es la reescisión. Sin embargo, existe una discreta variabilidad en la decisión de reescisión cuando la información es de proximidad del margen quirúrgico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Autoría- 1
Participación en la concepción y diseño, la adquisición de los datos, el análisis e interpretación de los datos del trabajo que ha dado como resultado el artículo en cuestión: Manuel Algara, Antonio Piñero, Laia Bernet y Francisco Vicente.
- 2
Participación en la redacción del texto y en las posibles revisiones del mismo: Manuel Algara, Ander Urruticoechea, Antonio Piñero, Laia Bernet, Francisco Vicente, Gregorio Gómez-Bajo y Sergi Vidal-Sicart.
- 3
Aprobación de la versión que finalmente va a ser publicada: Laia Bernet, Ander Urruticoechea, Francisco Vicente, Manuel Algara, Julia Camps, Gregorio Gómez-Bajo, Arantxa Moreno, Sergi Vidal-Sicart y Antonio Piñero.
Los autores declaran no tener ningún conflicto de intereses.
Los miembros del Grupo de Estudios Senológicos son: Manuel Algara, Julia Camps, Gregorio Gómez-Bajo, Arantxa Moreno, Antonio Piñero y Sergi Vidal-Sicart
| Comunidad | Hospital |
| Andalucía | Hospital de Almería |
| Hospital Comarcal de Huércal-Overa. Almería | |
| Hospital de Jerez (Cádiz) | |
| Hospital Virgen de las Nieves. Granada | |
| Complejo Hospitalario de Jaén | |
| Hospital San Agustín. Linares (Jaén) | |
| Hospital Universitario Virgen del Rocío. Sevilla. | |
| Hospital Comarcal «La Merced». Osuna (Sevilla) | |
| Aragón | Hospital Clínico Universitario «Lozano Blesa». Zaragoza |
| Hospital Universitario Miguel Servet. Zaragoza | |
| Asturias | Hospital Álvarez Buylla. Mieres. Asturias |
| Cantabria | Hospital Universitario Marqués de Valdecilla. Santander |
| Castilla-La Mancha | Hospital General Universitario de Ciudad Real |
| Hospital Universitario de Guadalajara | |
| Hospital Nuestra Señora del Prado de Talavera de la Reina. Toledo | |
| Castilla-León | Complejo Hospitalario de Ávila |
| Hospital Nuestra Señora de Sonsoles. Ávila | |
| Complejo asistencial Universitario de Burgos | |
| Complejo Hospitalario Santa Bárbara de Soria | |
| Catalunya | Hospital de la Santa Creu i Sant Pau. Barcelona |
| Institut Universitari Dexeus. Barcelona | |
| Parc de Salut Mar. Barcelona | |
| Hospital Universitari Germans Trias i Pujol. Badalona (Barcelona) | |
| Hospital General de Granollers (Barcelona) | |
| Hospital Universitario de Bellvitge/Institut Català d’Oncologia. L’Hospitalet de Llobregat (Barcelona) | |
| Fundació Althaia Xarxa Assistencial. Manresa (Barcelona) | |
| Consorci Sanitari del Garraf. Hospital Sant Camil. Sant Pere de Ribes (Barcelona) | |
| Hospital Esperit Sant de Santa Coloma de Gramanet (Barcelona) | |
| Hospital Universitari Mutua Terrassa (Barcelona) | |
| Hospital de Santa Caterina. Girona | |
| Hospital Arnau de Vilanova. Lleida | |
| Hospital Clinic. Barcelona | |
| Hospital Verge de la Cinta de Tortosa. Tarragona | |
| Galicia | Complejo Hospitalario Universitario de Ferrol (A Coruña) |
| Complejo Hospitalario Universitario de Vigo (Pontevedra) | |
| Madrid | Hospital Universitario 12 de Octubre. Madrid |
| Hospital Universitario La Paz. Madrid | |
| Hospital Clínico San Carlos de Madrid | |
| Hospital del Sureste. Arganda del Rey (Madrid) | |
| Hospital Universitario Puerta de Hierro. Majadahonda (Madrid) | |
| Murcia | Hospital General Universitario Reina Sofía de Murcia |
| Hospital Clínico Universitario «Virgen de la Arrixaca». Murcia | |
| Hospital Universitario «Santa Lucía». Cartagena (Murcia) | |
| Navarra | Complejo Hospitalario de Navarra. Pamplona |
| Centro B del Complejo Hospitalario de Navarra (antiguo Hospital Virgen del Camino). Pamplona | |
| Clínica Universidad de Navarra. Pamplona | |
| País Vasco | Hospital Universitario de Álava |
| Onkologikoa. Donosti | |
| Valencia | Hospital General de Castellón |
| Hospital Provincial de Castellón | |
| Hospital Clínico Universitario de Valencia | |
| Hospital Universitario Doctor Peset. Valencia | |
| Hospital Universitario de la Ribera. Alzira. Valencia | |
| Hospital de Sagunto. Valencia | |
| Hospital Lluis Alcanys, Xativa (Valencia) |