Determinar la influencia a nivel celular y molecular de varios tratamientos hormonales (estrógeno, tamoxifeno y fulvestrant) sobre las células epiteliales y las células madre de la mama sana y tumoral.
MétodosSe emplearon muestras de tejido mamario sano y tumoral, así como líneas celulares de cáncer de mama y células resistentes a tamoxifeno, para analizar los efectos de las hormonas sobre la proliferación y diferenciación celular.
ResultadosLas células epiteliales y las células madre de la mama respondieron de forma diferente a los tratamientos hormonales. Las células resistentes a tamoxifeno presentaban un mayor contenido de células madre cancerosas y expresaban niveles de Sox2 más elevados, mientras que los niveles de expresión del receptor de progesterona eran muy bajos. Las células resistentes a tamoxifeno eran, además, más resistentes al tratamiento con fulvestrant.
ConclusionesEl desarrollo de resistencia a tamoxifeno está asociado con un incremento en el contenido de células madre cancerosas. El tratamiento con fulvestrant no parece disminuir la población de células madre cancerosas. Sox2 podría ser un biomarcador de resistencia a tamoxifeno en el cáncer de mama.
To determine the influence of various hormones (estrogen, tamoxifen and fulvestrant) on cell proliferation and differentiation in normal and cancer breast stem cells.
MethodsPrimary tissue samples, breast cancer cell lines and tamoxifen-resistant cells were used to analyze the effects of hormones on cell proliferation and differentiation.
ResultsBreast epithelial cells and stem cells responded differentially to hormone treatments. Tamoxifen-resistant cells showed increased cancer stem cell content and expressed higher Sox2 levels, while progesterone receptor levels were very low. Tamoxifen-resistant cells were resistant to fulvestrant treatment.
ConclusionsThe development of tamoxifen resistance is associated with an increase in cancer stem cell content. Treatment with fulvestrant does not appear to reduce the cancer stem cell population. Sox2 could represent a biomarker of tamoxifen resistance in breast cancer.
La glándula mamaria es un órgano altamente regenerativo que puede experimentar múltiples ciclos de proliferación, diferenciación y apoptosis durante diferentes etapas de la vida, como la pubertad, el embarazo o la lactancia. Esta capacidad evidenció la presencia en la mama de células con características de células madre, es decir, con capacidad de autorrenovación (dar lugar a células iguales a ellas mismas) y de diferenciación (en la mama, a células luminales y células mioepiteliales)1. Debido a su larga vida, las células madre tienen el potencial de sufrir mayor número de mutaciones y, por lo tanto, perder el control de sus propiedades y dar origen a un tumor.
El cáncer de mama es una enfermedad muy heterogénea a nivel histológico y, sobre todo, a nivel molecular. Esta heterogeneidad se ve reflejada también a nivel celular con la identificación, en los carcinomas de mama, de una pequeña subpoblación de células con características de células madre, las células madre cancerosas (CSC).
Hoy en día es un hecho aceptado que las vías de señalización que controlan el destino y la función de las células madre se encuentran con frecuencia alteradas en el cáncer de mama y otros tipos de cáncer2. En consecuencia, se ha postulado la hipótesis de que las CSC son las células responsables de la iniciación de los tumores y, además, son más resistentes a las terapias actuales como la radioterapia3, la quimioterapia4 o la terapia hormonal5. Por otra parte, se ha demostrado que los tumores de alto grado contienen un mayor número de células con fenotipo de células madre que los tumores más diferenciados6,7.
Se han empleado diferentes estrategias para identificar y caracterizar las células madre de la mama sana y tumoral, incluyendo la capacidad de formar mamoesferas8, la presencia de células con fenotipo doble positivo (DP, es decir que expresan ambos antígenos de superficie, EMA+ y CALLA+)9, con la expresión de los marcadores de superficie CD44+CD24−/low10, side population (SP, con mayor capacidad de expulsar la tinción Hoechst 33342)11 o la elevada actividad aldehído deshigrogenasa12. En este estudio analizamos la respuesta de las células madre de la mama, empleando varios de estos fenotipos, para investigar la influencia de los estrógenos, tamoxifeno y fulvestrant sobre las células madre en la mama sana y en cáncer de mama, con especial énfasis en su implicación en la resistencia a la terapia hormonal.
Pacientes y métodosPacientesEl tejido de mama sano (n=15) fue obtenido de mujeres premenopáusicas sin historia previa de cáncer de mama, que se sometieron a mamoplastia de reducción. Las muestras de tumores (n=10) fueron obtenidas de mujeres con cáncer de mama (rango de edad de 42 a 80 años, sin criterios de inclusión ni exclusión, las muestras incluían diferentes tipos de carcinomas mamarios). En todos los casos las pacientes ofrecieron su consentimiento informado y firmado, y todos los procedimientos fueron aprobados por el Comité Ético de Investigación Clínica de Euskadi y del Hospital de Galdakao-Usansolo.
Materiales y métodosProcesamiento del tejido mamarioEl tejido mamario fue procesado inmediatamente para su estudio, como se ha descrito previamente13. El tejido fue cortado y digerido con colagenasa a 37°C. Después de varios lavados, los organoides (fragmentos muy pequeños de epitelio mamario, ductales y lobuloalveolares, obtenidos directamente tras la digestión del tejido mamario) fueron separados, filtrados y disgregados para dar lugar a una suspensión celular. Las células tumorales fueron aisladas empleando el mismo procedimiento.
Cultivo celularLas líneas MCF-7 y T47D se obtuvieron de la American Type Culture Collection, y las células resistentes a tamoxifeno de estas líneas celulares (MCF-7-TamR y T47D-TamR) fueron desarrolladas manteniendo las células en presencia de una concentración de 5×10−7M de 4-OH-tamoxifeno durante más de 6 meses. Las líneas fueron mantenidas en medio DMEM/F-12 con GlutaMAX™ suplementado al 10% con suero fetal bovino y con 1% penicilina/estreptomicina a 37°C y atmósfera del 5% de CO2. Las mamosferas se cultivaron durante una semana en medio DMEM/F-12 con GlutaMAX™, suplementado con 0,5X de B27 (Gibco), 10ng/ml EGF (Invitrogen), 2ng/ml bFGF (Invitrogen) y 1% penicilina-estreptomicina a 37°C y atmósfera del 5% de CO2.
Preparación y análisis de ácido ribonucleico y proteínasEl ARN total se extrajo siguiendo las recomendaciones del fabricante (Illustra™ RNAspin Mini Isolation Kit, GE Healthcare). La síntesis de ARN y su análisis cuantitativo por reacción en cadena de la polimerasa se llevó a cabo en un equipo 7300 Real-Time PCR System de 96 pocillos (Applied Biosystems), según se ha detallado previamente14. Los primers utilizados fueron: Sox2, forward primer (5’-3’): GCACATGAACGGCTGGAGCAACG, reverse: TGCTGCGAGTAGGACATGCTGTAGG; receptor de progesterona (PR), forward: CGCGCTCTACCCTGCACTC, reverse: TGAATCCGGCCTCAGGTAGTT; control 36B4, forward: GTGTTCGACAATGGCAGCAT, reverse: GACACCCTCCAGGAAGCGA. Las condiciones fueron 5min a 95°C, 15s a 95°C y 60s a 65°C. Así mismo, en ese trabajo se podrán encontrar detalles del análisis de proteínas por western blotting e inmunohistoquímica. Para el análisis por western blotting las células fueron extraídas directamente en solución Laemmli (Sigma). Los anticuerpos empleados fueron los siguientes: beta-actina (Sigma, AC-15/A5441), PR (Novocastra, PGR-312), Sox2 (Santa Cruz, sc-17320), HER2 (Cell Signaling, 2165). Para el estudio inmunohistoquímico, las muestras de carcinomas, fijadas en formalina y embebidas en parafina, fueron procesadas empleando el sistema Leica Bond-III y los tampones de Novocastra. Se siguió un paso de precalentamiento para el desenmascaramiento (20min, 100°C), y las secciones fueron lavadas e incubadas con el anticuerpo contra Sox2 (Stem Cells Technologies) durante 20min a temperatura ambiente. La peroxidasa fue bloqueada durante 10min, seguida de HRP y DAB con hematoxilina para el contraste. Los controles negativos incluyeron la omisión del primer anticuerpo y el uso de un anticuerpo control IgG.
Cuantificación y aislamiento de las poblaciones de células madrePara medir la actividad enzimática de aldehído deshidrogenasa en las células se llevó a cabo el ensayo ALDEFLUOR™ de acuerdo con el protocolo de la compañía (Stemcell Technologies). Para el fenotipo SP y las tinciones con anticuerpos de superficie contra EMA (BD, 559774) y CALLA (Dako, SS2/36) (DP) se siguieron los protocolos empleados previamente9. Para la tinción del fenotipo CD44/CD24 se emplearon los anticuerpos: CD44-APC (BD, G44-26) y CD24-PE (BD, ML5)5. Todas las muestras se examinaron en un citómetro de flujo FACSAria™. Los resultados se analizaron utilizando el programa FACSDiva™.
Ensayo de proliferaciónLas células MCF-7 y T47D fueron sembradas por triplicado en placa de 96 pocillos y tratadas con crecientes concentraciones de ICI 182,720 (Fulvestrant) y etanol como vehículo del fármaco. Después de 5 días, las células fueron lavadas y fijadas con una solución de cristal violeta y metanol, y la concentración de cristal violeta retenida fue cuantificada en un espectrofotómetro a 595nm. Los resultados son mostrados como fold change proliferation, es decir, el cambio en la proliferación celular producido como consecuencia del tratamiento hormonal con respecto al efecto en las células tratadas con el vehículo solo (MCF-7, n=7, T47D, n=5; p<0,05).
Análisis estadísticoDatos de por lo menos 3 experimentos independientes fueron expresados como media±DE. El test de la t de Student fue empleado para determinar las diferencias estadísticamente significativas, y p<0,05 fue considerado significativo.
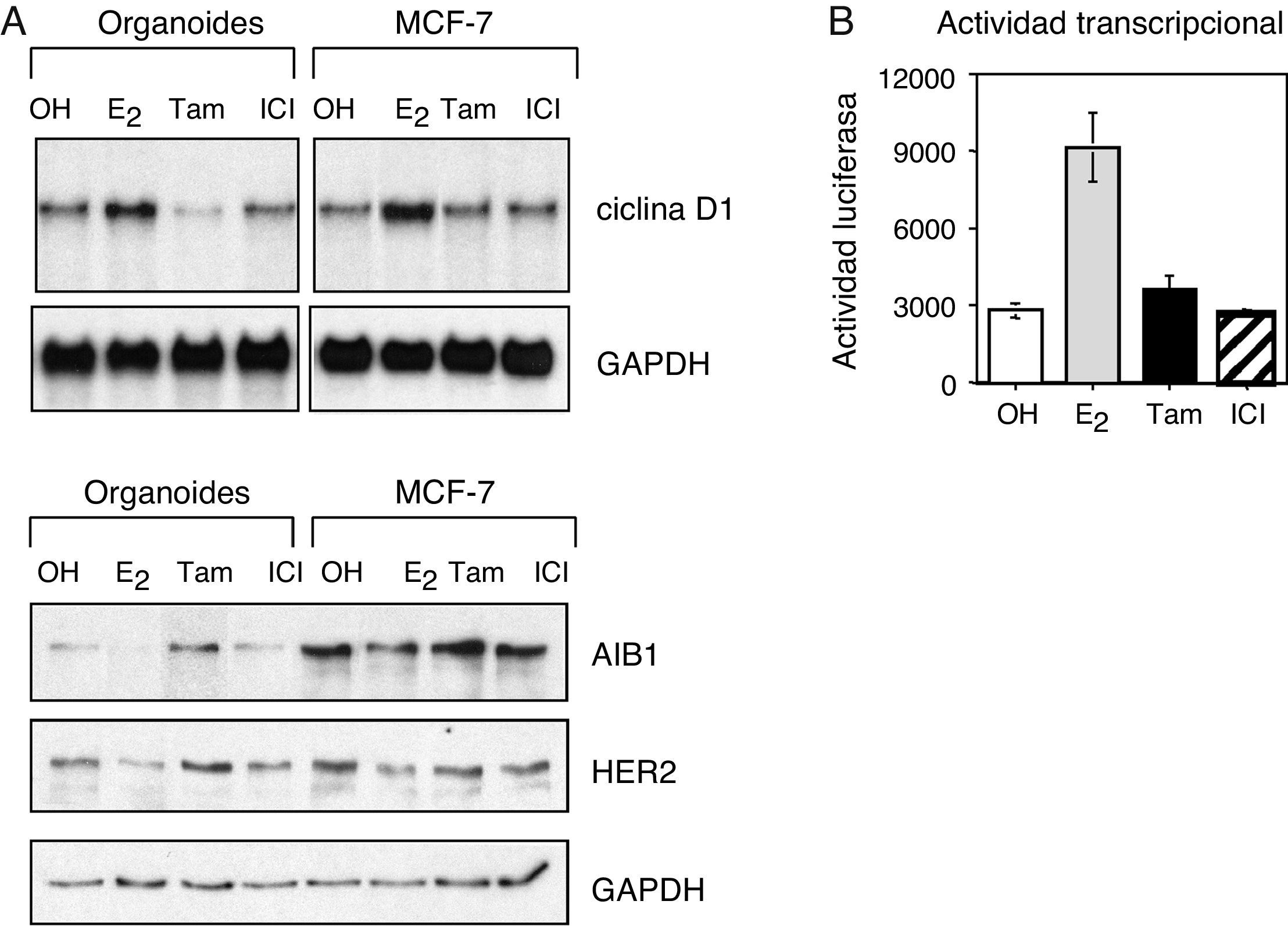
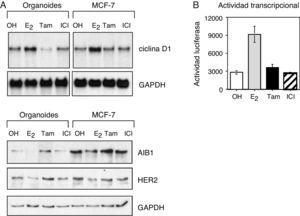
ResultadosLas células epiteliales de mama responden a los tratamientos hormonalesPara estudiar la respuesta de la mama a los tratamientos hormonales se determinó la actividad transcripcional del receptor de estrógeno (ER) en células de mama sana. Las células epiteliales fueron tratadas con diferentes hormonas: 17-beta-estradiol (estrógeno), 4-hidroxitamoxifeno (tamoxifeno), el antagonista completo ICI 182,780 (Faslodex®, nombre genérico: fulvestrant), o el control (etanol) durante un periodo de 24h. La activación del receptor por el estrógeno dio lugar a niveles de expresión más elevados de genes diana dependientes de estrógeno, como la ciclina D1, y redujo la expresión de AIB1 y HER2 (fig. 1A). Por otra parte, los antagonistas tamoxifeno y fulvestrant ejercieron el efecto contrario, dando lugar a una reducción de los niveles de ciclina D1 y un incremento en los niveles de AIB1 y HER2. Es interesante destacar que en las células de cáncer de mama MCF-7, empleadas como control positivo y estudiadas con frecuencia en los laboratorios como modelo de cáncer de mama ER-positivo, se obtuvo la misma respuesta. Además, se analizó la actividad transcripcional de ER empleando el ensayo de la actividad luciferasa. Estos ensayos mostraron una mayor actividad de ER en respuesta al estrógeno, mientras que los antagonistas no tuvieron ningún efecto (fig. 1B). En conjunto, estas observaciones demuestran que las células epiteliales de la mama sana responden a través del receptor de estrógeno a los tratamientos hormonales.
Las células epiteliales de la mama responden al tratamiento hormonal. A. Análisis por Western blot de los niveles de expresión de ciclina D1, AIB1 y HER2 en organoides aislados de tejido mamario sano y en células de cáncer de mama MCF-7. B. Actividad transcripcional del receptor de estrógeno en células epiteliales de mama transfectadas con un gen reportero de luciferasa y tratadas con 10−8M estrógeno (E2), 10−7M tamoxifeno (Tam) o 10−7M fulvestrant (ICI 182,780, ICI).
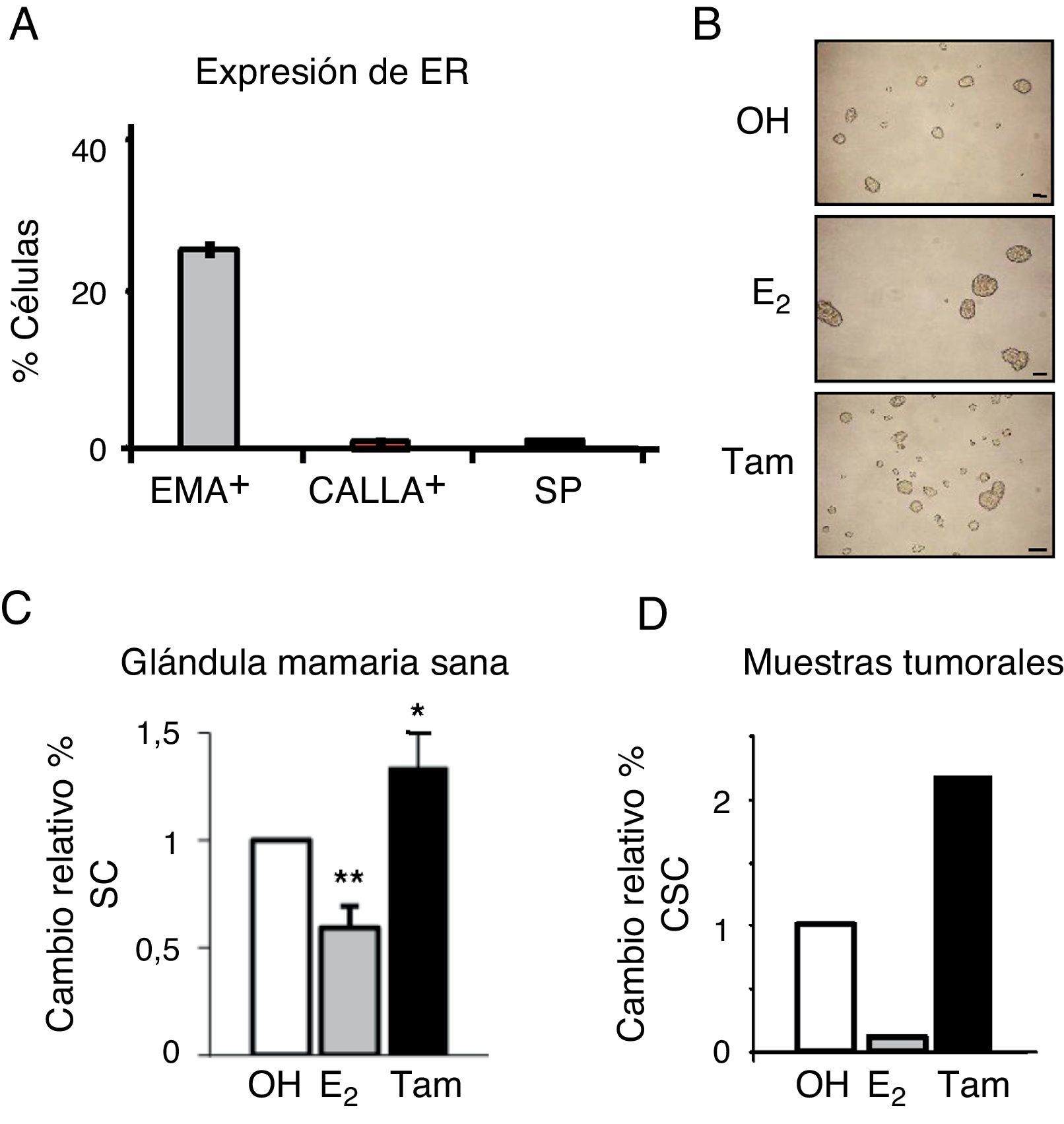
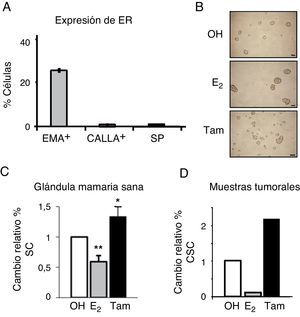
Para examinar los niveles de expresión de ER en los diferentes tipos celulares en la mama sana, las células epiteliales fueron separadas por fluorescence activated cell sorting, lo que permite aislar los diferentes tipos celulares basándose en el marcaje celular diferencial con un marcador de fluorescencia. En este caso, se aislaron las células diferenciadas en base a la expresión de proteínas de superficie específicas: EMA+, que identifica las células luminales, y CD10 o CALLA+, a las células mioepiteliales; por otro lado, se sortearon las células madre con fenotipo SP9. Se observó que aproximadamente el 25% de las células luminales (EMA+) expresaban ER (fig. 2A). Sin embargo, las células madre con fenotipo SP no expresaban ER, así como tampoco las células mioepiteliales (CALLA+). Estos resultados confirman la ausencia de ER en las células madre de mama sana.
La población de células madre se enriquece en respuesta al tratamiento con tamoxifeno. A. Expresión de ER (mARN) en células epiteliales de mama sana a nivel unicelular, representado como el porcentaje de cada tipo de células que expresa ER, EMA+ (luminales), CALLA+ (mioepiteliales) y SP (stem cells). B. Fotografía representativa de las mamoesferas formadas por células MCF-7 tratadas con estrógeno (E2), tamoxifeno (Tam) o el control (OH). C. Porcentaje de células madre (SC) con fenotipo DP en células de mama sana tratadas con estrógeno o tamoxifeno. D. Porcentaje de células madre cancerosas (CSC) con fenotipo CD44+CD24−/low en células de cáncer de mama tratadas con estrógeno o tamoxifeno.
A continuación se investigó la influencia de las hormonas sobre diferentes poblaciones de células madre. El tratamiento con estrógeno redujo de forma significativa el porcentaje de células madre en la mama sana, mientras que tamoxifeno ejercía el efecto contrario, y estos efectos se observaron con varios fenotipos diferentes, incluyendo formación de mamoesferas (fig. 2B) y porcentaje de células DP (EMA+, CALLA+) (fig. 2C). Igualmente, en las células de cáncer de mama aisladas de tumores primarios, el estrógeno reducía de forma significativa el porcentaje de CSC, mientras que se observaba un enriquecimiento de la población de CSC en respuesta a tamoxifeno (fig. 2D). Estas observaciones indican que el estrógeno reduce la población de células madre sanas y cancerosas en la mama.
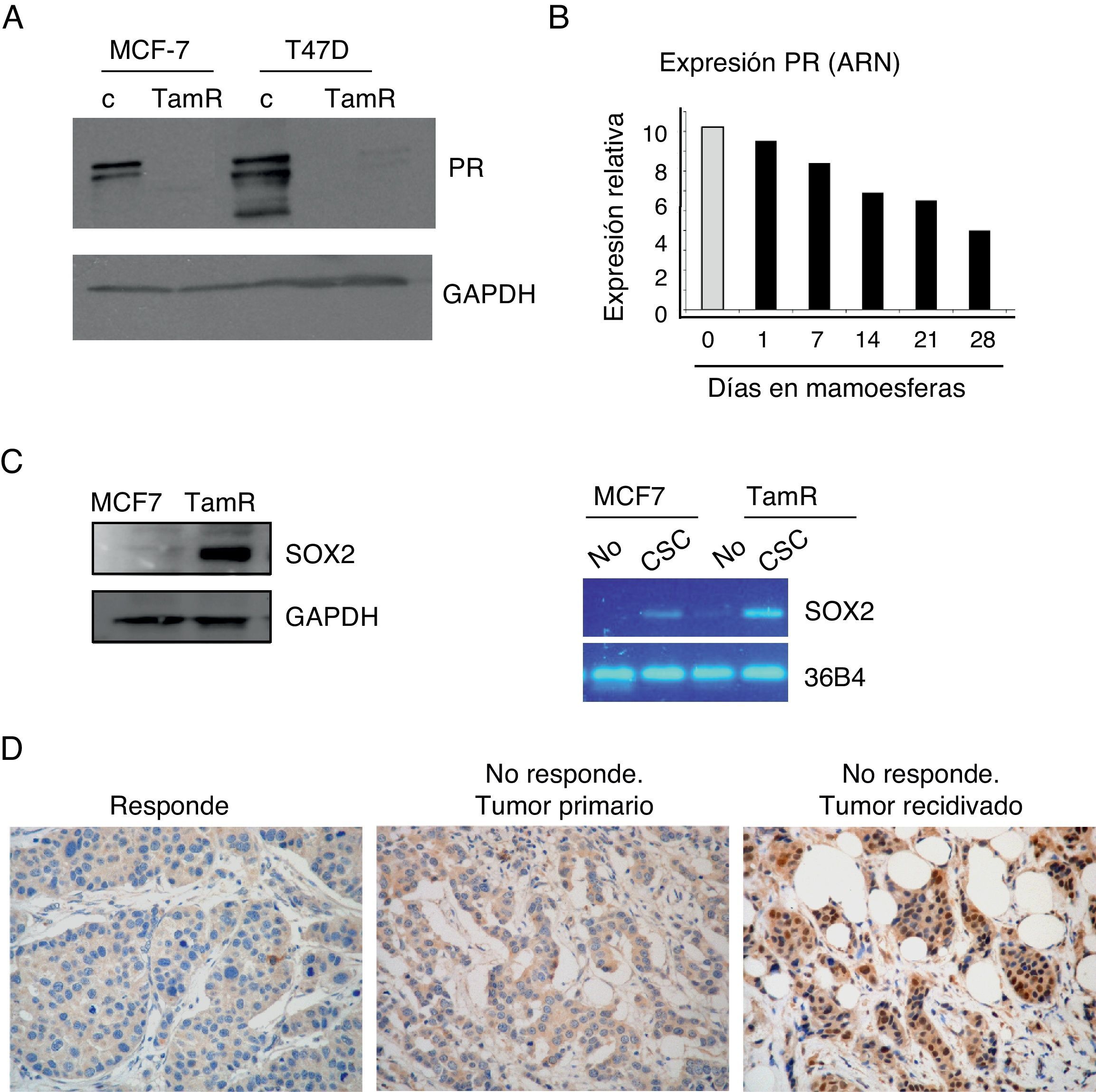
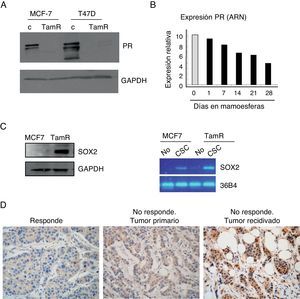
Los tumores resistentes a tamoxifeno contienen más células madre cancerosas, y expresan niveles más elevados de Sox2 y más reducidos de receptor de progesteronaLa observación de que la población de células madre se enriquece en respuesta a tamoxifeno daba lugar a la pregunta sobre sus consecuencias en el contexto del desarrollo de resistencia al mismo. Para examinar el papel de las CSC en este proceso se empleó un modelo de resistencia a tamoxifeno desarrollado a partir de 2 líneas celulares de cáncer de mama, MCF-7 y T47D, que desarrollaron resistencia a tamoxifeno tras varios meses de exposición a la terapia5. Estas células expresan ER, pero el receptor es menos activo a nivel transcripcional, como se puede inferir por los niveles muy reducidos de expresión de uno de sus genes diana más empleado en la clínica, el PR (fig. 3A). De hecho, observamos que el cultivo de las células de cáncer MCF-7 en mamoesferas, es decir, en condiciones de enriquecimiento de CSC, es suficiente para reducir considerablemente los niveles de expresión de PR (fig. 3B).
Mayor contenido de CSC en células resistentes a tamoxifeno. A. Análisis por Western blot de los niveles de expresión del receptor de progesterona (PR) en células MCF-7 y T47D parentales (c) o resistentes a tamoxifeno (TamR). GAPDH es el control de carga. B. Niveles de expresión de PR a nivel de ARN en células adherentes (barra gris) o en mamoesferas durante varios días en cultivo (barras negras). C. Análisis de los niveles de Sox2 por Western blot (izquierda) o ARN (derecha) en células CSC con fenotipo CD44+CD24−/low o no stem. GAPDH y 36B4 se emplearon como controles en cada caso. D. Estudio por inmunohistoquímica de la expresión de Sox2 en muestras de cáncer de mama ER-positivo. Izquierda, ejemplo representativo de muestra de tumor que respondió al tratamiento hormonal («Responde»); centro, ejemplo de muestra del tumor primario de una paciente que no respondió a tamoxifeno («No responde. Tumor primario); derecha, ejemplo de muestra de la recidiva desarrollada después del fallo de la terapia hormonal («No responde. Tumor recidivado»).
Para examinar el contenido de CSC se analizaron los niveles de expresión de Sox2, un marcador de células madre, y se observó que las células resistentes a tamoxifeno expresan niveles más altos de Sox2 que las células de cáncer parentales. Además, cuando las CSC fueron separadas del resto de las células tumorales, se observó que Sox2 se expresa de forma claramente mayoritaria en las CSC con respecto al resto de las células (fig. 3C). Estos resultados alentaron el análisis retrospectivo de los niveles de Sox2 en muestras tisulares de 55 pacientes con cáncer de mama. Los niveles de Sox2 eran apenas detectables en los tumores de aquellas pacientes que respondieron al tratamiento con tamoxifeno (un ejemplo representativo lo observamos en la figura 3D, como «Responde»). Sin embargo, los tumores primarios de pacientes que, más tarde, desarrollaron resistencia a tamoxifeno ya presentaban niveles significativos de Sox2 (fig. 3D, «No responde. Tumor primario»). Además, las recidivas de estas pacientes presentaban niveles de Sox2 aún más elevados (fig. 3D, «No responde. Tumor recidiva»). Estas observaciones confirman que los tumores resistentes a tamoxifeno presentan un mayor contenido de CSC, niveles reducidos de PR y elevada expresión de Sox2, lo cual sugiere que Sox2 podría ser un marcador de resistencia a tamoxifeno.
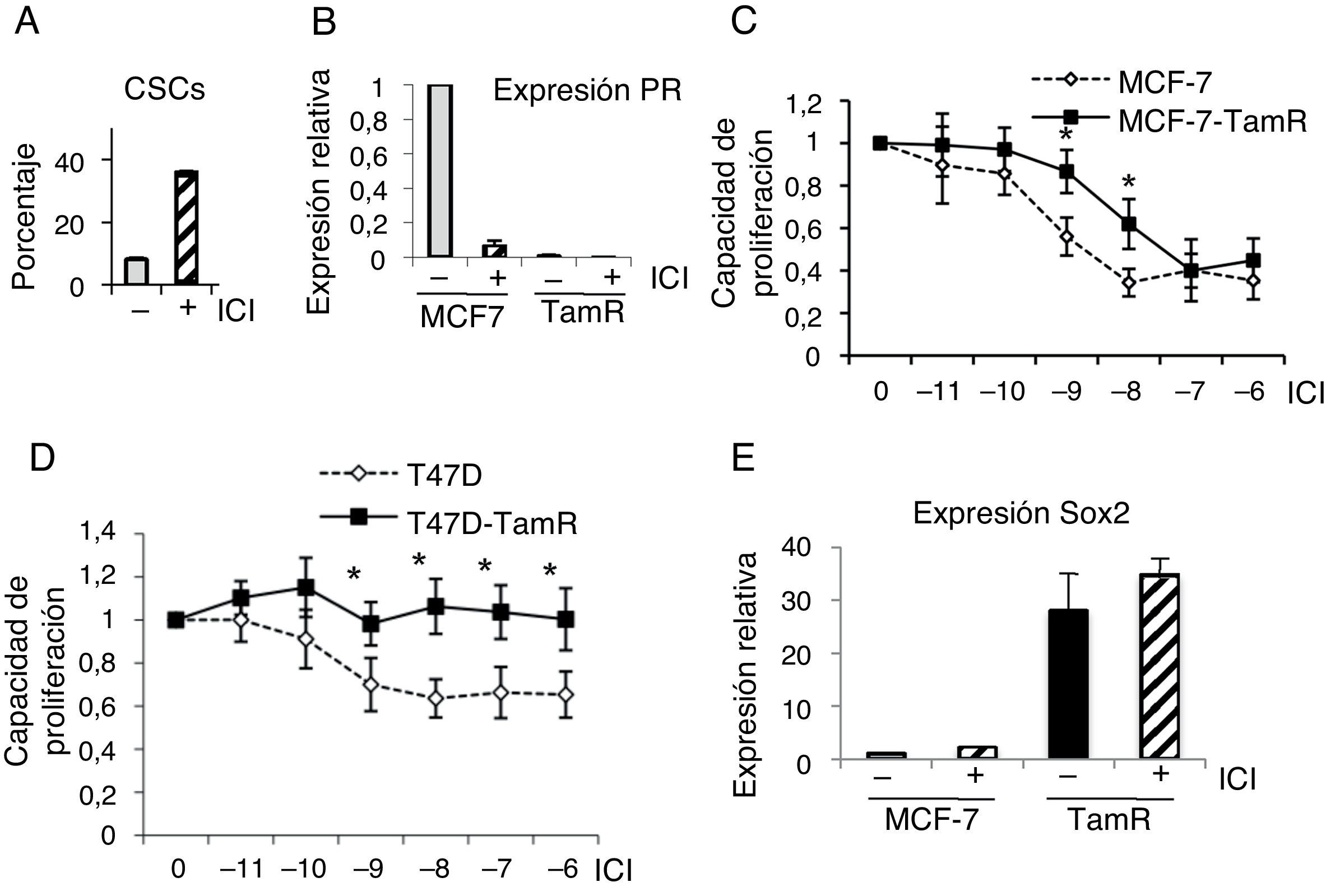
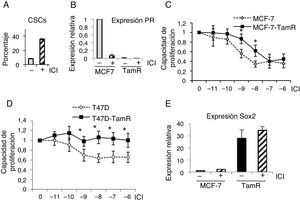
Las células madre cancerosas resistentes a tamoxifeno también lo son a fulvestrantSe ha planteado el uso de fulvestrant como tratamiento alternativo a tamoxifeno cuando este falla como terapia endocrina. En primer lugar, se trataron células de cáncer de mama T47D con fulvestrant y se examinó el porcentaje de CSC con fenotipo positivo para aldehído deshidrogenasa. Como resultado de este tratamiento el porcentaje de CSC se incrementó (fig. 4A). Por otra parte, el tratamiento con fulvestrant de células MCF-7 parentales y MCF-7 resistentes a tamoxifeno resultó en una fuerte reducción de los niveles de PR, indicando que el antagonista destruye el ER (fig. 4B y datos no mostrados). Para determinar la respuesta a fulvestrant de las células resistentes a tamoxifeno se realizaron ensayos de viabilidad celular en presencia de concentraciones crecientes de fulvestrant. Ambos modelos celulares de resistencia a tamoxifeno, bien derivados de las células MCF-7 (fig. 4C), bien de las T47D (fig. 4D), mostraron que las células resistentes a tamoxifeno también lo son a fulvestrant.
Células resistentes a tamoxifeno son resistentes a fulvestrant. A. Porcentaje de CSC (con fenotipo ALDH+) en células T47D, con fenotipo ALDH-positivas, en presencia o ausencia de fulvestrant (ICI). B. Análisis de expresión de PR (ARN) en células MCF-7 y resistentes a tamoxifeno (TamR) en presencia o ausencia de fulvestrant. C y D. Ensayo de proliferación de células MCF-7 y MCF-7-TamR (C) y células T47D y T47D-TamR (D) tratadas con concentraciones crecientes de fulvestrant (p<0,05). E. Niveles de expresión de Sox2 en células MCF-7 y resistentes a tamoxifeno en presencia o ausencia de fulvestrant.
Finalmente, los análisis del marcador Sox2 demostraron que los niveles de expresión de Sox2 se mantienen incrementados en las células resistentes a tamoxifeno tratadas con fulvestrant (fig. 4E), indicando que el contenido de CSC es muy alto en estas condiciones. Estos resultados evidencian que el tratamiento con fulvestrant mantiene el elevado porcentaje de CSC en las células resistentes a tamoxifeno, razón por la cual estos tumores son también resistentes a fulvestrant.
DiscusiónTamoxifeno ha sido empleado como tratamiento contra tumores ER-positivos durante muchos años. Sin embargo, la resistencia a tamoxifeno se desarrolla en un gran número de pacientes15,16. Con este trabajo hemos evaluado la respuesta de las células madre de la mama a los tratamientos hormonales y su implicación en la resistencia a tamoxifeno. Observamos que a pesar de que las células epiteliales de mama responden al tratamiento hormonal, las células madre pueden eludir sus efectos debido a la ausencia de ER. El estrógeno reduce la población de células madre, mientras que tamoxifeno la incrementa, lo que puede explicar el elevado contenido de Sox2, un marcador de CSC, y la notable reducción de los niveles de expresión de PR. Por otra parte, el tratamiento de las células resistentes a tamoxifeno con fulvestrant no elimina la población de CSC, lo que explica la resistencia a sus efectos antiproliferativos.
Tamoxifeno funciona como un antagonista de ER en la mama, uniéndose a dicho receptor y bloqueando su actividad transcripcional, mientras que fulvestrant degrada al receptor. Fulvestrant se puede emplear cuando el tratamiento con tamoxifeno, o con inhibidores de aromatasa, ha fallado. La posible utilidad de combinar fulvestrant con otros tratamientos está siendo investigada en ensayos clínicos, aunque algunos resultados preliminares son controvertidos, con frecuentes recidivas y pronósticos pobres17–19. Es posible que algunos de estos resultados poco prometedores puedan ser explicados por la observada capacidad de las células de resistir a los efectos de fulvestrant y el mantenimiento de la población de CSC, a pesar del tratamiento.
Se ha especulado que con los tratamientos anticancerosos actuales, una subpoblación de células, las CSC o células iniciadoras del tumor, pueden reiniciar el crecimiento de este después de la terapia en un considerable número de pacientes. Nuestros resultados coinciden con las observaciones obtenidas en varios laboratorios, que muestran que los tratamientos actuales eliminan la mayoría de la masa tumoral, resultando en un enriquecimiento del contenido de CSC, debido al hecho de que estas células pueden ignorar sus efectos y no verse afectadas por estos tratamientos1,20.
Las células madre en la mama sana son las responsables de la formación de nuevas células epiteliales dependiendo de las necesidades del organismo. Varios grupos de investigación, incluyendo el nuestro, han demostrado previamente que las células madre no expresan ER, o lo hacen a niveles muy bajos9,21. En el caso de las células tumorales tratadas con tamoxifeno, la ausencia de ER en las células madre facilita que las CSC se vuelvan insensibles a los efectos antiproliferativos de tamoxifeno (o de fulvestrant) y seguir creciendo, mientras las células más diferenciadas, que expresan ER, desaparecen, dando lugar a un tumor con mayor contenido de CSC y, por lo tanto, más agresivo5. En consonancia con estas observaciones, Sox2 también ha sido implicado en el mantenimiento de la población de CSC y en la resistencia a terapia en varios tipos de carcinomas, incluyendo glioblastoma22, cáncer de próstata23 y melanomas24. La elevada expresión de Sox2 en las muestras clínicas de pacientes con recidivas confirma observaciones previas, que mostraban tumores de mama pobremente diferenciados con una incrementada expresión de genes normalmente enriquecidos en células madre embrionarias25 y con una mayor proporción de CSC que los tumores bien diferenciados7, apoyando la noción de que el contenido de CSC refleja la malignidad del tumor6.
La correlación detectada entre los niveles de Sox2 y el desarrollo de resistencia a la terapia garantiza una sólida base para un estudio más detallado y amplio sobre el uso de Sox2 como marcador de resistencia a tamoxifeno, en los carcinomas de mama. La posible aplicación práctica de nuestros resultados es que la combinación de terapia endocrina para eliminar las células ER-positivas, junto con un inhibidor de Sox2 para atacar a las células madre, podría suponer una nueva estrategia terapéutica para prevenir la recurrencia en determinados grupos de pacientes con cáncer de mama.
En conclusión, el desarrollo de resistencia a tamoxifeno en cáncer de mama implica un incremento en el contenido de células madre cancerosas. El tratamiento con el antagonista fulvestrant no disminuye de forma significativa la población de células madre cancerosas. Sox2 podría ser un biomarcador de resistencia a tamoxifeno en el cáncer de mama.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores expresan su gratitud a todas las pacientes por su interés en cooperar con este estudio. M.M. Vivanco agradece especialmente el apoyo otorgado por varios proyectos: FIS del Instituto de Salud Carlos III (PI11/02251), del Departamento de Sanidad del Gobierno de la Comunidad Autónoma del País Vasco (PI2009-7) y de la Sociedad Española de Senología y Patología Mamaria.