El cáncer de mama en la mujer joven constituye cerca del 5-10% de los cánceres de mama. Recientes estudios han demostrado un aumento de la incidencia de cáncer de mama en la mujer joven pero es posible que estos resultados no sean aplicables a nuestro entorno. El objetivo del presente estudio fue analizar si en nuestro entorno ha habido un aumento real de la incidencia.
Material y métodosSe utilizaron los datos del registro poblacional de tumores de mama de la provincia de Castellón (Comunidad Valenciana, España), correspondientes al Hospital Universitario General de Castellón en el periodo 1995-2013. Se establecieron 3grupos: < 45 años, de 45 a 69 años y > 69 años. Se realizó otra división en menores y mayores de 40 años.
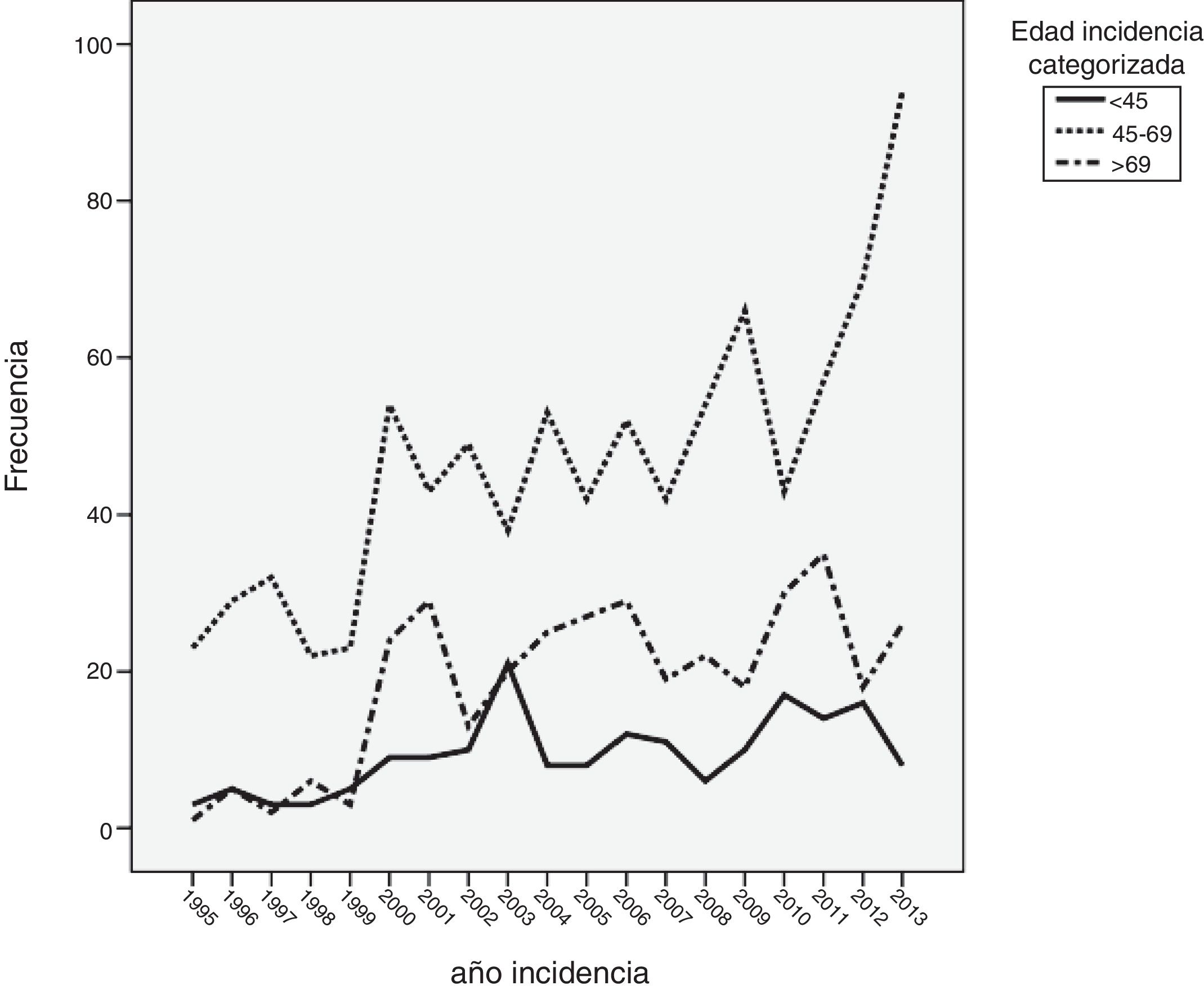
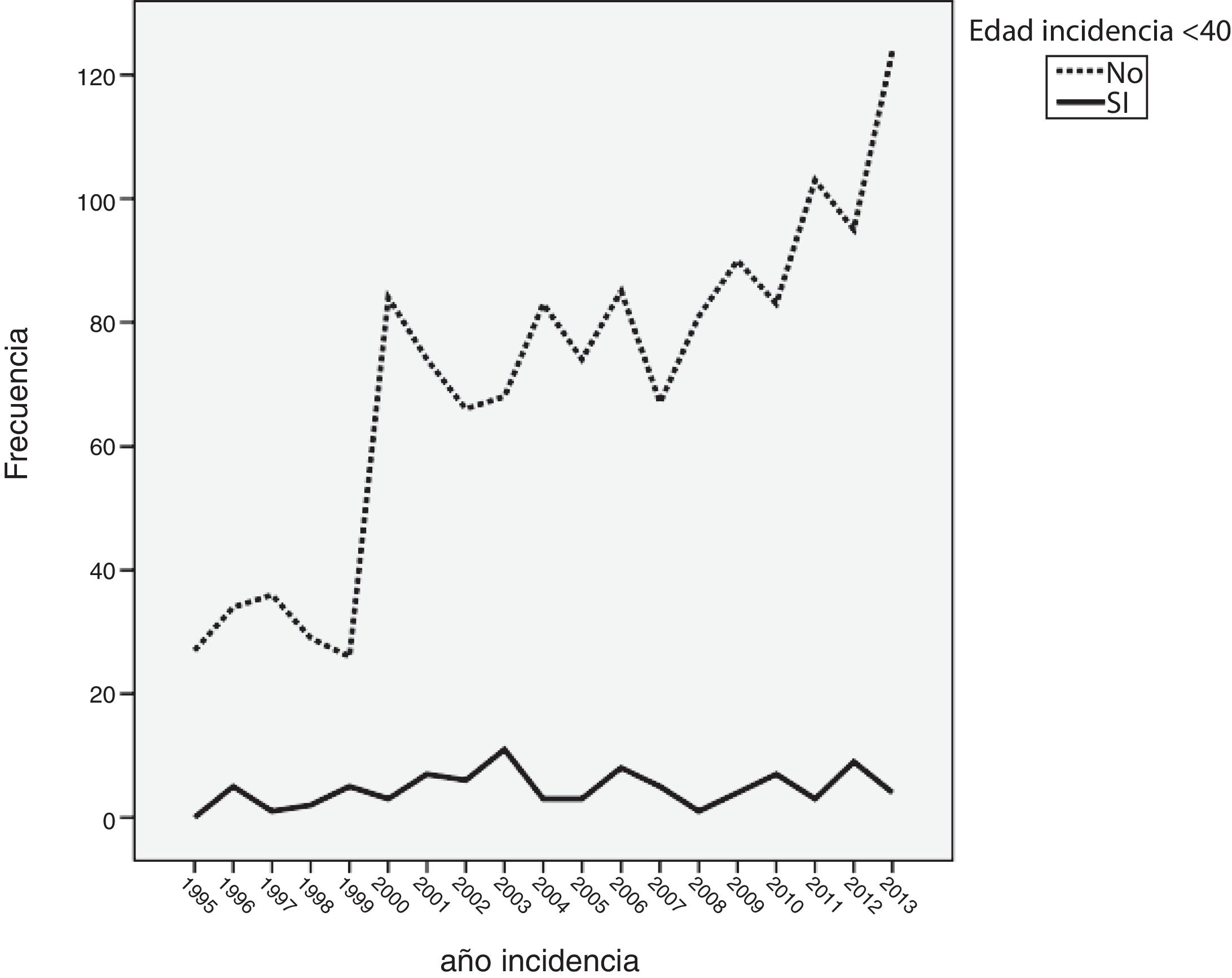
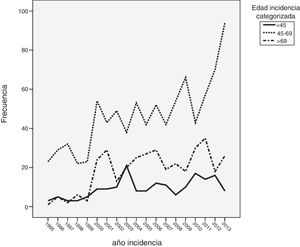
ResultadosDe los 1.416 casos analizados, 178 eran menores de 45 años (12,6%), 886 (62,6%) tenían entre 45 y 69 años, y 352 (24,9%) tenían > 69 años. Del total, 87 pacientes fueron menores de 40 años (6,1%). El número de casos diagnosticados entre los 45 y los 69 años se ha visto incrementado de manera progresiva. Por el contrario, el número de casos diagnosticados en pacientes menores de 45 años se mantuvo prácticamente constante durante todos los años de estudio. La incidencia en mujeres menores de 40 años se mantuvo casi constante durante los años de estudio.
ConclusiónNo se ha podido demostrar en nuestro entorno y en el periodo estudiado un aumento de incidencia en el número de casos de mujeres jóvenes, tanto cuando se establecieron los puntos de corte en 40 años o en 45 años.
Breast cancer in young women represents only 5-10% of breast cancers. Recent studies have demonstrated an increasing incidence of breast cancer in young women, but these results may not apply in our population. The objective of this study was to analyse whether there has been a real increase in the incidence of breast cancer in young women in our population.
Material and methodsData were retrieved from the Castellon Cancer Registry (C. Valenciana, Spain), a population-based cancer registry. Data from tumours diagnosed in Castellon General Hospital between 1995 and 2013 were used to conduct this study. We defined 3groups of patients: <45 years; 45-69 years and >69 years. Another analysis was performed, using a cutoff at 40 years.
ResultsOf the 1,416 patients analysed, 178 were aged <45 years (12.6%), 886 (62.6%) were aged between 45 and 69 years and 352 (24.9%) were > 69 years; 87 patients were <40 years old (6.1%). The number of incident breast cancer patients significantly increased in the group aged 45-69 years. However, the number of incident cases remained constant during the study period for both patients aged <45 years and those aged <40 years.
ConclusionWe did not find an increase in the incidence of breast cancer in young women in our population in the period analysed, or in women aged <45 years or <40 years old.
El cáncer de mama en la mujer joven es una situación relativamente infrecuente que constituye cerca del 5-10% de los cánceres de mama1,2, según las series y según los puntos de corte utilizados. A pesar de esta baja frecuencia relativa, las repercusiones bio-psico-sociales del cáncer de mama en este grupo de edad son tan importantes que resulta de interés estudiarlo de manera específica3,4. Por un lado, se ha demostrado en repetidas ocasiones que las mujeres jóvenes presentan un peor pronóstico global que las mujeres más mayores, tanto por una mayor tasa de recurrencia local, como de una peor supervivencia global5,6. Además, en la mayoría de los casos el diagnóstico se realiza por la aparición de síntomas, ya que en estas edades no se hace cribado poblacional y, por tanto, suelen ser estadios más avanzados. Por otro lado, en las mujeres jóvenes tienen especial interés la situación reproductiva, tanto si la paciente todavía no ha tenido hijos, como si está embarazada en el momento del diagnóstico o los hijos son todavía pequeños. Además, es importante considerar también en este grupo de edad la repercusión de la imagen corporal, las relaciones sexuales y las relaciones de pareja, así como la situación laboral en el momento del diagnóstico, condicionando todo ello un mayor riesgo de estrés y de alteraciones psicológicas y emocionales7-9.
En este contexto, recientes estudios realizados tanto en el ámbito europeo como estadounidense han demostrado un aumento de la incidencia de cáncer de mama en los grupos de edad más jóvenes que no se ha visto en otros grupos de edad10-15. No obstante, existen importantes diferencias étnico-geográficas en cuanto a la incidencia del cáncer de mama por edad que podrían hacer que estos resultados no fueran aplicables a nuestro entorno16-21.
El objetivo del presente estudio fue analizar si en nuestro entorno ha habido un aumento real de la incidencia del cáncer de mama en las mujeres jóvenes utilizando los datos y las variables de un registro poblacional de tumores.
Material y métodoPara el presente estudio se utilizaron los datos del registro poblacional de tumores de mama de la provincia de Castellón (Comunidad Valenciana, España). Este registro incluye a todos los pacientes diagnosticados de cáncer de mama en la provincia de Castellón desde el año 1995. En la provincia de Castellón hay 4 centros hospitalarios públicos y un centro privado. Para este estudio se utilizaron únicamente los datos correspondientes al Hospital Universitario General de Castellón de pacientes intervenidos quirúrgicamente desde el 1 de enero de 1995 hasta el 31 de diciembre del 2013.
Como criterios de inclusión se tomaron cánceres de mama en mujeres, excluyéndose los cánceres de mama en el varón. Se incluyeron únicamente los casos que habían sido intervenidos quirúrgicamente, desestimándose a las pacientes remitidas para tratamiento paliativo no quirúrgico.
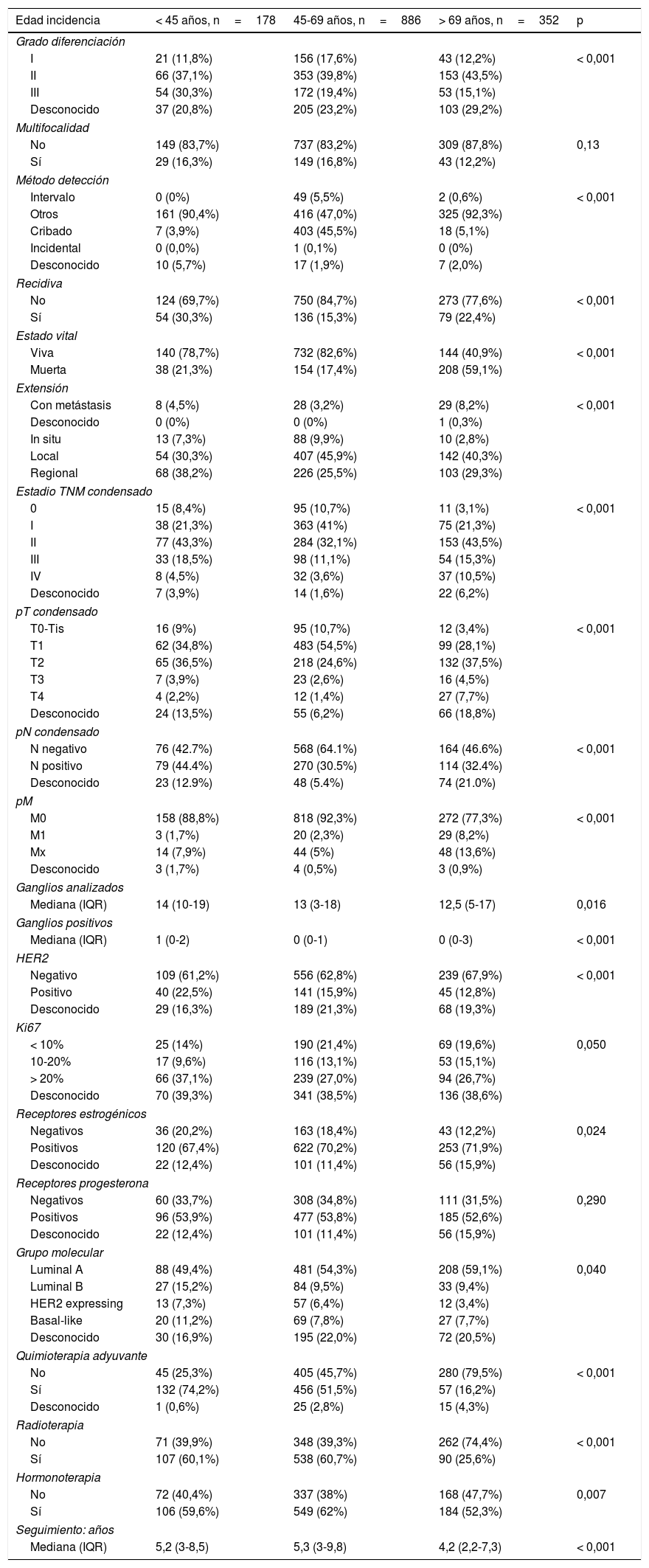
Las variables analizadas y disponibles en este registro fueron las que se muestran en la tabla 1.
Características de la población por grupos de edad
| Edad incidencia | < 45 años, n=178 | 45-69 años, n=886 | > 69 años, n=352 | p |
|---|---|---|---|---|
| Grado diferenciación | ||||
| I | 21 (11,8%) | 156 (17,6%) | 43 (12,2%) | < 0,001 |
| II | 66 (37,1%) | 353 (39,8%) | 153 (43,5%) | |
| III | 54 (30,3%) | 172 (19,4%) | 53 (15,1%) | |
| Desconocido | 37 (20,8%) | 205 (23,2%) | 103 (29,2%) | |
| Multifocalidad | ||||
| No | 149 (83,7%) | 737 (83,2%) | 309 (87,8%) | 0,13 |
| Sí | 29 (16,3%) | 149 (16,8%) | 43 (12,2%) | |
| Método detección | ||||
| Intervalo | 0 (0%) | 49 (5,5%) | 2 (0,6%) | < 0,001 |
| Otros | 161 (90,4%) | 416 (47,0%) | 325 (92,3%) | |
| Cribado | 7 (3,9%) | 403 (45,5%) | 18 (5,1%) | |
| Incidental | 0 (0,0%) | 1 (0,1%) | 0 (0%) | |
| Desconocido | 10 (5,7%) | 17 (1,9%) | 7 (2,0%) | |
| Recidiva | ||||
| No | 124 (69,7%) | 750 (84,7%) | 273 (77,6%) | < 0,001 |
| Sí | 54 (30,3%) | 136 (15,3%) | 79 (22,4%) | |
| Estado vital | ||||
| Viva | 140 (78,7%) | 732 (82,6%) | 144 (40,9%) | < 0,001 |
| Muerta | 38 (21,3%) | 154 (17,4%) | 208 (59,1%) | |
| Extensión | ||||
| Con metástasis | 8 (4,5%) | 28 (3,2%) | 29 (8,2%) | < 0,001 |
| Desconocido | 0 (0%) | 0 (0%) | 1 (0,3%) | |
| In situ | 13 (7,3%) | 88 (9,9%) | 10 (2,8%) | |
| Local | 54 (30,3%) | 407 (45,9%) | 142 (40,3%) | |
| Regional | 68 (38,2%) | 226 (25,5%) | 103 (29,3%) | |
| Estadio TNM condensado | ||||
| 0 | 15 (8,4%) | 95 (10,7%) | 11 (3,1%) | < 0,001 |
| I | 38 (21,3%) | 363 (41%) | 75 (21,3%) | |
| II | 77 (43,3%) | 284 (32,1%) | 153 (43,5%) | |
| III | 33 (18,5%) | 98 (11,1%) | 54 (15,3%) | |
| IV | 8 (4,5%) | 32 (3,6%) | 37 (10,5%) | |
| Desconocido | 7 (3,9%) | 14 (1,6%) | 22 (6,2%) | |
| pT condensado | ||||
| T0-Tis | 16 (9%) | 95 (10,7%) | 12 (3,4%) | < 0,001 |
| T1 | 62 (34,8%) | 483 (54,5%) | 99 (28,1%) | |
| T2 | 65 (36,5%) | 218 (24,6%) | 132 (37,5%) | |
| T3 | 7 (3,9%) | 23 (2,6%) | 16 (4,5%) | |
| T4 | 4 (2,2%) | 12 (1,4%) | 27 (7,7%) | |
| Desconocido | 24 (13,5%) | 55 (6,2%) | 66 (18,8%) | |
| pN condensado | ||||
| N negativo | 76 (42.7%) | 568 (64.1%) | 164 (46.6%) | < 0,001 |
| N positivo | 79 (44.4%) | 270 (30.5%) | 114 (32.4%) | |
| Desconocido | 23 (12.9%) | 48 (5.4%) | 74 (21.0%) | |
| pM | ||||
| M0 | 158 (88,8%) | 818 (92,3%) | 272 (77,3%) | < 0,001 |
| M1 | 3 (1,7%) | 20 (2,3%) | 29 (8,2%) | |
| Mx | 14 (7,9%) | 44 (5%) | 48 (13,6%) | |
| Desconocido | 3 (1,7%) | 4 (0,5%) | 3 (0,9%) | |
| Ganglios analizados | ||||
| Mediana (IQR) | 14 (10-19) | 13 (3-18) | 12,5 (5-17) | 0,016 |
| Ganglios positivos | ||||
| Mediana (IQR) | 1 (0-2) | 0 (0-1) | 0 (0-3) | < 0,001 |
| HER2 | ||||
| Negativo | 109 (61,2%) | 556 (62,8%) | 239 (67,9%) | < 0,001 |
| Positivo | 40 (22,5%) | 141 (15,9%) | 45 (12,8%) | |
| Desconocido | 29 (16,3%) | 189 (21,3%) | 68 (19,3%) | |
| Ki67 | ||||
| < 10% | 25 (14%) | 190 (21,4%) | 69 (19,6%) | 0,050 |
| 10-20% | 17 (9,6%) | 116 (13,1%) | 53 (15,1%) | |
| > 20% | 66 (37,1%) | 239 (27,0%) | 94 (26,7%) | |
| Desconocido | 70 (39,3%) | 341 (38,5%) | 136 (38,6%) | |
| Receptores estrogénicos | ||||
| Negativos | 36 (20,2%) | 163 (18,4%) | 43 (12,2%) | 0,024 |
| Positivos | 120 (67,4%) | 622 (70,2%) | 253 (71,9%) | |
| Desconocido | 22 (12,4%) | 101 (11,4%) | 56 (15,9%) | |
| Receptores progesterona | ||||
| Negativos | 60 (33,7%) | 308 (34,8%) | 111 (31,5%) | 0,290 |
| Positivos | 96 (53,9%) | 477 (53,8%) | 185 (52,6%) | |
| Desconocido | 22 (12,4%) | 101 (11,4%) | 56 (15,9%) | |
| Grupo molecular | ||||
| Luminal A | 88 (49,4%) | 481 (54,3%) | 208 (59,1%) | 0,040 |
| Luminal B | 27 (15,2%) | 84 (9,5%) | 33 (9,4%) | |
| HER2 expressing | 13 (7,3%) | 57 (6,4%) | 12 (3,4%) | |
| Basal-like | 20 (11,2%) | 69 (7,8%) | 27 (7,7%) | |
| Desconocido | 30 (16,9%) | 195 (22,0%) | 72 (20,5%) | |
| Quimioterapia adyuvante | ||||
| No | 45 (25,3%) | 405 (45,7%) | 280 (79,5%) | < 0,001 |
| Sí | 132 (74,2%) | 456 (51,5%) | 57 (16,2%) | |
| Desconocido | 1 (0,6%) | 25 (2,8%) | 15 (4,3%) | |
| Radioterapia | ||||
| No | 71 (39,9%) | 348 (39,3%) | 262 (74,4%) | < 0,001 |
| Sí | 107 (60,1%) | 538 (60,7%) | 90 (25,6%) | |
| Hormonoterapia | ||||
| No | 72 (40,4%) | 337 (38%) | 168 (47,7%) | 0,007 |
| Sí | 106 (59,6%) | 549 (62%) | 184 (52,3%) | |
| Seguimiento: años | ||||
| Mediana (IQR) | 5,2 (3-8,5) | 5,3 (3-9,8) | 4,2 (2,2-7,3) | < 0,001 |
Se establecieron 3grupos de edad según el esquema de cribado poblacional existente en nuestra comunidad, de modo que el cribado poblacional se inicia a los 45 años y finaliza a los 69 años. De este modo, se definieron 3grupos de edad: < 45 años, de 45 a 69 años y > 69 años. Asimismo, se realizó un estudio dividiendo a las pacientes en 2grupos, menores de 40 años y mayores de 40 años, por ser este el valor más repetido en la literatura para evaluar a las pacientes jóvenes. También se analizó el número de casos diagnosticados en cada década de edad.
Para la comparación estadística de variables cualitativas se utilizó la prueba de la chi cuadrado. Para variables cuantitativas se utilizaron la prueba de Mann-Whitney y la de Kruskal-Wallis.
Para investigar si las variaciones en el número de casos incidentes a lo largo de los años considerados en el análisis son casuales o no se efectuó un análisis de series temporales mediante la prueba de autorregresión. Dicha prueba controla las tendencias naturales, o autocorrelaciones, que con frecuencia pueden contener las series temporales (en este caso, variaciones de casos incidentes por aumento de población, o por aumento de la extensión poblacional del cribado, o por el potencial del propio registro de tumores, etc.) y que, por tanto, podrían actuar como factores de confusión.
Se establecieron como estadísticamente significativas diferencias en el valor de p < 0,05. Para el análisis estadístico se utilizó el programa informático IBM SPSS 15.
ResultadosEl número total de casos analizados fue de 1.416. Un total de 178 pacientes eran menores de 45 años (12,6%), 886 pacientes (62,6%) tenían entre 45 y 69 años, y 352 pacientes (24,9%) tenían > 69 años. Cuando se estableció el punto de corte en 40 años, el número de pacientes menores de 40 años fue de 87, lo que supone el 6,1% del total de casos. Las características de la población de estudio se describen en la tabla 1.
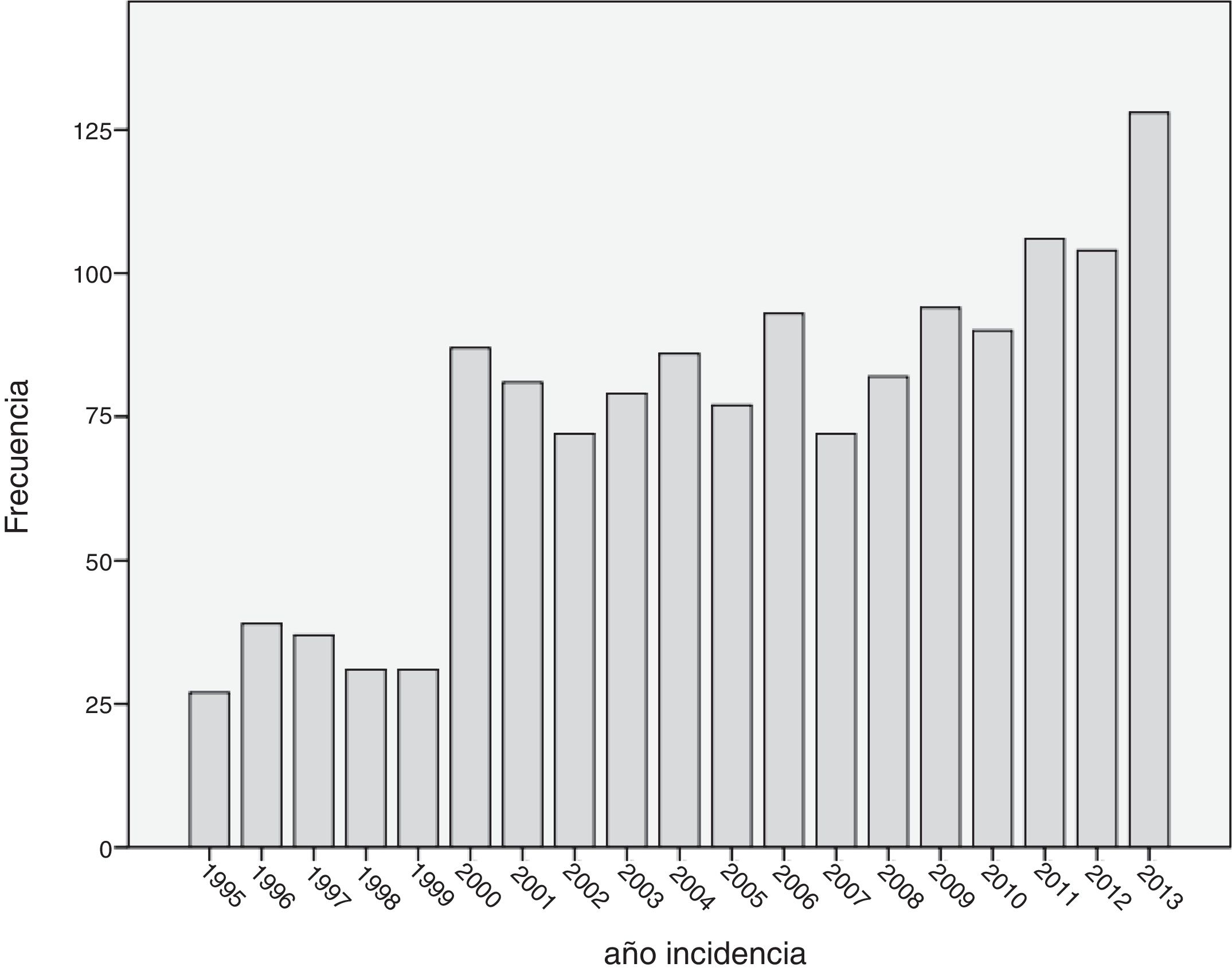
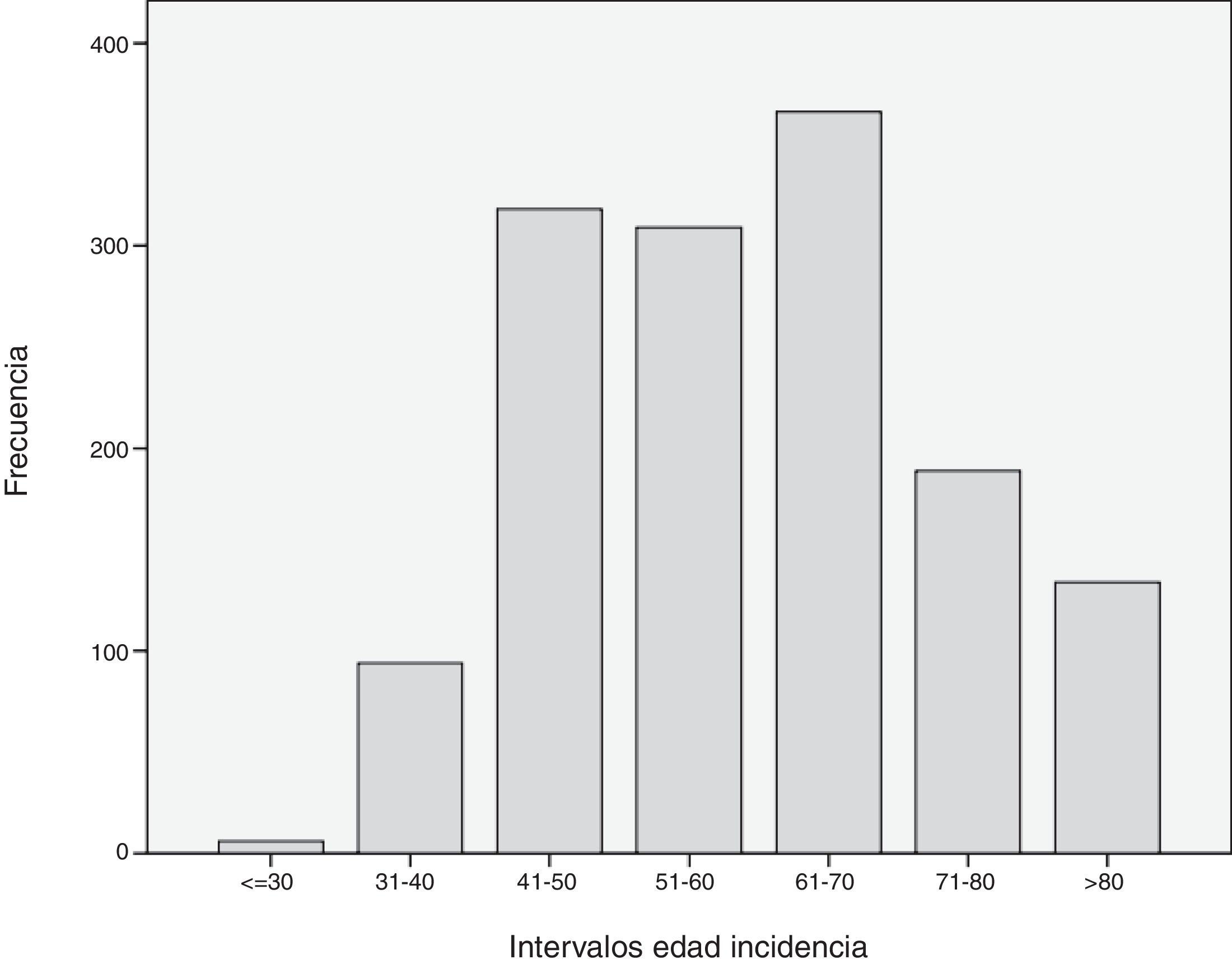
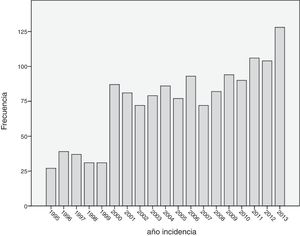
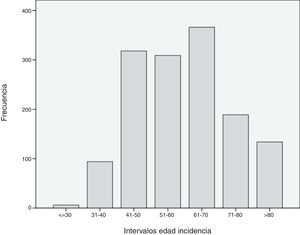
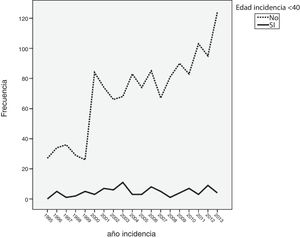
Cuando se analizó la distribución de edades de incidencia a lo largo del periodo de estudio, se vio que esta seguía una distribución normal, con una media ± desviación estándar de edad del diagnóstico de 60±14 años. Analizando descriptivamente el número de casos por año (fig. 1), teniendo en cuenta todas las edades, se vio un incremento sustancial de casos diagnosticados a partir del año 2000. Posteriormente, este número se mantuvo relativamente constante hasta el año 2010, donde se apreció un aumento progresivo del número de casos incidentes. Al analizar descriptivamente el número de casos por décadas de edad en el momento del diagnóstico, se obtuvieron los datos que se aprecian en la figura 2. Como se ve en esta gráfica, existió una gran diferencia entre los grupos, de forma que entre los 40 y los 70 años se diagnosticaron la mayor parte de los cánceres de mama. Estos datos no se corresponden exactamente con el periodo de cribado, que se inicia, como se ha dicho anteriormente, a los 45 años. Finalmente, cuando se realizó el análisis descriptivo de casos incidentes durante cada año de estudio, se observaron los datos que se muestran en la figura 3. Como se aprecia en esta gráfica, el número de casos diagnosticados entre los 45 y los 69 años, el periodo correspondiente al cribado poblacional se ha visto incrementado de manera progresiva. Por el contrario, el número de casos diagnosticados en pacientes menores de 45 años se mantuvo prácticamente constante durante todos los años de estudio. Cuando se establecieron los grupos de edad en mayores o menores de 40 años, estas diferencias se mantuvieron, de modo que las mujeres menores de 40 años presentaron una incidencia similar durante los años de estudio. Por el contrario, fue patente el aumento de casos mayores de 40 años (fig. 4).
En el análisis de ajuste por autorregresión, el grupo de edad < 45 años mostró una leve tendencia ascendente en su incidencia aunque no significativa (coeficiente = 0,048; p = 0,144). En el grupo de edad 45-69 años la tendencia también fue ligeramente ascendente pero estadísticamente significativa (coeficiente = 0,082; p < 0,001). En el grupo de edad > 69 años la tendencia de casos incidentes fue levemente descendente y significativa con el paso de los años (coeficiente = –0,075; p < 0,001). En cuanto a la agrupación de edad < 40 años, la tendencia ajustada fue ligeramente ascendente pero no significativa (coeficiente = 0,059; p = 0,254), mientras que para el grupo de 40 años o más fue mínimamente ascendente y tampoco estadísticamente significativa (coeficiente = 0,002; p = 0,167).
DiscusiónUna de las principales dificultades al hablar del cáncer de mama en la mujer joven radica, precisamente, en la definición de lo que se considera una mujer joven. De este modo, en la literatura científica son diferentes los criterios utilizados. Así, la mayoría de los grupos han definido un punto de corte arbitrario en 40 años22,23, aunque otros la han definido por debajo de los 35 años24, por debajo de los 50 años o según el estado menopáusico de las pacientes25. Conscientes de la dificultad de establecer un punto de corte concreto, en este trabajo se definieron 3grupos de trabajo en función de la edad en la que se realiza el cribado poblacional porque esta situación puede afectar directamente al número de casos diagnosticados. En nuestro entorno, la implantación del sistema de cribado poblacional se estableció en el año 1992 entre los 45 y los 65 años, ampliándose unos años más adelante a los 69 años. Por ello, los 3grupos de edad analizados fueron < 45 años, entre 45 y 69 años (dentro del programa de cribado) y > 69 años. No puede establecerse con el presente estudio la influencia directa y real de este programa de cribado en la incidencia de cáncer de mama en la mujer joven, pero es presumible que esta influencia se haya producido y consideramos que este estudio abre la puerta a futuras investigaciones al respecto.
Por otro lado, diferentes autores han valorado la influencia y las variaciones étnicas y geográficas del cáncer de mama en la mujer joven26. Así, por ejemplo, en el trabajo de revisión realizado por Assi et al.15, se encontraron importantes diferencias en cuanto a la incidencia del cáncer de mama en la mujer joven en distintos países. En Italia se comunicó una incidencia de mujeres menores de 40 años con cáncer de mama del 13,2%, el 12,8% en Francia, el 11% en Reino Unido, el 9,8% en Estados Unidos, el 8,8% en Japón o el 4,4% en China. Parece evidente que existe una diferencia geográfica importante en los diferentes países con diferentes sistemas sanitarios. Por otra parte, también se han demostrado diferencias étnicas en el caso del cáncer de mama en la mujer joven en cuanto a incidencia y pronóstico10,20.
Según nuestros resultados, del total de cánceres de mama diagnosticados durante este periodo, 87 correspondieron a mujeres menores de 40 años (6,1%) y 178 casos correspondieron a mujeres menores de 45 años (12,6%), lo cual es una de las incidencias más bajas de los países de nuestro entorno. Sin embargo, las características étnicas de las pacientes no pudieron ser evaluadas en nuestra serie porque las leyes españolas no permiten recoger estos datos en los registros sanitarios.
La influencia de otros potenciales factores que pudieran influir en nuestros resultados, como podrían ser los flujos migratorios desde o hacia otros países o comunidades, los cambios demográficos como el baby-boom de España en 1970, los cambios en el sistema de cribado en los diferentes periodos de estudio, el envejecimiento de la población, el aumento de la edad gestacional, la influencia de los factores exógenos de riesgo, entre otros muchos, se intentaron ajustar estadísticamente de un modo general pero no es seguro que una prueba estadística como la autorregresión tenga el potencial suficiente para efectuar un ajuste completo con las variables disponibles. De este modo, solo se percibió una leve evolución ascendente y significativa en cuanto a casos incidentes en el grupo de 45-69 años, pero no obstante creemos que estos factores de potencial confusión deberían seguir siendo tenidos en cuenta a la hora de interpretar nuestros resultados, así como para diseñar futuras investigaciones. En cualquier caso, en ningún grupo de edad puede identificarse un aumento notorio y claramente manifiesto de la incidencia del cáncer de mama durante los años analizados.
Una de las principales limitaciones del presente estudio es que se trata de un registro retrospectivo, con imposibilidad para la extrapolación de los resultados a otras comunidades con diferentes características. Sin embargo, justamente por este carácter retrospectivo, es una muestra de lo que ha ocurrido realmente durante estos años en nuestro medio, sin la influencia y el sesgo que podría condicionar un estudio prospectivo y controlado.
En conclusión, no se ha podido demostrar en nuestro entorno y en el periodo estudiado un aumento de incidencia en el número de casos de mujeres jóvenes, tanto cuando se establecieron los puntos de corte en 40 años o en 45 años.
Responsabilidades éticasConfidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.