El carcinoma mioepitelial de mama (o mioepitelioma maligno) es un tumor poco frecuente compuesto exclusivamente por células mioepiteliales malignas. Su diagnóstico supone un reto, y viene dado por los hallazgos anatomopatológicos apoyados por las técnicas de inmunohistoquímica. Presentamos un caso clínico y revisión bibliográfica.
Myoepithelial carcinoma of the breast (or malignant myoepithelioma) is a rare tumor composed exclusively of malignant myoepithelial cells. Its diagnosis is a challenge and is reached through pathological findings supported by immunohistochemical techniques. We present a case report and a review of the literature.
Las células mioepiteliales tienen características estructurales duales de células epiteliales y de músculo liso1; y en la mama están presentes formando una capa intermedia entre la membrana basal y el epitelio ductal o lobulillar, desempeñando un papel fundamental en el desarrollo y la fisiología de la glándula mamaria.
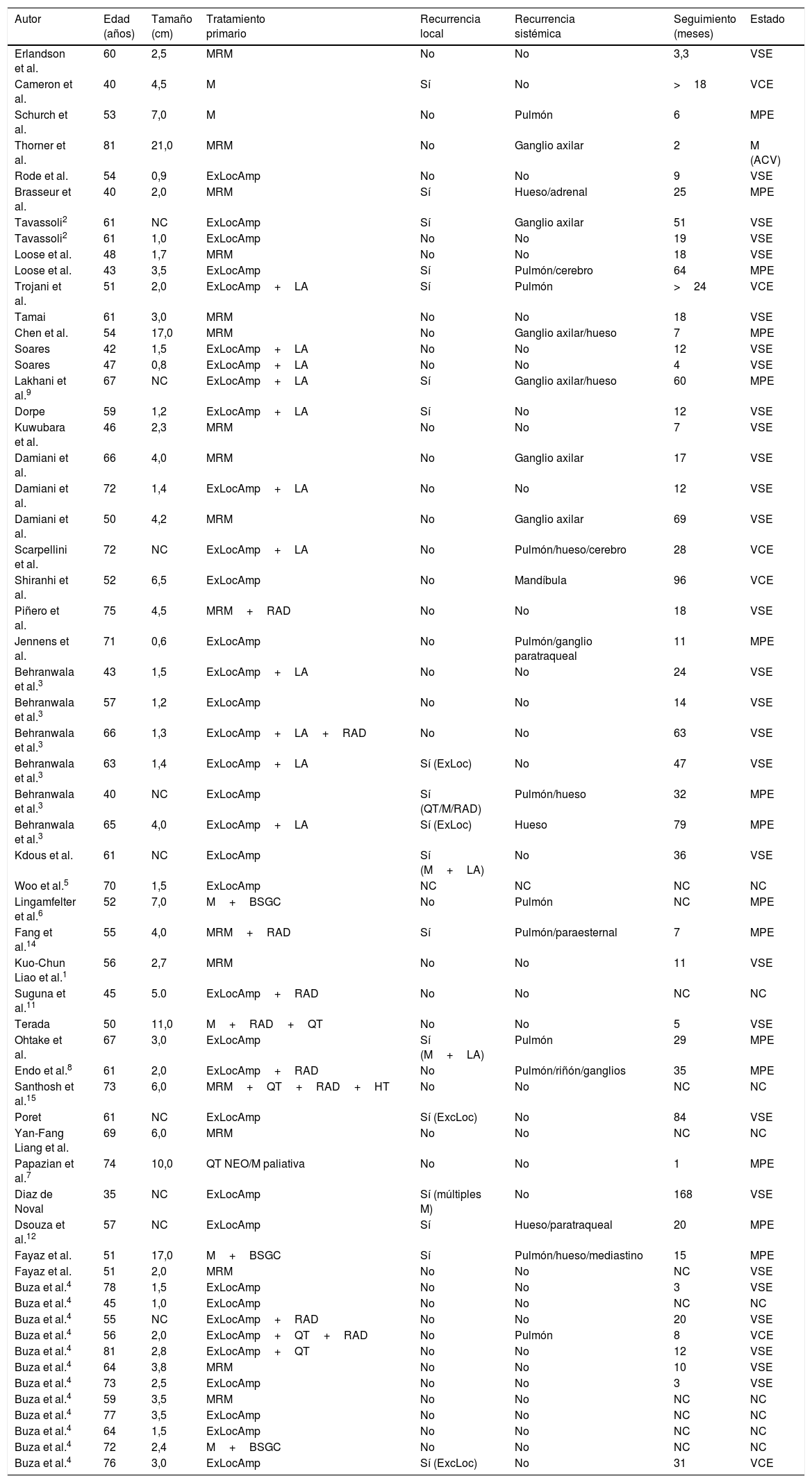
El carcinoma mioepitelial de mama es un carcinoma extremadamente raro, compuesto puramente por células mioepiteliales2, del que hay descritos unos 60 casos en la literatura indexada (tabla 1).
Resultados clínicos de pacientes con mioepitelioma maligno de mama en estudios previos
| Autor | Edad (años) | Tamaño (cm) | Tratamiento primario | Recurrencia local | Recurrencia sistémica | Seguimiento (meses) | Estado |
|---|---|---|---|---|---|---|---|
| Erlandson et al. | 60 | 2,5 | MRM | No | No | 3,3 | VSE |
| Cameron et al. | 40 | 4,5 | M | Sí | No | >18 | VCE |
| Schurch et al. | 53 | 7,0 | M | No | Pulmón | 6 | MPE |
| Thorner et al. | 81 | 21,0 | MRM | No | Ganglio axilar | 2 | M (ACV) |
| Rode et al. | 54 | 0,9 | ExLocAmp | No | No | 9 | VSE |
| Brasseur et al. | 40 | 2,0 | MRM | Sí | Hueso/adrenal | 25 | MPE |
| Tavassoli2 | 61 | NC | ExLocAmp | Sí | Ganglio axilar | 51 | VSE |
| Tavassoli2 | 61 | 1,0 | ExLocAmp | No | No | 19 | VSE |
| Loose et al. | 48 | 1,7 | MRM | No | No | 18 | VSE |
| Loose et al. | 43 | 3,5 | ExLocAmp | Sí | Pulmón/cerebro | 64 | MPE |
| Trojani et al. | 51 | 2,0 | ExLocAmp+LA | Sí | Pulmón | >24 | VCE |
| Tamai | 61 | 3,0 | MRM | No | No | 18 | VSE |
| Chen et al. | 54 | 17,0 | MRM | No | Ganglio axilar/hueso | 7 | MPE |
| Soares | 42 | 1,5 | ExLocAmp+LA | No | No | 12 | VSE |
| Soares | 47 | 0,8 | ExLocAmp+LA | No | No | 4 | VSE |
| Lakhani et al.9 | 67 | NC | ExLocAmp+LA | Sí | Ganglio axilar/hueso | 60 | MPE |
| Dorpe | 59 | 1,2 | ExLocAmp+LA | Sí | No | 12 | VSE |
| Kuwubara et al. | 46 | 2,3 | MRM | No | No | 7 | VSE |
| Damiani et al. | 66 | 4,0 | MRM | No | Ganglio axilar | 17 | VSE |
| Damiani et al. | 72 | 1,4 | ExLocAmp+LA | No | No | 12 | VSE |
| Damiani et al. | 50 | 4,2 | MRM | No | Ganglio axilar | 69 | VSE |
| Scarpellini et al. | 72 | NC | ExLocAmp+LA | No | Pulmón/hueso/cerebro | 28 | VCE |
| Shiranhi et al. | 52 | 6,5 | ExLocAmp | No | Mandíbula | 96 | VCE |
| Piñero et al. | 75 | 4,5 | MRM+RAD | No | No | 18 | VSE |
| Jennens et al. | 71 | 0,6 | ExLocAmp | No | Pulmón/ganglio paratraqueal | 11 | MPE |
| Behranwala et al.3 | 43 | 1,5 | ExLocAmp+LA | No | No | 24 | VSE |
| Behranwala et al.3 | 57 | 1,2 | ExLocAmp | No | No | 14 | VSE |
| Behranwala et al.3 | 66 | 1,3 | ExLocAmp+LA+RAD | No | No | 63 | VSE |
| Behranwala et al.3 | 63 | 1,4 | ExLocAmp+LA | Sí (ExLoc) | No | 47 | VSE |
| Behranwala et al.3 | 40 | NC | ExLocAmp | Sí (QT/M/RAD) | Pulmón/hueso | 32 | MPE |
| Behranwala et al.3 | 65 | 4,0 | ExLocAmp+LA | Sí (ExLoc) | Hueso | 79 | MPE |
| Kdous et al. | 61 | NC | ExLocAmp | Sí (M+LA) | No | 36 | VSE |
| Woo et al.5 | 70 | 1,5 | ExLocAmp | NC | NC | NC | NC |
| Lingamfelter et al.6 | 52 | 7,0 | M+BSGC | No | Pulmón | NC | MPE |
| Fang et al.14 | 55 | 4,0 | MRM+RAD | Sí | Pulmón/paraesternal | 7 | MPE |
| Kuo-Chun Liao et al.1 | 56 | 2,7 | MRM | No | No | 11 | VSE |
| Suguna et al.11 | 45 | 5.0 | ExLocAmp+RAD | No | No | NC | NC |
| Terada | 50 | 11,0 | M+RAD+QT | No | No | 5 | VSE |
| Ohtake et al. | 67 | 3,0 | ExLocAmp | Sí (M+LA) | Pulmón | 29 | MPE |
| Endo et al.8 | 61 | 2,0 | ExLocAmp+RAD | No | Pulmón/riñón/ganglios | 35 | MPE |
| Santhosh et al.15 | 73 | 6,0 | MRM+QT+RAD+HT | No | No | NC | NC |
| Poret | 61 | NC | ExLocAmp | Sí (ExcLoc) | No | 84 | VSE |
| Yan-Fang Liang et al. | 69 | 6,0 | MRM | No | No | NC | NC |
| Papazian et al.7 | 74 | 10,0 | QT NEO/M paliativa | No | No | 1 | MPE |
| Diaz de Noval | 35 | NC | ExLocAmp | Sí (múltiples M) | No | 168 | VSE |
| Dsouza et al.12 | 57 | NC | ExLocAmp | Sí | Hueso/paratraqueal | 20 | MPE |
| Fayaz et al. | 51 | 17,0 | M+BSGC | Sí | Pulmón/hueso/mediastino | 15 | MPE |
| Fayaz et al. | 51 | 2,0 | MRM | No | No | NC | VSE |
| Buza et al.4 | 78 | 1,5 | ExLocAmp | No | No | 3 | VSE |
| Buza et al.4 | 45 | 1,0 | ExLocAmp | No | No | NC | NC |
| Buza et al.4 | 55 | NC | ExLocAmp+RAD | No | No | 20 | VSE |
| Buza et al.4 | 56 | 2,0 | ExLocAmp+QT+RAD | No | Pulmón | 8 | VCE |
| Buza et al.4 | 81 | 2,8 | ExLocAmp+QT | No | No | 12 | VSE |
| Buza et al.4 | 64 | 3,8 | MRM | No | No | 10 | VSE |
| Buza et al.4 | 73 | 2,5 | ExLocAmp | No | No | 3 | VSE |
| Buza et al.4 | 59 | 3,5 | MRM | No | No | NC | NC |
| Buza et al.4 | 77 | 3,5 | ExLocAmp | No | No | NC | NC |
| Buza et al.4 | 64 | 1,5 | ExLocAmp | No | No | NC | NC |
| Buza et al.4 | 72 | 2,4 | M+BSGC | No | No | NC | NC |
| Buza et al.4 | 76 | 3,0 | ExLocAmp | Sí (ExcLoc) | No | 31 | VCE |
BSGC: biopsia selectiva de ganglio centinela; ExLocAmp: excisión local amplia; LA: linfadenectomía axilar; M: mastectomía; MPE: muerte por enfermedad; MRM: mastectomía radical modificada; NC: no consta; QT: quimioterapia; RAD: radioterapia; VCE: viva con enfermedad; VSE: viva sin enfermedad.
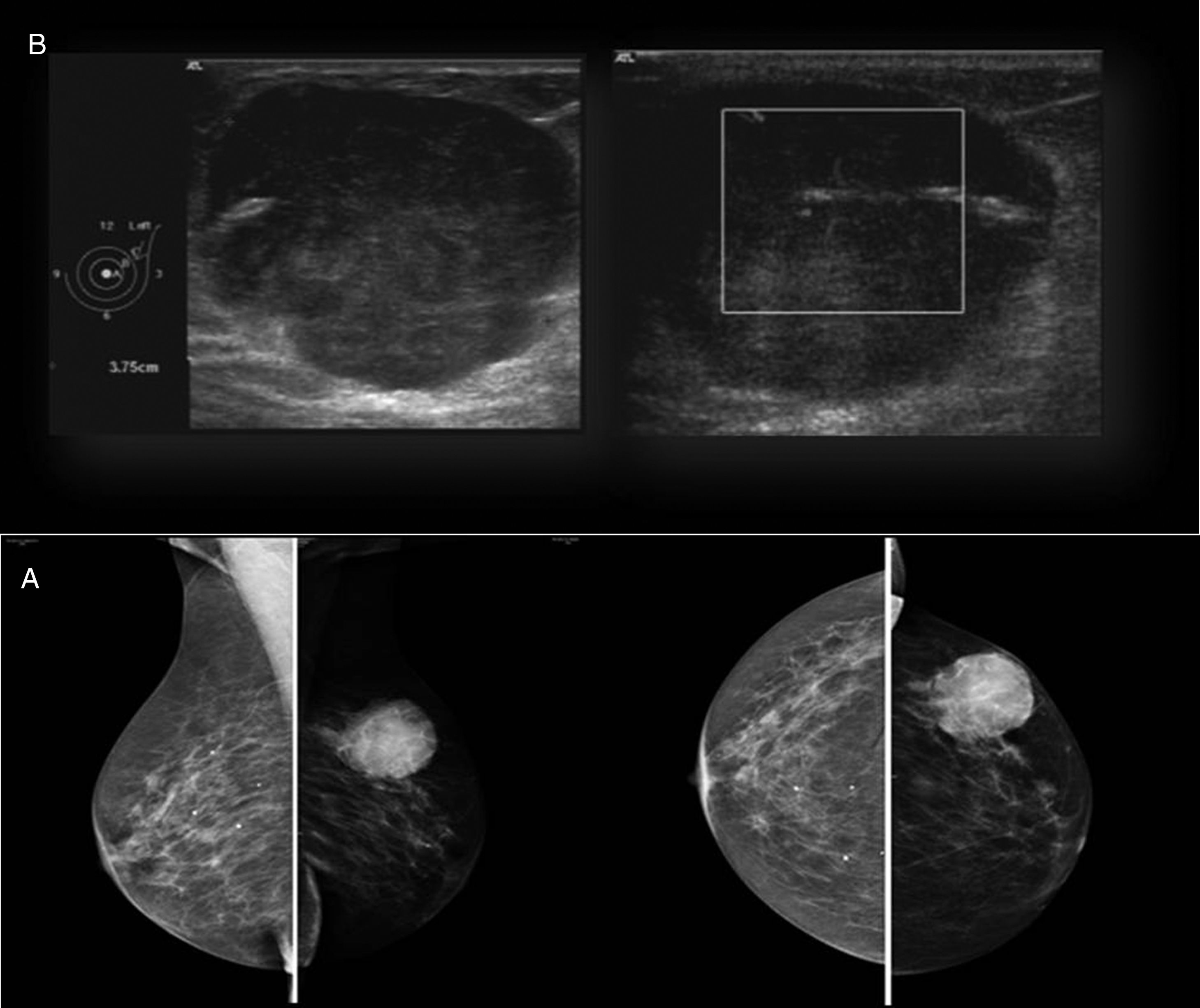
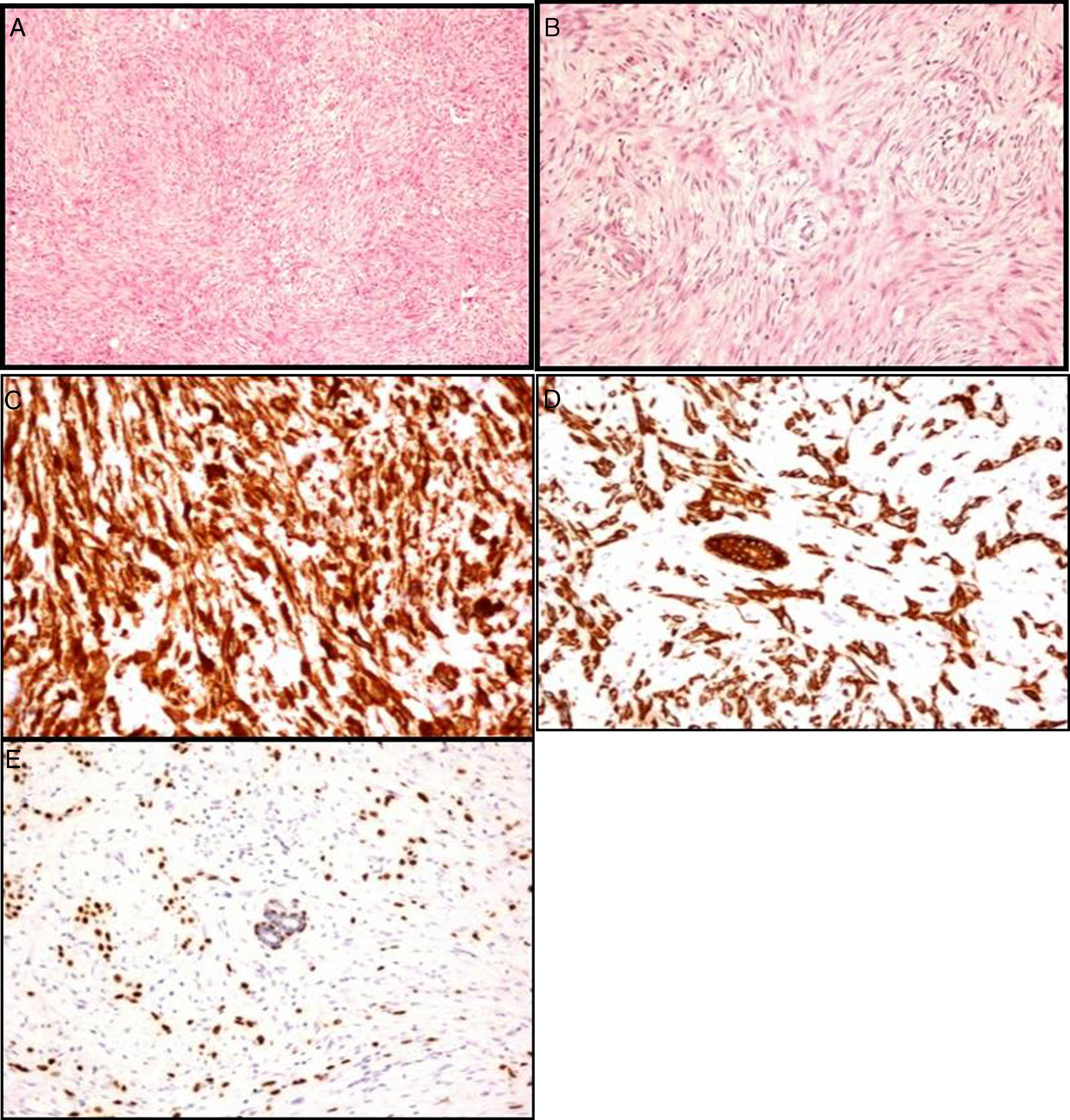
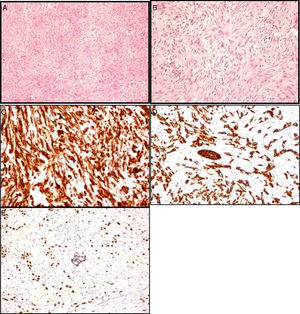
Paciente mujer de 86 años, pluripatológica, que consulta al presentar una lesión nodular mamaria de nueva aparición y rápido crecimiento. En la exploración física se palpa en el cuadrante supero-externo de la mama izquierda (CSE-MI) un nódulo duro, regular, bien delimitado, adherido a la piel, de 60mm de diámetro y sin adenopatías patológicas asociadas. El estudio radiológico mamario informó de la presencia de una lesión nodular parcialmente bien definida de 40mm, BI-RADS IV (figs. 1A y B). El estudio citológico tras punción aspiración con aguja fina (PAAF) informa de frotis con abundantes células ovoides con ligeras irregularidades en la membrana y en la cromatina, algunas de ellas con nucléolos llamativos, las cuales se disponen de forma aislada o en grupos poco cohesivos. Se identificaron igualmente escasos grupos estromales, alguno hipercelular, y en las preparaciones teñidas con Diff-Quick® se observa ocasional acúmulo de material metacromático de aparición fibrilar. En el estudio histológico tras biopsia con aguja gruesa (BAG) se observó una proliferación celular sin atipia ni actividad mitótica significativa, inmunofenotípicamente compatible con estirpe mioepitelial. Se practicó tumorectomía amplia, con exéresis de huso de piel, y se difirió el estudio anatomopatológico intraoperatorio; el cual confirmó una proliferación celular en la que se entremezclan elementos fusiformes de núcleo ovoide con otras células de núcleos más redondeados y citoplasma poligonal o estrellado, con atipia nuclear leve-moderada, siendo los bordes de la lesión de tipo infiltrativo, observándose atrapamiento de los conductos mamarios normales. El estudio inmunohistoquímico fue positivo para vimentina, citoqueratina (AE1-AE3), citoqueratina 5, 6, S-100, p63 y focal para actina; siendo negativo para EMA, citoqueratina 7, desmina y CD34; con Ki-67 positivo >20%, receptores de estrógenos, progesterona y Her-2/neu negativos (figs. 2A-E).
Estudio radiológico mamario: A) Mamografía (proyección mediolateral oblicua y craneocaudal): lesión nodular densa de 40mm en CSE-MI parcialmente definida. BI-RADS IV. B) Ecografía mama-axila: nódulo sólido de 38mm de diámetro, con vaso prominente con flujo en región central. Axila sin hallazgos patológicos. BI-RADS IV.
Estudio histológico-inmunohistoquímico: A) Proliferación de células fusiformes. B) Patrón infiltrativo en el tejido circundante. C) Vimentina (marcador estromal). D) Tinción de citoqueratinas AE1-AE3 (marcador epitelial). E) Tinción de los núcleos de las células mioepiteliales con p63.
Con el juicio diagnóstico de carcinoma mioepitelial de mama con bordes quirúrgicos libres de lesión, se comentó en el Comité de Tumores; y dada la edad de la paciente y su comorbilidad, se decidió realizar seguimiento clínico. Ocho meses después, la paciente presentó nueva lesión nodular de 23×17mm en área subcicatricial sin adenopatías regionales patológicas, confirmándose recidiva local; por lo que, tras descartar afectación sistémica, se practicó mastectomía simple, cuyos márgenes quirúrgicos quedaron libres de afectación tumoral. No se practicó linfadenectomía axilar ante petición de la paciente. Tras 6 años y medio, permanece libre de enfermedad.
DiscusiónEn 1991, Tavassoli2 estableció el sistema de clasificación de las lesiones mioepiteliales de la mama en 3 grupos: mioepiteliosis, adenomioepitelioma y mioepitelioma maligno. La mioepiteliosis y el adenomioepitelioma presentan células mioepiteliales mezcladas con células epiteliales; mientras que el mioepitelioma maligno está constituido exclusivamente por proliferación de células malignas de características mioepiteliales.
El carcinoma mioepitelial es un tumor extremadamente raro, siendo pocas las series publicadas3,4, dado que suelen publicarse casos aislados (tabla 1). Su incidencia es mayor en la 5.ª década de la vida; y clínicamente se manifiesta como lesiones nodulares no dolorosas de crecimiento rápido y predominio en los cuadrantes externos de la mama, que tienen un comportamiento agresivo a nivel local con potencial recurrencia y metástasis. Los hallazgos mamográficos y ecográficos5 son de poca utilidad al dar imágenes nodulares no específicas. El diagnóstico es un reto, dado que muestra una histología heterogénea, siendo el patrón oro el estudio histopatológico apoyado de las técnicas de inmunohistoquímica4,6,7. Macroscópicamente se manifiesta como una tumoración sólida homogénea, blanco-amarillenta, bien delimitada y parcialmente encapsulada; y microscópicamente muestra un patrón de crecimiento expansivo, con atipia leve y ocasionales mitosis, zonas de necrosis tumoral e infiltración linfoide. Las células mioepiteliales tienen morfología fusiforme o poligonal, núcleos periféricos y denso citoplasma eosinófilo; y se disponen en túbulos formando nidos sólidos delimitados en lóbulos separados por tejido conectivo y adiposo. El estudio inmunohistoquímico para la identificación de células mioepiteliales y sus neoplasias relacionadas se dirigen contra queratinas y miofilamentos7–9; incluyendo la proteína S-1002, proteínas de la membrana basal, colágeno tipo iv y laminina, citoqueratinas de alto peso molecular, actinas del músculo liso, vimentina y el p6310, el cual es un marcador útil, dada su alta sensibilidad y especificidad para las células mioepiteliales; así como la negatividad a receptores hormonales9. Es importante distinguir el carcinoma mioepitelial de otras formas de lesiones mamarias compuestas de células fusiformes, principalmente el carcinoma sarcomatoide monofásico, fibromatosis y sarcoma de células fusiformes puro1,7. Otros diagnósticos diferenciales deben realizarse con neoplasias malignas con diferenciación de células mioepiteliales (carcinoma adenoide quístico, adenomioepitelioma maligno, carcinoma adenoescamoso de bajo grado o carcinoma de mama pobremente diferenciado rico en células mioepiteliales). El tratamiento principal para el carcinoma mioepitelial es la excisión quirúrgica amplia y linfadenectomía axilar, seguido de radioterapia adyuvante1,8, no habiéndose estudiado el papel del ganglio centinela en este tipo de tumor. La cirugía conservadora es posible en pacientes seleccionadas, pero se asocia con mayor riesgo de recurrencia local si no se asocia radioterapia adyuvante11. El papel de la quimioterapia y la elección del agente no está bien definido12,13, aunque se considera debe incluir análogos de platino y paclitaxel12; y el de la hormonoterapia es desconocido. En cuanto al pronóstico, el 50% de los casos de mioepiteliomas malignos comunicados han presentado un curso agresivo14,15; por lo que se recomienda un estricto seguimiento dado el riesgo de recurrencia.
En conclusión, el carcinoma mioepitelial de mama es un tumor poco frecuente, que debe ser considerado en el diagnóstico diferencial de una lesión mamaria sólida. Aspectos múltiples que incluyen la edad, la comorbilidad y la autonomía del paciente deben tenerse en cuenta al elaborar un plan de tratamiento.
Responsabilidades éticasConfidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.