A pesar de los avances conseguidos en el tratamiento del cáncer de mama, todavía sigue siendo una causa importante de mortalidad en las mujeres. Por tanto, resulta necesario plantear nuevos enfoques de la fisiopatología de la enfermedad que contribuyan a realizar una mejor evaluación pronóstica, y a la mejora de las estrategias terapéuticas. Para ello, deberíamos considerar que el cáncer no es solo una transformación maligna de las células epiteliales y su progresión meramente autónoma; sino que, hoy en día, existen datos que apoyan el concepto del cáncer como un ecosistema basado en una sociología de diferentes tipos celulares, con sus interacciones complejas. Entre los diversos tipos de células que conforman el estroma tumoral, y que tienen un papel relevante en la progresión del cáncer de mama, se encuentran los fibroblastos asociados al cáncer, las células inflamatorias y las células endoteliales. Existen diferentes factores moleculares expresados por esas células que se asocian con el desarrollo de metástasis, tales como las metaloproteasas de matriz y sus inhibidores tisulares, citoquinas o receptores tipo toll. En base a la expresión de todos ellos, aquí proponemos 2 fenotipos de estroma del cáncer de mama con influencias marcadamente diferentes sobre el pronóstico de las pacientes. También analizamos los mecanismos involucrados en la interrelación tumor-estroma que pueden llevarnos a mejorar las estrategias terapéuticas en el cáncer de mama.
Despite advances in the treatment of breast cancer, it remains an important cause of mortality in women. Therefore, it is necessary to propose new approaches to the pathophysiology of the disease that could help to improve prognostic evaluation and therapeutic strategies. To do this, we should consider that cancer is not only a malignant transformation of the epithelial cells or their purely autonomous growth; nowadays, there are data that support the concept of cancer as a system based on a sociology of different cell types, with complex interactions. Among the various types of cells that make up the tumour stroma and which play an important role in the progression of breast cancer are cancer-associated fibroblasts, inflammatory cells and endothelial cells. Several molecular factors expressed by these cells are associated with the development of metastases, such as matrix metalloproteases and their tissue inhibitors, cytokines or toll-like receptors. Based on the expression of all of these factors, here we propose two types of stroma from breast cancer that display markedly different influences on patient prognosis. We also analyse mechanisms involved in the tumour-stroma interrrelationship that could help to improve therapeutic strategies in breast cancer.
El cáncer de mama es el tumor maligno más frecuente en las mujeres y una de las principales causas de muerte por cáncer, ya que en torno al 30% de las mujeres desarrollan metástasis a distancia tras el tratamiento de sus tumores aparentemente localizados1. Además, aunque los mecanismos relacionados con la progresión de esta neoplasia nunca fueron como hasta ahora tan bien conocidos, la realidad es que estamos aún lejos de curar a todas las pacientes2. Por otra parte, existen serios inconvenientes relacionados, tanto con la aplicación de las terapias convencionales como con las nuevas estrategias terapéuticas en el cáncer de mama, tales como efectos adversos, resistencia a los fármacos o toxicidad inmunológica. Por todo ello, necesitamos nuevos planteamientos conceptuales que nos permitan un mejor conocimiento fisiopatológico de la enfermedad en base al que realizar evaluaciones pronósticas individualizadamente más adecuadas y proponer nuevas alternativas que mejoren el éxito terapéutico. Para lograr esos objetivos, debemos abandonar el viejo dogma simplista del cáncer como una transformación maligna de las células epiteliales y la de su progresión meramente autónoma. Al contrario, hoy existen infinidad de datos que apoyan la idea del cáncer como un proceso complejo y un ecosistema integrado por una sociología celular y sus interacciones.
Tipos celulares del estroma tumoralEntre los diferentes tipos celulares que integran el estroma tumoral del cáncer de mama, se encuentran células residentes como los fibroblastos asociados al cáncer (FAC), células endoteliales y adipocitos, o provenientes del torrente sanguíneo, como las células inmuno-reguladoras3.
Los FAC, uno de los principales componentes del estroma tumoral, representan una población celular heterogénea que se diferencia genéticamente de los fibroblastos normales de los tejidos4–6, y que puede tener varios posibles orígenes. Si bien la mayoría de los FAC derivan de los fibroblastos residentes en el propio tejido, ellos también pueden derivar de las células madre mesenquimales, células epiteliales, adipocitos, células endoteliales o pericitos7. Los FAC pueden actuar propiciando la progresión tumoral mediante varios mecanismos, tales como ejerciendo fuerzas contráctiles que facilitan la invasión de las células cancerosas8, degradando y remodelando la matriz extracelular, activando la transición epitelial-mesenquimal, promoviendo la angiogénesis y una reprogramación metabólica hacia un fenotipo reverso de Warburg o alcanzando un rasgo de célula madre9. Los FAC promueven esas acciones mediante la secreción de un amplio espectro de factores de crecimiento y citoquinas10–13.
Las células inflamatorias que infiltran la masa tumoral, que incluyen una representación variable de leucocitos (linfocitos T y B, macrófagos, neutrófilos y células plasmáticas)14, han sido tradicionalmente consideradas como un mecanismo abortado de rechazo del tumor por parte del sistema inmune15. Sin embargo, hoy en día se asume que estas células, mediante la secreción de un repertorio de factores moleculares (citoquinas, factores de crecimiento o proteasas), pueden promover el crecimiento e invasión tumoral16,17.
Las células endoteliales son esenciales para el desarrollo de los vasos sanguíneos que suministran el oxígeno y los nutrientes a las células cancerosas. Pero también pueden regular el crecimiento tumoral mediante la secreción de factores moleculares que incrementan la agresividad biológica de las células cancerosas18.
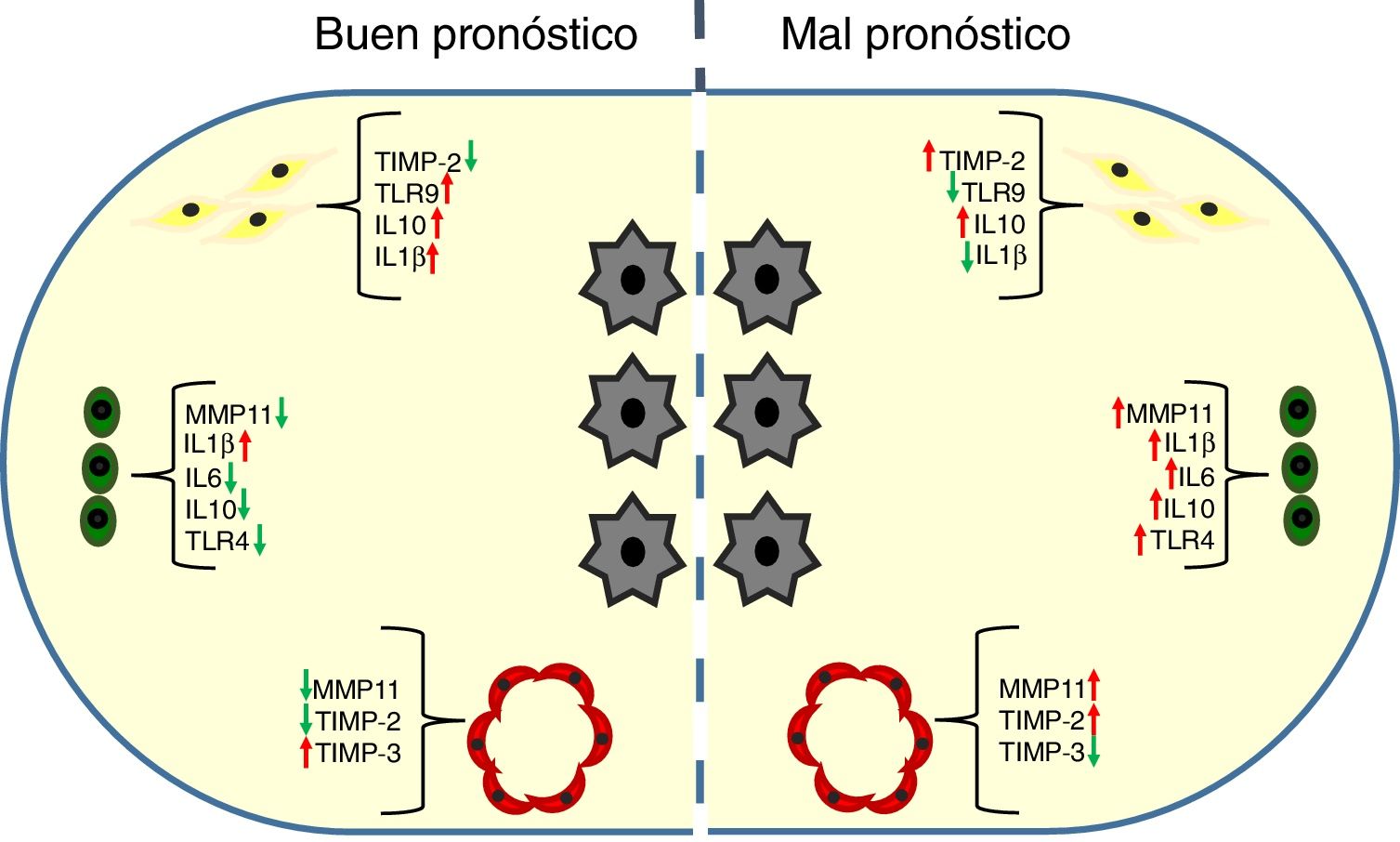
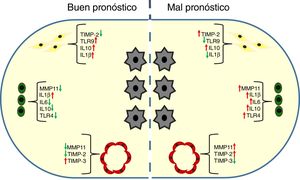
Factores moleculares relacionados con el fenotipo de las células del estroma tumoral y su implicación pronóstica en el cáncer de mamaDurante los últimos 10 años nuestro grupo ha contribuido a establecer una caracterización fenotípica y funcional de los componentes celulares principales del estroma tumoral del cáncer de mama. Entre los factores moleculares que pueden contribuir a esa caracterización, se encuentran las metaloproteasas de la matriz (MMP) y sus inhibidores tisulares (TIMP), citoquinas o receptores tipo toll (TLR). Basándose en la consideración de la expresión de esos factores por los diferentes tipos celulares, proponemos 2 tipos de estroma tumoral asociados al cáncer de mama (fig. 1).
Las MMP, aparte de desempeñar un papel relevante en la degradación de la matriz extracelular y membrana basal, facilitando así la invasión tumoral y las metástasis, desempeñan otros papeles básicos en la progresión tumoral. Esos incluyen la promoción de la angiogénesis, la activación de la proliferación o la inhibición de la apoptosis. Todos esos efectos los consiguen las MMP mediante su acción enzimática sobre receptores de superficie celular, factores de crecimiento, citoquinas/quimiocinas y factores pro-apoptóticos19,20. Además, Los TIMP son proteínas multifactoriales que, aparte de su efecto inhibitorio de las MMP, pueden tener efectos pro-tumorales estimulando la proliferación celular e inhibiendo la apoptosis21,22.
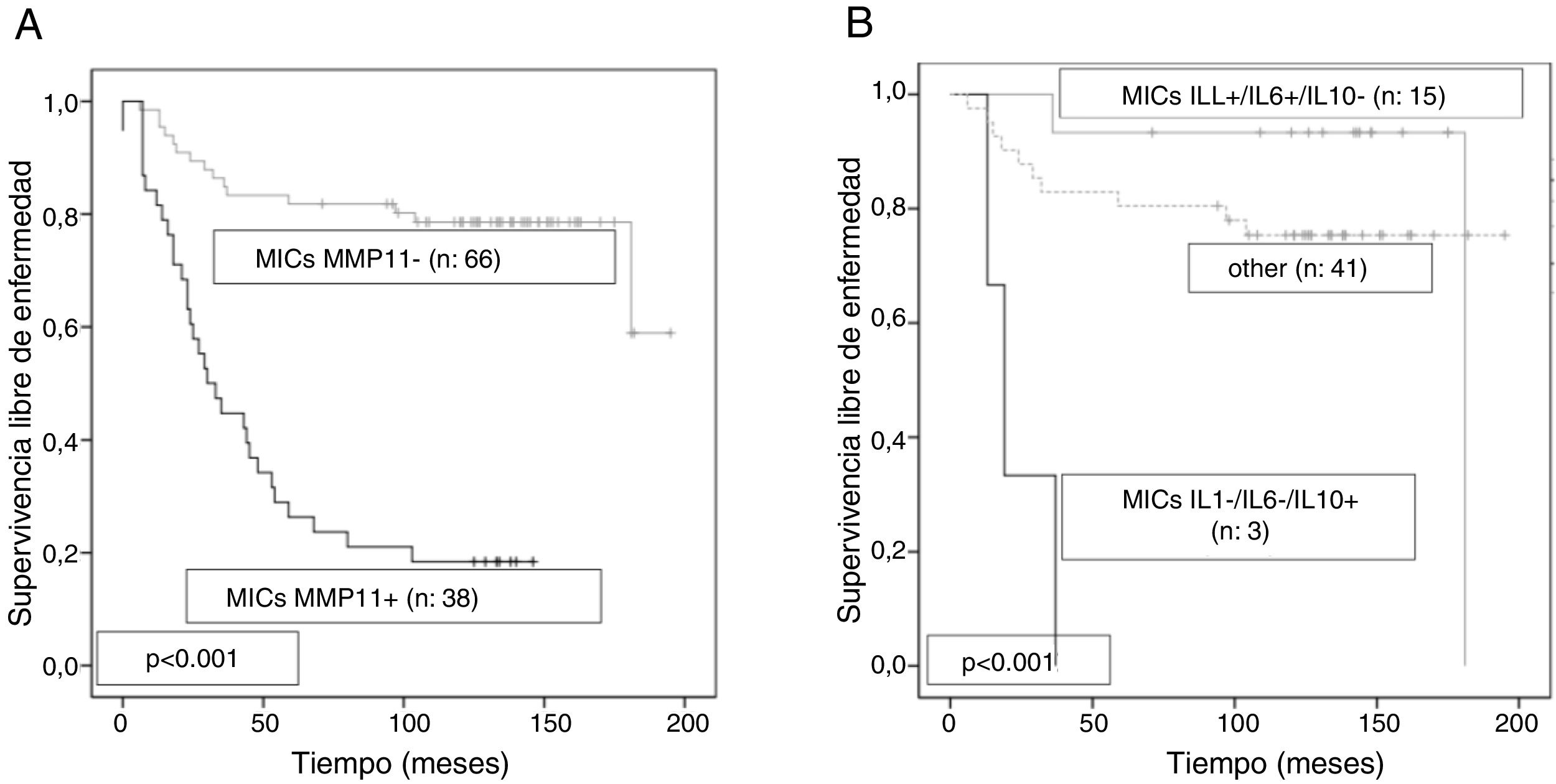
Las pacientes con tumores infiltrados por los FAC o las células mononucleares inflamatorias (CMI) mostrando una alta expresión de MMP/TIMP se asociaron con una elevadísima tasa de desarrollo de metástasis a distancia en comparación con las pacientes con tumores con un bajo perfil de expresión de MMP/TIMP (fig. 1)23–26. En estudios más recientes, encontramos que la expresión de MMP-11 (estromelisina-3) por las CMI o por las células endoteliales y el TIMP-2 por los FAC fueron potentes factores para predecir el pronóstico de las pacientes26,27. Además, resulta llamativo que la expresión de MMP-11 por las CMI se asocia con un perfil tumoral de expresión génica elevada de factores relacionados con la inflamación y el cáncer, tales como interleuquina-1β (IL-1β), IL-6, IL-17, interferón β (IFNβ) y el factor nuclear kappa B (NFκB)28,29.
CitoquinasLas citoquinas son proteínas de bajo peso molecular que media la comunicación intercelular de células inmunes con células del estroma tumoral, incluyendo los FAC y células endoteliales. Además de su papel central en los procesos inflamatorios, es sabido que las citoquinas regulan procesos implicados en la progresión tumoral, tales como la proliferación, la supervivencia y la migración celular, la angiogénesis, la estimulación de la transformación epitelio-mesenquimal, la activación de células inflamatorias o promoviendo la evasión de las células cancerosas a la respuesta inmune. No obstante, el papel de las citoquinas inflamatorias en el contexto tumoral resulta complejo, ya que también pueden desempeñar acciones antitumorales dependiendo de diversos factores microambiente tumoral30 del estado de desarrollo del propio tumor31.
Estudios previos asociaron los elevados niveles séricos de citoquinas con agresividad tumoral y recurrencia en el cáncer de mama32–34. En línea con esas observaciones, y en el contexto tisular del cáncer de mama, nosotros describimos la expresión de citoquinas por las células cancerosas de la inmensa mayoría de los carcinomas mama, lo que apoya el papel de esas proteínas como factores autocrinos contribuidores de la adquisición de un fenotipo maligno. No obstante, resultó llamativo comprobar un perfil variable de la expresión de citoquinas por las células estromales de los diferentes tumores35. De tal forma, que mientras la expresión de IL-1β por los FAC o las CMI, se asoció significativamente con una baja tasa de desarrollo de metástasis, la expresión de IL-10 por esos mismos tipos celulares se relacionó con un pronóstico muy adverso. Es más, comprobamos que la combinación de las expresiones de IL-1β, IL-6 e IL-10, por las CMI, permitió definir de forma muy potente diferentes grupos de tumores que difieren en su pronóstico, y contribuyó a mejorar nuestra clasificación pronóstica previa basada en la expresión de MMP-11 por las CMI35 (fig. 2). Esas observaciones parecen estar de acuerdo con algunos estudios que sugieren que, por una parte, la expresión de citoquinas puede inhibir el crecimiento tumoral36,37 y correlacionarse con un buen pronóstico38,39. Ello es debido a su capacidad de inducir una respuesta inmune antitumoral, si bien, también pueden contribuir a la progresión tumoral. Tal es el de la IL-10, una importante citoquina anti-inflamatoria que, debido a su efecto inmunosupresor sobre las células dendríticas y macrófagos, facilita la evasión inmunológica de las células cancerosas40.
Receptores tipo tollLos TLR canalizan señales de activación en una variedad de células inflamatorias relacionadas con la inmunidad innata y adquirida, de cara a combatir patógenos humanos41. Las células cancerosas también pueden expresar TLR, cuyas señales contribuyen a estimular la liberación de citoquinas y quimiocinas que, a su vez, pueden favorecer el reclutamiento de células inflamatorias con un perfil de citoquinas asociado con una inmunotolerancia. A su vez, los TLR estimulan la proliferación de las células cancerosas y su resistencia a la apoptosis; así como su capacidad invasiva y metastásica mediante la regulación de MMP e integrinas42–45. Además, existen datos que sugieren la importancia biológica y clínica de la expresión de los TLR por las células del estroma tumoral del cáncer de mama. Así, nosotros observamos que la expresión del TLR4 por las CMI estuvo asociada con una mayor incidencia de metástasis hematógenas, mientras que la expresión del TLR9 por los FAC se asoció con una menor tasa de metástasis a distancia46. Ese último dato indica un papel protector del TLR9 frente a la progresión tumoral, de acuerdo con observaciones experimentales y clínicas que indican que la estimulación del TLR9 activa los linfocitos B y las células dendríticas induciendo, así, una potente respuesta inmune anti-tumoral47. Asimismo, recientemente se han descrito mecanismos en esta misma línea que involucran a ligandos del TLR9 en la generación de señales antitumorales en los linfocitos T reguladores48. Así pues, todo ello, refleja la complejidad del estroma tumoral, donde parece resultar clave, una vez más, la consideración del tipo celular que expresa los diferentes factores en el contexto del microambiente tumoral.
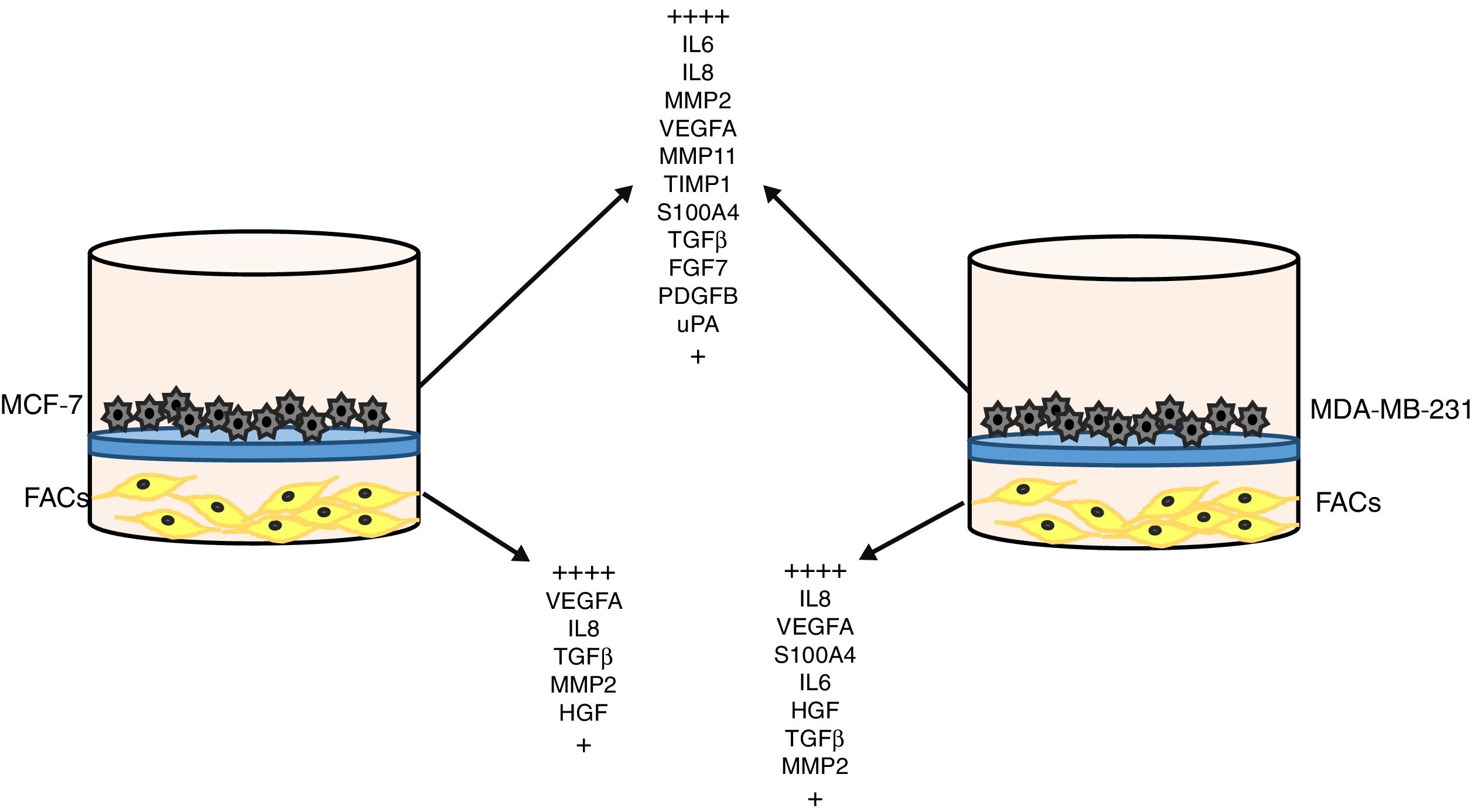
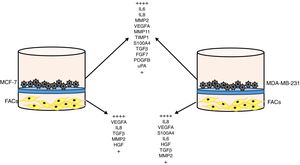
Sistema de comunicación intercelular en el cáncer de mamaExisten abundantes datos que indican la existencia de sistemas de señales bidireccionales de comunicación entre los distintos tipos celulares que integran la masa tumoral. Por una parte, las células cancerosas segregan factores moleculares, tales como el TGF-β, que es sabido que reclutan y activan los FAC49,50. Asimismo, ciertas citoquinas o quimiocinas liberadas por las células cancerosas, como la CCL2, intervienen en el reclutamiento intratumoral de macrófagos e inducen su transformación hacia un fenotipo protumoral51–53. Por otra parte, tras el reclutamiento intratumoral de esas células, existe una compleja dinámica de interacciones bidireccionales, cuyo resultado puede ser evidenciado por experimentos de tipo transwell. Así, por ejemplo, en ese contexto experimental demostramos que el co-cultivo de los FAC con líneas celulares de cáncer de mama (MCF-7 o MDA-MB-231) induce en ambos tipos celulares la sobreexpresión de una amplia gama de factores relacionados con la progresión tumoral, tales como S100A4, TGF-β, FGF7, PDGFB, uPA, IL6, IL8, MMP2, MMP11, TIMP1 y VEGFA (fig. 3)13,54. También es especialmente relevante el hallazgo de que la expresión de alguno de esos factores por las células cancerosas o por los FAC13, así como la capacidad invasiva o angiogénica de las células cancerosas54, fue llamativamente incrementada tras el co-cultivo con los FAC procedentes de tumores infiltrados por las CMI con expresión positiva de MMP-11, sugiriendo la importancia dinámica del fenotipo del estroma tumoral en el cáncer de mama.
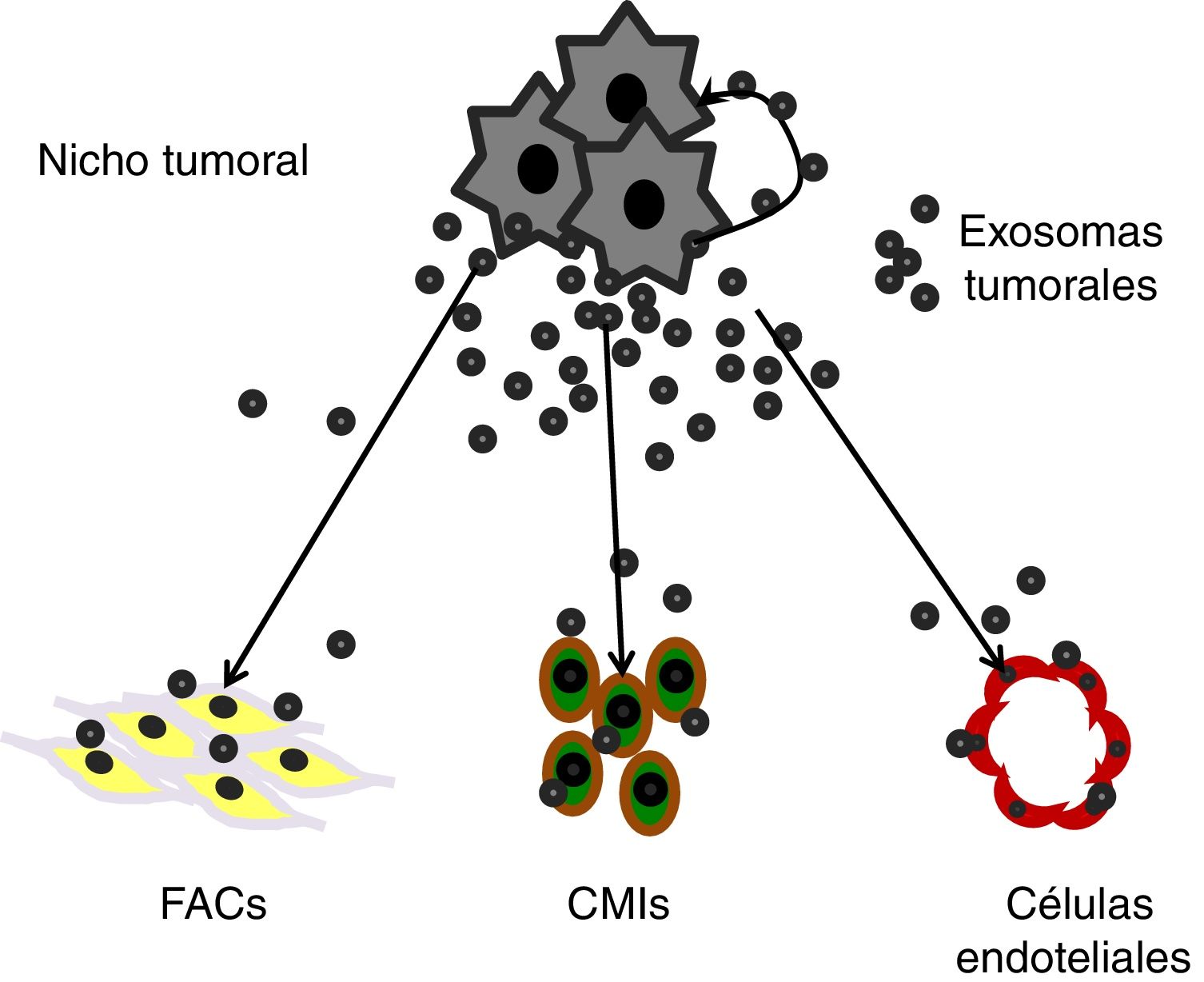
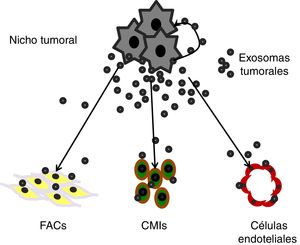
Cabe también destacar un emergente concepto de comunicación intercelular en biología celular, el cual está centrando la atención de muchos investigadores en cáncer, y que puede complementar el complejo sistema de señales derivadas de los factores solubles como los anteriormente señalados. Las vesículas extracelulares (EV) son producidas por todas las células en diferentes formatos y tamaños: cuerpos apoptóticos (1.000-5.000nm de diámetro), microvesículas (500-1.000nm) y exosomas (30-150nm)55. Los exosomas se originan en el compartimento endocítico de la célula a través de una serie de invaginaciones intraluminales que tienen lugar en los cuerpos multivesiculares. En consecuencia, su contenido molecular recapitula, al menos en parte, el contenido de la célula de origen56. Los exosomas, rodeados por una membrana bicapa de proteína-fosfolipídica, presentan una luz conteniendo diversas proteínas celulares, ácidos nucleicos, ARNm, miARN y ADN, así como factores solubles, incluidos las citoquinas y quimiocinas, enzimas y cofactores57. Al comunicarse con una célula receptora local o distante, los exosomas emiten señales que culminan en la reprogramación celular58,59. Aunque los mecanismos responsables de la entrega y el procesamiento de la carga de exosomas en las células receptoras aún no se conocen completamente, pueden consistir en el reconocimiento de un tipo de ligando inicial de receptor en la superficie celular seguido de endocitosis o fagocitosis de exosomas60.
Se sabe que las células cancerosas son ávidas productoras de exosomas, con firmas moleculares distintas de las de los exosomas derivados de células normales61, que están presentes de forma ubicua en el medio tumoral y en los fluidos corporales de todos los pacientes con cáncer61,62. Así, esos exosomas tumorales pueden mediar señales paracrinas con células no cancerosas del microambiente tumoral, y promover la supervivencia y expansión de las propias células cancerosas63,64 (fig. 4).
Estroma tumoral y oportunidades terapéuticasLa experiencia positiva de los ensayos clínicos en pacientes con cáncer de mama avanzado en los que se consideró la angiogénesis tumoral como diana terapéutica, representa un claro ejemplo de las oportunidades terapéuticas que nos ofrece el estroma tumoral65. En este sentido, y en base a los datos anteriormente expuestos, las terapias antitumorales podrían idealmente considerar la disrupción de la dinámica de las interrelaciones entre las células cancerosas y los elementos celulares del estroma tumoral. De hecho, estudios que investigaron el papel de los FAC en el cáncer parecen indicar que la selección terapéutica de las células cancerosas por sí solas es insuficiente para el tratamiento del cáncer66. Por lo tanto, los FAC son componentes esenciales para el microambiente del tumor y, por lo tanto, representan una diana terapéutica para el tratamiento del cáncer67. Además, en comparación con las células cancerosas, los FAC son relativamente más estables genéticamente y, por tanto, con una probabilidad reducida de desarrollar resistencia a los medicamentos, lo que representa un objetivo terapéutico potencial con menores posibilidades de desarrollar quimiorresistencia68. Muchos agentes nuevos relacionados con el bloqueo de las acciones pro-tumorales de los FAC están siendo ya sometidos a evaluación preclínica y clínica69.
Por otra parte, también se han implementado varios ensayos clínicos para evaluar los inhibidores de los receptores de citoquinas o los anticuerpos neutralizantes que impiden la exposición sostenida a estos mediadores inflamatorios que promueven la progresión tumoral70,71. Del mismo modo, uno de los ensayos clínicos más implementados para el cáncer de mama en el contexto metastásico son los medicamentos que se dirigen a los puntos de control intrínsecos de las células inmunitarias. El bloqueo de uno de estos puntos de control, el antígeno 4 asociado a los linfocitos T citotóxicos (CTLA-4), o el receptor de muerte celular programada 1 (PD-1), pueden proporcionar una prueba de concepto del interés de un enfoque de inmunomodulación en el tratamiento de un cáncer de mama72.
Por otra parte, una posible alternativa innovadora podría ser la utilización de agentes que actuasen contra las células cancerosas y las del estroma tumoral. Con respecto a este aspecto, recientemente describimos un nuevo tipo de células madre mesenquimales, denominadas células madre del cérvix uterino humano (human Uterine Cervical Stem Cells [hUCESCs]), que se obtienen de la zona de transición del cuello uterino de las mujeres sanas por medio de frotis cervicales de Papanicolaou73. Nuestros resultados iniciales muestran que el secretoma o medio condicionado (MC-hUCESCs) de este tipo de células madre tiene un efecto antitumoral específico sobre la proliferación, apoptosis e invasión de células tumorales agresivas MDA-MB-231 y en cultivos primarios de carcinomas mamarios in vitro73,74. Asimismo, comprobamos que el MC-hUCESCs induce una inhibición del crecimiento del tumor in vivo en un modelo de tumor de xenoinjerto en ratón. Esas acciones antitumorales difieren de las descritas para otros tipos de células madre mesenquimales75–77, y pueden ser debidas, en parte, a que el MC-hUCESCs tiene una concentración más alta, por ejemplo que el MC de las células madre mesenquimales de origen adiposo, de factores de reconocido efecto anti-tumoral, tales como LIGHT (o TNFSF14), ligando tirosina quinasa 3 relacionado con Fms (ligando FLT-3), proteína inducible por interferón gamma-10 (IP-10) y proteína asociada a la latencia73.
También pudimos comprobar que el MC-hUCESCs reduce drásticamente la proliferación y capacidad invasiva de los FAC de carcinomas mamarios, así como inhibe y revierte la diferenciación de monocito a macrófago73. Esos datos resultan interesantes a causa de que el secretoma o medio condicionado de las células madre mesenquimales es considerado como una nueva estrategia terapéutica en el contexto de la medicina regenerativa78. El secretoma, que surge de un nuevo tipo de regulación biológica que involucra la comunicación entre las células, se define como el conjunto de factores/moléculas secretadas al espacio extracelular. Estos factores incluyen, entre otros, proteínas solubles, ácidos nucleicos libres, lípidos y vesículas extracelulares, incluidos los exosomas. Además, su aplicación resuelve varios aspectos de seguridad asociados con el trasplante de poblaciones de células vivas y proliferativas (compatibilidad inmune, tumorigenicidad, formación de embolias y transmisión de infecciones); se puede evaluar su seguridad, dosis y potencia de manera análoga a los agentes farmacéuticos convencionales; su almacenamiento puede realizarse sin la aplicación de agentes crioconservantes potencialmente tóxicos durante un largo período sin pérdida de potencia del producto; es más económico y más práctico para la aplicación clínica, ya que evita los procedimientos de recolección de células invasivas; su producción en masa es posible a través de líneas celulares hechas a medida bajo condiciones de laboratorio controladas.
Conclusiones y perspectivas futurasLos FAC, las CMI y las células endoteliales son componentes principales del estroma tumoral del cáncer de mama, que pueden contribuir de una forma decisiva a la progresión tumoral, y que muestran una heterogeneidad fenotípica entre los diferentes tumores. Las expresiones por esos tipos celulares de MMP, TIMP, citoquinas y TLR, nos permiten identificar diferentes tipos funcionales de estroma que condicionan pronósticos muy diferentes de la enfermedad. Por ello, la caracterización fenotípica del estroma podría ser incorporada en la valoración pronóstica del cáncer de mama, de cara a tomar decisiones terapéuticas individualizadamente más adecuadas. Por otra parte, considerando que la dinámica molecular de las interacciones célula cancerosa/célula del estroma resultan clave en la progresión tumoral, el estroma tumoral puede emerger como una nueva diana terapéutica en el cáncer de mama. De hecho, se han implementado varios ensayos clínicos para evaluar el bloqueo de los FAC o inhibidores de los receptores de citoquinas o anticuerpos neutralizantes que evitan la exposición sostenida a estos mediadores inflamatorios que promueven la progresión del tumor. En este contexto, además de factores moleculares solubles que transmiten señales, el estudio de los exosomas derivados de las células cancerosas pueden permitirnos descubrir nuevas claves de la comunicación intercelular e identificar nuevas estrategias terapéuticas. Asimismo, una posible alternativa innovadora podría ser la utilización de agentes que actuasen contra las células cancerosas y las del estroma tumoral. Un ejemplo de esto último podría ser el reciente hallazgo de un nuevo tipo de células madre mesenquimales cuyo secretoma muestra un potente efecto contra las células cancerosas y los FAC, así como un efecto inmuno-regulador de potencial terapéutico para el cáncer de mama.
FinanciaciónEl presente trabajo ha sido financiado por el Instituto de Salud Carlos III [PI17/02236].
Conflicto de interesesFV y NE son co-autores de una patente («Población de células madre de cuello uterino humano y usos de la misma») propiedad de GiStem Research, de la cual FV, NE y SC son partícipes. Dicha entidad no ha tenido ningún papel en el diseño de esta revisión, en la recopilación, análisis o interpretación de los datos, en la redacción del manuscrito, o en la decisión de publicar los resultados.