Estudio prospectivo de pacientes con cáncer de mama precoz tratadas con cirugía conservadora oncoplástica y radioterapia intraoperatoria con intención de dosis única o monoterapia.
Material y métodoVeintitrés pacientes intervenidas entre junio de 2016 y agosto de 2018, que han cumplido criterios de administración de radioterapia intraoperatoria establecidos por nuestro comité multidisciplinar de tumores de mama (carcinoma ductal infiltrante<3cm, unifocal, con axila clínica y radiológicamente negativa, receptores hormonales positivos y HER2 negativo) y han sido candidatas a cirugía oncoplástica.
ResultadosTras el estudio anatomopatológico, todas las piezas de resección tenían márgenes libres y 16 pacientes seguían cumpliendo criterios de radioterapia intraoperatoria como monoterapia. En 7 pacientes se precisó administrar radioterapia glandular externa por no cumplir alguno de los criterios.
ConclusionesLa cirugía oncoplástica asociada a radioterapia intraoperatoria es una evolución en el tratamiento del cáncer de mama precoz en un importante número de nuestras pacientes. Presenta un alto grado de satisfacción y una menor percepción de la enfermedad por parte de las pacientes.
Prospective study of patients with early breast cancer treated with oncoplastic conservative surgery and intraoperative radiotherapy with single-dose intent or monotherapy.
Material and methodWe included 23 patients who underwent surgery between June 2016 and August 2018 and who met the criteria for administration of intraoperative radiotherapy established by our multidisciplinary committee of breast tumours (infiltrating ductal carcinoma<3cm, unifocal, with a clinically and radiologically negative axilla, hormone receptor-positive and HER2-negative) and who were candidates for oncoplastic surgery.
ResultsAfter pathological study, all the surgical specimens had free margins and 16 patients continued to meet the intraoperative radiotherapy criteria for monotherapy. In 7 patients who did not meet any of the criteria, external glandular radiotherapy was administered.
ConclusionsOncoplastic surgery associated with intraoperative radiotherapy is a development in the treatment of early breast cancer in a significant number of patients. It produces a high degree of satisfaction and a lower disease perception among patients.
El cáncer de mama representa en la actualidad la primera causa de cáncer entre la población femenina.
El manejo en el tratamiento está en continua evolución, alejándose de las cirugías radicales de otras épocas y evolucionando hacia las técnicas conservadoras de la actualidad. Como tratamiento estándar para el cáncer de mama precoz está aceptado, por amplio consenso, la cirugía conservadora seguida de radioterapia glandular.
Uno de los principales problemas que se encuentra el cirujano es el resultado estético de la mama intervenida. Los procedimientos oncoplásticos han permitido introducir diversas técnicas en la cirugía conservadora del cáncer de mama con el objetivo de conseguir los mejores resultados estéticos, manteniendo parámetros oncológicos como la supervivencia y la recurrencia de la enfermedad1,2.
El tratamiento radioterápico convencional administrado a las pacientes que han recibido cirugía conservadora actualmente se realiza de forma fraccionada durante 5-6 semanas o mediante tratamientos hipofraccionados. Hasta un 85% de las recurrencias locales después de la cirugía conservadora van a aparecer en el tejido adyacente a la resección primaria. Es en este contexto en el que, en algunos centros, se ha comenzado a realizar la radioterapia intraoperatoria (RIO), ofreciendo la posibilidad de una única dosis de radiación directamente en el lecho tumoral dentro del propio acto quirúrgico3. Los resultados del estudio TARGIT-A han permitido establecer una comparación entre la RIO y la irradiación externa tradicional4. Estos estudios han demostrado, al menos, unos resultados de equivalencia en cuanto a recidiva local en comparación con la radioterapia externa. Aunque quedan preguntas abiertas y años de investigación por delante, la no inferioridad en cuanto a los resultados está permitiendo numerosos beneficios a muchas de las pacientes que reciben RIO.
El Hospital Universitario Miguel Servet comenzó a realizar RIO en cáncer de mama precoz en mayo de 2015. Desde entonces nuestro centro ha intervenido a más de 300 pacientes con administración de RIO entre los servicios de Cirugía General y Ginecología. Con la experiencia de dicha casuística, se ha decidido dar lo que entendemos que es el siguiente paso a realizar, combinar las ventajas de la cirugía conservadora de mama con técnicas oncoplásticas y la RIO. Ambas técnicas suponen la vanguardia de los procedimientos disponibles que podemos aportar a una paciente con cáncer de mama en estadio precoz.
En el presente artículo se revisan las pacientes tratadas mediante técnicas quirúrgicas oncoplásticas y que han recibido RIO.
Material y métodoSe realiza un estudio prospectivo desde mayo de 2015 hasta agosto de 2018 analizando los datos de las 148 pacientes intervenidas por cáncer de mama con cirugía conservadora y RIO en el Servicio de Cirugía General del Hospital Universitario Miguel Servet de Zaragoza (Unidad de Mama, Cirugía Endocrina y Bariátrica).
Los criterios de inclusión al diagnóstico para la administración de RIO como dosis única fueron: edad>45 años, tumor<3cm, unifocal, con receptores hormonales positivos, HER2 negativo, axila clínica y ecográficamente negativa y no precisar neoadyuvancia. Aquellas pacientes que por las características de sus mamas (tamaño de la mama, ptosis importante, asimetría), la localización y el tamaño tumoral fueron candidatas a técnicas de cirugía oncoplástica son las que se incluyeron en este estudio.
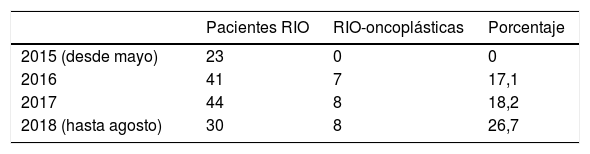
Entre las 148 pacientes intervenidas, 23 fueron candidatas a utilizar un patrón oncoplástico para la resección tumoral, lo que se corresponde con un 15,54% (tabla 1).
La técnica quirúrgica fue realizada por el mismo equipo quirúrgico en todas las pacientes, existiendo únicamente variabilidad en su cirujano principal, pero existiendo unas directrices comunes en cuanto a la técnica a seguir tanto en el diseño quirúrgico del patrón oncoplástico como en la RIO. En cuanto a las técnicas oncoplásticas utilizadas, se realizaron patrones verticales de rama única, vertical de doble rama y patrones horizontales, siempre con simetrización de la mama contralateral. En todas ellas se realizó biopsia selectiva del ganglio centinela, con estudio diferido si se obtenían menos de 3 ganglios, dado que en nuestro hospital seguimos los criterios del ACOSOG Z00115.
Para la administración de RIO utilizamos el equipo Axxent de Xoft®, que utiliza una fuente de rayos X de 50kV y un aplicador esférico tipo balón. Utilizamos 2 tamaños de aplicador, el de 3-4cm, que admite volúmenes entre 30 y 45cc, y el de 4-5cm, de entre 45 y 75cc. La planificación, la dosis y el tiempo de administración dependen de los servicios de Oncología Radioterápica y Física. El tiempo de irradiación es proporcional al volumen del balón, oscilando entre 8 y 17min, dado que en ningún caso se ha utilizado un aplicador con un volumen superior a 60cc.
Se procede a analizar la distribución de las pacientes por año, edad, tipo de tumor resecado, patrón oncoplástico utilizado y complicaciones surgidas. No se han observado pérdidas de seguimiento de ninguna de nuestras pacientes.
ResultadosSe han intervenido 23 pacientes entre junio de 2016 y agosto de 2018. La edad media fue de 65,6 años, con un rango entre 47-80 años.
El 13% de ellas eran fumadoras, otro 13% eran exfumadoras y un 13% diabéticas, circunstancias ambas importantes en la posible aparición de complicaciones postoperatorias en las técnicas oncoplásticas.
Todas las pacientes en el momento del diagnóstico cumplían criterios de RIO como monoterapia.
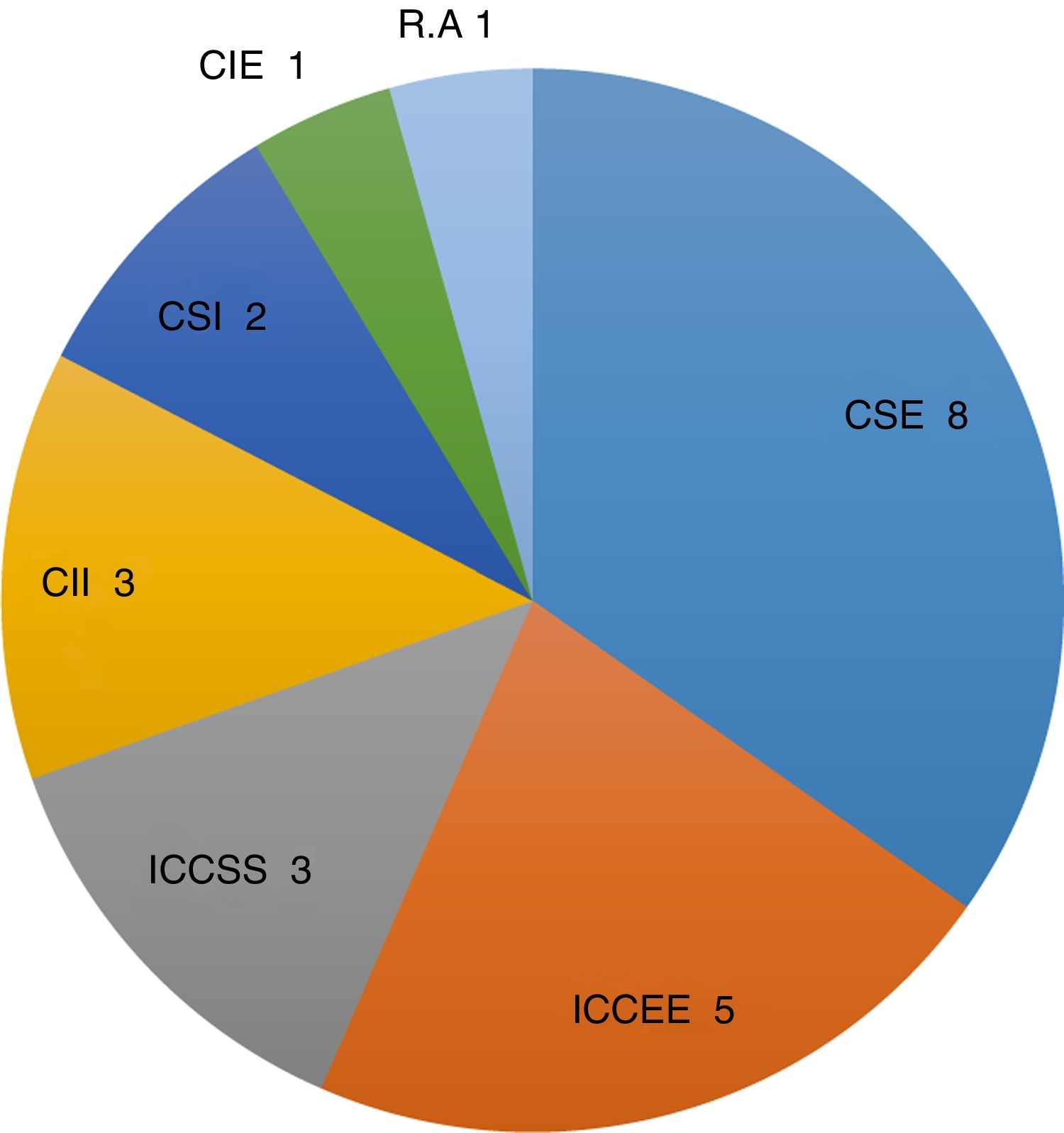
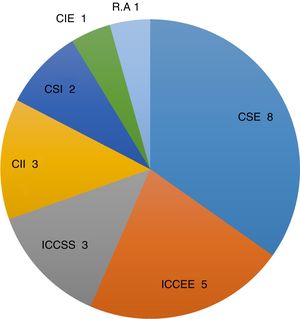
En cuanto a la localización tumoral: 17 se encontraban en la mama derecha y 6 en la izquierda. Por cuadrantes (fig. 1): cuadrante superoexterno 8, intercuadrantes superiores 3, intercuadrantes externos 5, cuadrante inferointerno 3, cuadrante inferoexterno una, cuadrante superointerno 2 y cuadrante retroareolar una.
Se administró profilaxis antibiótica con amoxicilina-clavulánico 2g iv y fosfomicina 4g en alérgicas a betalactámicos.
Con respecto al tamaño tumoral, 16 casos eran T1 y 8 T2 menores de 3cm.
El estudio inmunohistoquímico de la biopsia tumoral reflejó los siguientes resultados: receptores de estrógenos positivos: 23, receptores de progesterona positivos: 19, HER2 negativo: 23, Ki67<14%: 6, Ki67>14%: 17.
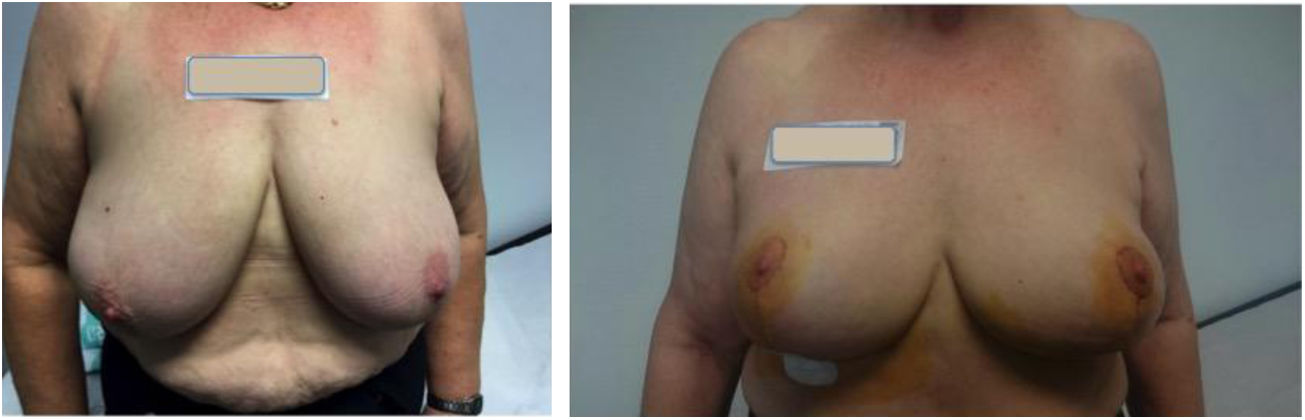
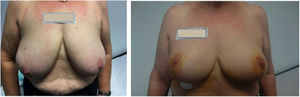
Los patrones oncoplásticos utilizados fueron: vertical de doble rama 8 (fig. 2), horizontal 12, vertical de rama única 3. En todas las pacientes se realizó simetrización de la mama contralateral con el mismo patrón. El tiempo medio promedio de administración de RIO fue de 12min (rango 8,4-17min).
Durante la intervención quirúrgica realizamos sistemáticamente estudio intraoperatorio de bordes y se comprobó que estaban libres en todos los casos, lo que se corroboró en el estudio anatomopatológico definitivo. La biopsia selectiva de ganglio centinela fue negativa en 16 pacientes (69,6%) y positiva en 7 (4 macrometástasis y 3 micrometástasis, estudio por OSNA). Dos pacientes precisaron de una linfadenectomía axilar, una de ellas inmediata por presentar 3 ganglios centinela positivos, y otra diferida, decidida en comité de tumores, por hallar 2 ganglios centinela y ambos positivos para macrometástasis. En una paciente la anatomía definitiva fue de tumor multifocal. Así pues, la afectación axilar en cualquier modalidad y/o la aparición de multifocalidad fueron motivo de administrar radioterapia externa en 7 pacientes, considerándose en estos casos la RIO como «boost» o sobreimpresión.
La estancia media hospitalaria fue de 1,17 días (rango 1-2 días).
Existieron complicaciones en 2 pacientes (8,7%): una epidermólisis del complejo aréola pezón que fue tratada de forma conservadora con buena evolución y una dermatitis grado 2 (eritema y edema moderados).
DiscusiónLa cirugía conservadora acompañada de radioterapia adyuvante es el «gold standard» en el cáncer precoz de mama. En nuestra unidad, en los últimos 2 años la cirugía conservadora representa más del 85% del total de las intervenciones. La cirugía oncoplástica en el cáncer de mama es aquella que pretende llevar a cabo un patrón de resección con criterios oncológicos, obteniendo unos márgenes libres de tumor y unos criterios estéticos adaptados a cada paciente, remodelando la mama y evitando así alteraciones en su forma e incluso mejorando en otras ocasiones el aspecto de la misma, simetrizando la mama contralateral y movilizando el CAP6. Representa actualmente un alto porcentaje del total de nuestra cirugía conservadora. Este tipo de cirugía tiene una serie de ventajas e inconvenientes inherentes a ella. Entre las ventajas, hay que destacar que permite resecciones tisulares mayores, con lo que disminuimos la posibilidad de afectación de márgenes. Conlleva un mejor resultado estético, además de simetrizar la mama contralateral. Permite un mayor porcentaje de conservación mamaria tras tratamientos neoadyuvantes. Y, por último, evita la pérdida de localización en el tratamiento radioterápico adyuvante.
Como inconvenientes, destacan un aumento del tiempo quirúrgico, la necesidad de cirugía a doble campo, un ligero aumento de la estancia hospitalaria, la necesidad de una formación específica y la posibilidad de complicaciones posquirúrgicas propias, como son: la necrosis del CAP (total o parcial), la dehiscencia de las heridas quirúrgicas, la hemorragia y la necrosis grasa7. Por todo ello, entre las pacientes candidatas a cirugía conservadora en el cáncer de mama, un porcentaje de ellas podrán ser candidatas a este tipo de técnicas: las que precisen mayores resecciones tisulares y las que presenten ptosis mamaria, macromastia y asimetrías. También tendremos en cuenta la edad de la paciente y evitaremos a grandes fumadoras y pacientes diabéticas, por el mayor aumento de complicaciones.
Todas las pacientes a las que realicemos cirugía conservadora precisarán radioterapia adyuvante para completar el tratamiento hoy considerado como «gold standard». Si unimos los criterios de la cirugía oncoplástica y las indicaciones de la RIO obtendremos una serie de pacientes que van a beneficiarse de ambas técnicas8-10. El número de pacientes va aumentando progresivamente año a año.
Las ventajas de la RIO son múltiples. Así, tratamos directamente el lecho tumoral, evitando la pérdida de localización geográfica. También permite el tratamiento en una sola sesión como monoterapia en las pacientes indicadas o como «boost» o sobreimpresión si tras la intervención no se cumple algún criterio o si así se decide preoperatoriamente11,12. Evita demoras del tratamiento motivadas por terapias sistémicas adyuvantes y obtiene un alto grado de satisfacción de la paciente y una menor percepción de enfermedad. Finalmente, consigue una optimización de los recursos en el empleo de máquinas de radioterapia y disminución de costes, directos e indirectos. Si además realizamos una cirugía oncoplástica tenemos la ventaja de radiar antes, ya que en ocasiones las complicaciones cutáneas postoperatorias de estas técnicas hacen que se retrase la radioterapia externa y llevarla a cabo en el sitio exacto.
ConclusionesLa cirugía oncoplástica asociada a la RIO es un avance en el tratamiento del cáncer de mama precoz que puede ser útil en un importante número de pacientes, con escasas complicaciones.
Responsabilidades éticasConfidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.