la publicación de ensayos aleatorizados con resultados a largo plazo ha demostrado que la radioterapia intraoperatoria (RIO) en cáncer de mama en estadio precoz puede ser una alternativa terapéutica en casos bien seleccionados. En el presente trabajo se presentan los resultados del Primer Consenso de Radioterapia Intraoperatoria en Cáncer de Mama realizado de manera multidisciplinar en España.
Material y métodose hizo una revisión sistemática de la literatura y se invitó a todos los oncólogos radioterápicos y cirujanos expertos en RIO en cáncer de mama de España a participar en el consenso.
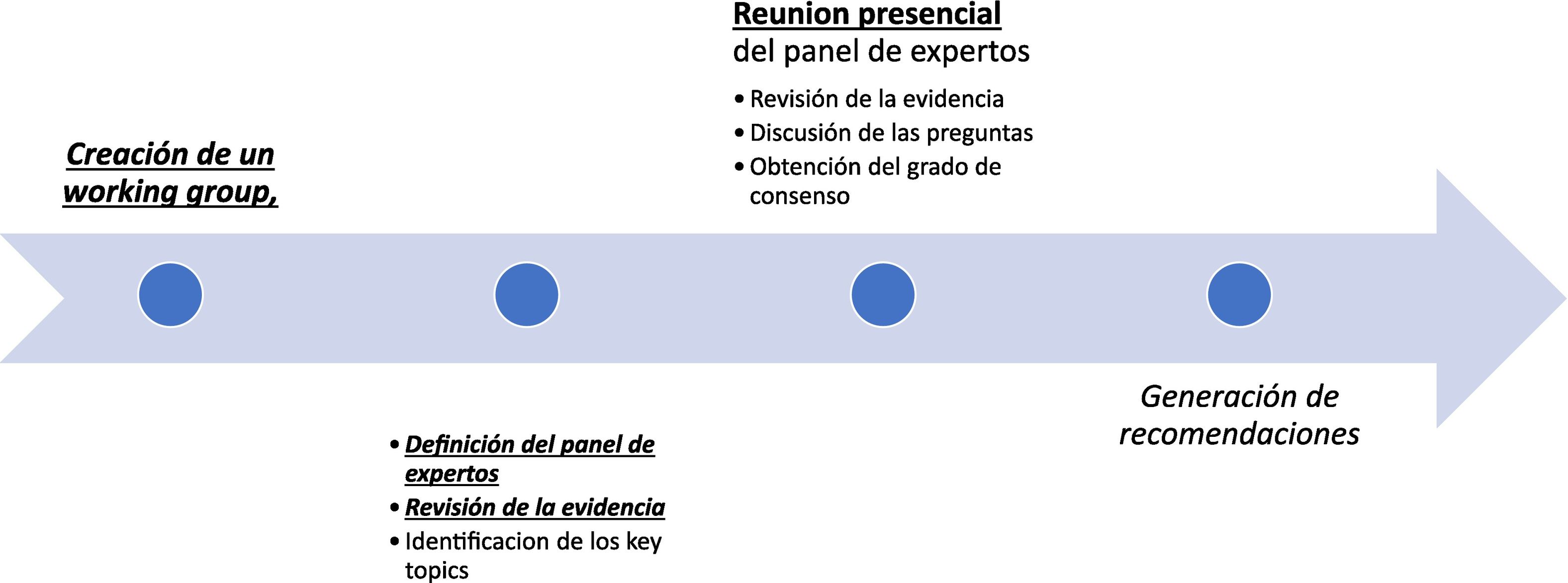
Se aplico la siguiente metodología en 2 fases: a) la creación de un grupo de trabajo y la revisión de la evidencia; b) la realización de la encuesta y generación de recomendaciones consensuadas.
Resultadoshan participado un total 95,65% de los centros que actualmente utilizan esta técnica en cáncer de mama y que fueron invitados. Los expertos estuvieron de acuerdo en el uso de RIO exclusiva en cáncer de mama en aquellas pacientes mayores de 60 años y por encima de 50 años posmenopáusicas, con carcinoma ductal infiltrante o subtipos histológicos favorables, sin invasión linfovascular, tumores menores o iguales a 25 mm, márgenes de resección libres y receptores hormonales positivos. La utilización de RIO como rescate de recidiva local después de la irradiación externa alcanzó un nivel de consenso muy fuerte.
Conclusiónel presente consenso pretende establecer las guías respecto a las indicaciones de RIO exclusiva o como sobreimpresión anticipada y ser una ayuda para la toma conjunta de decisiones.
The publication of randomized trials with long-term results has demonstrated that intraoperative radiation therapy (IORT) in early-stage breast cancer can be a therapeutic alternative for well-selected cases. This paper present work presents the results of the first multidisciplinary consensus on IORT in breast cancer carried out in Spain.
Materials and methodsA systematic literature review was conducted, and all radiation oncologists and surgeons with expertise in IORT for breast cancer in Spain were invited to participate in the consensus. The following methodology was employed in two phases: a) creation of a working group and review of the evidence; b) conduct of the survey and generation of consensus recommendations.
ResultsA total of 95.65% of the invited centers currently utilizing this technique in breast cancer participated. The experts agreed on the use of exclusive intraoperative radiation therapy in breast cancer for patients above 60 years of age and above 50 years postmenopausal, with invasive ductal carcinoma or favorable histological subtypes, no lymphovascular invasion, tumors less than or equal to 25 mm, clear surgical margins, and positive hormone receptor. The use of IORT as salvage surgery for local recurrence after external irradiation achieved a very strong consensus level.
ConclusionThe present consensus aims to establish guidelines regarding the indications for exclusive IORT or as an early boost, and to serve as an aid for joint decision-making.
El tratamiento del cáncer de mama en estadio precoz basado en la cirugía conservadora seguida de radioterapia complementaria es el tratamiento de elección de las pacientes1 y además obtiene mejores resultados en términos de supervivencia2.
En casos bien seleccionados y de bajo riesgo de recidiva la irradiación se puede realizar sin tratar toda la mama mediante técnicas de irradiación parcial acelerada (IPA). Así lo contempla diversos consensos internacionales como ASTRO, ESTRO y GEC-ESTRO, de manera que esta modalidad de tratamiento se puede realizar de forma asistencial3. Existen diversas técnicas para la realización de la IPA de la mama como son la braquiterapia (intersticial o basada en sistemas de balón), la radioterapia externa y la radioterapia intraoperatoria (RIO), que puede realizarse con aceleradores móviles de electrones o bien con sistemas de fotones de baja energía4. La RIO fue incluida como opción para la irradiación parcial en la revisión del consenso de ASTRO de 20165.
La irradiación intraoperatoria tras la tumorectomía como tratamiento exclusivo ha demostrado su utilidad en ensayos aleatorizados habiéndose publicado resultados a largo plazo. El primero de ellos fue el ensayo ELIOT, realizado con acelerador de electrones, comparado con la irradiación completa de la mama. A largo plazo se demostró mayor tasa de recaída local en las pacientes tratadas con RIO atribuyéndose dichos resultados a una selección de pacientes que no coincide con los criterios de bajo riesgo aceptados actualmente en los consensos6. Por otra parte, el ensayo TARGIT, realizado con el sistema Intrabeam® e iniciado en una fecha posterior, y por tanto con una mejor selección de las candidatas, ha reportado solo una discreta tasa superior de recaída local pero dentro de los rangos de no inferioridad establecidos en el diseño del estudio, además de demostrar una menor mortalidad no cáncer específica en las pacientes sometidas a RIO7.
En casos en los que se presentan factores de riesgo aumentados para recaída local, la sobreimpresión del lecho tumoral ha demostrado una disminución clara del riesgo de recidiva sobre todo en las pacientes jóvenes8. Dicha sobreimpresión también se puede realizar de forma anticipada mediante las técnicas disponibles de RIO, si bien las dosis de dicha sobredosificación varían dependiendo de los estudios basados en las distintas unidades disponibles de RIO.
A pesar de la evidencia de la seguridad y efectividad de la RIO, esta técnica no se ha implementado de una manera homogénea habiendo una gran variabilidad en su indicación en función de la presencia de diversos factores de riesgo. No existe ningún consenso sobre RIO como irradiación parcial o como sobreimpresión anticipada que establezca recomendaciones sobre la mejor indicación de esta técnica en la práctica clínica.
Nuestro objetivo es presentar el primer consenso de RIO en cáncer de mama realizado de manera multidisciplinar en España, bajo el auspicio de la Sociedad Española de Senología y Patología Mamaria (SESPM) y la Sociedad Española de Oncología Radioterápica (SEOR).
Material y métodosLa aplicación de una metodología de consenso y la elaboración de una guía con recomendaciones en el uso de RIO en cáncer de mama ha contado con la aprobación de SESPM y de SEOR. Nuestro trabajo se inició en junio y finalizó en octubre de 2022. Dicha metodología se aplicó siguiendo 2 fases:
a) La creación de un grupo de trabajo, revisión de la evidencia y consenso en la formulación de preguntas.
b) La realización de la encuesta y generación de recomendaciones consensuadas.
Se constituyó un núcleo coordinador o comité directivo (Steering comittee [SC]) formado por 4 profesionales con responsabilidades de liderazgo clínico y técnico, de gestión y seguimiento del proyecto. Sus funciones fueron definir los objetivos de la guía, la selección de la búsqueda bibliográfica a revisar, definir la formulación final de las preguntas clínicas, definir el panel de expertos, síntesis y la valoración de la evidencia y la redacción final del documento.
En septiembre de 2022 se llevó a cabo la primera reunión presencial del consenso con el SC. Se procedió a la búsqueda electrónica de MEDLINE, Embase y en el Cochrane Central Register of Controlled Trials (CENTRAL). Los elementos de búsqueda específicos fueron «breast cancer», «intraoperative radiotherapy, IORT». Los resultados de interés fueron el control local, supervivencia libre de enfermedad, supervivencia causa específica de la enfermedad y supervivencia global, toxicidad aguda y tardía. Solo se incluyeron ensayos controlados aleatorizados (ECA) o metaanálisis de ECA, o estudios observacionales prospectivos de más de 100 pacientes. En total se examinaron 56 artículos.
Definición de las preguntasBasada en la revisión de la evidencia publicada se definieron 29 preguntas relacionas con las áreas predominantes de controversia. Para definir las preguntas se realizó una encuesta online a todos los lideres de España de la oncología radioterápica. La respuesta a las preguntas se debía formular con SI/NO/Blanco, excepto una que tenía varias opciones. El objetivo era conseguir una votación independiente, evitar la influencia de las opiniones del resto de expertos y permitir así mismo poder contestar tras disponer de la información completa puesta en común.
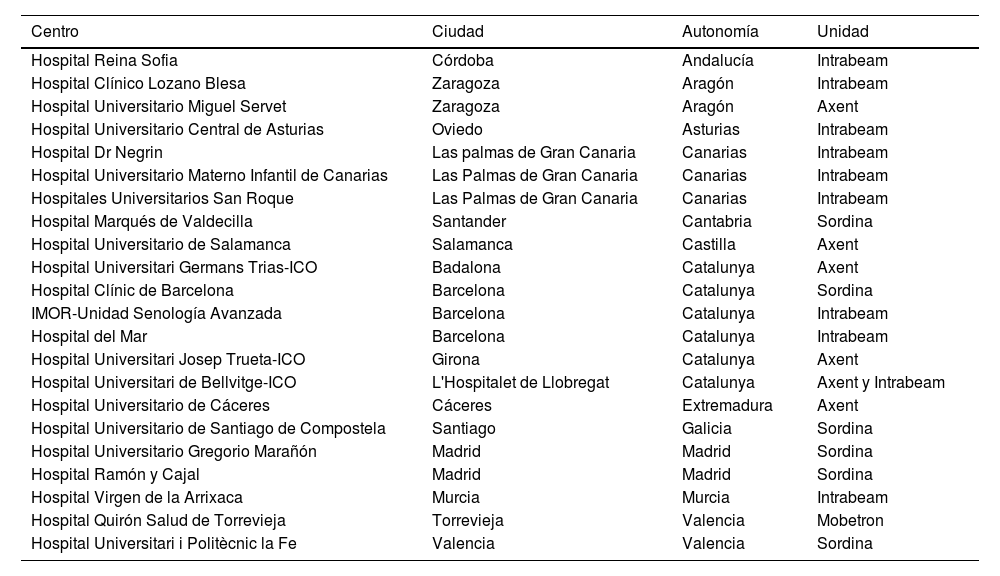
Se definió el panel de expertos. Los expertos fueron invitados a participar en la encuesta y un debate cara a cara. Los miembros del panel fueron elegidos sobre la base de los siguientes criterios de selección: cobertura de todas las especialidades involucradas en el manejo del tratamiento local del cáncer de mama, especialistas en el marco de la radioterapia y cirugía de mama, y con experiencia en RIO. Todas ellos especialistas que trabajan en unidades de mama con participación regular en equipos multidisciplinares y reuniones de equipo para discusión de casos clínicos. Se convocaron a los 24 centros de España que disponen de la técnica (fig. 1).
Realización de la encuesta y generación de recomendaciones consensuadasLa reunión de consenso se llevó a cabo en octubre de 2022, donde se revisó la evidencia, la encuesta y posterior presentación del documento de consenso con la aceptación definitiva por parte de todos los expertos. Se limitó a un voto por centro. Se mostró pregunta a pregunta la información recopilada y las respuestas de cada uno de los miembros de modo que se ponderaron las discrepancias y justificaciones. Tras ello, se discutieron y redactaron una a una las recomendaciones obteniendo el porcentaje de consenso del grupo de trabajo, así como la dirección y la fuerza con la que se expresaba cada una quedando completamente establecidas en diciembre de 2022. El proceso metodológico se muestra en la figura 2.
Recomendación y metodología de consensoPara conseguir la recomendación se ha utilizado el sistema GRADE que se trata de un método de graduación de la fuerza de la misma9, utilizado por ASTRO/ASCO para dictar las recomendaciones en el uso del hipofraccionamiento en cáncer de mama y próstata10. Las recomendaciones se clasificaron como fuertes o condicionales. Los miembros del grupo de trabajo realizaron la encuesta mostrando su grado de acuerdo con una escala de 10 puntos, siendo 10 el grado máximo de acuerdo y 0 cuando se estaba en total desacuerdo.
Según nuestro baremo consideramos que existe consenso si se alcanza el 75%. Se considera un consenso fuerte entre 75 y 85% y consenso muy fuerte entre 85 y 100%.
ResultadosDe los 24 centros que disponen unidades de RIO de España, uno declinó la invitación ya que no utilizan esta tecnología en cáncer de mama y otro no participó. En total los centros participantes han sido 22 que representan un 95,65% de los 23 que actualmente utilizan esta técnica en cáncer de mama. La lista de los centros participantes se muestra en la tabla 1. En dicha tabla se comprueba que están representados tanto los centros con aceleradores de electrones como con fotones de baja energía.
Listado de centros participante
| Centro | Ciudad | Autonomía | Unidad |
|---|---|---|---|
| Hospital Reina Sofia | Córdoba | Andalucía | Intrabeam |
| Hospital Clínico Lozano Blesa | Zaragoza | Aragón | Intrabeam |
| Hospital Universitario Miguel Servet | Zaragoza | Aragón | Axent |
| Hospital Universitario Central de Asturias | Oviedo | Asturias | Intrabeam |
| Hospital Dr Negrin | Las palmas de Gran Canaria | Canarias | Intrabeam |
| Hospital Universitario Materno Infantil de Canarias | Las Palmas de Gran Canaria | Canarias | Intrabeam |
| Hospitales Universitarios San Roque | Las Palmas de Gran Canaria | Canarias | Intrabeam |
| Hospital Marqués de Valdecilla | Santander | Cantabria | Sordina |
| Hospital Universitario de Salamanca | Salamanca | Castilla | Axent |
| Hospital Universitari Germans Trias-ICO | Badalona | Catalunya | Axent |
| Hospital Clínic de Barcelona | Barcelona | Catalunya | Sordina |
| IMOR-Unidad Senología Avanzada | Barcelona | Catalunya | Intrabeam |
| Hospital del Mar | Barcelona | Catalunya | Intrabeam |
| Hospital Universitari Josep Trueta-ICO | Girona | Catalunya | Axent |
| Hospital Universitari de Bellvitge-ICO | L'Hospitalet de Llobregat | Catalunya | Axent y Intrabeam |
| Hospital Universitario de Cáceres | Cáceres | Extremadura | Axent |
| Hospital Universitario de Santiago de Compostela | Santiago | Galicia | Sordina |
| Hospital Universitario Gregorio Marañón | Madrid | Madrid | Sordina |
| Hospital Ramón y Cajal | Madrid | Madrid | Sordina |
| Hospital Virgen de la Arrixaca | Murcia | Murcia | Intrabeam |
| Hospital Quirón Salud de Torrevieja | Torrevieja | Valencia | Mobetron |
| Hospital Universitari i Politècnic la Fe | Valencia | Valencia | Sordina |
Los centros invitados estuvieron representados por 28 especialistas en oncología radioterápica, 11 en cirugía y 7 en ginecología.
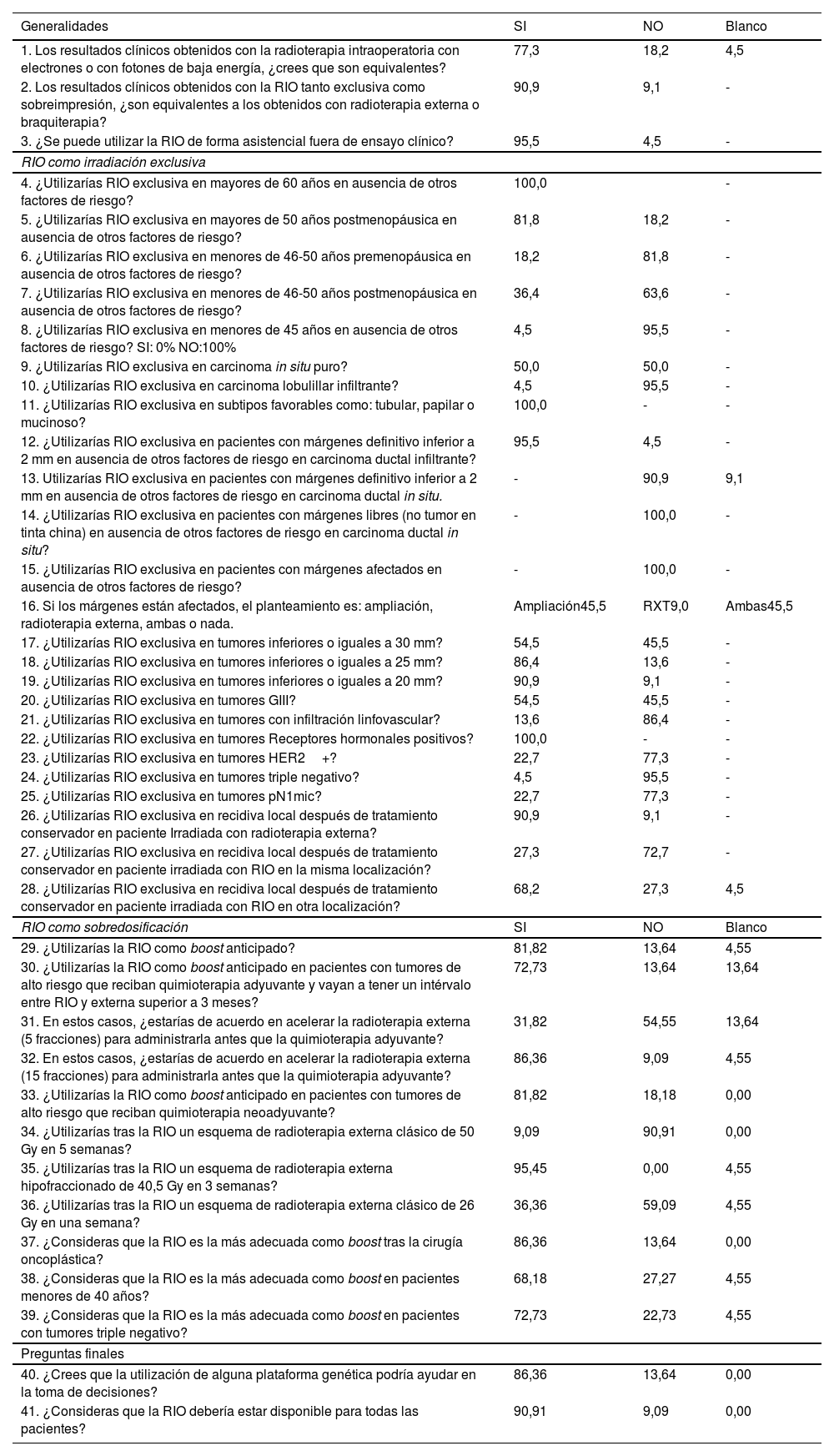
En la tabla 2, se muestran los porcentajes de respuestas a las preguntas efectuadas al panel de expertos. Se han clasificados en generalidades, RIO como tratamiento exclusivo, RIO como sobredosificación y preguntas finales
Listado de preguntas y porcentaje de respuestas
| Generalidades | SI | NO | Blanco |
|---|---|---|---|
| 1. Los resultados clínicos obtenidos con la radioterapia intraoperatoria con electrones o con fotones de baja energía, ¿crees que son equivalentes? | 77,3 | 18,2 | 4,5 |
| 2. Los resultados clínicos obtenidos con la RIO tanto exclusiva como sobreimpresión, ¿son equivalentes a los obtenidos con radioterapia externa o braquiterapia? | 90,9 | 9,1 | - |
| 3. ¿Se puede utilizar la RIO de forma asistencial fuera de ensayo clínico? | 95,5 | 4,5 | - |
| RIO como irradiación exclusiva | |||
| 4. ¿Utilizarías RIO exclusiva en mayores de 60 años en ausencia de otros factores de riesgo? | 100,0 | - | |
| 5. ¿Utilizarías RIO exclusiva en mayores de 50 años postmenopáusica en ausencia de otros factores de riesgo? | 81,8 | 18,2 | - |
| 6. ¿Utilizarías RIO exclusiva en menores de 46-50 años premenopáusica en ausencia de otros factores de riesgo? | 18,2 | 81,8 | - |
| 7. ¿Utilizarías RIO exclusiva en menores de 46-50 años postmenopáusica en ausencia de otros factores de riesgo? | 36,4 | 63,6 | - |
| 8. ¿Utilizarías RIO exclusiva en menores de 45 años en ausencia de otros factores de riesgo? SI: 0% NO:100% | 4,5 | 95,5 | - |
| 9. ¿Utilizarías RIO exclusiva en carcinoma in situ puro? | 50,0 | 50,0 | - |
| 10. ¿Utilizarías RIO exclusiva en carcinoma lobulillar infiltrante? | 4,5 | 95,5 | - |
| 11. ¿Utilizarías RIO exclusiva en subtipos favorables como: tubular, papilar o mucinoso? | 100,0 | - | - |
| 12. ¿Utilizarías RIO exclusiva en pacientes con márgenes definitivo inferior a 2 mm en ausencia de otros factores de riesgo en carcinoma ductal infiltrante? | 95,5 | 4,5 | - |
| 13. Utilizarías RIO exclusiva en pacientes con márgenes definitivo inferior a 2 mm en ausencia de otros factores de riesgo en carcinoma ductal in situ. | - | 90,9 | 9,1 |
| 14. ¿Utilizarías RIO exclusiva en pacientes con márgenes libres (no tumor en tinta china) en ausencia de otros factores de riesgo en carcinoma ductal in situ? | - | 100,0 | - |
| 15. ¿Utilizarías RIO exclusiva en pacientes con márgenes afectados en ausencia de otros factores de riesgo? | - | 100,0 | - |
| 16. Si los márgenes están afectados, el planteamiento es: ampliación, radioterapia externa, ambas o nada. | Ampliación45,5 | RXT9,0 | Ambas45,5 |
| 17. ¿Utilizarías RIO exclusiva en tumores inferiores o iguales a 30 mm? | 54,5 | 45,5 | - |
| 18. ¿Utilizarías RIO exclusiva en tumores inferiores o iguales a 25 mm? | 86,4 | 13,6 | - |
| 19. ¿Utilizarías RIO exclusiva en tumores inferiores o iguales a 20 mm? | 90,9 | 9,1 | - |
| 20. ¿Utilizarías RIO exclusiva en tumores GIII? | 54,5 | 45,5 | - |
| 21. ¿Utilizarías RIO exclusiva en tumores con infiltración linfovascular? | 13,6 | 86,4 | - |
| 22. ¿Utilizarías RIO exclusiva en tumores Receptores hormonales positivos? | 100,0 | - | - |
| 23. ¿Utilizarías RIO exclusiva en tumores HER2+? | 22,7 | 77,3 | - |
| 24. ¿Utilizarías RIO exclusiva en tumores triple negativo? | 4,5 | 95,5 | - |
| 25. ¿Utilizarías RIO exclusiva en tumores pN1mic? | 22,7 | 77,3 | - |
| 26. ¿Utilizarías RIO exclusiva en recidiva local después de tratamiento conservador en paciente Irradiada con radioterapia externa? | 90,9 | 9,1 | - |
| 27. ¿Utilizarías RIO exclusiva en recidiva local después de tratamiento conservador en paciente irradiada con RIO en la misma localización? | 27,3 | 72,7 | - |
| 28. ¿Utilizarías RIO exclusiva en recidiva local después de tratamiento conservador en paciente irradiada con RIO en otra localización? | 68,2 | 27,3 | 4,5 |
| RIO como sobredosificación | SI | NO | Blanco |
| 29. ¿Utilizarías la RIO como boost anticipado? | 81,82 | 13,64 | 4,55 |
| 30. ¿Utilizarías la RIO como boost anticipado en pacientes con tumores de alto riesgo que reciban quimioterapia adyuvante y vayan a tener un intérvalo entre RIO y externa superior a 3 meses? | 72,73 | 13,64 | 13,64 |
| 31. En estos casos, ¿estarías de acuerdo en acelerar la radioterapia externa (5 fracciones) para administrarla antes que la quimioterapia adyuvante? | 31,82 | 54,55 | 13,64 |
| 32. En estos casos, ¿estarías de acuerdo en acelerar la radioterapia externa (15 fracciones) para administrarla antes que la quimioterapia adyuvante? | 86,36 | 9,09 | 4,55 |
| 33. ¿Utilizarías la RIO como boost anticipado en pacientes con tumores de alto riesgo que reciban quimioterapia neoadyuvante? | 81,82 | 18,18 | 0,00 |
| 34. ¿Utilizarías tras la RIO un esquema de radioterapia externa clásico de 50 Gy en 5 semanas? | 9,09 | 90,91 | 0,00 |
| 35. ¿Utilizarías tras la RIO un esquema de radioterapia externa hipofraccionado de 40,5 Gy en 3 semanas? | 95,45 | 0,00 | 4,55 |
| 36. ¿Utilizarías tras la RIO un esquema de radioterapia externa clásico de 26 Gy en una semana? | 36,36 | 59,09 | 4,55 |
| 37. ¿Consideras que la RIO es la más adecuada como boost tras la cirugía oncoplástica? | 86,36 | 13,64 | 0,00 |
| 38. ¿Consideras que la RIO es la más adecuada como boost en pacientes menores de 40 años? | 68,18 | 27,27 | 4,55 |
| 39. ¿Consideras que la RIO es la más adecuada como boost en pacientes con tumores triple negativo? | 72,73 | 22,73 | 4,55 |
| Preguntas finales | |||
| 40. ¿Crees que la utilización de alguna plataforma genética podría ayudar en la toma de decisiones? | 86,36 | 13,64 | 0,00 |
| 41. ¿Consideras que la RIO debería estar disponible para todas las pacientes? | 90,91 | 9,09 | 0,00 |
Tal como se muestra en la tabla 2, se obtuvo un nivel de consenso fuerte en la equiparación de los resultados clínicos con los diferentes tipos de RIO y muy fuerte en la afirmación de la similitud de los resultados de la RIO a los obtenidos con irradiación externa o braquiterapia. El panel de expertos obtuvo un nivel de consenso muy fuerte en el hecho de poder utilizar de forma asistencial la RIO.
Irradiación intraoperatoria exclusivaEn cuanto a la edad existió un nivel de consenso muy fuerte para utilizarla la RIO por encima de 60 años y fuerte para hacerlo por encima de 50 años y posmenopausia. También existió un nivel de consenso fuerte para no utilizarla de forma exclusiva por debajo de 50 y premenopausia y muy fuerte para no utilizarla por debajo de los 45 años. No se alcanzó el consenso entre 46 y 50 años y posmenopausia, pues la mayoría de los expertos (63%) opinó que no debería utilizarse en este grupo de pacientes.
No se alcanzó el consenso en la utilización de la RIO exclusiva en el carcinoma intraductal (CDIS), se llegó a un nivel de consenso fuerte en la no utilización en el carcinoma lobulillar y en cambio sí a favor de la utilización en cáncer de mama con subtipos favorables.
El nivel de consenso fue muy fuerte para la utilización de la RIO exclusiva en caso de márgenes inferiores a 2 mm en el tumor infiltrante y de no hacerlo en el CDIS. Ocurrió lo mismo en el caso de afectación de márgenes; en este caso, el 45,5% optaría por ampliación, el 45,5% por ampliación e irradiación externa y el 9% por irradiación externa exclusiva.
En cuanto al tamaño tumoral, no se alcanzó el consenso en utilizar la RIO exclusiva en tumores entre 25 y 30 mm, pero sí que existió consenso muy fuerte, en tumores inferiores a 25 mm.
La mayoría de los centros (54,55%) optaría por utilizar la RIO exclusiva en GIII, pero sin llegar al nivel del consenso, que sí se alcanzó, de forma muy fuerte, para no utilizarla en tumores con infiltración linfovascular.
En cuanto a los subtipos tumorales, existe un nivel de consenso muy fuerte para utilizar la técnica en tumores con receptores hormonales positivos y fuerte para no utilizarla en caso de tumores HER2+.
La utilización de RIO como rescate de recidiva local después de la irradiación externa alcanzó un nivel de consenso muy fuerte.
Irradiación intraoperatoria como sobredosificaciónEl panel de expertos, con nivel de consenso fuerte, estuvo de acuerdo en utilizar la RIO como sobredosificación anticipada y con un consenso más débil si se conoce de forma previa la necesidad de quimioterapia adyuvante que provocaría un intervalo de tiempo entre las irradiaciones de más de 3 meses. En estos casos existe un nivel de consenso muy fuerte para realizar la irradiación en 15 fracciones previa a la quimioterapia, pero no se alcanzó el consenso para utilizar un esquema ultrahipofraccionado de 5 días.
Se alcanzó un nivel de consenso fuerte para utilizar la RIO como sobredosificación después de tratamiento sistémico primario, también se llegó a un nivel de consenso (86%) en considerar la RIO como la técnica más adecuada tras la cirugía oncoplástica y con un nivel más débil (72%) en tumores triple negativos. No se alcanzó consenso, aunque existe una tendencia favorable (68%) en menores de 40 años.
En relación con el esquema de irradiación externa complementario, existió un nivel de consenso muy fuerte en no utilizar el esquema clásico de radioterapia y si utilizar el esquema de 15 fracciones. No se alcanzó consenso en utilizar las 5 fracciones.
Preguntas finalesLos expertos consideraron que la utilización de una plataforma génica podría ayudar en la toma decisiones y que la RIO debería estar disponible para todas las pacientes, ambas con un nivel de consenso muy fuerte.
Conclusiones y futuroEl presente consenso pretende establecer las guías respecto a las indicaciones de RIO exclusiva o como boost anticipado, y ser una ayuda para la toma conjunta de decisiones. En el diseño del mismo se han tenido en cuenta los resultados clínicos independientemente de los aspectos tecnológicos y dosimétricos, de forma que, las principales conclusiones a las que llegó el panel de expertos son las siguientes:
- 1.
Los resultados en la salud (efectividad y seguridad) son equivalentes con las distintas tecnologías disponibles, tanto si se utiliza como tratamiento exclusivo o como boost anticipado, y también son equivalentes a los obtenidos con radioterapia externa o braquiterapia de alta tasa. La RIO puede utilizarse de forma asistencial fuera de ensayo clínico.
- 2.
A las pacientes mayores de 50 años, postmenopáusicas que presenten carcinomas precoces, ductal u otro subtipo favorable, de tamaño menor o igual a 25 mm, con expresión de receptores hormonales y HER2 negativo (Luminal A y seudo-B), con axila clínicamente negativa, pueden tratarse con RIO exclusiva.
- 3.
La RIO se presenta como opción para la realización de segundas cirugías conservadoras en las pacientes previamente tratadas con radioterapia externa si el nuevo tumor cumple estrictamente los criterios anteriormente descritos.
- 4.
La RIO puede utilizarse como boost anticipado en las pacientes con tumores de alto riesgo (HER2 y especialmente triples negativos) que van a recibir tratamiento sistémico adyuvante y cuyo intervalo entre la cirugía y la radioterapia externa se prevea mayor de 3 meses. La radioterapia externa se realiza posteriormente de forma hipofraccionada estándar (15 sesiones).
- 5.
También en la cirugía oncoplástica la RIO puede utilizarse como boost anticipado y se consideraría la mejor opción en estas situaciones.
- 6.
La aplicación de una plataforma génica ayudaría en la toma de decisiones.
- 7.
La RIO debería ser una técnica disponible para todas las pacientes.
Por último, hay que destacar el alto grado de satisfacción de los equipos quirúrgicos de la mama y oncólogos radioterápicos con la técnica y, lo más importante, el alto grado de satisfacción de las pacientes con el resultado estético y con el bienestar físico y psicosocial que aporta la realización del tratamiento local del cáncer de mama en un acto único.
FinanciaciónNo se ha recibido ningún fondo de financiación específico para la realización de esta revisión.
Los autores declaran que no tienen intereses financieros en conflicto que podrían haber influido en el trabajo reportado en este artículo.
Consideraciones éticas y consentimiento del pacienteAl tratarse de un artículo de revisión no aplica la aprobación por parte del Comité de Ética ni el consentimiento de los pacientes.
AutoríaAutores que han contribuido en la realización de la encuesta y análisis de los resultados: Arantxa Eraso, Manuel Algara, Javier Sanz y Reyes Ibáñez
Todos los autores han contribuido a la redacción y revisión del artículo.
AgradecimientosA la Sociedad Española de Oncología Radioterápica, Sociedad Española de Senología y Patología Mamaria, Carl Zeiss, Axxent, Sordina y Mobetron y a todos los participantes.
Profesionales participantes en la contestación de la encuesta y en la reunión de consenso
| Apellidos, Nombre | Especialidad | Centro |
| Cejas Arjoña, Francisco Javier | CIR | Hospital Universitario Reina Sofía |
| Rioja Torres, Pilar | CIR | Hospital Universitario Reina Sofía |
| Espinosa Calvo, Maria | OR | Hospital Universitario Reina Sofía |
| Ibáñez Carreras, Reyes | OR | Hospital Clínico |
| Ibáñez Carreras, Reyes | OR | Hospital Miguel Servet |
| Alonso Martínez, M Begoña | CIR | HUCA |
| Perez Payo, M Paz | OR | HUCA |
| Caminero Cueva, Maria Jesús | OR | HUCA |
| Canteli Castañón, Mercedes | OR | HUCA |
| Juan Rijo, Germán | OR | HUCA |
| Fernández Carrión, M Jezabel | CIR | Hospital Universitario Doctor Negrín |
| Jiménez Diaz, Laura | CIR | Hospital Universitario Doctor Negrín |
| Rodríguez Ibarria, Nievas Gloria | OR | Hospital Universitario Doctor Negrín |
| Pinar Sedeño, María Beatriz | OR | Hospital Universitario Doctor Negrín |
| Reyes Rodríguez, M Isabel | GINE | HUMIC |
| Cazorla Betancor, Manuel | GINE | HUMIC |
| Jiménez Medina, M Concepción | GINE | HUMIC |
| Pérez Padrón, Nedabia | GINE | HUMIC |
| Lara Jiménez, Pedro | OR | Hospitales Universitarios San Roque |
| Anchuelo, Javier | OR | Hospital Marqués de Valdecilla |
| Eguía Larrea, Marta | CIR | Hospital Universitario de Salamanca |
| Alonso Rodríguez, Orlanda | OR | Hospital Universitario de Salamanca |
| Luna Tomás, Miguel Angel | CIR | Hospital Germans Trias-ICO |
| Comas, Silvia | OR | Hospital Germans Trias-ICO |
| Molina, Jessica Guadalupe | OR | Hospital Germans Trias-ICO |
| Oses, Gabriela | OR | Hospital Clinic |
| Algara López, Manuel | OR | Hospital del Mar |
| Sanz Latiesas, Xavier | OR | Hospital del Mar |
| García Zamora, Ivan | OR | IMOR-Unidad de Serología Avanzada |
| Guix Melcior, Benjamín | OR | IMOR-Unidad de Serología Avanzada |
| Ulla Miravet, Maria | GINE | IMOR-Unidad de Serología Avanzada |
| Alonso Ruano, Luis Miguel | GINE | Hospital Josep Trueta-ICO |
| Eraso, Arantxa | OR | Hospital Josep Trueta-ICO |
| Pla Farnós, Mª Jesús | GINE | Hospital de Bellvitge-ICO |
| Martínez Pérez, Evelyn | OR | Hospital de Bellvitge-ICO |
| Marcos Jiménez, Francisco J. | OR | Hospital Universitario Cáceres |
| Salvador, Nuria | OR | Hospital Universitario de Santiago |
| Rivas Fidalgo, Sonia | CIR | Hospital Ramón y Cajal |
| Hernanz de Luca, Raul | OR | Hospital Ramón y Cajal |
| Calín Lorca, Ana | OR | Hospital Universitario Gregorio Marañón |
| Piñero, Antonio | CIR | Hospital Virgen de la Arrixaca |
| Servet Pérez de Lema, Carmen María | CIR | Hospital Virgen de la Arrixaca |
| Cárdenas Cánovas, Enrique | OR | Hospital Virgen de la Arrixaca |
| De la Fuente Muñoz, Isabel | OR | Hospital Virgen de la Arrixaca |
| Cañón Rodríguez, Rosa M | OR | Hospital Quiron Salud - Torrevieja |
| Ripoll Orts, Francisco | CIR | Hospital Universitari i Politècnic la Fe |
CIR: Cirugía; OR: Oncología Radioterápica; GINE: Ginecología; HUCA: Hospital Universitario Central de Asturias; HUMIC: Hospital Universitario Materno Infantil de Canarias; ICO: Instituto Catalán de Oncología.
Los autores declaran los siguientes intereses relaciones personales que podrían considerarse como posibles conflictos de intereses:
Manuel Algara y Antonio Piñero informan de una relación con la editorial de la revista que incluye membresía en el equipo editorial de la revista.