Tras la cirugía conservadora de cáncer de mama está indicada la radioterapia adyuvante, dicho tratamiento se puede realizar como irradiación parcial en casos bien seleccionados y sin factores de riesgo de recaída local, siguiendo las directrices de los consensos internacionales. La irradiación parcial se administra mediante diversas técnicas como son la braquiterapia intersticial, la radioterapia externa y también mediante técnicas de radioterapia intraoperatoria en el mismo acto quirúrgico, gracias a aceleradores móviles de electrones o de fotones de baja energía. Esto permite realizar el tratamiento local en un solo día alargando el tiempo quirúrgico, pero con ventajas en cuanto a la correcta localización del lecho tumoral, la inmediatez de la irradiación y una mayor satisfacción de las pacientes. Existe una amplia experiencia en el uso de esta técnica con resultados comparables a otras modalidades de irradiación parcial en cuanto a control local, mínimos efectos secundarios, buen resultado estético e incluso mejor supervivencia no relacionada con la neoplasia. En este artículo se revisa la evidencia en el uso de la radioterapia intraoperatoria en el cáncer de mama en estadio inicial a partir de los principales ensayos que la comparan con la irradiación completa de la mama, para confirmar que es un tratamiento ya disponible para la práctica fuera de ensayo clínico en las pacientes candidatas para irradiación parcial.
After conservative surgery in breast cancer adjuvant radiation therapy is indicated, such treatment can be performed as partial irradiation in well-selected cases and without risk factors for local relapse following the guidelines of international consensus. Partial irradiation is performed by several techniques such as interstitial brachytherapy, external radiation therapy, and also through intraoperative radiation therapy techniques at the same surgical act due to mobile electron accelerators or low-energy photons units. This allows local treatment to be performed in a single day, increasing the surgical time, but with advantages in terms of the tumor bed localization accuracy, immediacy of irradiation and greater patient satisfaction. There is extensive experience in the use of this technique with results comparable to other ways of partial irradiation in terms of local control, minimal side effects, good cosmetic results and even better no cancer related survival. This article reviews the evidence in the use of intraoperative radiation therapy in early-stage breast cancer derived from the main trials comparing it to whole breast irradiation, to confirm that it is already available for standard of care practice in patients who are candidates for partial irradiation.
El tratamiento local estándar para el cáncer de mama en fase inicial, en los estadios I y II, es la cirugía conservadora de mama seguida de radioterapia externa de toda la mama (WBI, por sus siglas en inglés). A pesar de que está demostrado que la WBI disminuye la posibilidad de recurrencia local y reduce el riesgo de muerte debido al cáncer de mama, presenta una serie de efectos secundarios en la propia mama, la piel y la mama contralateral, y en los órganos críticos como el corazón1 y el pulmón. Sin embargo, en los últimos tiempos, las grandes mejoras de las técnicas de irradiación y la reducción de las dosis en los tejidos sanos han permitido disminuir de forma drástica la incidencia de los efectos secundarios2.
En contraste con la WBI, la irradiación parcial acelerada de mama (APBI, por sus siglas en inglés) se caracteriza por dirigir y localizar la radiación únicamente a la parte de la mama donde se ha resecado quirúrgicamente el tumor3, con base en que la mayoría de recurrencias ipsilaterales tienen lugar dentro del mismo cuadrante de la lesión inicial (de 80 a 85%)4. Cuando se compara con la WBI, la APBI presenta varios beneficios como la reducción del tiempo de tratamiento y de la irradiación de los tejidos sanos5, y representa una alternativa segura a la WBI en las pacientes seleccionadas de cáncer de mama en estadio inicial6.
La radioterapia intraoperatoria (RIO o IORT por sus siglas en inglés) de mama se ha incorporado desde el año 2000 como una modalidad de APBI, ya que permite irradiar solo el lecho tumoral durante la propia cirugía7, utilizando electrones o rayos X de baja energía8, y constituye una modalidad en franca expansión. La presente revisión pretende demostrar que la RIO se puede utilizar de manera habitual en las pacientes seleccionadas de cáncer de mama en estadio inicial con base en la evidencia de los resultados publicados y las recomendaciones internacionales9.
Evidencia clínica de la irradiación parcialLa APBI se caracteriza por irradiar el lecho tumoral, incluyendo un margen de tejido adyacente para incluir la posible enfermedad microscópica y las variaciones diarias en el tratamiento, si se realiza con radioterapia externa. Este volumen es irradiado con una dosis por fracción más alta durante un programa de tratamiento más breve que la WBI, generalmente entre 5 y 15 sesiones. Al dirigir la radiación al área del tumor resecado, la APBI evita irradiar los tejidos adyacentes, reduciendo así las secuelas a largo plazo. Se ha demostrado que la APBI disminuye significativamente la dosis al corazón10,11. Por ello, la APBI puede reducir la morbimortalidad cardiaca, ambas reconocidas como eventos adversos a largo plazo de la WBI.
Por otra parte, los resultados clínicos muestran que la APBI puede ser tan efectiva como la WBI en términos de supervivencia y de control local de recurrencias, siempre en las pacientes seleccionadas de bajo riesgo12,13. Para estas pacientes (de 15 a 30% del total de los casos de cáncer de mama en un servicio de radioterapia), la APBI es una alternativa a la WBI que consigue una excelente tasa de control local y resultados estéticos, en la mayoría de los casos, buenos o excelentes.
Siguiendo la evidencia clínica positiva de la APBI, se han publicado directrices y consensos por parte de la American Society for Radiation Oncology (ASTRO)5, el Groupe Européen de Curiétherapie-European Society for Therapeutic Radiology and Oncology (GEC-ESTRO)14, la American Society of Breast Surgeons (ASBS)15 y la American Brachytherapy Society (ABS)16. El consenso inicial publicado por ASTRO en 2009 establecía 3 grupos de pacientes: «apropiado», «con precaución» y «no apropiado» para el tratamiento mediante APBI fuera del contexto de ensayos clínicos5. Este consenso se actualizó en 2016 para revisar los criterios requeridos para recibir APBI (edad, histología, tamaño total del tumor, márgenes, estado de los ganglios, etc.) y las técnicas disponibles para realizarlas. La APBI, por tanto, se ha convertido en una opción de tratamiento estándar para las pacientes adecuadamente seleccionadas con cáncer de mama en estadio inicial, puesto que ha demostrado excelentes resultados clínicos en los seguimientos a largo plazo.
La APBI se puede realizar mediante diferentes técnicas6. La variedad de modalidades implica que pueden producirse diferencias entre ellas en cuanto a la distribución dosimétrica, la administración, los efectos adversos y los resultados de tolerancia. La técnica implementada por vez primera y que por tanto cuenta con seguimientos más largos es la braquiterapia intersticial multicatéter con fuentes de Iridio 192 de baja o de alta tasa. Esta consiste en la colocación de un implante formado por catéteres situados en disposición paralela en el lecho tumoral para administrar, una vez se dispone del resultado patológico, un tratamiento fraccionado que más frecuentemente ha consistido en 7 a 10 sesiones en 3 a 5 días de tratamiento. Los resultados más destacados de esta técnica proceden del ensayo publicado por Polgár et al., que con 20 años de seguimiento demuestra la eficacia de esta técnica con un resultado estético favorable17. El ensayo aleatorizado de GEC-ESTRO que en 1.184 pacientes compara esta técnica con la WBI demuestra una eficacia similar del brazo de irradiación parcial con unos resultados de estética y calidad de vida similares, pero con menores efectos secundarios18.
Otra técnica de APBI altamente extendida es la radioterapia externa, dada la disponibilidad de la misma en todos los centros de oncología radioterápica. Se realiza mediante haces externos de fotones o combinación de fotones y electrones mediante diversas incidencias e incluso con técnicas avanzadas de intensidad modulada o arcoterapia volumétrica. Los ensayos iniciales utilizaron esquemas de tratamiento de 10 sesiones en 5 días (bifraccionamiento) con buenos resultados de control de la enfermedad19, menos efectos secundarios agudos, pero con un discreto incremento de la toxicidad crónica o deterioro de la estética20,21. En un ensayo aleatorizado comparando la APBI con la WBI, utilizando técnicas de intensidad modulada, fraccionamiento diario y 5 sesiones en total, se obtuvo una equivalencia en los resultados de control local a 10 años y una evidente reducción de la toxicidad crónica, por lo que este esquema se ha convertido en uno de los más utilizados para la irradiación parcial22.
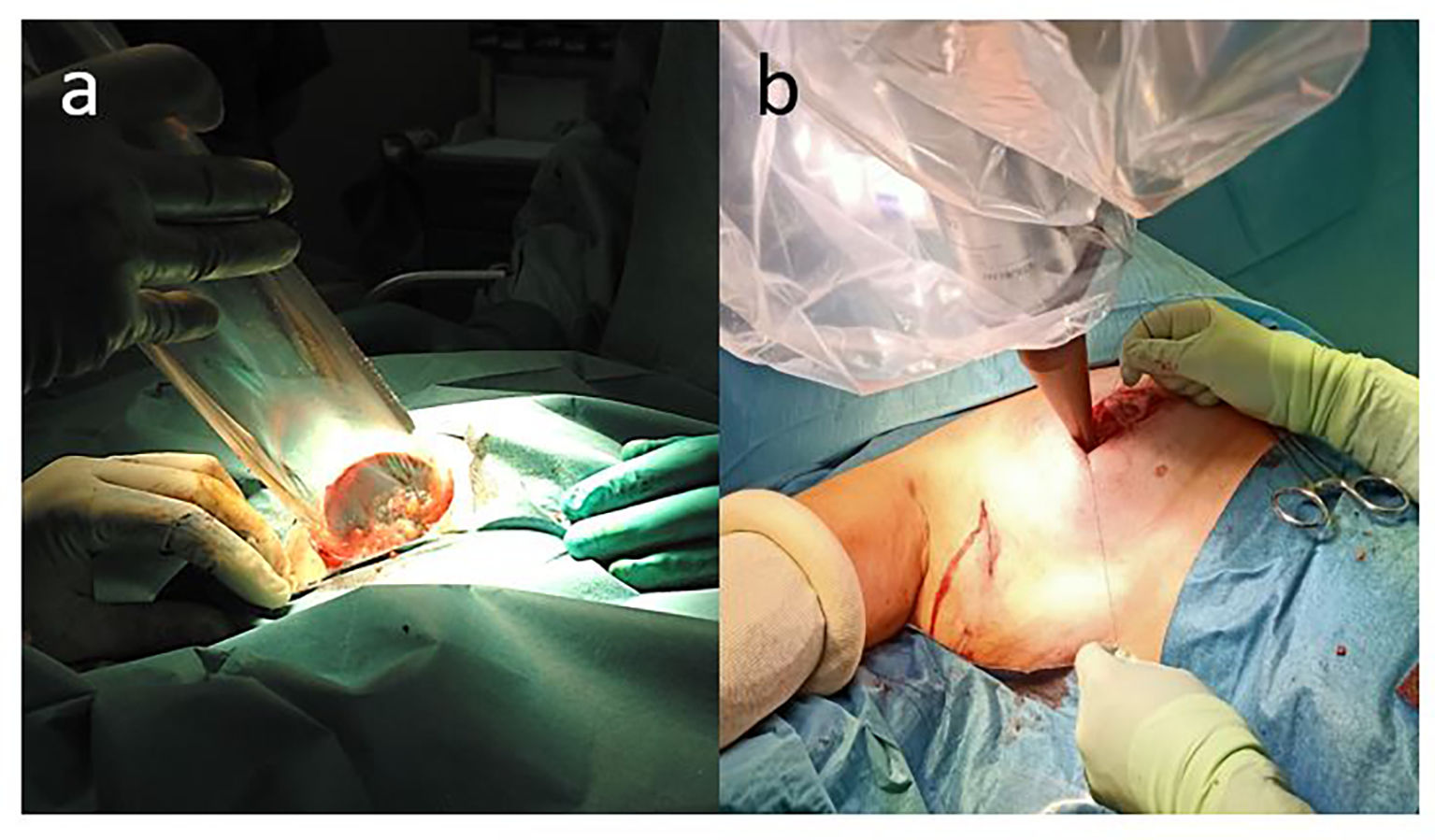
Evidencia clínica de la radioterapia intraoperatoria en el cáncer de mamaLa última técnica incorporada como opción para la APBI es la RIO. Esta se puede realizar mediante unidades móviles de electrones o bien con sistemas de fotones de baja energía. La técnica mediante aceleradores de electrones (LIAC® [fig. 1A] y Mobetron® [fig. 1B]) supone que inmediatamente a la realización de la tumorectomía se remodela el lecho tumoral de forma que mediante la disección digital hasta la fascia pectoral se habilita espacio para poner provisionalmente un disco protector que impide la profundización del haz y por otro lado se realiza una aproximación de los márgenes laterales para exponer el tejido a riesgo y realizar la irradiación (fig. 2A). La técnica más reciente mediante fotones de baja energía (sistemas Intrabeam® [fig. 1C] y Xoft-Axxent® [fig. 1D]) que dispone de un mayor rendimiento en profundidad y por otro lado aplicadores esféricos que se adaptan a la cavidad de tumorectomía sin remodelación de la misma (fig. 2B), tiene como ventajas una menor curva de aprendizaje y menos requerimientos de radio-protección dado que no precisan de un aislamiento especial del quirófano. Ambas técnicas implican solo un discreto incremento en el tiempo operatorio. La RIO tiene la gran ventaja de una mayor precisión en la localización de la cavidad de la tumorectomía, la inmediatez del tratamiento que dificulta la repoblación tumoral, el incremento de la respuesta inmunológica por el efecto en el microambiente peritumoral de una dosis elevada de radioterapia y la gran comodidad de poder realizar todo el tratamiento local, la cirugía y la radioterapia, en un solo tiempo.
La principal evidencia clínica de la efectividad de la RIO como forma de APBI para el tratamiento del cáncer de mama en estadio inicial proviene de 2 ensayos aleatorizados y prospectivos. El ensayo ELIOT del Istituto Europeo di Oncologia de Milán, aleatorizó 1.305 pacientes para recibir WBI 50 Gy seguida de sobreimpresión del lecho tumoral versus RIO mediante electrones a una dosis de 21 Gy. La tasa de recaída ipsilateral a más de 5 años se cifraba en 4,4% vs. 0,4% en el brazo WBI23. Los resultados publicados a más largo plazo confirman una mayor tasa de recaída en el brazo de RIO (12,6% vs. 2,4%)24. Es muy remarcable que las pacientes tratadas dentro de este ensayo no corresponden a los criterios de irradiación parcial dentro del grupo «apropiado» de los últimos consensos. Recientemente en un análisis de las pacientes tratadas dentro del ensayo ELIOT, las pacientes agrupadas en el grupo más favorable por sus características patológicas, no demuestran diferencias significativas en control local respecto al brazo de WBI25. Esto viene a corroborar la validez de esta técnica para la APBI26.
El segundo ensayo aleatorizado TARGIT-IORT, que utilizó fotones de 50 kV de un sistema Intrabeam®, se propuso en 1999 para comparar una única dosis de RIO durante la tumorectomía frente a WBI. Los estudios piloto previos realizados desde 1998 habían demostrado la seguridad y viabilidad de este enfoque27. TARGIT-IORT es un estudio prospectivo, internacional, multicentro, abierto y aleatorizado de fase III, en el que se trataron 1.140 pacientes. Se trata de un ensayo de no inferioridad, de forma que el riesgo de recurrencia local del brazo de RIO menos el riesgo con WBI no debería presentar una diferencia absoluta entre ambos brazos mayor de 2,5% a los 5 años28. En dicho estudio las pacientes que recibieron la RIO inmediatamente a la resección quirúrgica tuvieron mejores resultados en el control local que la cohorte de pacientes que lo recibieron tras obtener el resultado de anatomía patológica29. Los resultados de TARGIT-A están sujetos a cierta discusión. No obstante, cabe tener en cuenta que participaron pacientes con perfil de riesgo más alto que en otros estudios de APBI. Por ejemplo, los ensayos que comparan la radioterapia externa con no recibir ningún tipo de radioterapia presentaron una recurrencia local a los 5 años de 2 a 3 veces más alta que la obtenida en TARGIT-IORT30. Las pacientes incluidas en TARGIT-A comprendían una población de riesgo medio, aunque con un número sustancial de pacientes con mayor riesgo de recaída: pacientes menores de 70 años (83%), con tumores de tamaño superior a 2 cm (16%), cáncer de grado 3 (20%), ganglios afectados (22%) y receptores hormonales negativos (19%). La diferencia absoluta de las tasas en bruto de recurrencia local a los 5 años de seguimiento es del 1,16%, por lo que se cumple el criterio de no inferioridad preespecificado de 2,5%. No hubo diferencias en el control local o distante, la preservación de la mama o la mortalidad por cáncer de mama tras una mediana de seguimiento de 9 años. En cambio, las muertes por causas ajenas al cáncer de mama fueron significativamente menores en TARGIT-IORT, con tasas a 12 años de 5,41% frente al 9,85%28. La RIO habría supuesto una disminución del 4,44% en fallecimientos por problemas cardiovasculares, de pulmón y de otros tipos de cáncer28, resultando en un beneficio estadísticamente significativo31. Otros beneficios que obtuvieron las pacientes tratadas con RIO fue la menor incidencia de dolor, una toxicidad reducida y una calidad de vida superior. La RIO adaptada al riesgo en las pacientes de cáncer de mama en fase inicial de TARGIT-IORT evitó la inconveniencia y la toxicidad asociadas a la WBI en 8 de cada 10 pacientes. Además, si bien los casos de recurrencia local son poco frecuentes en RIO y WBI, las pacientes de TARGIT-IORT mantienen un excelente pronóstico en estas situaciones, lo que no siempre sucede en el grupo control. Con esta técnica se han tratado al menos 44.752 pacientes desde 1998 hasta principios del 2020 en 265 centros de 35 países29, demostrando su aceptación.
Por otra parte, diversos estudios con otros sistemas de fotones de baja energía como XoftAxxent® han dado resultados similares8,32 que confirman los obtenidos en el estudio TARGIT. En 2018 se publicó un análisis retrospectivo de 184 pacientes a las que se administró RIO con rayos X de baja energía, clasificándolas en los 3 grupos que establecen los criterios revisados de ASTRO, encontrándose que los criterios eran útiles, aunque podrían requerir alguna modificación específica33. Los prometedores resultados de TARGIT-IORT han llevado a ofrecer a las mujeres que no reúnen los criterios de elegibilidad, participar en el ensayo TARGIT-B, en el que se compara la RIO como sobreimpresión en sustitución de la radioterapia externa. Este estudio se encuentra en marcha en 38 centros internacionales, con una cohorte de mujeres más jóvenes o de riesgo más elevado. El objetivo es evaluar la superioridad del tratamiento en términos de control local y supervivencia.
Recientemente en nuestro país 46 expertos en RIO (28 especialistas en oncología radioterápica, 11 en cirugía y 7 en ginecología) se reunieron durante el 40 Congreso de la Sociedad Española de Senología y Patología Mamaria y realizaron un consenso sobre la utilización de esta técnica34. Se elaboró una guía de utilización de la RIO como APBI o como sobredosificación y el 95,45% de los participantes afirman que la RIO puede ser utilizada de forma habitual y el 90,9% consideran que debería estar disponible para todas las pacientes.
ConclusionesLa evidencia clínica de APBI y RIO demuestra una eficacia similar a la WBI, con un potencial de riesgo mayor de recurrencia local, pero con menor mortalidad por causas ajenas al cáncer de mama. Es destacable que tanto ELIOT como TARGIT incluyeron pacientes que no habrían sido seleccionadas para RIO según los criterios actuales por lo que sus resultados demuestran, por tanto, el papel crucial de una adecuada selección de pacientes. Así, las pacientes bien seleccionas con tumores ductales de hasta 3 cm, grado I o II, unifocales, sin carcinoma intraductal extenso, con receptores hormonales positivos y ganglios negativos son las candidatas para recibir APBI y en concreto con la RIO de forma habitual.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Consideraciones éticasEl presente trabajo no incluye experimentación con seres humanos ni animales.
Se dispone de los consentimientos pertinentes para la publicación de datos gráficos anonimizados.
Conflictos de interesesJavier Sanz ha recibido honorarios de Carl Zeiss como conferenciante experto.
Manuel Algara ha recibido honorarios de Sysmex, Siemens y Carl Zeiss como conferenciante experto. El resto de los autores declaran no tener conflicto de intereses.