Los linfocitos B maduros emergen de la médula ósea y continúan diversificando su repertorio genético de inmunoglobulinas a través de 2 procesos dependientes de antígeno, conocidos como hipermutación somática y cambio de isotipo. Estos 2 procesos requieren AID, una enzima con la capacidad de editar el ADN. Predominantemente, ambos procesos tienen lugar en los centros germinales, donde los linfocitos B interaccionan con antígenos peptídicos presentados por los linfocitos T, en lo que se conoce como respuesta T-dependiente (TD). Estudios recientes demuestran que los linfocitos B reciben ayuda adicional de células del sistema inmune innato, que incluyen células «natural killer T», células dendríticas y distintos granulocitos, especialmente neutrófilos, eosinófilos y basófilos. Estos tipos celulares del sistema inmune innato mejoran las respuestas TD, activando vías de señalización que ayudan a los linfocitos B presentes en diferentes compartimentos, ya sea en los centros germinales, ya en los centros posgerminales linfoides o en la médula ósea. Además de mejorar y complementar la actividad de los linfocitos B en respuestas TD, las células del sistema inmune innato son capaces de producir señales por las cuales se puede iniciar una respuesta T-independiente. Este tipo de respuestas T-independiente se da en zonas específicas como la mucosa y la zona marginal del bazo. En estos casos, los linfocitos B inician respuestas que inducen a la generación rápida de anticuerpos de una manera innata. En esta revisión discutiremos los avances más recientes en los campos de la modulación del cambio de isotipo en los linfocitos B cuando estos han sido activados por células del sistema inmune innato.
Mature B cells emerge from the bone marrow and continue to diversify their immunoglobulin genes through 2 antigen-dependent processes known as somatic hypermutation and class switch recombination. These processes require AID, a DNA-editing enzyme. Although both processes predominantly occur in germinal center B cells engaged in a T cell-dependent (TD) antibody response against protein antigens recent, evidence shows that B cells receive additional help from invariant natural killer T cells, dendritic cells, and various granulocytes, including neutrophils, eosinophils, and basophils. These innate immune cells enhance TD antibody responses by delivering B-cell helper signals whether in germinal centers, postgerminal lymphoid centers, or the bone marrow. In addition to enhancing and complementing the B-cell helper activity of canonical T cells, invariant natural killer T cells, dendritic cells, and granulocytes can deliver T cell-independent B-cell helper signals at the mucosal interface and in the marginal zone of the spleen to initiate rapid innate-like antibody responses. In this review, we discuss recent advances in the role of innate cells in B-cell helper signals and in antibody diversification and production.
El sistema inmune de los mamíferos se compone de 2 ramas, el sistema adaptativo y el sistema innato. Este último es capaz de construir respuestas protectoras rápidas para hacer frente a patógenos invasivos. El sistema inmune innato incluye células dendríticas (DC por sus siglas en inglés), macrófagos, granulocitos y células «natural killer» (NK), las cuales participan en respuestas rápidas pero inespecíficas al reconocer estructuras microbianas genéricas a través de receptores de patrones de reconocimiento, los cuales incluyen los receptores toll-like (TLR)1. Por otro lado, el sistema inmune adaptativo incluye linfocitos T y B, los cuales son capaces de mediar respuestas altamente específicas, pero temporalmente más lentas. Estos linfocitos son capaces de reconocer epítopos antigénicos a través de receptores altamente diversificados gracias a recombinaciones somáticas2. Estos receptores de linfocitos B confieren protección al producir anticuerpos, también conocidos como inmunoglobulinas (Ig), las cuales son capaces de reconocer antígenos a través de dominios de unión que pueden ser de baja o alta afinidad3,4. Los precursores de los linfocitos B en médula ósea generan Ig altamente diversificadas a través de un proceso de recombinación genética. Este proceso es independiente de antígeno y lo lleva a cabo una endonucleasa conocida como RAG (del inglés, «recombination activating gene»). Esta enzima yuxtapone fragmentos no contiguos variables (V), diversos (D) y de unión (J, de «join» en inglés), los cuales conforman las regiones V de las inmunoglobulinas donde se unirá el antígeno5. Después de varios procesos de maduración, distintos subgrupos de linfocitos B maduros, los cuales coexpresan IgM e IgD en su superficie, emergen de la médula ósea y colonizan distintos compartimentos linfoides, donde pueden iniciar la fase antígeno-dependiente del desarrollo de los linfocitos B.
Los linfocitos B residentes en el folículo, conocidos como células B-2, participan fundamentalmente en respuestas de anticuerpos T-dependientes (TD), las cuales se asocian a determinantes altamente específicos, generalmente vinculados a proteínas microbianas6. La reacción del centro germinal en folículos linfoides genera anticuerpos de alta afinidad en respuestas TD, y está estrechamente regulada por linfocitos T de folículo (TFH, «T-folicular helper»). Este subtipo de linfocito TFH tiene como características fundamentales la expresión del receptor inducible y coestimulador de linfocitos T, el receptor de quimiocina CXCR5, el receptor de inhibición de respuesta de muerte celular programada (PD-1), y el factor de transcripción Bcl-67,8. Los linfocitos TFH proporcionan señales de ayuda a los linfocitos B del folículo vía CD40L (ligando de CD40), y las citocinas IL-21, IL-4 e IL-107,8. Estudios recientes han demostrado la participación de otros subtipos muy especializados de linfocitos T en respuestas de anticuerpo folicular. Estos subtipos incluyen linfocitos T reguladores de folículo y células NKT invariantes (iNKT)9–13.
En los últimos años se ha puesto de manifiesto la existencia de diferentes subgrupos de linfocitos B capaces de generar respuestas de anticuerpos rápidas independientes de células T (TI). Estos subtipos de linfocitos B extrafoliculares se conocen como linfocitos B-1, linfocitos de la zona marginal del bazo (o linfocitos IgM de memoria en humanos) y linfocitos B perisinusoidales de médula ósea14–18. Estos subtipos de linfocitos B se caracterizan por responder y generar anticuerpos frente a determinantes altamente conservados asociados a microbios de tipo carbohidrato y glucolipídico. Se conoce que las respuestas de anticuerpo TI se dan generalmente en mucosa o en la zona marginal del bazo. A diferencia de las células B foliculares, que expresan principalmente los BCR monorreactivos, muchas células B de la zona marginal del bazo expresan BCR polirreactivos que pueden reconocer patrones moleculares bacterianos17,19,20. En algunos casos, el perfil de reconocimiento de estos BCR polirreactivos es ampliamente similar al de los TLR. Los linfocitos B de la zona marginal también expresan altos niveles de TLR, permitiendo así la cooperación entre los sistemas innatos y adaptativos. En efecto, la doble activación de BCR y TLR por moléculas microbianas conservadas, tales como el lipopolisacárido (LPS) o peptidoglicano, pueden estimular respuestas de anticuerpos de baja afinidad que actúen rápidamente en espera de las respuestas más lentas de linfocitos foliculares que generan anticuerpos de alta afinidad19,21,22.
En esta minirrevisión de la literatura publicada recientemente, discutiremos los avances más recientes que han permitido ampliar nuestro conocimiento de los mecanismos por los cuales el sistema inmune innato aporta señales de ayuda a los linfocitos B.
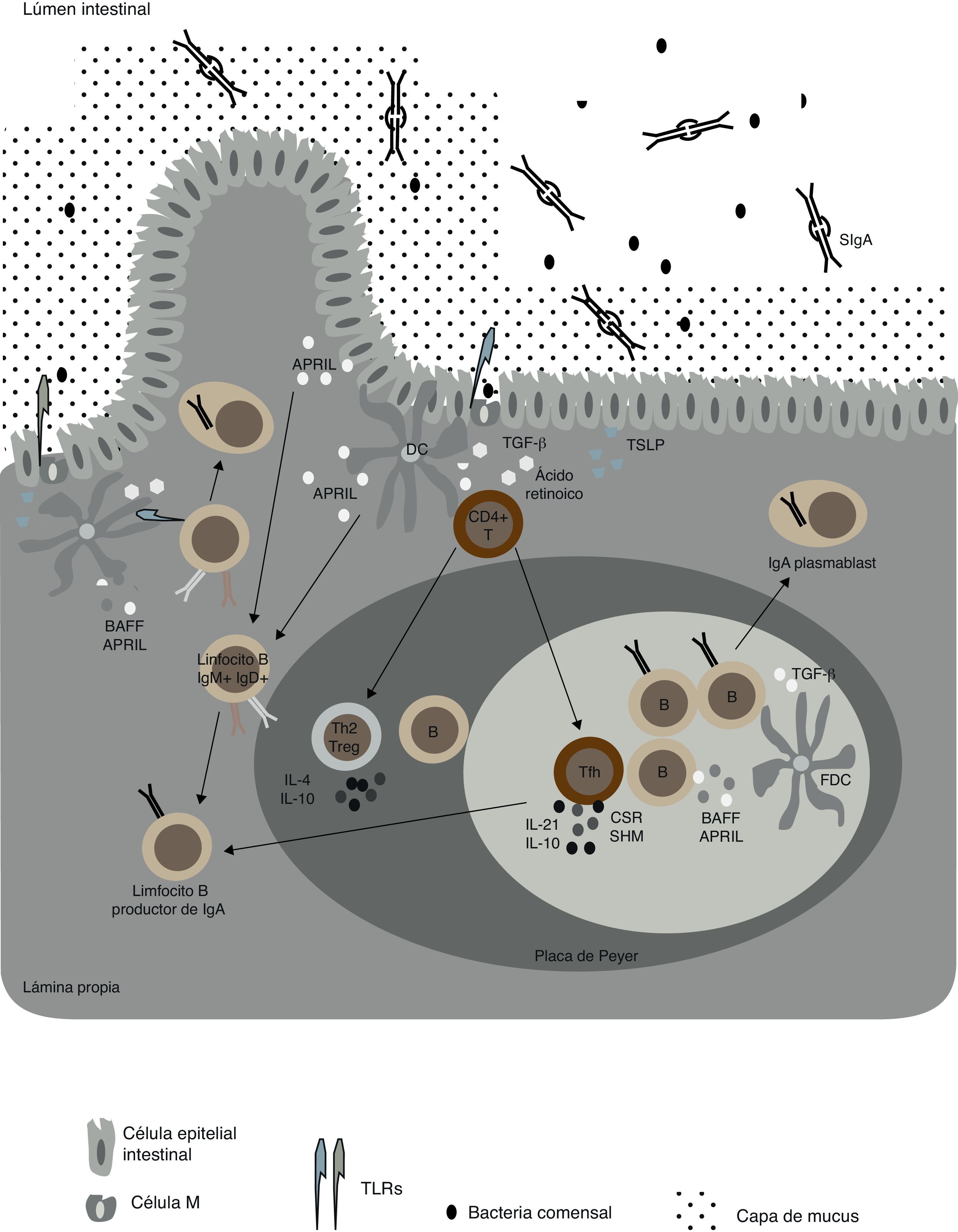
Células dendríticas y células epiteliales aportan señales de cambio de isotipo a linfocitos BLas DC, después de recibir un estímulo a través de sus TLR, son capaces de activar a otras DC liberando BAFF y APRIL, así como ácido retinoico (un metabolito de la vitamina A)23. Al mismo tiempo, estas citocinas actúan activando células del sistema inmunitario innato como macrófagos, granulocitos y células epiteliales de mucosa, las cuales también son capaces de liberar BAFF y APRIL. Estas moléculas pertenecen a la superfamilia del factor de necrosis tumoral (TNF, del inglés «tumor necrosis factor») y cooperan con ligandos de TLR para inducir cambio de isotipo (CSR, del inglés «class switch recombination») en linfocitos B de mucosa del intestino. En la mucosa intestinal habitan grandes comunidades de bacterias comensales, las cuales se mantienen separadas del resto del sistema a través de distintas estrategias, generando protección sin causar inflamación. Una de las estrategias principales para conseguir un estado no-inflamatorio incluye la producción de manera TI de anticuerpos IgA por linfocitos B residentes en los folículos de la mucosa, como por ejemplo las denominadas «placas de Peyer» o las zonas extrafoliculares24 (fig. 1). La IgA neutraliza toxinas, bacterias patógenas, así como moléculas inflamatorias de origen microbiano, como sería el ejemplo del LPS25. Simultáneamente, la presencia de IgA impide la unión de bacterias comensales en la superficie epitelial a través del impedimento estérico, la inducción de aglutinación bacteriana, el enmascaramiento de epítopos de adhesión y las interacciones con la capa de mucus a través del complemento secretor de la IgA26. Otra de las funciones fundamentales de la IgA es la interacción con receptores de DC para facilitar el muestreo de antígenos intestinales27.
Redes celulares importantes en las respuestas de mucosa asociada a IgA. Células epiteliales intestinales «condicionan» células dendríticas (DC) cuando liberan TSLP (del inglés «thymic stromal lymphopoietin») y ácido retinoico en respuesta a la activación de sus TLR por bacterias comensales. Distintos subgrupos de DC intestinales, discutidas en el texto, liberan TGF-β, IL-10, ácido retinoico y óxido nítrico (NO), los cuales promueven las respuestas IgA en las placas de Peyer y en los ganglios linfáticos mesentéricos (MLN). A su vez, las distintas poblaciones de DC son capaces de inducir linfocitos T reguladores (Treg) y T helper (Th), incluso TFH, las cuales derivan en sí mismas de Treg. Los linfocitos TFH activan a su vez células B foliculares vía CD40L, TGF-β, IL-4, IL-10 e IL-21. Por su parte, las DC foliculares aumentan la producción de IgA al liberar factores activadores de células B pertenecientes a la familia de los TNF (BAFF y APRIL). Por otra parte, cuando DC foliculares son activadas por TLR ligandos y ácido retinoico secretan TGF-β, también promueven el aumento de la producción de IgA en folículos intestinales. Asimismo, existen subgrupos de DC intestinales capaces de inducir la producción de IgA de manera T-independiente, ya sea en ganglios linfáticos mesentéricos o en la lámina propia, al liberar BAFF, APRIL, ácido retinoico y NO en respuesta a ligandos TLR de bacterias comensales o IFN-β de células estromales. En humanos, estas señales T-independientes podrían inducir cambio de isotipo de IgM o de IgA1 a IgA2. Los anticuerpos IgA surgidos de todas estas reacciones atraviesan las células epiteliales intestinales por un proceso de transcitosis mediado por el receptor polimérico de Ig.
En ambientes foliculares intestinales, las células dendríticas residentes liberan otras citocinas que pueden inducir la producción de grandes cantidades de IgA, como es el caso de TGF-β. Los linfocitos T helper de folículo intestinal liberan citocinas como CD40L, IL-21 y también TGF-β, que mejoran la producción de IgA no inflamatoria y al mismo tiempo disminuyen la producción de IgG proinflamatoria24 (fig. 1). Recientemente se ha demostrado cómo las células plasmáticas producen IgA específica para bacterias comensales en las placas de Peyer28. Los autores a través de modelos de ratón demostraron como el correceptor de muerte celular programada PD-1 es necesario para la correcta selección de células plasmáticas productoras de IgA en el intestino. Aún así, la depleción de PD-1 no es una propiedad intrínseca de las células productoras de IgA, sino que la ausencia de este receptor afecta la diferenciación de linfocitos TFH. Ratones deficientes en PD-1 exhiben alteraciones en la composición de su microbiota intestinal, sugiriendo la necesidad de un equilibrio entre el sistema inmune y la flora intestinal residente28.
Los linfocitos B de las placas de Peyer y ganglios linfáticos mesentéricos pueden ser inducidos a CSR de IgA de una forma TI en respuesta a señales emergentes de células dendríticas plasmacitoides (pDC), las cuales son capaces de liberar grandes cantidades de BAFF y APRIL en respuesta a interferón de tipo i generado por células estromales del intestino29. Otra localización intestinal donde se produce el CSR son los «folículos linfoides aislados». Este tipo particular de folículos contienen células inductoras del tejido linfoide, caracterizadas por liberar otra molécula de la familia del TNF, la linfotoxina-β, después de recibir señales vía TLR de bacterias comensales30. La interacción de la linfotoxina-β con su receptor de membrana en células estromales induce en estas últimas la liberación de quimiocinas que atenúan la acción de las DC, como la CCL19 y la CCL2130. La función del TNF en células dendríticas es la de estimular la producción de TGF-β, una citocina capaz de inducir CSR a IgA de forma TI, en cooperación con BAFF y APRIL, ambos también liberados por DC activadas por ligandos específicos de TLR30.
Además de los folículos linfoides aislados, otra de las zonas intestinales donde hay producción de IgA es la lámina propia intestinal, donde linfocitos B se encuentran de forma dispersa y sin formar estructuras de folículo27,31. La producción de IgA en esta zona específica del intestino recibe el apoyo de múltiples subtipos de células dendríticas residentes en el mismo distrito de la lámina propia, las cuales aportan señales activadoras a los linfocitos B de manera TI. Un subtipo de DC que participa activamente en este tipo de procesos se conoce como TipDC32. Las TipDC producen iNOS (en inglés «inducible nitric oxide synthase») después de recibir señales de citocinas de la familia del TNF, las cuales ayudan a la producción de IgA, ya que incrementan la expresión del receptor de TGF-β en linfocitos B vía óxido nítrico, de manera que los linfocitos B se sensibilizan a señales inducibles provenientes de TGF-β para empezar a producir IgA32. Señales microbianas de tipo TLR activan las TipDC y su propia producción de BAFF y APRIL. Otro subtipo de DC residente en lámina propia son las que constitutivamente expresan el receptor de flagelina (TLR5)33. Estas DC tienen una expresión de TLR4 muy baja o no detectable y se ha demostrado que son capaces de inducir el CSR a IgA de forma TI al liberar ácido retinoico e IL-6, cuando bacterias comensales con compuestos de flagelina en su membrana activan los TLR5 de este tipo de DC33.
Además de DC, las células epiteliales intestinales pueden liberar señales activadoras de CSR a IgA como BAFF y APRIL, al reconocer bacterias por múltiples TLR34,35. Esta vía epitelial contribuye a la generación de anticuerpos específicos de isotipo IgA2, los cuales son resistentes a la degradación a bajo pH34. Además, las células epiteliales pueden ampliar las funciones de activación de las CD colindantes liberando la citocina TSLP («thymic stromal lymphopoietin»)34,35. TSLP es una citocina perteneciente a la familia de la IL-7, y está descrita por ser capaz de aumentar la producción de BAFF y APRIL en DC que hayan sido estimuladas a su vez por TLR34,35. Otra forma que tienen las CD de promover respuestas de linfocitos B, además de proporcionar factores que ayudan al CSR, es presentando antígenos TI intactos a los mismos linfocitos B36. Recientemente, se ha podido demostrar la existencia de un subtipo de DC dedicadas a reconocer bacterias directamente en la luz intestinal, ya que contienen proyecciones dendríticas que o bien atraviesan las «tight-junctions», o son capaces de proyectar dendritas a través de poros transcelulares formados por células epiteliales especializadas, conocidas como células M37–39. Otros subtipos de DC de mucosa capturan antígenos de bajo peso molecular, los cuales pueden atravesar pasajes formados por células «goblet»40. Todos estos tipos especializados de DC podrían reciclar antígenos TI no procesados y, a la vez, presentarlos directamente en la superficie de los linfocitos B41. Teniendo en cuenta que tanto BAFF como APRIL son citocinas que activan vías de supervivencia en células plasmáticas42, la combinación de estímulos emergentes de DC así como células epiteliales puede crear una vía alternativa para la continua producción de anticuerpos IgA, fundamentales para una buena defensa contra patógenos y para el control de comensales en la mucosa intestinal.
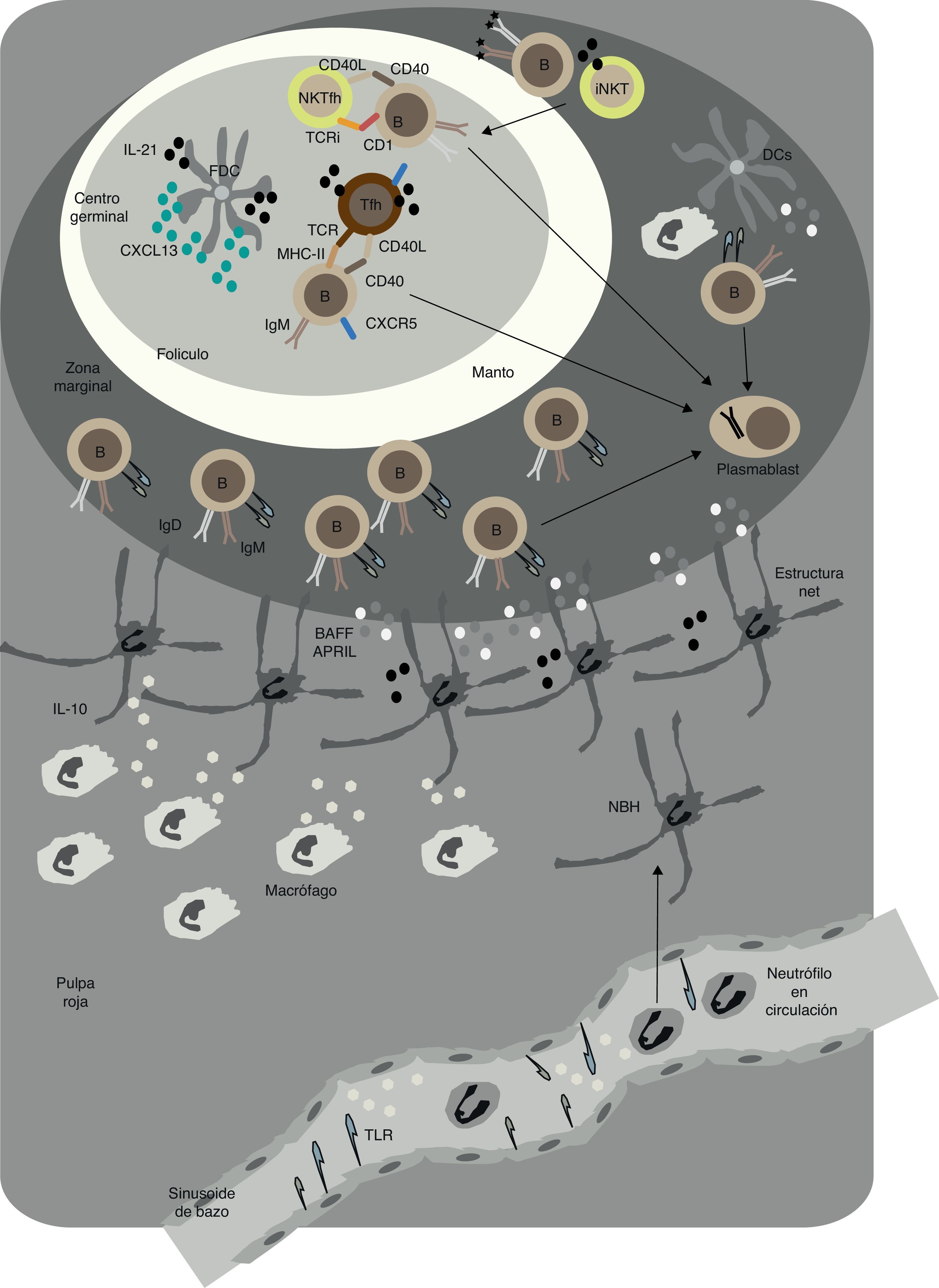
Células natural killer T invariantes proporcionan señales reguladoras de linfocitos BComo hemos mencionado al principio de esta revisión, la regulación de las respuestas de células B foliculares no se restringe a células TFH, ya que existen señales adicionales que pueden provenir de otros subconjuntos de linfocitos T, como es el ejemplo de las células iNKT (fig. 2). Estas células expresan un receptor de linfocitos T (TCR) invariante Vα14+ que reconoce antígenos glucolipídicos presentados por una molécula no polimórfica similar a MHC-I, conocida como CD1c43,44. Después de reconocer el glucolípido α-galactosilceramida en el CD1d expresado en DC o macrófagos subcapsulares presentes en órganos linfoides secundarios como bazo y ganglios linfáticos, las células iNKT proporcionan ayuda a los linfocitos B mediante la formación de DC eficientes en la presentación de antígeno o macrófagos con capacidad de expresar CD40L e interferones43,44. Posteriormente, la expansión de células TFH conduce a la formación de una reacción de centro germinal que induce la producción de IgG de forma moderada, a la maduración de afinidad a través de la hipermutación somática (SHM por sus siglas en inglés: «somatic hypermutation») y a la memoria inmunológica45.
Respuestas T-dependientes y T-independientes en los folículos y en la zona marginal del bazo en humanos. En el folículo, linfocitos B se activan mediante la acción de los linfocitos TFH y las células dendríticas foliculares (FDC). Tras interaccionar con los linfocitos B, los linfocitos iNKT se diferencian a linfocitos NKTFH. Mediante la expresión de CD40L, IL-21 y otros factores activadores de linfocitos B, las TFH inducen la formación del centro germinal y el cambio de isotipo de IgM a IgG y la hipermutación somática. Estas reacciones generan linfocitos B memoria y células plasmáticas de alta afinidad. Los linfocitos NKTFH inducen una reacción de centro germinal caracterizada por la producción de IgG sin prácticamente maduración de la afinidad. En la zona marginal, neutrófilos NBH inducen la producción de anticuerpos por los linfocitos B de la zona marginal (MZ), mediante la secreción de BAFF, APRIL y otras moléculas estimuladoras. Las estructuras parecidas a los NETS que forman pueden ayudar a la activación de los linfocitos B de la MZ. Macrófagos y células endoteliales de las sinusoides del bazo activadas por señales TLR pueden ayudar a la formación de NBH. La interacción de los NBH y los linfocitos B de la MZ permite la formación de un repertorio innato de IgM, IgG e IgA que puede actuar como rápida barrera protectora frente la invasión sistémica por microbios.
Estudios más recientes han demostrado que las células iNKT también pueden ayudar de forma más directa a los linfocitos B. En efecto, una subpoblación de células iNKT regula la expresión de CXCR5 después de interaccionar con glucolípidos presentados por los linfocitos B que expresan CD1d11. Posteriormente, la entrada en el folículo estimula las células iNKT que activan un programa mediado por BCL6 a la diferenciación a células NKTFH que expresan CD40L, IL-21 y otras moléculas de coestimulación como son el coestimulador inducible (ICOS) y PD-19,11 (fig. 2). La reacción posterior de centro germinal induce una fuerte producción primaria de IgG, pero no induce la maduración de afinidad o a la memoria inmune9,11. En la zona extrafolicular también se puede dar una interacción dependiente de CD1d entre linfocitos B y células iNKT, pero se induce predominantemente la producción de IgM y cierta producción de IgG46. Similar a las vías TI, estas células iNKT permiten la producción de una rápida oleada de anticuerpos IgG e IgM mutados contra patógenos invasivos (fig. 2).
Activación de los linfocitos B mediante la actuación de los granulocitosLos granulocitos son células del sistema inmune innato caracterizadas por la presencia de un núcleo multilobulado y una variedad de gránulos citoplásmicos, los cuales permiten la identificación de 3 poblaciones de granulocitos morfológica y funcionalmente distintas: neutrófilos, eosinófilos y basófilos47. Así como otros tipos celulares del sistema inmune innato, los granulocitos detectan la presencia de microbios o productos microbianos mediante receptores de reconocimiento de signaturas moleculares microbianas altamente conservadas, incluyendo los TLR. Estos sensores microbianos no específicos liberan señales de activación que estimulan las funciones fagocíticas y citotóxicas de los granulocitos, promoviendo así la contención inicial y eliminación de los microbios invasivos1.
Además de contener compuestos citotóxicos e inflamatorios, los granulocitos liberan citocinas, quimiocinas y otros mediadores inmunes que promueven el reclutamiento y activación de monocitos y DC48–50. Los granulocitos pueden además modular la respuesta inmune adaptativa mediante la liberación de citocinas capaces de inducir directamente la activación y diferenciación de los linfocitos T48,50. El papel de los granulocitos en las respuestas de linfocitos B es menos conocido, pero estudios recientes han puesto de manifiesto diferentes mecanismos por los cuales ciertos subtipos de granulocitos envían señales a linfocitos B y células plasmáticas, modulando su actividad.
Los basófilosDurante años, los basófilos han sido unas células enigmáticas que representan menos del 1% de los leucocitos en sangre en condiciones normales. Son la mayor fuente de histamina y otros compuestos vasoactivos liberados durante procesos alérgicos, y son también fundamentales en la defensa de infecciones por parásitos48. Recientemente se ha podido demostrar la participación de los basófilos en respuestas humorales de linfocitos B. Además de presentar complejos antígeno-MCH-II a linfocitos T CD4+, los basófilos liberan IL-4 e IL-6, induciendo la formación de linfocitos Th2 con capacidad de activar linfocitos B51.
Los basófilos pueden capturar eficientemente antígenos solubles mediante los anticuerpos IgE unidos a receptores de superficie Fc¿RI. El reconocimiento de antígeno por IgE de baja afinidad no provoca la liberación de histamina, sino la regulación positiva de la expresión de CD40L y la liberación de IL-4 e IL-6 por basófilos. El conjunto de estos factores mejora las respuestas humorales mediante la inducción de linfocitos Th2 que secretan citocinas activadoras de linfocitos B que incluyen IL4, IL-5, IL-6, IL-10 e IL-1352. Sorprendentemente, los basófilos también pueden activar los linfocitos B directamente, como se ejemplifica por su capacidad para desencadenar el CSR de IgM a IgE e IgG4 cuando los linfocitos B han sido estimulados a través de IL-4, IL-13 y CD40L53.
Además de IgE, los basófilos también unen en su superficie IgD, aunque el receptor de IgD sigue siendo desconocido. IgD es un isotipo enigmático que se ha conservado a lo largo de la evolución desde los peces hasta humanos54. Linfocitos B maduros y transicionales que surgen de médula ósea expresan receptores IgM e IgD en su superficie, pero la expresión de IgD generalmente disminuye al contacto con el antígeno afín. No obstante, grupos de linfocitos B activados en la mucosa del tracto respiratorio superior pueden dar lugar a células plasmáticas secretoras de IgD mediante un proceso de CSR no convencional de IgM a IgD55,56. Los anticuerpos IgD producidos por las células plasmáticas del tracto respiratorio superior se caracterizan por estar altamente hipermutados, pero en gran parte se han encontrado por ser polirreactivos al poder enlazar múltiples determinantes antigénicos de comensales y patógenos, promoviendo así la protección de la mucosa55–58. Además de cruzar la barrera epitelial para llegar a la superficie de la mucosa, la IgD es capaz de entrar en la circulación sanguínea donde puede interaccionar con basófilos, monocitos y neutrófilos56. En el caso de los basófilos, la unión de IgD induce la liberación de péptidos antimicrobianos (catelicidina), factores de opsonización (pentraxina PTX3), citocinas inflamatorias (TNF e IL-1β), citocinas inductoras de Th2 (IL-4 e IL-13), y factores estimulantes de linfocitos B (BAFF y APRIL)56. Consistente con estos resultados, se ha demostrado también que la activación de basófilos por IgD está incrementada en los trastornos autoinflamatorios asociados a TNF e IL-1β56.
Los eosinófilosPresentes en un 1-4% del total de leucocitos en sangre, están principalmente implicados en respuestas contra parásitos y respuestas alérgicas50. Estudios recientes han demostrado que también pueden modular la respuesta adaptativa mediante la expresión de moléculas MHC-II, así como mediante la secreción de citocinas, quimiocinas, mediadores lipídicos y factores de crecimiento50,59. Mediante la expresión en superficie de receptores FcγRII, los eosinófilos unen anticuerpos específicos para alérgenos IgG1 e IgG3, aunque no son capaces de reconocer o unir IgG4. Los eosinófilos han sido descritos también por expresar FcαRI (o CD89), que es el receptor que reconoce IgA50, indicando una posible ruta de modulación de la homeostasis intestinal, la cual no ha sido descrita hasta la fecha con claridad. Estudios recientes han demostrado que los eosinófilos son claves en la producción sustentada de anticuerpos en la médula ósea60,61. En efecto, los eosinófilos son capaces de producir y liberar grandes cantidades de APRIL, citocina capaz de promover la supervivencia a largo plazo de las células plasmáticas en nichos específicos de la médula ósea61. En general, se conoce que las células plasmáticas surgen de una reacción de centro germinal y es necesaria una liberación continuada de estímulos para su supervivencia. De esta forma, la supervivencia promovida por factores secretados por eosinófilos es esencial para la liberación continua de anticuerpos de alta afinidad en circulación y para una respuesta humoral eficiente y sostenida.
En la médula ósea los eosinófilos han sido descritos como secretores de IL-6, otra citocina crítica en la diferenciación y la supervivencia de células plasmáticas61. En presencia de antígeno que pueden reconocer a través de sus receptores de alta o baja afinidad, los eosinófilos de la médula ósea liberan IL-4 e IL-10, las cuales mejoran la estimulación de células plasmáticas y su supervivencia60,61.
Las señales de supervivencia proporcionadas por los eosinófilos son críticas para el correcto mantenimiento de la población de células plasmáticas en médula ósea dado que la depleción de eosinófilos se traduce en un aumento rápido del ratio de apoptosis en células plasmáticas61. No es sorprendentemente que los eosinófilos de la médula ósea tengan también una comunicación con células del estroma. Estas últimas liberan CXCL12, una quimocina que se une al receptor CXCR4 también presente en células plasmáticas61,62. Dado el papel clave descrito para los eosinófilos en la migración de células plasmáticas, así como su retención en médula ósea, es de esperar que la depleción de sistémica eosinófilos haga aumentar el número de células plasmáticas en el bazo, así como en los ganglios linfáticos61.
Los neutrófilosEste subtipo de granulocitos son los más abundantes en la circulación sanguínea, y son capaces de movilizarse rápidamente para eliminar patógenos y células necróticas en áreas de infección o inflamación63. Después de migrar a tejidos periféricos, los neutrófilos activan programas de defensa que promueven la fagocitosis, la destrucción intracelular y la inflamación. Los neutrófilos pueden interactuar con células del sistema inmune innato y adaptativo mediante la liberación de citocinas, quimiocinas y factores de crecimiento49,63.
En relación específica con las respuestas de linfocitos B, se ha demostrado que los neutrófilos pueden aumentar la producción de anticuerpos TD mediante la recopilación y transporte de antígeno a DC, así como promoviendo el reclutamiento, la activación y diferenciación de linfocitos T CD4+64. Al mismo tiempo, se ha podido demostrar que los neutrófilos también liberan moléculas relacionadas con la biología de linfocitos B, como CD40L, BAFF y APRIL65,66. La producción de BAFF y APRIL por parte de los neutrófilos y otras células del sistema inmune innato, así como otros tipos celulares como son las células epiteliales, mejora las respuestas extrafoliculares independientes de células T. Este tipo particular de respuesta TI es llevada a cabo por linfocitos B situados en mucosa así como en la zona marginal del bazo (MZ por sus siglas en inglés).
Se ha descrito cómo los neutrófilos pueden colonizar la MZ del bazo en respuesta a infecciones en la circulación sanguínea67,68. Estudios recientemente publicados por nuestro grupo han demostrado que los neutrófilos ocupan áreas perifoliculares de la MZ del bazo en ausencia de infección o inflamación mediante una vía no inflamatoria que comienza durante la vida fetal69. Esta colonización se ve acelerada después del nacimiento, momento que coincide con la colonización de las superficies mucosas por parte de bacterias comensales69. Los neutrófilos del bazo no solo se han descrito en el ser humano, se encuentran también en el ratón y en los primates. Este tipo particular de neutrófilos liberan señales inductoras de respuestas de anticuerpo de linfocitos B de la MZ, y por lo tanto se ha definido como neutrófilos «B-helper» o NBH69 (fig. 2). Al comparar neutrófilos en circulación con NBH, se ha demostrado que estos últimos expresan un fenotipo activado y secretan más factores estimulantes de linfocitos B como BAFF, APRIL, CD40L e IL-2169. Estas características únicas probablemente reflejan la activación y la reprogramación de las células NBH por señales microambientales locales solamente presentes en el bazo. Ligandos de TLR microbianos también pueden estimular la reprogramación de los neutrófilos convencionales a NBH mediante la liberación de citocinas no inflamatorias, como son IL-10, por parte de las células endoteliales sinusoidales del bazo y posiblemente otros tipos celulares presentes en este órgano como los macrófagos.
Se ha demostrado que los NBH inducen la expresión de AID, fomentando el CSR a IgG e IgA, así como a la formación de células secretoras de anticuerpos (o plasmablastos), pero al mismo tiempo pueden suprimir la activación de linfocitos T, por lo menos in vitro69. Al ejercer esta doble función, los NBH pueden promover las respuestas contra antígenos extracelulares TI y reducir al mínimo las respuestas de linfocitos B foliculares contra antígenos TD. En consecuencia, los NBH entrarían en los espacios foliculares del bazo solamente bajo condiciones inflamatorias, quizá para promover la actividad de los linfocitos T. Consistente con esta teoría, se ha podido demostrar que pacientes inmunodeficientes con alteraciones cuantitativas o funcionales de neutrófilos (neutropenias) tienen un menor número de linfocitos B de la MZ, así como unos niveles reducidos de IgG e IgA contra hidratos de carbono TI, pero no contra antígenos de proteínas TD en estado estacionario69.
El mecanismo por el cual los NBH activan los linfocitos B de la MZ probablemente implica la colonización de la mucosa por bacterias comensales69. Se ha podido demostrar la presencia de cantidades discretas de productos microbianos, como el LPS, presentes en la zona peri-MZ poco después del nacimiento69. Otra característica definitoria de estos NBH es la presencia de unas estructuras similares a las trampas extracelulares de neutrófilos (NETS, «neutrophil extracellular traps» en inglés). Estas estructuras se han descrito por aparecer cuando los neutrófilos atrapan productos microbianos, como por ejemplo ARN bacteriano, y establecen extensas interacciones con los linfocitos B de la MZ69,70. Las estructuras NETS, al atrapar antígenos comensales presentes en sangre y posiblemente procedentes de las superficies de mucosa, o ya sea por activación por parte de ligandos de TLR, podrían facilitar la activación de los linfocitos B de la MZ en condiciones de homeostasis71,72.
En general, la interacción entre los NBH y los linfocitos de la MZ puede ser un instrumento muy eficiente para la generación de una segunda línea de defensa innata (o natural) basada en la producción de anticuerpos contra la invasión sistémica por antígenos comensales y por microbios que rompen la primera barrera de la mucosa.
ConclusionesLos distintos miembros del sistema inmune innato han recibido en el pasado distintos grados de atención, sobre todo focalizado en las DC y los macrófagos. De esta forma, los granulocitos, como conjunto de distintas y específicas poblaciones, han permanecido menos estudiados. Los granulocitos han estado clásicamente relacionados con respuestas tipo 2 (Th2) TD, pero hay pocos ejemplos de estudios que relacionen los granulocitos directamente con poblaciones de células B.
Aún así, en los últimos años se ha puesto de manifiesto la gran interconectividad entre el sistema inmune innato y el adaptativo en distintos niveles, cuya plasticidad es fundamental para promover respuestas duraderas para hacer frente a patógenos invasivos. Los granulocitos están tomando un papel central en estas respuestas, así como con su papel fundamental para promover esta interconectividad entre las distintas ramas del sistema inmune. El estudio de las respuestas fomentadas por granulocitos para la activación de células B puede ser beneficioso para el mejor desarrollo de nuevas vacunas, así como la promoción sustentada de respuestas inmunes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nos gustaría aprovechar esta oportunidad para dar las gracias al Ministerio de Ciencia e Innovación por su subvención SAF 2011-25241 y el programa Juan de la Cierva (IP), el apoyo del European Research Council 2011 Advanced Grant 20.110.310 (AC), a las ayudas a investigación de los Institutos Nacionales de Salud (NIH) AI61093, AI057653, AI95613, AI96187 i AI07437 (AC). Al mismo tiempo estamos agradecidos por sus comentarios durante la redacción de este manuscrito a Alfie y Ruby Magee y Kira Siesto.