las 14 semanas de la transposición del peroné. Hubo 6 complicaciones precoces en 5 pacientes, y cinco complicaciones tardías en 4 pacientes. Todas atribuibles a la propia patología o a la técnica quirúrgica y todas ellas tratables. La lesión primaria y la extensión de la cirugía influyeron sobre el tiempo de consolidación.
Notas preliminares
Los grandes defectos segmentarios diafisarios de la tibia tienen una incidencia baja pero son de difícil manejo para el cirujano ortopeda. Los defectos debido a traumatismos son especialmente complejos de tratar debido a las lesiones asociadas de las partes blandas. Se han aplicado distintos métodos de tratamiento para el salvamento de la extremidad en casos de grandes defectos tibiales1, 5, 8-10: la técnica de Ilizarov para el transporte óseo2,4,11,15,17,18,20-22,27,29, las técnicas que utilizan la transposición de peroné tanto ipsi como contralateral, o ambas1,3,5,7,10,16,18,19,24,26,28,29, y los injertos vascularizados de cresta ilíaca23,25.
En 19 pacientes con un defecto óseo medio de 10 cm tratados con la técnica de transporte óseo de Ilizarov, Paley y Maar20 se describe un tiempo medio de 16 meses de fijador externo. Detectan una refractura, una disimetría residual de las extremidades inferiores, y 2 uniones viciosas. Concluyen, que la mayor desventaja de la técnica es el tiempo de fijación externa. Un tratamiento adecuado permite una carga precoz, una movilidad inmediata o precoz de la rodilla y el tobillo, no requiriendo una constante vigilancia por parte del paciente o del cirujano. Con un alto índice de éxito y un aceptable índice de complicaciones se minimiza la morbilidad física y mental.
El objetivo de este estudio es evaluar la eficacia del tratamiento con clavo intramedular y transposición ipsilateral de peroné para el tratamiento de los defectos tibiales.
Principios quirúrgicos y objetivos
Reconstrucción de los grandes defectos tibiales causados por traumatismos, infección o resecciones tumorales, mediante transposición ipsilateral del peroné y estabilización con clavo intramedular. Rehabilitación funcional precoz.
Ventajas
* Sin necesidad de fijación externa.
* Rehabilitación funcional temprana.
* Corta hospitalización.
* Puede ser factible con una única intervención quirúrgica.
Inconvenientes
* Riesgo de sepsis en pacientes con infección.
* Traumatismo sobre la rodilla debido a la inserción del clavo.
Indicaciones
* Pérdida ósea segmentaria de la diáfisis tibial con peroné intacto o reconstrucción viable:
- Postraumática.
- Infectada.
- Tras una resección neoplásica.
Contraindicaciones
* Segmento articular/metafisario tibial proximal y/o distal insuficiente para encerrojar el clavo intramedular.
* Peroné deficiente o ausente.
* Resección incompleta de tejido/hueso infectado o neoplásico.
* Imposibilidad de proporcionar una adecuada cobertura de partes blandas.
* Disfunción del pie que no permita una correcta carga, incluso si la reconstrucción tibial es exitosa.
Información al paciente
* Riesgos comunes a la cirugía, como infección, tromboflebitis, embolismo.
* Extensión de la resección y sus implicaciones.
* Necesidad de reconstrucción de partes blandas (incluyendo el injerto cutáneo) en algunos casos de patología primaria.
* Necesidad de llevar el clavo intramedular por largo tiempo.
* Riesgo de fracaso del implante (clavo o pernos).
* Riesgo de fractura de esfuerzo de peroné.
* Riesgo potencial de no unión en los puntos de fusión tibioperoneos.
* Complicaciones en la zona dadora del injerto óseo.
* Inmovilización postoperatoria con una férula posterior.
Planificación preoperatoria
* Estudio radiológico con radiografías en proyección antero-posterior y lateral de la extremidad inferior.
* Pruebas de imagen para establecer la extensión de la neoplasia.
Instrumental e implantes quirúrgicos
* Equipo básico de ortopedia: escoplo, pinzas de tracción, elevadores, cucharillas, etc.
* Sistema de clavo intramedular con capacidad de encerrojado.
* Guías intramedulares, con punta y romas.
* Sierra quirúrgica.
* Fresas intramedulares.
* Instrumental base para tornillos de pequeños fragmentos.
* Pinzas de reducción grandes.
* Intensificador de imágenes.
Anestesia y colocación del paciente
* Anestesia general o regional.
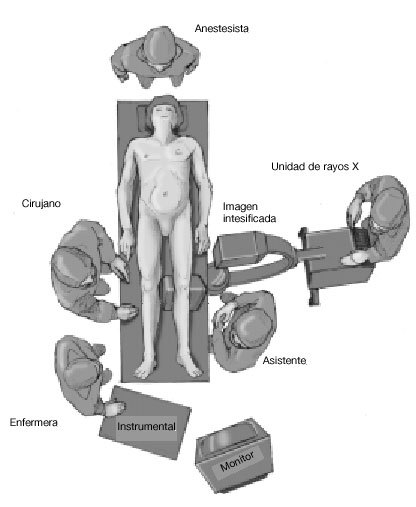
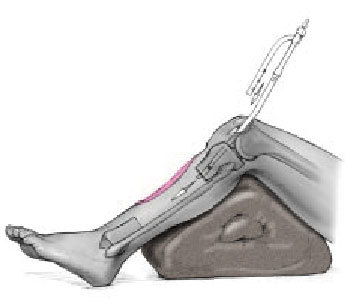
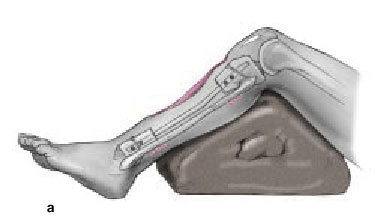
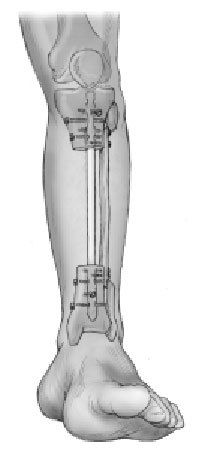
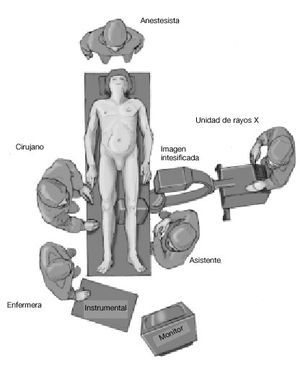
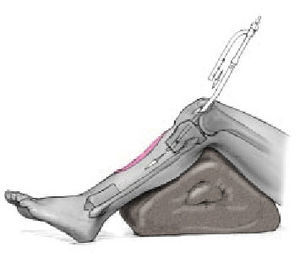
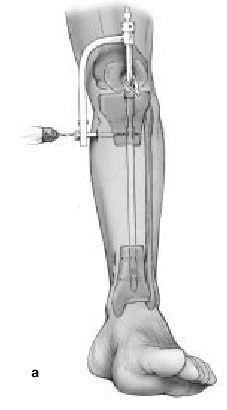
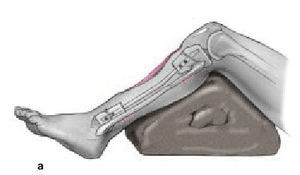
* Colocación en supino, en mesa radiotransparente (fig. 1).
Figura 1. Se coloca el paciente en supino en una mesa radiotransparente con un soporte triangular debajo de la rodilla de la pierna afectada. Se coloca un torniquete en el muslo. El intensificador de imágenes en el lado de la pierna afectada y perpendicular a la mesa y a la extremidad. El cirujano se coloca en el lado contralateral con un asistente hacia los pies de la mesa en el lado afectado. La instrumentista en el mismo lado que el cirujano, y la mesa del instrumental en los pies de la mesa operatoria.
Preparación y entallado de la cresta ilíaca y entallado de la extremidad. Se cubre la cresta ilíaca con plástico adhesivo (steri drape).
Técnica quirúrgica
Figuras 2 a 8
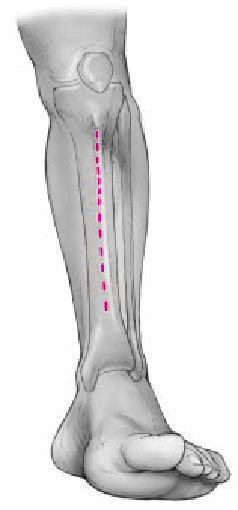
Figura 2. Resección ósea.
La incisión para la diafisectomía tibial sigue la cresta de la tibia. Neoplasia: aplicación de los principios oncológicos, la diáfisis tibial se reseca mediante un abordaje anterior o anteromedial longitudinal con el correcto margen de partes blandas. Resección ósea según el margen de seguridad tumoral. El tamaño del defecto habitualmente no afecta al éxito del procedimiento ni tiene efecto sobre las complicaciones potenciales. La resección ósea será con amplios márgenes siempre y cuando subsistan segmentos proximal y distal de suficiente tamaño para encerrojar el clavo proximal y distalmente. De forma provisional se envuelve la herida para cerrarla definitivamente tras la estabilización del clavo intramedular.
Infección crónica. El procedimiento sigue los principios de la resección neoplásica de amplios márgenes puesto que es difícil determinar la extensión de la afectación ósea incluso con técnicas de imagen sofisticadas.
Infección aguda o subaguda: resección inicial seguida de una reconstrucción tardía. Se reseca el segmento infectado junto a las partes blandas implicadas y se maneja la herida con espaciadores con bolas de antibiótico almacenadas en una bolsa estéril con un método de succión para drenar el exceso de fluido acumulado y asegurarse así el cierre del compartimiento. Las bolas de antibiótico se pueden personalizar añadiendo antibiótico en polvo (específico según el germen aislado y el antibiograma, habitualmente vancomicina y tobramicina) al metilmetacrilato, formando bolas y uniéndolas con sutura no reabsorbible. El antibiótico se diluye en el hematoma y proporciona concentraciones elevadas de antibiótico localmente. La reconstrucción se realiza a los 5-7 días y se retiran las bolas de antibiótico.
Traumatismo-fractura abierta con gran defecto óseo: se siguen los principios estándares de soporte vital del traumático. La extremidad lesionada se inmoviliza tras las maniobras de resucitación y hasta el tratamiento de las lesiones de las vías respiratorias y otras lesiones prioritarias. Posteriormente se procede a limpiar la extremidad con cepillo dejándola preparada para la cirugía. Se utilizarán dos equipos de instrumental empezando por una cuidadosa resección de la herida, desbridamiento e irrigación. Si se prevé que existirá, tras la resección del tejido desvitalizado, un defecto óseo, es mejor ser generoso con la resección puesto que no existe mucha diferencia entre tratar un defecto de 5 cm o uno de 7 cm, y las ventajas son importantes. Nos aseguramos la resección de todo el tejido óseo desvitalizado de la zona lesionada. Tras el manejo de la herida, se prepara de nuevo la extremidad para el enclavado intramedular con un nuevo equipo de instrumental. La herida traumática no se cerrará y se aplicará un espaciador con bolas de antibiótico hasta la reconstrucción final.
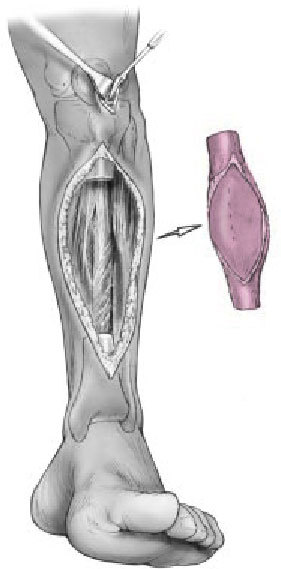
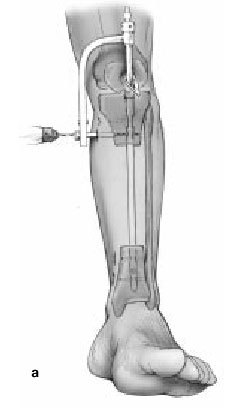
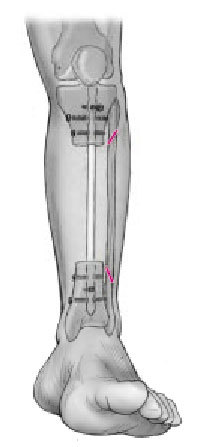
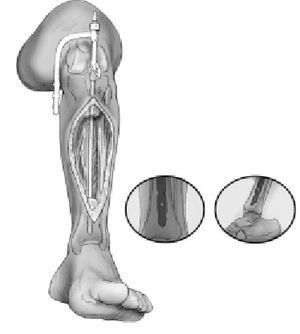
Figura 3. Clavo intramedular encerrojado.
Tras la diafisectomía, la incisión para la inserción del clavo intramedular se realiza en el polo distal de la rótula ligeramente por fuera del punto medio de la tibia proximal. De forma percutánea y con ayuda del intensificador de imágenes, se localiza y se abre el canal medular. No se fresa si el canal medular admite como mínimo un clavo de 10 mm, mejor si es de mayor grosor. El fresado será necesario en canales medulares estrechos. En estos casos se aconseja aflojar el torniquete para minimizar la lesión térmica ósea. Se parará el fresado en la zona del defecto óseo para evitar lesionar las partes blandas.
Figura 4a. Se determina la longitud del clavo con la planificación preoperatorio o midiendo intraoperatoriamente con una regla y el intensificador de imágenes. El punto crítico es asegurarse que el clavo atraviese el fragmento proximal paralelo al eje longitudinal tanto en la proyección anteroposterior como lateral.
Figura 4b. La entrada al segmento distal se ve directamente por la herida traumática. El clavo debe mantenerse paralelo al eje longitudinal en las dos proyecciones mientras atraviesa la zona del defecto óseo, para asegurarse una correcta colocación el segmento distal. La rotación debe controlarse clínicamente antes del encerrojado. Intraoperatoriamente es útil para obtener una correcta rotación, flexionar ligeramente la rodilla y alinear la tuberosidad tibial con el primer espacio.
Figuras 5a y b. Encerrojado del clavo. a) El encerrojado proximal se realiza con la guía adosada al mecanismo introductor del clavo. Debido a que habitualmente el fragmento proximal es corto es mandatario como mínimo dos tornillos de bloqueo para una correcta estabilización.
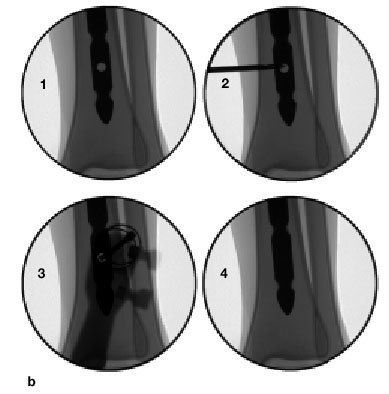
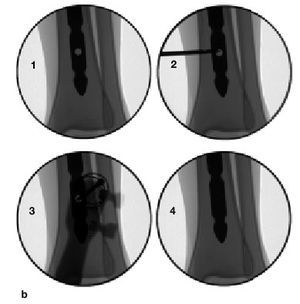
b) Para el encerrojado distal es necesario manipular el intensificador de imágenes hasta visualizar el agujero del tornillo como un círculo perfecto, y así usar la técnica de manos libres1. Se marca el centro del agujero en la piel y se hace una incisión2. Con una correcta protección del tejido blando, se broca la tibia en el centro del agujero del tornillo de bloqueo3. Tras medir la longitud del tornillo se inserta. Se confirma radiológicamente la situación del tornillo4, en ambas proyecciones AP y lateral. Habitualmente, se colocan dos tornillos distales con la misma técnica.
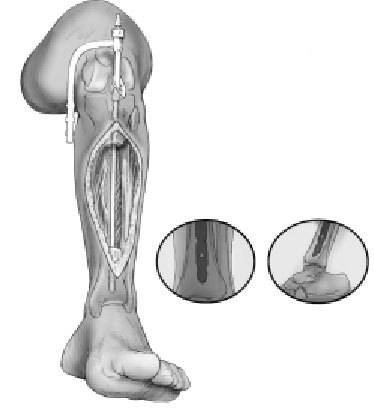
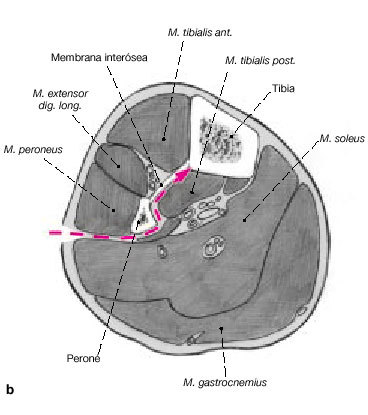
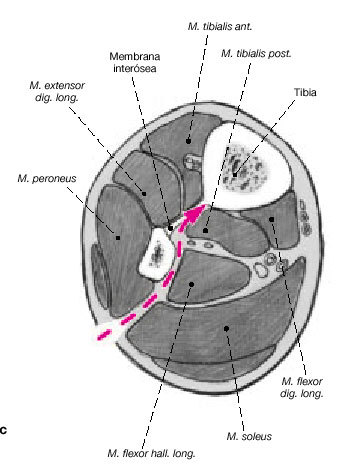
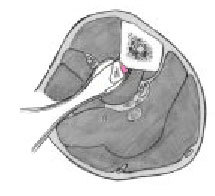
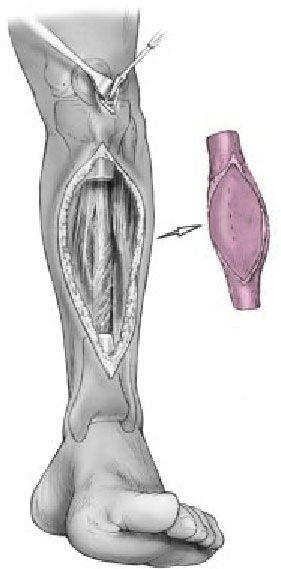
Figuras 6a-c. Transposición ipsilateral del peroné. La transposición ipsilateral del peroné puede realizarse en el mismo acto quirúrgico que el enclavado intramedular o más tarde. En pacientes politraumáticos o en fracturas abiertas de alto grado, es preferible posponer la transposición. Los niveles de los márgenes de resección de la tibia se dejan marcados
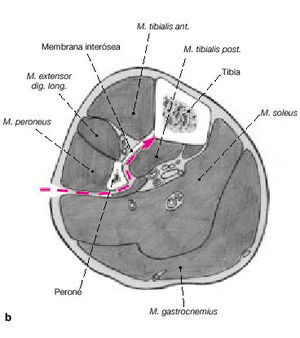
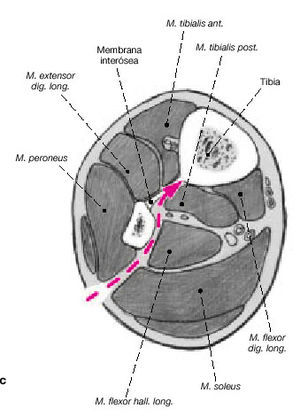
en la cara posterolateral de la pierna. Se realizan dos incisiones longitudinales posterolaterales de unos 6 cm (a). Las incisiones se realizan a nivel de la unión del compartimiento lateral con el posterior de la pierna y centradas en los márgenes de resección tibial (b, c). Los dos abordajes se realizan entre el compartimiento lateral y posterior hacia el peroné. A continuación, para exponer el peroné, la membrana interósea y la superficie posterolateral de la tibia en los dos niveles, se utiliza el abordaje de Harmon.
Figura 7. Se diseca circunferencialmente el peroné a 2 cm proximal y distalmente a los márgenes de resección de la tibia. Se realizan osteotomías oblicuas a 2-3 cm. Proximal y distal a las líneas de resección tibial, con irrigación para evitar quemar el hueso. Se realiza osteotomía oblicua para no dejar extremos afilados tras la transposición del peroné.
Figura 8. Disección y transposición del peroné. Se desperiostiza las superficies posteriores de la tibia en la aposición tibioperonea. Se preparan las superficies de contacto de la tibia y el peroné para asegurar una correcta unión. Se transpone el peroné y temporalmente se estabiliza con una pinza reductora hasta insertar los tornillos a tracción interfragmentarios que deben evitar el clavo intramedular. Se utilizan dos tornillos por zona y se aporta injerto autólogo de hueso esponjoso. Se cierran las heridas quirúrgicas de la inserción del clavo y de los tornillos de bloqueo. También se cierra la herida de los casos de resección tumoral, osteomielitis crónica e infecciones agudas o subagudas que se han dejado para un segundo tiempo. En algunos casos será necesaria la ayuda de un cirujano plástico para una correcta cobertura cutánea mediante un colgajo. La técnica del espaciador con bolas de cemento y el cierre tardío a los 5-7 días se utiliza para las fracturas abiertas agudas e infecciones agudas o subagudas. Férula posterior para prevenir el pie equino.
Manejo postoperatorio
* Movilización del paciente según tolerancia, limitando la carga a solo tocar el dedo al suelo. Inicio precoz de ejercicios de movilidad de rodilla y tobillo.
* El paciente es dado de alta cuando se moviliza y se maneja con analgésicos orales. Normalmente a los 4-6 días de la cirugía. Retirada de los puntos cutáneos a la 1.ª-2.ª semana tras la cirugía.
* La carga y los ejercicios de resistencia se inician con los primeros signos radiológicos de consolidación en la unión tibioperonea, habitualmente a las 6 semanas. Deben evitarse las actividades de impacto como mínimo durante 6 meses.
* Se realizan radiografías a las 6 semanas y luego mensualmente hasta objetivar una clara consolidación. Es muy útil la proyección oblicua (en rotación interna) para visualizar la unión tibioperonea. Tras conseguir la consolidación no serán necesarios más controles radiológicos a menos que la clínica lo indique.
Errores, riesgos y complicaciones
* Se debe tener mucha precaución, sobre todo en resecciones muy proximales, de no lesionar el nervio peroneo común o sus ramas, ni la arteria tibial anterior que transcurre entre la tibia y el peroné proximalmente. No es necesario una exploración rutinaria del nervio peroneo a menos que exista un riesgo de lesión.
* Las resecciones amplias dejan unos segmentos proximal y distal relativamente cortos aumentando el riesgo de mala alineación. Es por ello importante centrar el clavo en ambos segmentos tibiales. Los tornillos de bloqueo pueden ser de gran ayuda (fig. 10).
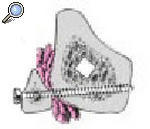
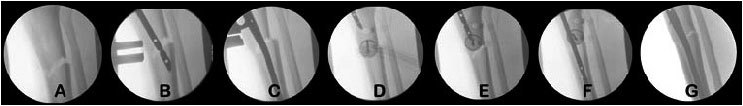
Figuras 10a-g. Principio del tornillo de bloqueo. a) Radiografía lateral de una fractura oblicua corta de la tibia proximal. b) Colocación del clavo intramedular. Debido a que el canal es amplio, el clavo cruza el fragmento proximal oblicuamente. c) Tras la total introducción del clavo existe una traslación posterior. d) Se coloca una aguja transversal (se puede utilizar un tornillo) en el fragmento proximal para mantener el clavo en el segmento anterior de la tibia (e, f). g) Se retira la aguja una vez colocados los tornillos de bloqueo proximal para mantener la posición. (Si se utiliza un tornillo de bloqueo se puede dejar en su sitio.)
* La no unión puede suceder tanto en la zona proximal como distal de la aposición tibioperonea. Se evitará con una correcta preparación de la zona de contacto, una estabilización firme con tornillos interfragmentarios, y aporte de injerto de hueso esponjoso. Si no existe consolidación, se debe revisar la fijación y aportar de nuevo injerto óseo.
* Existe el fracaso de los implantes, clavos y/o tornillos. El fracaso de los tornillos de bloqueo tras la consolidación ósea no requiere tratamiento a menos que la ruptura de los tornillos sea sintomática. En este caso sólo se retira la porción del tornillo que molesta. La ruptura, temprana, por fatiga, del clavo requiere un clavo de revisión. Si la ruptura es tardía, cuando el peroné ya está hipertrofiado, se puede retirar el clavo o dejarlo si es asintomático.
* La infección profunda con partes blandas de buena calidad puede tratarse mediante la revisión del clavo con un clavo impregnado de antibiótico. Éste es un clavo canulado y encerrojado que tras el bloqueo distal se le introduce una cadena de bolas de antibiótico. Las bolas están sujetas con un alambre y no con una sutura de hilo. El tipo de antibiótico depende del germen responsable. Si las partes blandas son de mala calidad, la revisión del clavo debe hacerse junto al cirujano plástico para mejorar la cobertura.
* La rigidez del tobillo se evita con la rehabilitación temprana mediante ejercicios activos asistidos tan pronto como lo permita el dolor. En el postoperatorio inmediato se coloca una férula posterior para mantener la posición plantígrada del pie y así evitar la contractura del tendón de Aquiles.
Resultados
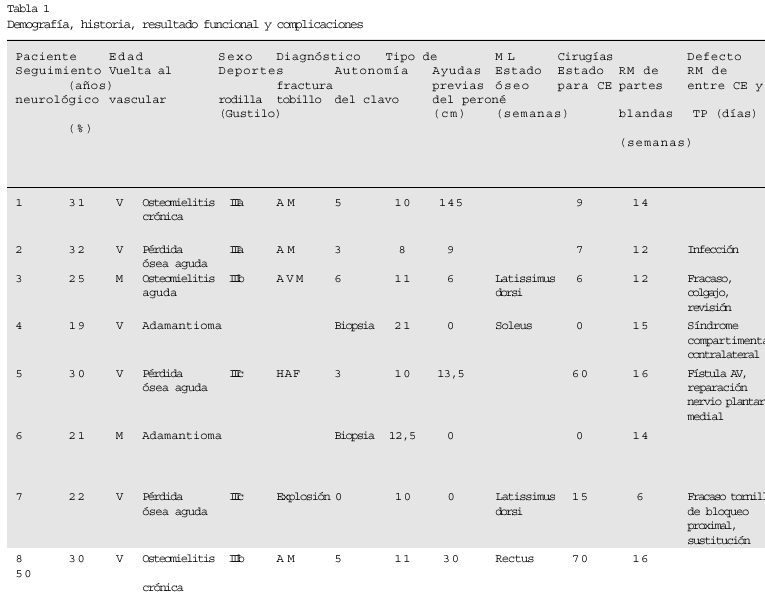
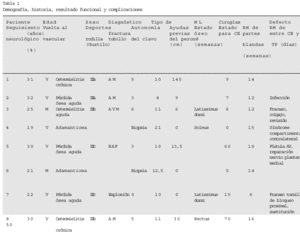
Ocho pacientes (6 varones y 2 mujeres) con defectos tibiales segmentarios por pérdida ósea traumática, osteomielitis y neoplasia fueron tratados mediante enclavado intramedular y transposición ipsilateral de peroné entre abril de 1984 y abril de 1996 (tabla 1). En 5 casos se trató de la tibia izquierda. La edad media en el momento de la cirugía fue de 26 años (intervalo: 19-32 años). Los pacientes neoplásicos discretamente más jóvenes, de 19 y 21 años, y los traumáticos algo mayores con una edad media de 29 años (intervalo: 22-32 años).
Dos pacientes diagnosticados de adamantioma de tibia fueron tratados mediante diafisectomía. Tres pacientes con pérdida ósea aguda traumática (fracturas abiertas, uno Gustilo grado IIIb y dos grado IIIc). Tres pacientes fueron tratados por osteomielitis aguda o crónica secundaria a fractura abierta. El tratamiento de la osteomielitis conllevó al defecto segmentario de la diáfisis tibial. El traumatismo inicial fue un accidente de moto o vehículo a motor en cuatro casos, herida por arma de fuego en un caso, y explosión de una bomba en un caso. El paciente herido por arma de fuego presentó una laceración de la arteria poplítea y el de la explosión de la bomba una laceración de la arteria tibial, ambos casos requirieron tratamiento.
En todos los pacientes se valoró la extremidad, distal al defecto óseo, siendo funcional y salvable. En todos los casos existía sensibilidad protectora en la planta del pie, no realizándose de forma rutinaria estudios electrodiagnósticos.
Los 2 pacientes neoplásicos fueron sometidos a una cirugía previa simple que consistió en una biopsia a cielo abierto para obtener el diagnóstico. Uno de los pacientes traumáticos se trató de forma aguda, y los cinco restantes recibieron una media de 4 tratamientos previos en otros centros (intervalo: 3-6). El tiempo medio desde la lesión hasta el tratamiento fue de 41 semanas (intervalo: 6-147 semanas) para los pacientes traumáticos.
Los 2 pacientes diagnosticados de adamantioma fueron tratados por los servicios de oncología y ortopedia-trauma. Tras la completa evaluación y diagnóstico tisular, el equipo oncológico procedió a la resección tumoral y seguidamente el servicio de ortopedia-trauma procedió a la colocación del clavo intramedular y a la transposición peronea. En un caso fue necesario un colgajo soleo de rotación y injerto cutáneo para la cobertura de partes blandas.
Los pacientes con defectos secundarios a fracturas abiertas severas de tibia se trataron mediante un protocolo secuencial establecido. Tras una correcta evaluación, se procede a un desbridamiento radical de todo el tejido necrótico e infectado tanto óseo como de partes blandas. Se coloca una tracción esquelética transcalcánea durante 5-10 días. Posteriormente se inserta el clavo intramedular tibial y se retira el clavo calcáneo. Cuatro de los 6 pacientes necesitaron colgajos de cobertura.
El tiempo quirúrgico se pudo recopilar en siete de los 8 pacientes. El tiempo medio de los 4 pacientes sometidos a distintas sesiones de cirugía, fue para el clavo intramedular de 108 min (intervalo: 84-152 min) y para la transposición del peroné de 101 min (intervalo: 80-104 min). Para los 3 pacientes sometidos a una sola sesión, el tiempo medio quirúrgico fue de 173 min (intervalo: 100-235 min).
En 4 pacientes se utilizó el espaciador con bolas de antibiótico tras el desbridamiento. Todos los pacientes recibieron antibióticos peroperatoriamente, profilaxis en los casos limpios o traumáticos, y tratamiento según los cultivos previos en los casos infectados. Tres pacientes fueron tratados con antibiótico intravenoso de acción prolongada según los cultivos intraoperatorios previos. En un paciente se aisló Staphylococcus aureus, Staphylococcus epidermidis, y Pseudomona aeruginosa. En otro paciente Pseudomona aeruginosa, y en el tercero Staphylococcus aureus y Pseudomona aeruginosa.
La movilización de los pacientes, en descarga, se autorizó tan pronto como las partes blandas lo permitieron. La transposición ipsilateral del peroné se realizó a los
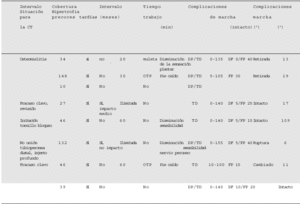
0-70 días tras la colocación del clavo intramedular. Previamente se confirmó la ausencia de problemas de la herida y la maduración de los tejidos blandos transferidos. No se autorizó la carga de la extremidad afectada durante 6 semanas, a partir de las cuales se inició carga parcial según tolerancia.
Se siguieron los pacientes tanto clínica como radiológicamente tras el alta hospitalaria, a las 6 semanas, mensualmente, y luego con un intervalo aproximado de 3-6 meses. Siete de los 8 pacientes fueron controlados durante un tiempo medio de 77 meses (intervalo: 27-148 meses). Un paciente se perdió para el seguimiento durante 10 meses. A los 10 meses el injerto de peroné era perfecto y la carga total.
Se revisó a los pacientes retrospectivamente e independientemente del equipo de cirujanos que los había tratado. Se recogieron datos subjetivos del paciente y datos clínicos objetivos. También se recopilaron datos referentes a las complicaciones, precoces y tardías, y las intervenciones adicionales para tratar dichas complicaciones.
Se compararon las radiografías del postoperatorio inmediato con las del último control. Así se evaluaron las radiografías estándares AP y lateral teniendo en cuenta el tamaño del defecto, la unión en los puntos de contacto tibioperoneo, la conservación de la alineación, y la hipertrofia del peroné. Para eliminar errores de tamaño del peroné debidos al diferente nivel de magnificación radiológica, se utilizó el diámetro del clavo para determinar el factor de magnificación.
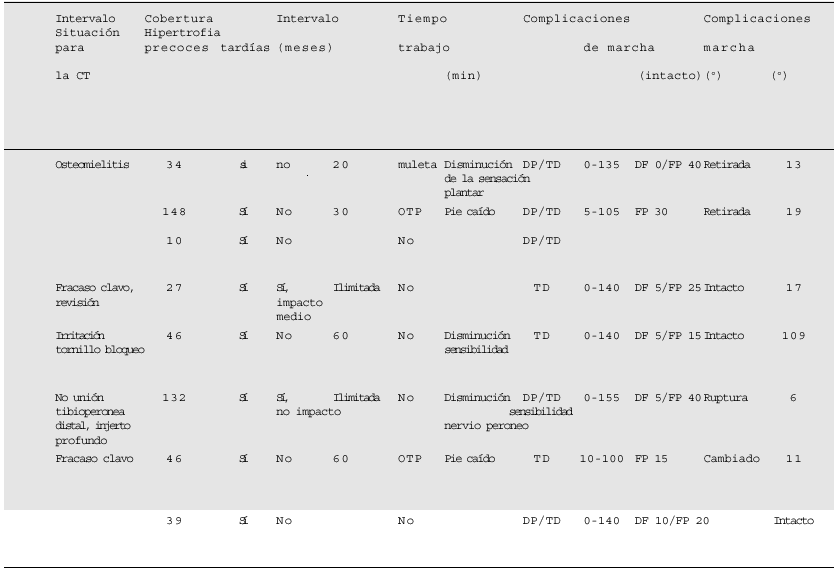
En la última valoración del seguimiento ningún paciente presentaba dolor nocturno ni en reposo. Seis de 7 pacientes presentaban dolor relacionado con la actividad física. Ningún paciente precisaba analgesia. Todos los pacientes a las 16 semanas de la transposición peronea hacían carga total. Un paciente requirió una ortesis tipo Sarmiento y una muleta tras la retirada del clavo secundaria a una infección hematógena tardía (fig. 9). Ningún otro paciente necesitó, para la deambulación, soportes externos. La autonomía de marcha máxima osciló entre 20 min y tiempo ilimitado. Tres pacientes, previa a la lesión, eran trabajadores que realizaban esfuerzos físicos moderados, y dos eran trabajadores de esfuerzo importante. Todos los pacientes se incorporaron a su actividad laboral al mismo nivel que antes de la lesión. Dos pacientes estaban capacitados para los deportes pero deportes sin impacto.
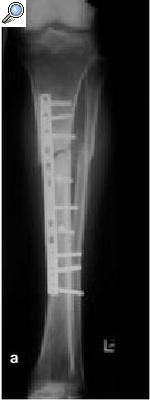
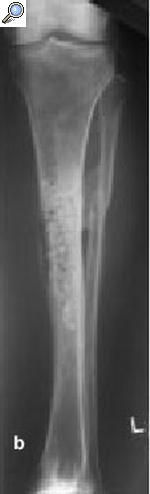
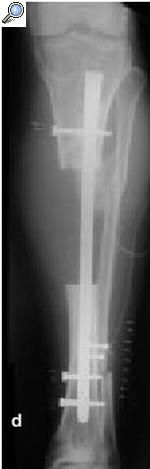
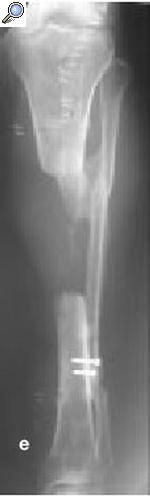
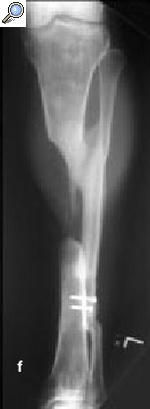
Figuras 9a-f
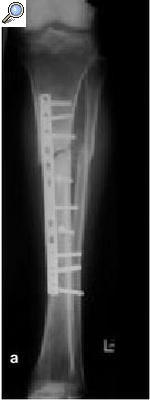
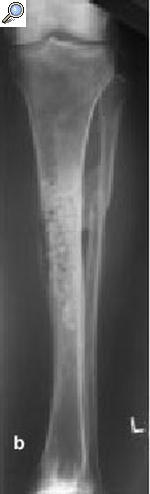
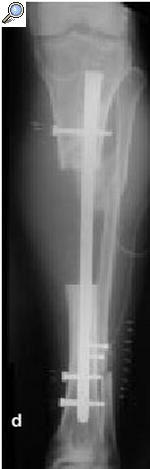
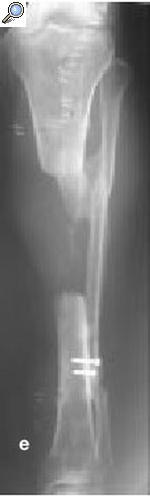
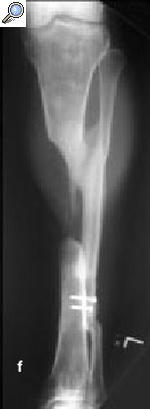
a) Fractura abierta de tibia en un varón de 29 años tratado con fijador externo, sin consolidar, por lo que se le aplicó una fijación no convencional. b) La tibia se infectó, y el paciente fue sometido a numerosos procedimientos incluyendo desbridamiento, espaciadores con bolas con antibiótico y cobertura con colgajos locales para controlar la infección. c) A pesar de la consolidación de la fractura, no se controló la infección por lo que se realizó una diafisectomía. Se objetiva una unión cruzada entre la tibia y el peroné secundario al injerto óseo posterolateral. d) Posteriormente se colocó un clavo intramedular y se realizó la transposición del peroné. e) Tres años y medio más tarde el paciente se presentó con una infección recurrente secundaria a una proliferación hematógena de un absceso dental. f) Se retiró el clavo, sin necesidad de otro sistema de fijación ni inmovilización. Imágenes radiológicas a los 9 años de la diafisectomía y a los 6 de la retirada del clavo.
La exploración física de los 7 pacientes con un seguimiento superior a los 2 años no evidenció dismetría de las extremidades inferiores. La alineación en ambos planos, sagital y coronal, aceptable en todos los pacientes. La alineación rotacional era simétrica a la extremidad contralateral en todos los pacientes. La deambulación era normal en 3 pacientes, y cuatro cojeaban. La movilidad media fue la siguiente: flexión de rodilla de 130º (intervalo: 100º-155º), dorsiflexión de tobillo de 4º (intervalo: 0º-5º) y la flexión plantar de 25º (intervalo: 10º-45º).
Los 7 pacientes presentaron una correcta perfusión del pie ipsilateral. La exploración neurológica fue normal en sólo 2 pacientes, en otros dos existía una disminución de la sensibilidad plantar, y en uno existía una disminución de la sensibilidad dependiente del nervio peroneo profundo. Dos pacientes diagnosticados de parálisis motora completa del nervio peroneo común con sensibilidad plantar intacta. Todos estos déficit neurológicos ya fueron detectados antes de iniciar la reconstrucción, y en ningún caso se determinó como complicación de la transposición peronea.
El estudio radiológico inicial del postoperatorio apreció un defecto mínimo tibial de 8 cm con una media de 11,8 cm (intervalo: 8-12,5). En el último control el clavo intramedular se hallaba intacto en 3 pacientes, roto a nivel del bloqueo proximal en un caso, y retirado en tres casos. La presencia de un puente óseo de unión entre la tibia y el peroné indicó la existencia de consolidación. Todos los puntos de contacto tibioperoneos alcanzaron la consolidación. La hipertrofia peronea media fue del 28% con un intervalo de 6-109%. No se observó ningún cambio en la alineación ni proximal ni distal de los segmentos metafisarios tibiales.
Cinco de los 8 pacientes presentaron 6 complicacio nes precoces. Un paciente presentó una infección recurrente que fue tratada con drenajes y antibiótico intravenoso. A pesar de dicho tratamiento, la fistulización permaneció, por lo que se le retiró el clavo solucionándose el problema. En otro paciente el colgajo libre fracasó en dos ocasiones, por lo que requirió sucesivas transposiciones de partes blandas. Otro paciente desarrolló un síndrome compartimental en la pierna contralateral debido a la posición durante la intervención. Fue tratado con fasciectomías e injertos cutáneos en un segundo tiempo. La intervención se realizó en una mesa de tracción, la resección oncológica se complicó con una lesión vascular que tuvo que repararse, alargando el tiempo quirúrgico con la pierna sana del paciente en mala posición. Actualmente sólo usamos la mesa de tracción en las fracturas abiertas agudas.
Otro paciente desarrolló una fístula arteriovenosa de la arteria tibial anterior, consecuencia de la lesión por arma de fuego, que necesitó reparación vascular. Otra complicación temprana fue el fracaso del tornillo de bloqueo proximal que tuvo que reemplazarse.
Cinco complicaciones tardías se detectaron en 4 pacientes. Un paciente tratado por una osteomielitis crónica desarrolló, a los 40 meses de la reconstrucción, una infección hematógena secundaria a un absceso dental (fig. 9). El germen aislado fue distinto al aislado al inicio del tratamiento de la osteomielitis, y el paciente fue sometido a tratamiento antibiótico intravenoso primero seguido de antibiótico oral, previa retirada del implante, consiguiendo la resolución de la infección. Otras complicaciones tardías fueron la rotura del clavo en dos casos, uno a los 20 meses de su colocación, por lo que se colocó uno de nuevo sin otras complicaciones. La rotura del otro clavo se diagnosticó a los 68 meses. Puesto que el paciente estaba asintomático no se reintervino. Otra complicación fue la no consolidación en un punto de contacto tibioperoneo que se solucionó con éxito con el aporte de injerto antólogo de hueso esponjoso. Otro paciente presentó molestias en el tornillo de bloqueo que desaparecieron al retirar el tornillo.
La transposición del peroné ipsilateral sin la utilización de ningún soporte mecánico, obliga a mantener una inmovilización prolongada de la extremidad en un yeso o una ortesis5, 14 o un fijador externo12,14,16,24,30. Según la experiencia de los autores, la transposición del peroné sin adición de soporte mecánico requiere una inmovilización prolongada con yeso u ortesis durante 18 meses o más tras la cirugía, con el fin de facilitar la carga. En esta serie el clavo intramedular ha permitido iniciar la carga a las 6 semanas, en todos los casos, sin inmovilización externa. Todos los pacientes han realizado carga total a las 14 semanas de la cirugía. Un paciente necesitó la muleta tras la retirada del clavo por la infección hematógena tardía.
Todos los puntos de contacto tibioperoneo consolidaron, aunque un paciente precisó de varias intervenciones y aporte de injerto óseo. Este fracaso de consolidación se consideró debido al espacio entre tibia y peroné en la transposición inicial. No se detectó ninguna fractura por fatiga del peroné. La hipertrofia del peroné sucedió en todos los casos aunque con una media del 30% y sólo en un caso superior al 100%. Puede ser debido al efecto de distribución de carga del clavo intramedular. Yajima & Tamai30 detectaron que el soporte mecánico más central provocaba más hipertrofia que el lateral. Esta diferencia es debido a las mayores fuerzas de estrés a las que el soporte mecánico central se ve expuesto. Podría deberse también a la mala calidad de los tejidos blandos de cobertura debido al grave traumatismo, el amplio desbridamiento por infección o a la resección tumoral.
En dos de los 8 pacientes con seguimiento medio el clavo fracasó. Las cargas mecánicas se transmiten a través del clavo intramedular reduciendo las fuerzas de estrés del peroné que por ello disminuye su capacidad de hipertrofia. Aunque el fracaso del clavo en un paciente no presentó clínica, en el otro caso se asoció a dolor y dificultad para la marcha por lo que se tuvo que cambiar el clavo. No se puede atribuir este fracaso a un tipo determinado de clavo puesto que la incidencia ha sido baja. Queda por conocer si la fatiga del clavo sería responsable de la fractura del peroné en caso de una hipertrofia insuficiente por las cargas en bipedestación.