Notas preliminares
La infección periprotésica es la complicación más temida asociada a la artroplastia total articular. Pese a las modernas técnicas, el 10% de las rodillas requiere artrodesis1,3,12,21,22,27,51 y en hasta un 6% es necesaria la amputación39. La proporción de mortalidad en complicaciones sépticas puede alcanzar el 1,2%2,3,21,30.
La prevalencia oscila según autores entre el 1 y 2%2,22,31,40. En nuestro centro la tasa de infección en 1.400 prótesis de rodilla implantadas fue de 0,85%46. Se describieron alteraciones de la cicatrización en hasta el 20% de las infecciones periprotésicas precoces28,51. De forma independiente respecto al intervalo de la infección, los pacientes con una poliartritis presentan un riesgo de 1,5 a 2,5 veces mas elevado de riesgo de infección22,40,52 y en el caso de los hombres ello se multiplica por cuatro. Una hospitalización preoperatoria superior a una semana dobla el riesgo de infección22. En las prótesis de vástago largo intramedular el riesgo de infección en un período de seis años en un promedio de tres a cuatro veces más alto que en los modelos bicondíleos o unicondíleos28.
En el espectro de patógenos predominan los gram positivos. El pronóstico es menos favorable en gram negativos y en infecciones mixtas. En hasta el 8% de los casos y pese a las pruebas positivas clínicas y de laboratorio los cultivos permanecen negativos28,29.
El concepto de tratamiento de la infección periprotésica comprende
1. antibioterapia sistémica e intraarticular
2. procedimiento primario conservador de la prótesis me- diante sinovectomía y desbridamiento
3. recambio de prótesis en un tiempo
4. recambio de prótesis en dos tiempos
Como procedimientos de salvamento caso que no se pueda curar la infección nos queda la artrodesis o la artroplastia de resección.
En el 90% de los casos se puede aislar el germen de forma preoperatoria a través de la artrocentesis del derrame48. La antibioterapia aislada sistémica e intraarticular es puramente paliativa. Las indicaciones serían la incapacidad para ser operado y un paciente inoperable con una escasa expectativa de vida. En la bibliografía se publica una tasa de reinfección entre un 70 a 90%2,3,27,38. También se ha de mencionar en este tratamiento el riesgo del desarrollo de resistencias y una no despreciable tasa de hasta un 6% de las complicaciones letales.
Los resultados en la bibliografía de los procedimientos que conservan las prótesis primarias son desalentadores2,6,11,23,33,42,45,49,52. La tasa de reinfección se halla en un 70%. Sin embargo destacan, desde el punto de vista pronóstico, tres factores para el éxito de un desbridamiento:
1. establecimiento del diagnóstico de infección dentro de las dos primeras semanas
2. gérmenes patógenos de escasa virulencia
3. prótesis bien anclada sin erosiones óseas
Los resultados en nuestro estudio no pudieron confirmar un peor pronóstico de las prótesis constreñidas de tallo largo3,40,42.
Cuando se siguen estos criterios de selección6,23,35,42 se puede obtener hasta un 80% de curación.
Los procedimientos conservadores de la prótesis con intervalos mayores o con espectros bacterianos menos favorables presentan tasas de recidiva > 80%. Además y de forma significativa se añaden más complicaciones tras los procedimientos de revisión23.
Las infecciones crónicas periprotésicas con erosión del hueso y/o inicio de aflojamiento corresponden al dominio de los recambios de prótesis en uno o dos tiempos. El implante se retira acompañado de cualquier cemento residual y se sustituye con una prótesis cementada en un procedimiento en uno o dos tiempos. Se añaden antibióticos al cemento atendiendo al antibiograma. De este modo se pueden obtener concentraciones de antibiótico local extremadamente altas pero progresivamente decrecientes.
Aunque la mayoría de los autores anglosajones favorecen el recambio en dos tiempos persisten las ventajas de un recambio en un tiempo. Con una sola intervención se puede obtener una curación con garantías y una función de rodilla correcta. Para el éxito es decisivo un cultivo exacto preoperatorio, un desbridamiento radical e impregnar el cemento óseo con el antibiótico específico para los patógenos detectados47. Son factores pronósticos importantes los microorganismos de baja virulencia y una buena calidad de hueso13,15.
Aunque estudios escandinavos3 no hallan ninguna diferencia significativa en la tasa de curación entre las estrategias en uno o dos tiempos, la mayoría de los autores favorecen el cambio en dos tiempos1,5,8,16,17,22,24,25,27,41,43,51-53.
En una revisión en dos tiempos la colocación de un cemento óseo cargado con un antibiótico o una malla reabsorbible antibiótica durante el intervalo previo a la reimplantación también asegura una concentración antibiótica inicialmente alta pero decreciente de forma continua de antibióticos bactericidas. El cemento óseo se impregna con antibiótico en concordancia con el antibiograma en cuanto a sensibilidad y se introduce en forma de rosarios o espaciadores de cemento óseo4,32,34. El espaciador de cemento óseo se coloca modelando la forma de la prótesis o en varias formas de endurecimiento9,19,24,34,36. No se hallaron diferencias significativas en los resultados funcionales entre espaciadores estáticos y dinámicos10.
La duración del intervalo se establece en la bibliografía en un promedio de seis semanas. Intervalos más cortos < 2 semanas no se han podido garantizar24,40. Existen diferencias significativas entre autores oscilando entre 4-6 meses31. La mayoría de los autores prefieren una inmovilización con un fijador externo o una ortesis.
El problema de un recambio en dos tiempos con inmovilización de la rodilla consiste en el desarrollo de contracturas de partes blandas, atrofia muscular, y debilidad del hueso debido a la inmovilización. Las consecuencias son a menudo la necesidad de realizar liberaciones de partes blandas con cuadriceplastias, reconstrucción de ligamento rotuliano, e incluso la recolocación de la tuberosidad tibial anterior20,41,44,53.
Por el contrario la colocación de espaciadores temporales sin inmovilización permite una fisioterapia postoperatoria inmediata y una rápida movilización. Los espaciadores temporales se pueden moldear manualmente de cemento óseo o ya venir en formas determinadas para evitar la enfermedad de las partículas17,19,24,34. En contra tenemos hasta en el 44% de los casos una pérdida de hueso7. Los espaciadores canulados esculpidos a mano permiten además un drenaje de la cavidad medular pero presentan la misma desventaja en forma de liberación decreciente de antibiótico26.
Para el recambio en dos tiempos de una prótesis séptica utilizamos en el intervalo un espaciador de fabricación industrial45,46 que en forma y en geometría articular imita la prótesis a colocar posteriormente (endoprótesis rotacional, casa W. Link). El catéter de instilación continua de antibiótico en el espaciador garantiza unas concentraciones muy elevadas que garantizan una curación durante el intervalo. Las ventajas en frente de un espaciador de cemento residen en una mejor estabilidad en ejercicios y en carga así como la minimización de la pérdida ósea y de las lesiones de partes blandas.
La ventaja del procedimiento en dos tiempos sobre un tiempo es la posibilidad de utilizar la información sobre el germen obtenida en las muestras bacteriológicas e histológicas en el tiempo de intervalo entre las dos cirugías. Bajo control de los hallazgos clínicos y de laboratorio así como la evolución bacteriológica se puede asegurar con más garantía una curación de la infección durante el intervalo. A través de la utilización de dispositivos internos o espaciadores se pueden evitar las desventajosas contracturas de partes blandas y el crecimiento óseo del intervalo. La prótesis de revisión cementada definitiva se implantará en un lecho libre de infección con el máximo de hueso y partes blandas conservados.
A la vista de lo descrito no se puede plantear hoy en día una visión dogmática del tratamiento para revisión de las prótesis infectadas56. Se debe en cada caso individual valorar los datos clínicos, bacteriológicos y los hallazgos intraoperatorios para elegir el procedimiento quirúrgico más adecuado. En el punto central de esta decisión se debe hallar el paciente individual y la experiencia concreta del centro.
Nuestra propia estrategia actual limita la indicación de procedimientos que conserven el implante primario a infecciones agudas con patógenos de baja virulencia con prótesis firmemente asentadas. En infecciones crónicas de bajo grado con patógenos de baja virulencia y escasa afectación ósea preferimos un procedimiento en un tiempo con una prótesis de revisión cementada y antibióticos añadidos al cemento de acuerdo al antibiograma.
Los cursos de infección fulminantes con patógenos de alta virulencia y una infiltración ósea significativa así como las recidivas de infecciones son para nosotros una clara indicación para un recambio en dos tiempos. Preferimos un régimen de intervalo con un espaciador que libere antibióticos.
En el caso que no se pueda curar la infección, lo cual es muy infrecuente, aún tenemos la artrodesis como última alternativa en la rodilla y en la cadera la artroplastia de resección.
Principios quirúrgicos y objetivos
Recambio en dos tiempos de una prótesis infectada con acortamiento del intervalo de implante. Pontaje de la fase de intervalo con una prótesis espaciador, que permita la movilización y evite así las contracturas de partes blandas. Al mismo tiempo instilación diaria de antibiótico según el espectro de sensibilidad en el lugar de la infección y a través de la prótesis.
Ventajas
* Administración de antibiótico de manera dirigida en suficiente dosis en el lugar de la infección.
* Concentraciones extremadamente altas a nivel local con lo cual se combate más rápidamente la infección.
* Alta eficacia especialmente en colonias de patógenos difíciles de erradicar.
* Duración escasa in situ del implante temporal.
* La cirugía se puede realizar inmediatamente sin conocimiento de la resistencia del patógeno; una vez conocido el test de sensibilidad la dosis de antibiótico se puede modificar fácilmente.
* El patógeno se puede identificar con un alto grado de garantía de los aspirados intraoperatorios y de los especímenes de biopsia.
* Resección de las zonas óseas altamente infectadas utilizando la plantilla de corte original para el implante definitivo.
* El antibiótico se puede cambiar si aparecen resistencias in situ.
* Tras disminución de los parámetros de inflamación (monitorización de la proteína C reactiva [PCR]) ya a las tres semanas se puede realizar el segundo tiempo50.
* Mantenimiento de la longitud y de la movilidad de las estructuras de partes blandas a través del aplicador espaciador y la posibilidad de utilizar férulas de movilización.
* Mayor movilidad del paciente durante la fase de curación de la infección.
* En el segundo tiempo quirúrgico sólo se requiere el desbridamiento del lecho de la prótesis y una segunda sinovectomía.
* La colocación de la prótesis definitiva se puede realizar con el cemento elegido mediante el antibiograma.
* La reconstrucción definitiva con aloinjertos se hará con la implantación en un lecho libre de infección.
* Tras la limpieza y esterilización se puede reutilizar el instrumento (aplicador espaciador de antibióticos) con lo cual se hace progresivamente más económico.
Desventajas
* Colocación de un puerto subcutáneo con necesidad de inyecciones diarias.
* Alternativa: extracción de un catéter de silicona desde el espacio intramedular a través de la piel con el riesgo de ser una fuente de infección todo y que el catéter esté rellenado de antibiótico.
* En caso de colocación inestable: riesgo de luxación.
Indicaciones
* Infecciones periprotésicas que precisen un largo intervalo sin prótesis para garantizar la curación de la infección.
* Prevención de contracturas y adherencias en el segundo tiempo de la revisión.
* Infecciones periprotésicas agudas con patógeno y antibiograma desconocido.
* Infecciones periprotésicas con gérmenes difíciles de tratar.
Contraindicaciones
* Osteoporosis severa.
* Defectos óseos amplios que excluyan la estabilidad primaria del aplicador espaciador.
* Cuadros clínicos neurológicos como complicación que impidan la coordinación motora.
* Obesidad mórbida y pacientes no cumplidores.
Información al paciente
* Riesgos quirúrgicos generales.
* Recambio de prótesis en dos tiempos que requiere un instrumento temporal para mantener el equilibrio de partes blandas y con la aplicación de antibiótico directamente en el lecho de la infección.
* Resistencia a antibióticos y alergias.
* Necesidad de una segunda intervención tras curar la infección.
* Riesgo de fractura en caso de carga inadecuada.
* Concepto de tratamiento postoperatorio.
* Alternativa: recambio en un tiempo con cemento con antibiótico.
Preparación preoperatoria
* Punción de la articulación para identificar el patógeno y obtener un antibiograma.
* Radiografía actual (placa grande) y si es posible gammagrafía ósea.
* Administración parenteral de un antibiótico de gran espectro con buena penetrancia ósea, p. ej., Cefotiam, desde la intervención hasta obtener el primer antibiograma, tras el cual se puede cambiar el fármaco si es necesario.
* Preparación del paciente para el transporte a quirófano (intervención séptica eventualmente con estafilococos polirresistentes que pueden requerir medidas especiales de transporte).
* Preparación del quirófano para una intervención séptica.
* Isquemia preventiva de la rodilla.
Instrumental e implantes
* Caja de prótesis de rodilla, caja de recambio de prótesis, sistema de lavado, juego de motores.
* El espaciador aplicador adecuado a la caja de prótesis de rodilla o cadera.
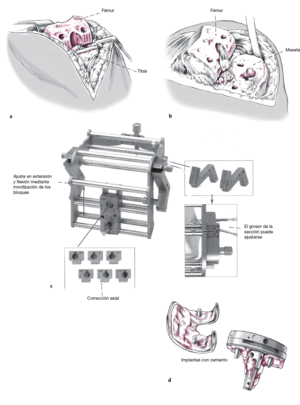
* Para el recambio de prótesis de superficie de rodilla por prótesis de superficie (modelo Gemini, casa W. Link, Barkhausenweg 10, 22339 Hamburgo) utilizamos los componentes retirados tras ser reesterilizados para ser colocados de nuevo con una fina capa de cemento y se coloca en medio el espaciador perforado temporal a modo de polietileno (casa W. Link; fig. 1a). Como en el implante original, existen cinco diferentes tamaños con sus respectivas alturas a disposición (fig. 1b).
Figuras 1a a 1d
a) Espaciador para un recambio de prótesis de superficie; se cambia el polietileno por un implante metálico perforado.
b) Diferentes tamaños de espaciadores para la prótesis de superficie.
c) Espaciadores para prótesis de bisagra, versión derecha e izquierda.
d) Espaciador para recambio de cadera
* Para el recambio de un sistema de bisagra rotacional utilizamos un espaciador aplicador de antibiótico en base al modelo de rodilla rotacional Endomodel (casa W. Link, fig. 1c).
* Para el recambio de cadera disponemos de un espaciador aplicador en base del modelo Lubinus Classic (casa W. Link) (fig. 1d).
* Drenaje de silicona Ch 8.
* Llave de tres pasos.
* Alternativa: puerto subcutáneo (p. ej., intraport, casa Fresenius Kabi, 61346 Bad Homburg).
Anestesia y posición
* Anestesia general.
* Isquemia preventiva para abordajes de rodilla.
* Decúbito supino para abordajes de rodilla.
* Colocación en decúbito lateral para abordajes de cadera.
Técnica quirúrgica
Figuras 2 a 5
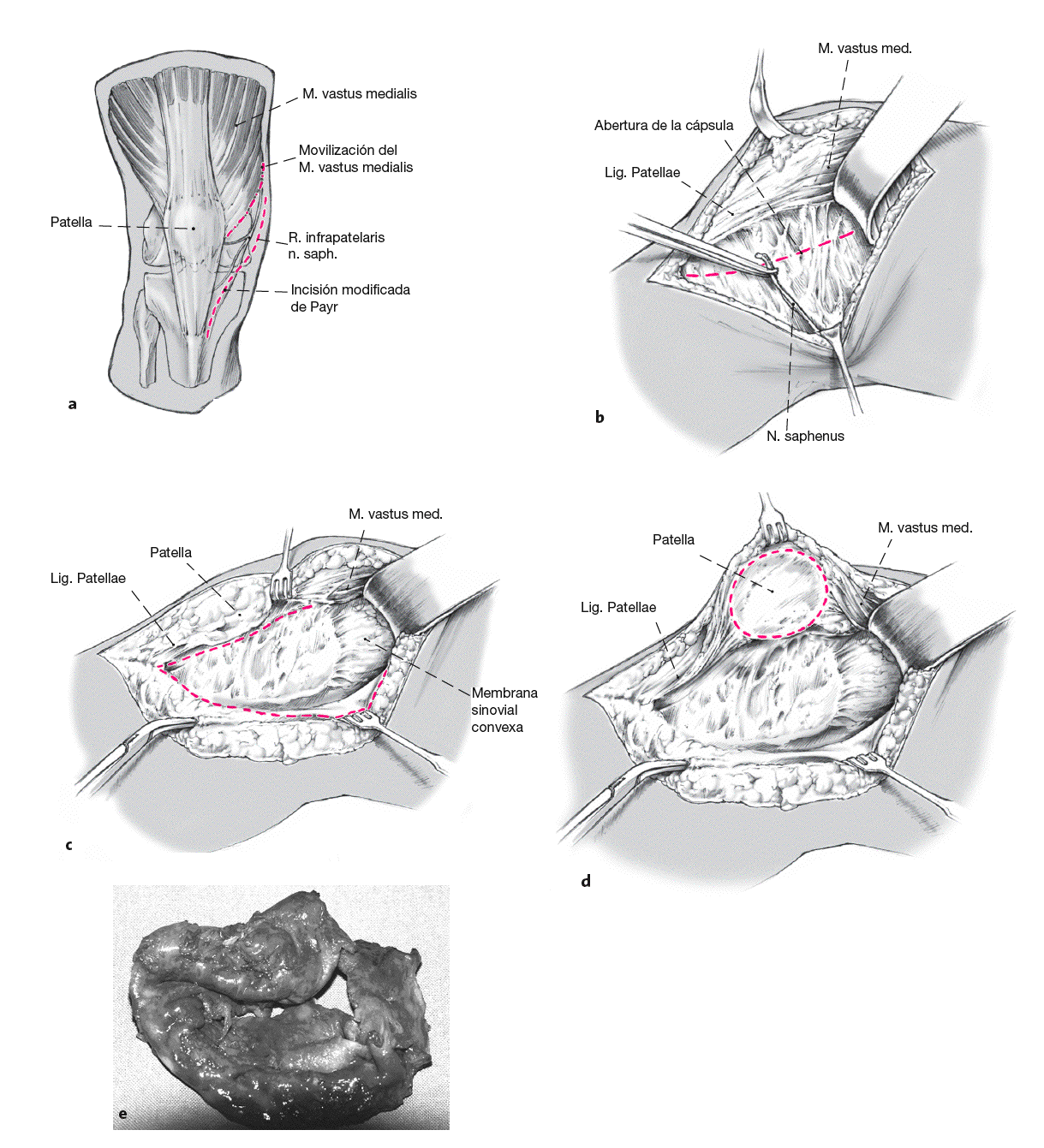
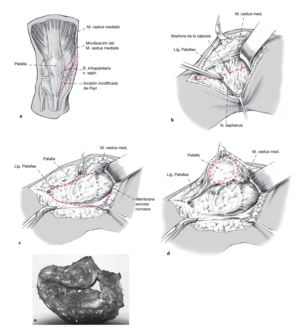
Figuras 2a a 2e
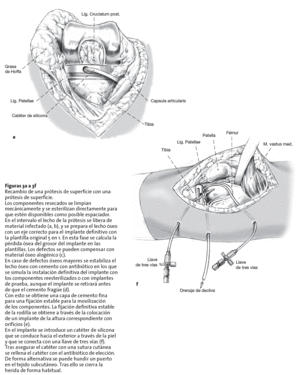
La articulación de la rodilla se abordó con la línea de incisión modificada de Payr (a [línea roja]). Se diseca el ramo infrapatelar del nervio safeno hasta la fosa poplítea y a continuación se reseca para denervación de la rótula (b). Con ello se puede renunciar a un recambio de la articulación femoropatelar. La articulación de la rodilla se abre mediante la movilización roma del músculo vasto medial (a) y con la resección de la parte medial de la membrana sinovial (b [línea roja], c), se evierte la patela (d) y se denerva alrededor de forma circular con el electrocauterio. A continuación se puede realizar la sinovectomía de todo el compartimento lateral de la rodilla (e).
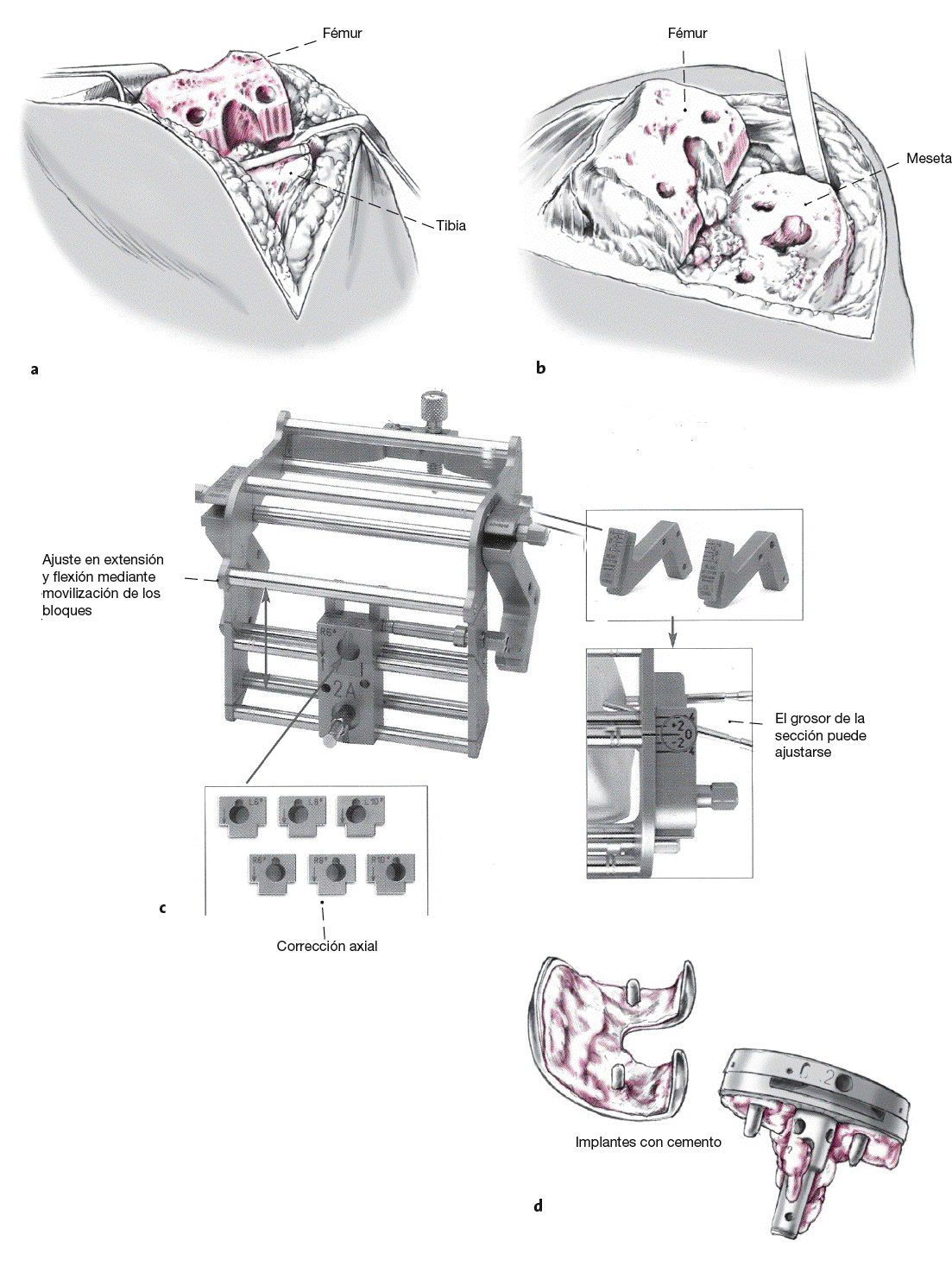
La rodilla artificial infectada se reseca intentando preservar el máximo de hueso posible pero al mismo tiempo extirpando los límites óseos infiltrados con inflamación o pannus. Según sean las lesiones puede prepararse el instrumental para una prótesis total de superficie (modelo Gemini) si los ligamentos se hallan íntegros, o para una prótesis constreñida (endomodell) para obtener una superficie ósea lista para albergar la prótesis definitiva. En la mayoría de los casos conseguimos así el lecho ideal y estable para colocar el espaciador con aplicador para la instilación de antibióticos.
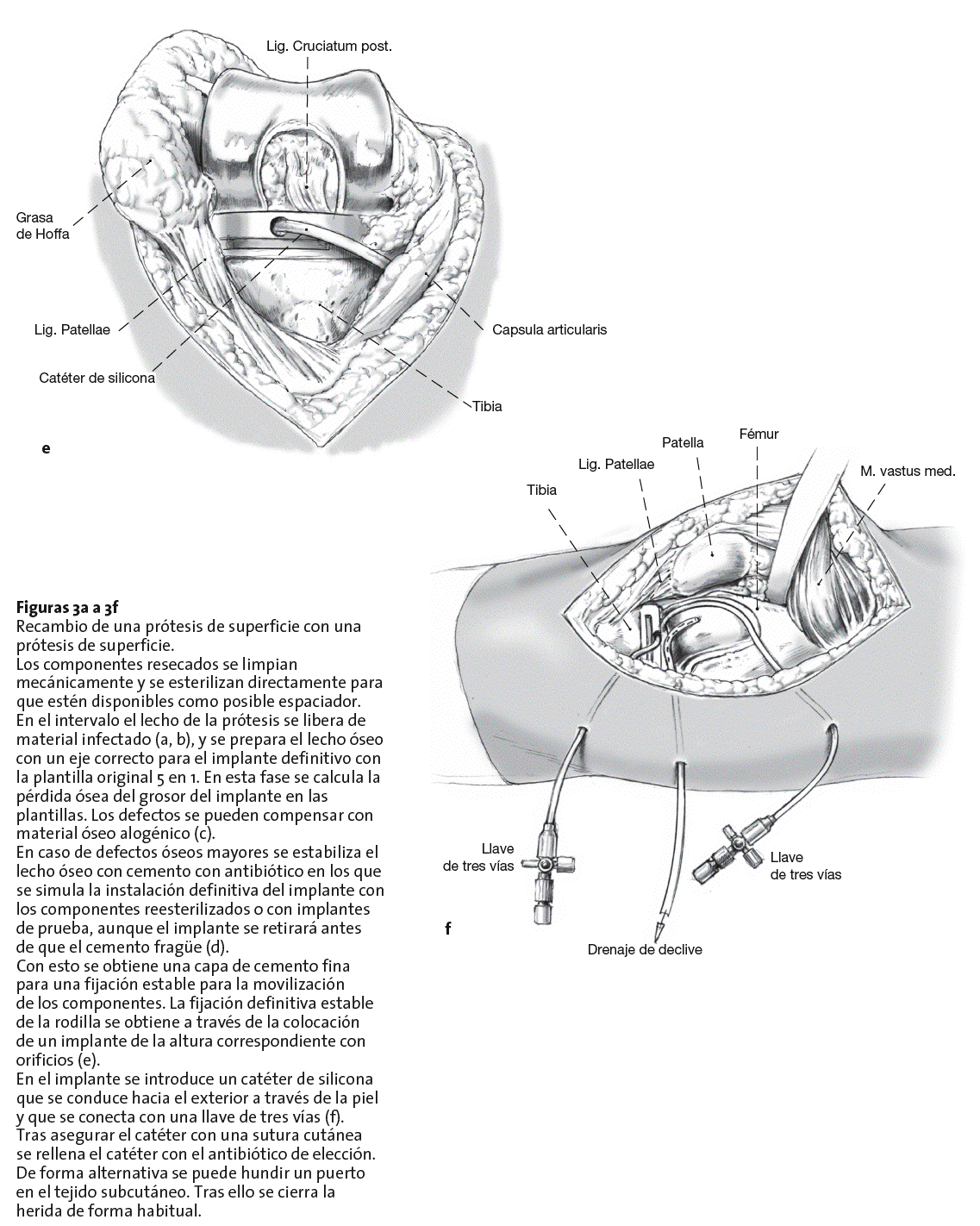
Figuras 3a a 3f
Recambio de una prótesis de superficie con una prótesis de superficie.
Los componentes resecados se limpian mecánicamente y se esterilizan directamente para que estén disponibles como posible espaciador. En el intervalo el lecho de la prótesis se libera de material infectado (a, b), y se prepara el lecho óseo con un eje correcto para el implante definitivo con la plantilla original 5 en 1. En esta fase se calcula la pérdida ósea del grosor del implante en las plantillas. Los defectos se pueden compensar con material óseo alogénico (c).
En caso de defectos óseos mayores se estabiliza el lecho óseo con cemento con antibiótico en los que se simula la instalación definitiva del implante con los componentes reesterilizados o con implantes de prueba, aunque el implante se retirará antes de que el cemento fragüe (d).
Con esto se obtiene una capa de cemento fina para una fijación estable para la movilización de los componentes. La fijación definitiva estable de la rodilla se obtiene a través de la colocación de un implante de la altura correspondiente con orificios (e).
En el implante se introduce un catéter de silicona que se conduce hacia el exterior a través de la piel y que se conecta con una llave de tres vías (f). Tras asegurar el catéter con una sutura cutánea se rellena el catéter con el antibiótico de elección. De forma alternativa se puede hundir un puerto en el tejido subcutáneo. Tras ello se cierra la herida de forma habitual.
Figuras 4a y 4b
Recambio de una prótesis de superficie por una prótesis constreñida.
Si los defectos óseos aparecidos tras la infección no permiten asegurar una fijación segura y una función de la movilidad correcta se prepara la rodilla para el implante definitivo para una prótesis constreñida o de bisagra. En este caso el cirujano utiliza el instrumental especial que se suministra para colocar la rodilla constreñida, dado que se requieren las mismas resecciones óseas para la prótesis constreñida que para el espaciador-aplicador de antibióticos. Tras adaptar los componentes femorales, se perfora un orificio de 6 mm medial con la rodilla en flexión usando una guía de perforación que encaje en el canal medular fresado para el vástago (a). El orificio perforado se alineará con el orificio del vástago del espaciador a través del cual se pasará el catéter percutáneo de silicona. Si el componente de liberación de antibiótico no puede estabilizarse para hacer ejercicio se puede añadir un tornillo de bloqueo adicional a través de la guía de fresado en la porción diafisaria del vástago perforado a través de una incisión puntiforme. La tibia se prepara de la misma forma (b): la cánula se introduce a través de una incisión puntiforme hasta contactar hueso y se perfora un orificio de 6 mm. El tubo de silicona se puede intr; una fina capa de cemento con antibiótico para asegurar la fijación del espaciador. El espaciador aplicador se retirará justo antes del fraguado del cemento. Se ha de tener en cuenta en este paso no bloquear el paso de antibiótico a través del vástago por restos de cemento. A continuación se avanza un tubo de silicona Ch 8 a través del orificio de 6 mm dentro de los vástagos perforados del espaciador tibial y del espaciador femoral y se posiciona en el lecho preparado del implante.
Figura 5
Colocación del catéter de silicona.
En la colocación del catéter de silicona se ha tener en cuenta que esté garantizado un flujo de antibiótico inalterado. La colocación de un catéter muy flexible se realiza mejor de forma retrógrada. El catéter se introduce a través del orificio adyacente a la articulación mediante la cánula de 6 mm con el instrumental especial en el vástago, si es necesario estabilizado con un mandril. De forma alternativa se puede introducir primero el catéter por el orificio perforado y luego en el vástago. Con suficiente longitud de catéter se puede colocar el implante con tracción simultánea del catéter para asegurar que la parte distal del catéter permanezca en la prótesis. De este modo podemos asegurar no doblar el catéter ni comprimirlo. El extremo superior del catéter se pasa a través de la piel y se conecta con una llave de tres pasos. Al final se comprueba el paso seguro de líquido y la colocación correcta del catéter mediante irrigación de prueba. A continuación y a demanda se puede colocar el tornillo de bloqueo.
Tras comprobar la posición correcta del catéter y el paso de antibiótico no impedido se conectan los componentes de la prótesis. Entonces se fija el catéter en un puerto subcutáneo en el lado medial.
Nosotros preferimos una salida del drenaje de silicona a través de la piel y conectamos con una llave de tres vías, a través de la cual se introduce el antibiótico elegido en dosis parenterales en el espaciador aplicador. En el catéter permanece un resto de antibiótico que impide una infección retrógrada; los puntos de introducción a través de la piel se limpiarán y protegerán con un apósito empapado en un medio antiséptico.
Se cierra la rodilla de forma habitual; se añaden dos drenajes de redón durante 24 h como drenaje de declive. Tras ello se inyectarán sólo dos o tres veces al día el antibiótico que se haya demostrado como eficaz en el antibiograma. En caso de antibiograma desconocido aplicamos hasta recibir el antibiograma un antibiótico soportable localmente de amplio espectro, por regla general gentamicina. De esta manera las dosis normales de antibiótico producen concentraciones extremadamente altas en el lugar de la infección sin producir necrosis de los tejidos.
Consideraciones especiales
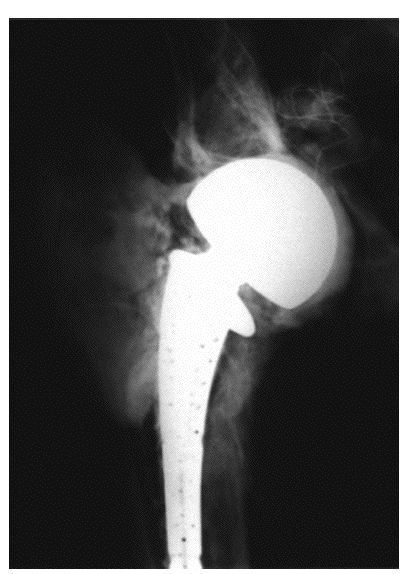
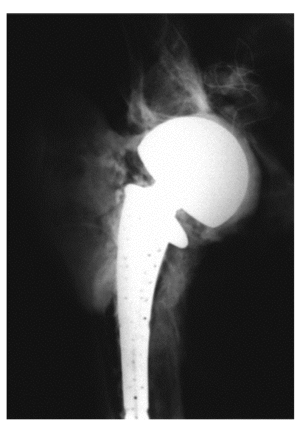
* Para el recambio de prótesis de cadera nosotros preferimos el abordaje dorsolateral. Para la cadera se dispone de un vástago con perforaciones de la prótesis Lubinus "Classic" (casa W. Link). La cabeza modular pulida está disponible en varios tamaños (fig. 1d). La superficie externa está pulida para evitar mayor usura ósea en cótilos ya alterados. La parte en contacto con la articulación muestra perforaciones que también se hallan en la parte del cuello de contacto con el vástago de tal manera que el antibiótico alcanza también el cótilo, donde se distribuye uniformemente. Podemos demostrar este efecto por medio de contraste tras 14 días (fig. 6).
Figura 6
Recambio de prótesis de cadera.
* El espaciador aplicador asegura la difusión del antibiótico tanto en el espacio intramedular como en el espacio del antiguo acetábulo. Tras curar la infección el nuevo vástago y el nuevo cótilo se implantarán con cemento con antibiótico.
* El espaciador aplicador se desmonta tras la retirada, se puede limpiar y reesterilizar. Está así disponible para otras intervenciones sin coste económico añadido.
Tratamiento postoperatorio
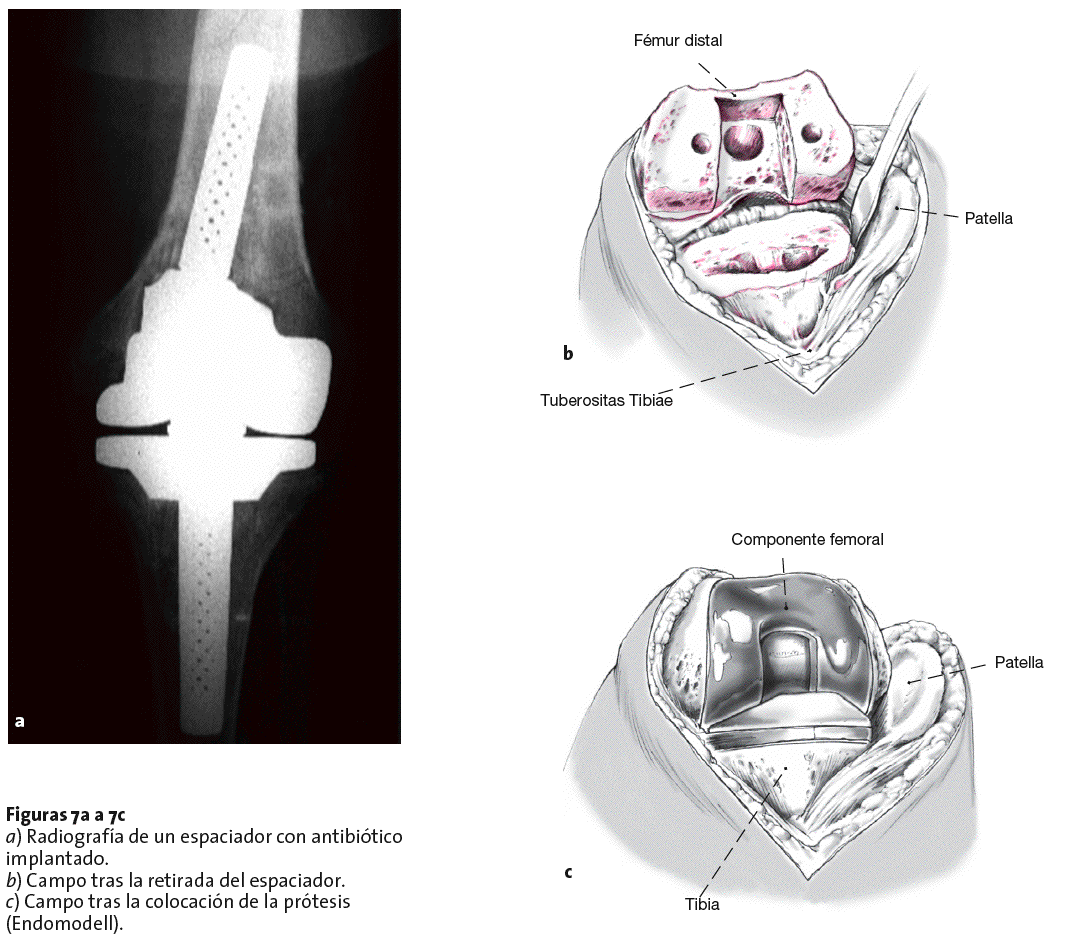
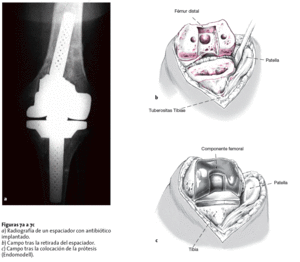
* Tras retirada del drenaje de declive se inicia la administración de antibiótico intramedular y periarticular dos o tres veces al día en dosificación parenteral. De forma asociada se administra otro antibiótico de forma parenteral. Control de la actividad de inflamación mediante la PCR. Fisioterapia tras retirada del drenaje de redón. Tras el primer tratamiento con fisioterapia se realizará como forma de documentación y como forma de comprobación de estabilidad del implante una radiografía (fig. 7a).
Figuras 7a a 7c
a) Radiografía de un espaciador con antibiótico implantado.
b) Campo tras la retirada del espaciador.
c) Campo tras la colocación de la prótesis (Endomodell).
* Según sea la estabilidad primaria del implante aplicador se inician ejercicios activos de la articulación; la movilización obtenida de esta manera se mantiene de forma pasiva con un artromotor. El contacto de la suela con el suelo y la marcha en descarga son por regla general posibles. Ello mantiene el espacio articular, un manto de partes blandas móviles y una musculatura funcional.
* La prótesis de recambio definitiva se puede colocar tras un promedio de 3-4 semanas una vez se ha normalizado la PCR. La administración intramedular de antibióticos se ha de mantener hasta la retirada del espaciador. Una vez retirado el espaciador el lecho del implante se desbrida meticulosamente y se practica una sinovectomía total. Los restos de tejido en el lecho del implante se resecan (fig. 7b) y el lecho se limpia con un lavado a presión. La prótesis definitiva se implanta con el cemento mezclado con antibiótico (fig. 7c).
* La membrana sinovial y los tejidos recogidos se estudian nuevamente microbiológicamente. Se administra antibiótico parenteral durante seis semanas y después se cambia si es posible a administración oral. Si se dispone de un antibiótico oral se prolonga el tratamiento hasta normalizar la PCR.
Elección del antibiótico
* Las siguientes sustancias son las que mejor se adaptan para la aplicación diaria de antibióticos:
1. aminogligósidos y sus derivados, que se pueden administrar con pequeñas cantidades de líquido, tienen largas vidas medias, y valores altos de concentraciones mínimas inhibitorias; incluyen gentamicina, fosfomicina, vancomicina, teicoplanina, etc.37;
2. ciprofloxacino y similares;
3. rifampicina para el tratamiento de las infecciones por tuberculosis y anfotericina B para infecciones por Candida;
4. las penicilinas de segunda y tercera generación tienden a provocar alergias rápidamente tras aplicación local y es mejor reservarlas para administración parenteral suplementaria.
Errores, problemas, complicaciones
* Carga en exceso precoz en caso de hueso apreciado intraoperatoriamente como muy débil con riesgo de hundimiento del aplicador espaciador de antibiótico: reducción de la movilización para disminuir el riesgo de luxación, tener preparados bloques espaciadores para la implantación definitiva para poder reconstruir la interlínea articular.
* Signos de irritación en el punto de salida del catéter de silicona: cuidado de la herida diario.
* Necrosis de la piel y de tejidos: cambio de la administración de antibiótico. Por lo general todas las dosis parenterales se toleran localmente. Las penicilinas y sus derivados por lo general despiertan reacciones alérgicas de forma rápida por lo que sólo se recomiendan cuando fallen otros antibióticos. Ocasionalmente desbridamiento de los tejidos necróticos y cobertura mediante cirugía plástica.
* Estabilidad insuficiente del espaciador aplicador apreciable intraoperatoriamente: se puede aumentar la estabilidad mediante tornillos de bloqueo, se puede personalizar el tratamiento postoperatorio limitando la movilización, la carga, etc.; de otro modo es de esperar un aumento de la pérdida de masa ósea.
* Administración de antibiótico en forma de lavado aspiración. Si se aplica el antibiótico en forma de lavado aspiración y el antibiótico sólo se puede reabsorber de forma limitada mientras que no se alcanzan concentraciones suficientemente altas en los tejidos: eficacia disminuida, prolongación de la fase de intervalo hasta la normalización de la PCR, mayor desarrollo de resistencias.
* Los antibióticos deberían mantenerse hasta el momento de la cirugía de revisión; en ese momento se debe mezclar con el cemento el antibiótico adecuado.
* Atasco precoz del catéter: retirada del catéter y adelantar la intervención de recambio antes que las cifras de PCR hayan vuelto a la normalidad.
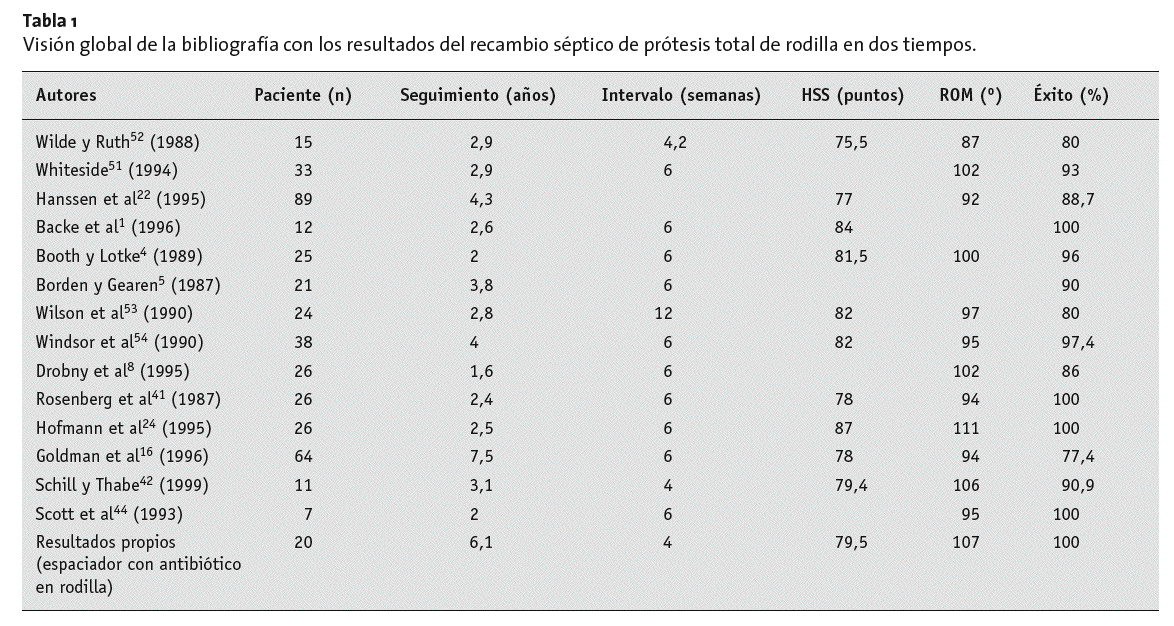
Resultados
En nuestra propia serie de pacientes se operaron desde 1992 con la técnica descrita 36 prótesis realizando un recambio en dos tiempos. En el espectro microbiológico dominaron los gérmenes grampositivos, Staphylococcus aureus (16 infecciones), y Staphilococcus epidermidis (ocho infecciones). Se hallaron gramnegativos en cinco infecciones y en infecciones mixtas en tres articulaciones. Dos reinfecciones se debieron a colonizaciones con Candida albicans, dos casos se debieron a Mycobacterium tuberculosis. Se usó un espaciador de rodilla en veinte casos y de cadera en dieciséis. El intervalo entre intervenciones se decidió orientándose con la normalización de la PCR, que por regla general a las 3-4 semanas ya disminuía. Los pacientes con infecciones por Candida y las tuberculosis presentaban un intervalo de 6-8 semanas. El tiempo medio entre intervenciones fue de 27 días y la media de ingreso fue de 43 días. El intervalo más largo libre de infección fue de más de diez años. La edad media del paciente en el momento de la primera intervención fue de 72,3 años (48 83 años). En las infecciones se trató en 17 casos de recidivas tras un desbridamiento, en trece casos se trataron de infecciones hematógenas tardías, seis de ellas en pacientes recibiendo tratamiento con antagonistas del factor de necrosis tumoral *, y seis infecciones iatrógenas tras tratamiento con repetidas infiltraciones.
El seguimiento se basó en controles clínicos y radiológicos. El promedio de tiempo hasta el control fue de 6,1 años. Todas las 36 intervenciones tuvieron éxito. Hasta la fecha ninguno de los pacientes ha precisado una intervención de revisión. Una paciente con una infección recurrente por Candida albicans tras una revisión en un tiempo precisó un recambio en dos tiempos con espaciador aplicador que curó la infección14,55. En total el conjunto de pacientes mostró un buen resultado funcional con una valoración media del Hospital of Special Surgery Score39 (HSS-Score) de 79,5 puntos y un arco de movilización de flexoextensión de 0/0/106º para la rodilla y una valoración de Harris-Score de 81,3 y un arco de movilización de 10/0/110º para la cadera31.
Los resultados tras procedimientos de recambio en dos tiempos con el espaciador de cemento o la prótesis provisional16,18,24,43 en comparación con la inmovilización durante el intervalo entre intervenciones3,8,35,41,52,53 explican una mejor recuperación de la función de la rodilla mientras se consigue la misma tasa de erradicación de la infección.
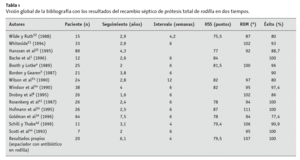
Un estudio de la bibliografía1,4,5,8,12,16,18,22,24,25,41,42,51-54 de un total de 417 procedimientos en dos tiempos (tabla 1) con una media de seguimiento de 3,6 años confirma una tasa de éxito primario de 91% independientemente del régimen de intervalo. Los resultados funcionales también son buenos con un arco de movilidad medio de 107º y un HSS-Score39 de 80,4 puntos. Los intervalos hasta la colocación de la prótesis definitiva son sin embargo más largos.