El sistema de dos-componentes BarA/UvrY de Escherichia coli activa directamente la expresión de los RNAs pequeños no-codificantes CsrB y CsrC. Estos RNAs pequeños funcionan como antagonistas de la actividad de la proteína CsrA, la cual regula positiva y negativamente la traducción de múltiples mensajeros blanco. El circuito BarA/UvrY-CsrA está conservado en las γ-proteobacterias y aunque el mecanismo de acción se mantiene, existen importantes diferencias funcionales que representan los requerimientos especiales de cada especie bacteriana. En esta revisión compararemos las estrategias que diferentes bacterias emplean para llevar a cabo la regulación del mencionado circuito en función a su estilo de vida.
The BarA/UvrY two-component system of Escherichia coli directly activates the expression of the small non-coding RNAs CsrB and CsrC. These small RNAs function as antagonist of the CsrA activity, which regulates the translation of numerous target mRNAs. The BarA/UvrY-CsrA circuitry is conserved in the γ-proteobacteria and although the mechanism of action is preserved, there are important functional differences that represent the particular requirements of each bacterial species. In this review we compare the strategies that different bacterial species employ in order to carry out the regulation of the above circuitry in function of their life style.
En las bacterias las señales ambientales son transducidas a la célula predominantemente por los sistemas de dos componentes (SDC). El SDC prototipo consta de una histidina cinasa (HC) y de una proteína reguladora de la respuesta (RR). Las HC son usualmente proteínas integrales de membrana, que ante la presencia de un estímulo específico, se autofosforilan a través de un mecanismo dependiente de ATP, en un residuo conservado de histidina y después transfieren el grupo fosforilo a un residuo aspartato conservado en el RR. La fosforilación del RR ocasiona cambios conformacionales que le permiten funcionar como factor transcripcional, controlando la expresión de genes blanco, en respuesta al estímulo específico[1,2]. Muchas bacterias patógenas se enfrentan a diferentes microambientes durante su ciclo de infección y su habilidad para adaptarse a diferentes nichos dentro y fuera de sus organismos hospederos frecuentemente está mediada por los SDC, por lo tanto, pueden ser considerados como un pre-requisito para su patogenicidad[3].
El SDC conformado por la HC BarA (bacterial adaptative response gene A) y por el RR UvrY de Escherichia coli está ampliamente conservado en las γ-proteobacterias, incluyendo a los sistemas: BarA/SirA (Salmonella) GacS/GacA (Pseudomonas), VarS/VarA (Vibrio), ExpS/ExpA (Pectobacterium) y LetS/LetA (Legionella pneumophila), en donde regulan el metabolismo central del carbono, la formación de biopelículas, resistencia a estrés, así como otros fenotipos asociados a la patogenicidad y virulencia (para más detalles acerca del efecto de los homólogos del SDC BarA/UvrY en diferentes especies bacterianas ver ref. [4–6]).
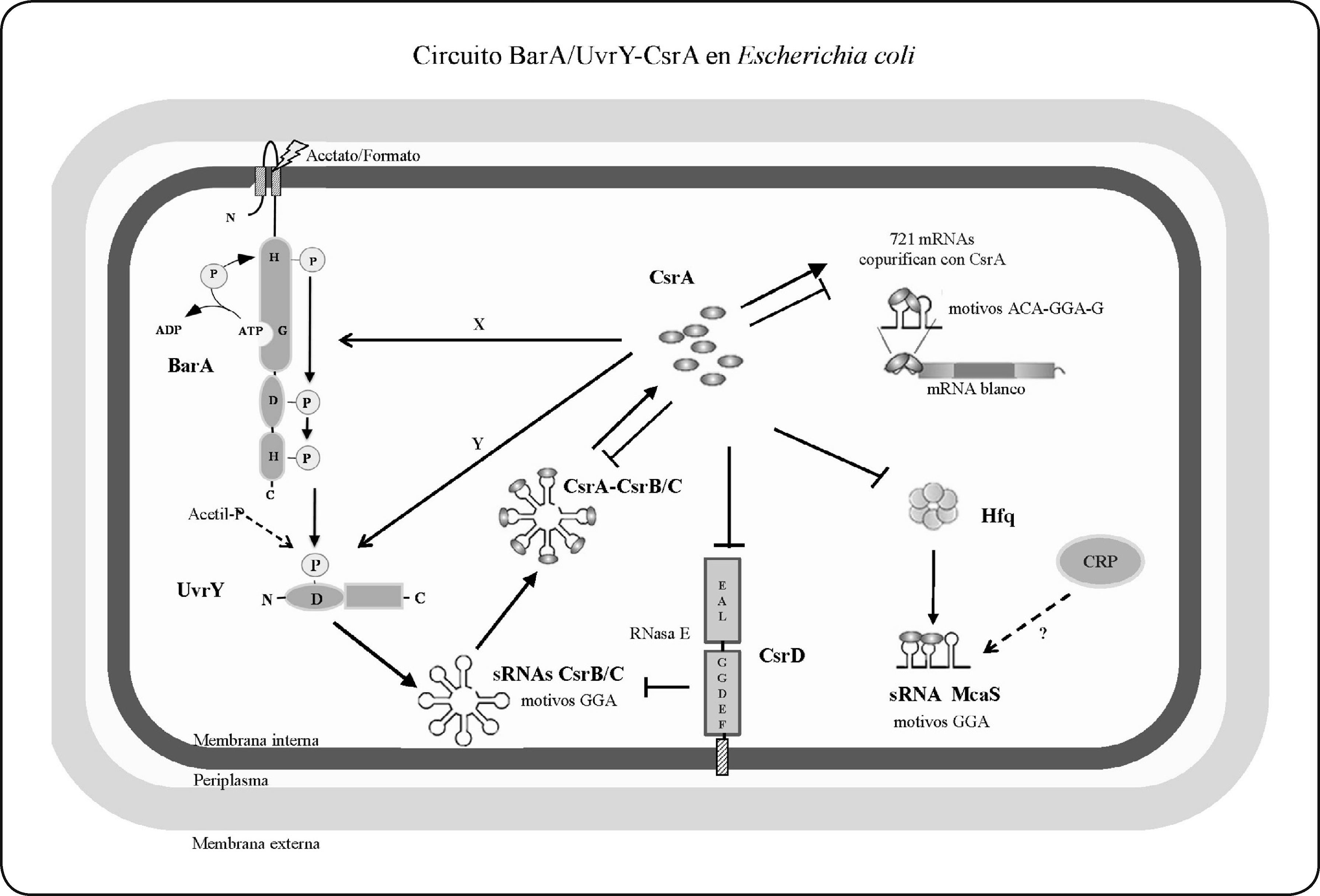
Dependiendo de la especie, este sistema activa directamente la expresión de uno a ocho RNAs pequeños no-codificantes (sRNAs) que están constituidos por motivos GGA conservados, los cuales al ser sitios de unión para la proteína de regulación global CsrA (carbon storage regulator A) (y sus ortólogos RsmA/E/F; repressor of secondary metabolites), funcionan como antagonistas de su actividad. Esta proteína, que además está conservada fuera de las γ-proteobacterias, es un homodímero que actúa principalmente como represor traduccional de transcritos que contienen motivos ACA-GGA-G, ubicados en estructuras tipo “asa y tallo” en su región líder[7,8]. Las características generales de este circuito regulatorio, tomando como referencia los estudios realizados en E. coli se describen en la Fig. 1.
Modelo del circuito regulatorio BarA/UvrY-CsrA en E. coli. BarA es una histidina cinasa híbrida, que contiene en su extremo N-terminal un dominio sensor seguido por un dominio transmisor, con un residuo de histidina (H) conservado, un dominio receptor con un residuo de aspartato (D) y un dominio de fosfotransferencia con otro residuo H. UvrY contiene un dominio receptor con un residuo D conservado, seguido de un dominio efector con un motivo de unión al ADN. En presencia de acetato y/o formato, BarA se autofosforila de manera dependiente de ATP en el residuo H, y posteriormente transfosforila a UvrY (UvrY-P) en el residuo D vía un fosforelevo que involucra el dominio receptor y de fosfotranferencia de BarA. UvrY-P activa directamente la transcripción de los RNAs pequeños no-codificantes (sRNAs) CsrB y CsrC, los cuales poseen 18 y 9 sitios de unión a la proteína CsrA, regulando negativamente su actividad. Hasta el momento en E. coli se han identificado más de 700 posibles mensajeros blanco de CsrA. La estabilidad de los sRNAs depende de la proteína integral de membrana CsrD, cuya traducción es reprimida por CsrA, que los convierte en blancos de degradación a través de un mecanismo que involucra a la RNasa E. Además, CsrA activa indirectamente la expresión de UvrY y afecta positivamente la actividad cinasa de BarA a través de los factores X y Y, respectivamente, los cuales aún no han sido identificados. Finalmente, la proteína Crp activa la expresión del sRNA McaS, el cual secuestra a CsrA en la fase estacionaria tardía. Modificado de la ref. 8.
Varias revisiones han descrito a detalle el mecanismo general del circuito BarA/UvrY-CsrA en E. coli y en otras bacterias, con particular énfasis en el papel de CsrA y sus ortólogos[6–8]. Esta revisión tiene como objetivo, describir las características generales del circuito en diferentes especies bacterianas, con la finalidad de comparar las estrategias que cada especie emplea, para mantener el balance entre la expresión de los sRNAs csrB, csrC (en bacterias entéricas), rsmB (en Pectobacterium) y rsmX, rsmY y rsmZ (en Pseudomonas y Legionella pneumophila) y la proteína libre CsrA (RsmA/E/F).
EL SDC BARA/UVRY EN E. COLI Y SUS GENES BLANCOEl gen barA (también llamado AirS) se identificó como un supresor multicopia de una mutante envZ osmóticamente comprometida. Por lo tanto, se pensó que BarA, junto con EnvZ regulaba la fosforilación del regulador de respuesta OmpR, sin embargo la transferencia del grupo fosforilo entre BarA y OmpR no se pudo demostrar in vitro[9]. Posteriormente, BarA se involucró en procesos asociados a la virulencia, ya que en E. coli uropatogénica se reportó que su transcripción se inducía después del contacto con la superficie celular eucariótica y que jugaba un papel clave en la colonización del tracto epitelial urinario durante la infección[10]. Por otro lado, en E. coli K-12 se encontró que BarA inducía la expresión del factor sigma RpoS[11], de tal manera que una mutante barA mostraba una sensibilidad aumentada al peróxido de hidrógeno[12]. Finalmente, a través de análisis genéticos y estudios de fosfotransferencia in vitro, se descubrió que BarA forma un SDC con la proteína UvrY[13].
La conexión entre el sistema BarA/UvrY con CsrA se demostró cuando descubrieron que UvrY-P (UvrY fosforilado), activa la transcripción de csrB[14] y de csrC[15], los cuales contienen 18 y 9 sitios de unión a CsrA, respectivamente[16]. Recientemente se identificó el motivo de unión de UvrY-P a los promotores de csrB y de csrC, el cual consiste en la secuencia conservada TGTGAGAGATCTCTTACAyTGTGAGACATTGCCGATA, respectivamente[17]. SirA-P y GacS-P (los homólogos de UvrY en Salmonella enterica y en Pseudomonas, respectivamente) reconocen una secuencia similar de 18 pb denominada “UAS” (upstream activating sequence) conservada en los promotores de sus respectivos sRNAs blanco[18–20].
Cabe mencionar que E. coli también expresa al sRNA McaS (multi-cellular adhesive sRNA), el cual posee dos sitios de unión a CsrA[21], sin embargo su expresión no depende del SDC BarA/UvrY, sino de la proteína Crp (catabolite repression protein) y de la chaperona de ARN Hfq. Aunque la expresión de CsrB, CsrC y McaS aumenta cuando las células entran en la fase estacionaria de crecimiento, la expresión de McaS se mantiene hasta la fase estacionaria tardía (∼24h). Por lo tanto, se ha propuesto que este último puede regular la actividad de CsrA en esta fase de crecimiento[22].
MECANISMOS QUE MODULAN LA ACTIVACIÓN DEL SISTEMA BARA/UVRY Y SUS HOMÓLOGOSLa función de los SDC de este circuito, es activar directamente la expresión de los sRNAs que titulan a la proteína CsrA/RsmA, antagonizando sus efectos regulatorios. La activación y modulación adecuada de estos SDC, es importante para mantener el balance entre la producción de los sRNAs Csr (en bacterias entéricas)/Rsm (en Pseudomonas y Legionella pneumophila) y la proteína libre CsrA/RsmA/E/F. A continuación se presentan los principales mecanismos que permiten su expresión, a través de los SDC en diferentes especies bacterianas.
Estímulo específicoLa activación de los SDC está condicionada en primer lugar, por la presencia y la detección de la señal específica a través de la HC. Si bien el estímulo específico no se ha determinado en la mayoría de las especies, se ha demostrado que BarA de E. coli se autofosforila en presencia de acetato y formato[23]. En condiciones de crecimiento en laboratorio, la expresión de csrB y csrC, comienza en la transición de la fase exponencial a la fase estacionaria, que correlaciona con la acumulación de acetato en el medio[23]; cabe mencionar que el acetato es uno de los ácidos carboxílicos más abundantes en el tracto gastrointestinal de hospederos mamíferos, por lo tanto, se ha sugerido su relevancia fisiológica sobre la activación del sistema homólogo BarA/SirA en Salmonella[24]. Por otra parte, en Pseudomonas, se ha sugerido que la activación del sistema a través de GacS (global activation of antibiotic and cyanide synthesis) (homólogo de BarA) puede estar influenciada por intermediarios del ciclo de Krebs[25].
Proteínas accesoriasAdemás de la señal específica, en Pseudomonas el estado de fosforilación del sistema GacS/GacA también depende de las cinasas híbridas RetS (regulator of exopolysaccharide and type III secretion) y LadS (lost adherence), las cuales inhiben y activan al sistema, respectivamente. Existe evidencia que tanto RetS, como LadS interactúan físicamente con GacA[26,28]. Aunque la señal que dispara estas interacciones y los detalles del mecanismo aún no se conocen, se sabe que RetS forma heterodímeros con GacS, previniendo su autofosforilación y por lo tanto la fosforilación de GacA[26]; LadS, se une a GacS y estimula su actividad a través de un mecanismo desconocido[27,28]. En Pseudomonas aeruginosa, se ha demostrado que este mecanismo es más complejo e implica la participación de dos proteínas adicionales. Por un lado la cinasa híbrida anotada como PA1611, la cual se une directamente a RetS para contrarrestar la represión de los sRNAs rsmY y rsmZ[29] y por otro, la fosfotransferasa HptB que interactúa con RetS-P para reprimir específicamente la expresión del sRNA rsmY[30,31].
Es importante mencionar que en E. coli no existen homólogos de RetS y LadS, sin embargo, recientemente se demostró en este organismo, que la actividad cinasa y fosfatasa de BarA está regulada indirectamente por CsrA[32]. Este hallazgo es interesante, ya que indica que en adición del estímulo de BarA, se necesita además de una o más proteína(s) regulada(s) por CsrA, para la correcta actividad de BarA[32].
Efecto del (p)ppGppLa alarmona tetrafosfato de guanosina (ppGpp), en cooperación con el supresor DnaK (DksA), una proteína que se une al canal secundario de la ARN polimerasa y amplifica el impacto de la alarmona[33], son los jugadores clave del sistema de respuesta astringente, que es cuando las bacterias se encuentran en condiciones limitantes de nutrientes y rápidamente detienen la síntesis de ADN, RNAs estables, proteínas ribosomales y componentes de membrana, para producir factores que son cruciales para la resistencia a estrés, glucólisis y síntesis de aminoácidos[34,35].
En Pectobacterium spp., y L. pneumophila, se ha observado que altas concentraciones de ppGpp promueven la expresión de los sRNAs rsmB y rsmX/rsmY/rsmZ respectivamente, presuntamente a través de la activación de los sistemas GacS/GacA y LetS/LetA[36]. Sin embargo, hasta el momento no hay evidencia bioquímica, que indique que funcione como la señal de estos sistemas. Aunque en E. coli, también se ha reportado un efecto del ppGpp sobre la expresión de csrB y csrC[37,38], su papel no está claro, pues mutaciones en los genes relA y spoT, los cuales codifican enzimas necesarias para la síntesis de ppGpp, no afectan la expresión de csrB en medio LB[39]. Además aunque CsrA reprime la traducción de relA y por lo tanto, en esta mutante los niveles de ppGpp incrementan significativamente[30], su inducción no es suficiente para contrarrestar la falta de expresión de csrB en la mutante csrA[14].
MECANISMOS QUE REGULAN LA ESTABILIDAD LOS SRNAS CSR/RSMEfecto de la proteína CsrDLa vida media de los sRNAs Csr depende de la proteína integral de membrana CsrD (también llamada YhdA)[40] en E. coli, la cual parece estar conservada en otras enterobacterias, y de su homólogo MshH (33% de identidad) en Vibrio cholerae[41]. A pesar de que CsrD tiene dominios GGDEF y EAL, característicos de las diguanilato ciclasas y de las fosfodiesterasas, no sintetiza o degrada al segundo mensajero c-di-GMP. Aunque la señal o el mecanismo por el cual CsrD modula la vida media de CsrB y CsrC se desconocen, se ha observado que in vitro se une con alta afinidad pero baja especificidad a estos sRNAs para, presumiblemente, cambiar su conformación y convertirlos en blancos de degradación a través de la RNasa E[40]. Por otro lado, aunque CsrA reprime directamente la traducción de csrD, el significado biológico de esta autorregulación no está claro, ya que en una mutante csrA la vida media de CsrB y/o CsrC no está afectada[40,42].
Por otra parte, en V. cholerae MshH además de regular la vida media de los sRNAs CsrB/CsrC/CsrD, también reprime la formación de biopelículas por interferir directamente con la actividad de la enzima glucosa-específica IIA (EIIAGlc), un regulador central del metabolismo[41]. Hasta hace poco en E. coli sólo se conocían a CsrB y CsrC como blancos directos de CsrD. Sin embargo, recientemente se demostró que el dominio EAL de CsrD puede unirse in vitro a la forma desfosforilada de la enzima EIIAGlc y aunque se desconoce si esta interacción regula otros fenotipos, se observó que cuando la glucosa está presente en el medio, también influye en la vida media de CsrB y CsrC[43].
Efecto de RsmA y HfqNo todas las γ-proteobacterias cuentan con homólogos de CsrD, sin embargo en P. aeruginosa se ha observado que RsmA y Hfq se unen concomitantemente a RsmY, para protegerlo del corte por la RNasa E[44]. Curiosamente en E. coli, CsrA reprime directamente la traducción de Hfq, pero en Pseudomonas éste no parece ser el caso, en su lugar se ha observado que el ARN regulatorio CrcZ, el cual se expresa a través de la proteína Crc (homólogo de Crp), se une y secuestra a Hfq[45].
EXPRESIÓN DIFERENCIAL ENTRE LOS SRNAS REDUNDANTESUna característica de este circuito es que la expresión de los sRNAs está influenciada uno con otro y además están regulados diferencialmente. Por ejemplo, en E. coli y S. enterica la pérdida de csrB da lugar a un incremento en la expresión de csrC y viceversa, la anulación de csrC regula positivamente la expresión de csrB[15,46]. También se ha observado en E. coli que el nivel de expresión de csrB es más alto que el de csrC y que cuando se anula a uvrY hay una reducción de más de 10 veces la expresión de csrB, comparada con una reducción de 2.5 en csrC[39]. Esta disparidad entre la expresión de los sRNAs del circuito parece ser consistente en otras especies. Por ejemplo en Pseudomonas la expresión de rsmZ (homólogo de csrB) se induce durante la fase estacionaria de crecimiento, pero no la de su sRNA redundante rsmY[20], mientras que en Yersinia pseudotuberculosis, en contraste con otras especies, la expresión de csrC no se transcribe a través de UvrY-P; por el contrario, se ha encontrado que la expresión de csrB mediada por UvrY-P resulta en una regulación negativa de los niveles de csrC[47]. Curiosamente, gran parte de la expresión diferencial entre estos sRNAs se debe a la acción de otras proteínas y parámetros ambientales, discutidos a continuación.
Efecto de proteínas asociadas al nucleoideEn varias especies bacterianas, tanto la alarmona ppGpp, como las proteínas IHF, H-NS y Crp se han involucrado en la regulación de la expresión diferencial de los sRNAs Csr/Rsm. Aunque cada una de éstas tienen funciones específicas, todas comparten una misma característica: las funciones que desempeñan implican procesos que repercuten en la estructura del nucleoide. De hecho, IHF y H-NS han sido definidos como dos de las principales proteínas asociadas a nucleoide (NAPs, nucleoid-associated proteins), las cuales son los factores más abundantes que se asocian al cromosoma, pues cuentan con cientos de sitios de unión al ADN[48]. IHF (integration host factor) es una proteína heterodimérica compuesta por dos subunidades homólogas, IhfA e IhfB, que se une al ADN facilitando que su estructura se doble y favoreciendo la transcripción de varios genes[49]. Por otro lado, H-NS (histone-like nucleoid structuring protein) funciona como un silenciador transcripcional global, que se une preferentemente a sitios con secuencias ricas en residuos AT[50,51], regulando aproximadamente el 5% de los genes de E. coli. Mientras que Crp, el jugador clave en la represión por catabolito, considerado tradicionalmente como un factor transcripcional convencional[52], se une también a cientos de sitios de unión al ADN, a través de la secuencia consenso TGTGA-N6-TCACA[53,54]. Algunos estudios que han vinculado a estas NAPs con la expresión diferencial de los componentes de este circuito, se discuten a continuación.
Mientras que en P. aeruginosa RsmA y Hfq regulan exclusivamente la vida media del sRNA RsmY[44], en Pseudomonas fluorescens, el regulador transcripcional PsrA e IHF inducen exclusivamente la expresión de rsmZ durante la fase estacionaria de crecimiento[55]. Aunque el efecto de PsrA aún no está claro, aparentemente reconoce una secuencia localizada en la región conservada UAS; por otro lado, se ha observado que IHF se une con alta afinidad a dos sitios de unión, localizados entre -100 y -40 pb relativos al inicio de la transcripción de rsmZ[55]. Consistentemente, en L. pneumophila[56] y S. enterica[18] la expresión de los sRNAs rsmY/rsmZ y csrC, respectivamente, también está afectada positivamente por IHF. Mientras que en L. pneumophila el mecanismo aún está por definirse, en S. enterica se ha observado que IHF interactúa directamente con un sitio de unión localizado entre el sitio de unión de SirA y el promotor de csrB[18]. A este respecto, recientemente se identificó un posible sitio de unión de IHF en el promotor de csrB de E. coli, que co-localiza con el sitio de unión de UvrY-P, en donde se ha sugerido que IHF promueve la unión de UvrY-P al promotor de csrB[17].
Aunque las implicaciones fisiológicas del efecto de IHF, sobre la expresión exclusiva de los sRNAs de este circuito, así como la señal ambiental que controla su actividad, son desconocidas, es importante mencionar, que en P. fluorescens se ha observado que las proteínas MvaT y MvaU (ortólogos de H-NS) se unen al promotor de rsmZ y reprimen su expresión[57], es decir, antagonizan con el efecto de IHF. Aunque tampoco se conocen las condiciones que controlan la actividad de MvaT/MvaU, se ha observado en E. coli, V. cholerae y S. enterica que IHF contrarresta con el silenciamiento de la expresión genética dependiente de H-NS[58,59,60], probablemente al sobrelapar con los sitios de unión de H-NS[61].
Efecto de parámetros ambientalesSe ha sugerido que un incremento en la densidad celular es también una señal de inducción para la síntesis de los sRNAs Csr/Rsm[5], sin embargo, en algunas bacterias se ha reportado que diferentes parámetros ambientales activan su expresión, incluso desde la fase exponencial de crecimiento. Por ejemplo, en Y. pseudotuberculosis (en donde la expresión de CsrC no depende de UvrY-P) se ha observado que la transcripción de CsrC se induce al máximo durante la fase estacionaria de crecimiento a 25°C y durante la fase exponencial a 37°C[47]. Además, cuando las células crecen en medio rico hay altos niveles de CsrC, mientras que en medio mínimo su transcripción está fuertemente reprimida, lo que ha sugerido una conexión entre este circuito con la proteína Crp[6]. De manera interesante, en S. enterica se ha observado que la proteína Crp incrementa la expresión de ambos sRNAs a través de activar indirectamente la transcripción de sirA[24].
Por otro lado, en E. coli se ha reportado que las ARN helicasas DeaD y SrmB, asociadas con actividades para la maduración del ARN ribosomal a bajas temperaturas[62], activan la expresión de CsrB y CsrC en la fase exponencial de crecimiento, probablemente a través de liberar una estructura de ARN inhibitoria que se forma entre la región líder de uvrY y la secuencia codificante proximal[63]. Aunque los detalles del mecanismo de estas proteínas sobre la activación de UvrY no están definidos, se ha observado que no afectan su estado de fosforilación, por lo tanto no se conoce cómo es que puede activar la expresión de los sRNAs en la fase exponencial.
VARIABILIDAD EN EL CIRCUITO REGULATORIO BARA/UVRY-CSRA INTER E INTRA ESPECIESAunque el mecanismo general de circuito está conservado, existen importantes diferencias en cuanto a la relevancia y la función que desempeñan algunos de sus componentes. Aparte de las diferencias en la activación y modulación de la fosforilación de los SDC, discutidas previamente, ahora discutiremos acerca de mecanismos autorregulatorios que involucran a la proteína CsrA y sus ortólogos y la redundancia entre los sRNAs de este circuito. Lo que posiblemente refleja la adaptación de este sistema a los requerimientos individuales de la bacteria durante la patogénesis.
La proteína CsrA/RsmAEfectos autoregulatorios de CsrAEn P. aeruginosa RsmA modula la estabilidad de RsmY[44] y aunque en E. coli, CsrA no afecta la vida media de CsrB y/o CsrC[40,42], juega un papel crítico en su expresión a través del sistema BarA/UvrY. Recientemente se reportó que CsrA modula indirectamente tanto la transcripción como la traducción de UvrY, pero además regula indirectamente la actividad cinasa y fosfatasa de BarA[32]. Por lo tanto, aunque en una mutante csrA la expresión de uvrY está significativamente disminuida, la proteína restante no se activa como factor transcripcional, ya que no puede ser fosforilada a través de BarA[32].
CsrA/RsmA parálogos y esencialidadEn adición al control del metabolismo y otros procesos fisiológicos, CsrA/RsmA es crítico para la regulación de sistemas de virulencia requeridos para la infección del hospedero, sin embargo ¿las bacterias pueden vivir sin esta proteína? Se ha descrito en E. coli y S. enterica que CsrA es una proteína esencial, por lo tanto, sólo se pueden hacer mutantes condicionales de esta proteína. En contraste, en otras bacterias no es esencial y aunque en Y. pseudotuberculosis la mutante csrA se encuentra considerablemente afectada en el crecimiento[47], en P. aeruginosa la anulación de rsmA tiene un efecto mínimo[64,65]. Aunque P. aeruginosa expresa al parálogo RsmF (RsmN) el cual muestra el 31% de identidad con RsmA, parecen tener funciones regulatorias específicas[66], por lo tanto es posible que en esta bacteria otros mecanismos compensen la función de RsmA en su ausencia.
Por otro lado, CsrA también parece ser esencial para L. pneumophila - enfatizando su importancia en la fisiología celular de este patógeno[67], pero curiosamente varias especies de este género codifican de 4 a 7 parálogos de CsrA (que tienen desde el 58% al 28% de identidad). Si bien es cierto, que no todos los posibles parálogos de Legionella han sido caracterizados de manera experimental, resulta interesante notar que CsrR (CsrA-similar protein for resilience) que muestra el 28% de identidad[68], conserva muchos de los residuos necesarios para la unión a moléculas de ARN, pero no comparte redundancia funcional con CsrA[68]. Lo mismo ocurre con los parálogos en Pseudomonas, en donde aunque los sitios de unión al ARN se encuentran bien conservados, el resto de la región codificante varía considerablemente[66,69].
CsrA en Bacillus subtilisComo se mencionó en un inicio, el circuito regulatorio BarA/UvrY-CsrA y sus homólogos están ampliamente conservados en las γ-proteobacterias. Sin embargo, fuera de este rango taxonómico el único componente que prevalece es la proteína CsrA, la cual se ha caracterizado en B. subtilis[70]. Aunque su mecanismo de acción se conserva, su papel en la fisiología celular es mucho más limitado que en las Gram-negativas. CsrA en B. subtilis está codificada en el operón de genes flagelares y su función es unirse a dos sitios que se encuentran en la región líder del transcrito de hag, el cual codifica la proteína flagelina, para reprimir su traducción[70]. Vestigios de esta modulación se conservan en E. coli -aunque al igual que lo ocurrido con los parálogos de CsrA en otras bacterias, su función es estabilizar el transcrito del regulador flagelar flhDC[71,72].
Aunque en B. subtilis se han predicho in silico homólogos de CsrB[73], aún no se cuenta con una validación experimental de su papel como antagonista de CsrA. En su lugar, han descubierto que la proteína FliW, la cual se une a Hag para controlar la síntesis de flagelina en B. subtilis, actúa como su antagonista[71]. Tanto csrA como fliW se encuentran codificados adyacentemente en muchos Firmicutes, Spirochaetales, Thermotogales y en las Δ- y ¿-proteobacterias y aunque están ausentes en las α y β-proteobacterias, csrA, reaparece en las γ-proteobacterias. Estas observaciones plantean la posibilidad que en la evolución temprana de las proteobacterias, las γ-proteobacterias pudieron adquirir a csrA a través de una transferencia horizontal, seguido por la adquisición de los sRNAs, en sustitución de FliW[71].
Diferencias y redundancia entre los sRNAsA pesar de que el número de los sRNAs Csr/Rsm puede variar de una especie a otra, ejercen la misma función de antagonizar con la proteína CsrA/RsmA/E/F. De hecho, en una variedad de bacterias, la redundancia en la función de éstos, hace que sólo la anulación de ambos genes en E. coli y S. enterica o los tres en P. fluorescens y V. cholerae, tengan un fenotipo distinguible de la cepa silvestre[20,46]. Además se ha demostrado en varias especies que estos sRNAs pueden complementar con los sRNAs homólogos en otras especies[46].
Sin embargo, la complementación interespecies no es un rasgo común en una gran parte de los sRNAs de este circuito. Por ejemplo, los sRNAs Csr de Y. pseudotuberculosis y V. cholera no comparten homología y son sólo 50% idénticos a sus equivalentes en E. coli y S. enterica; por otra parte, RsmY y RsmZ de L. pneumophila y P. aeruginosa se encuentran en un grupo más lejano del resto de los sRNAs Csr[6]. Los sRNAs de Pseudomonas difieren significativamente de los de E. coli y S. enterica, tanto en longitud, número de sitios de unión a CsrA/RsmA y estabilidad[6,40]. CsrB de E. coli por ejemplo, tiene una longitud de 369 nt, posee 18 sitios de unión a CsrA y tiene una vida media de 1.7 minutos[40]. En contraparte los sRNAs Rsm de Pseudomonas son aproximadamente la mitad del tamaño de los de E. coli (y por lo tanto poseen la mitad o un tercio de sitios de unión a RsmA), pero son mucho más estables (20 a 60min)[74,75]. Su gran estabilidad posiblemente está relacionada con la ausencia de un homólogo de CsrD en Psedomonas. Con la finalidad de explorar estas relaciones es necesario realizar una comparación entre la estabilidad de los sRNAs Csr/Rsm y la presencia o ausencia de los homólogos de csrD en varias especies bacterianas.
Aparte de las diferencias entre especies, la presencia de varios sRNAs Csr/Rsm en una misma especie (a excepción de Pectobacterium carotovorum que sólo cuenta con RsmB)[76], lleva a la pregunta del ¿por qué se producen múltiples sRNAs cuando tienen la misma función? Aunque la respuesta a esta pregunta aún no está clara, una diferencia funcional importante reside en su capacidad de unirse a diferentes moléculas de CsrA/RsmA/E/F. CsrB de E coli exhibe de 22 a 18 sitios de unión a CsrA y por lo tanto es capaz de secuestrar a ∼9 dímeros de CsrA, mientras que CsrC posee sólo 9 sitios de unión potenciales[15]. Además la posesión de múltiples sRNAs redundantes permite la regulación diferencial de su síntesis y/o estabilidad en respuesta a diferentes estímulos ambientales, lo cual es algo característico en este circuito regulatorio.
CONCLUSIONESEl circuito BarA/UvrY-CsrA y sus homólogos constituyen un mecanismo de control post-transcripcional muy importante que se ha estudiado ampliamente en una variedad de bacterias. En los patógenos, el circuito juega funciones que permiten la expresión de factores de virulencia específicos, con consiguientes cambios fisiológicos asociados a la infección. Por otro lado, en E. coli este circuito permite coordinar la expresión de genes que participan en algunas vías metabólicas importantes y probablemente ésta es una de las razones por la cual, en esta bacteria la proteína CsrA es esencial.
Por otro lado, aunque estos circuitos se han estudiado ampliamente, aún hay muchas interrogantes acerca de los mecanismos que gobiernan el balance entre la producción de los sRNAs y la proteína CsrA/RsmA/E/F. Como se discutió previamente, las diferentes formas de modulación de la actividad en estos SDC, aunado al papel que juegan algunos reguladores globales sobre la expresión diferencial de los sRNAs, permite al sistema responder a diferentes señales ambientales. Como consecuencia, cada bacteria ha adaptado la funcionabilidad y esencialidad del circuito, en función a sus requerimientos especiales. Una pregunta interesante por determinar sería, ¿cómo influye el hábitat y estilo de vida de cada bacteria, en la complejidad del circuito?
Finalmente, debido a la gran cantidad de información que se tiene día con día acerca de estos circuitos, es pertinente interpretar cuidadosamente cada uno de estos estudios, ya que no siempre es posible extrapolar el papel de cada componente, así como de otros factores, sobre la expresión y la dinámica del circuito en otras especies bacterianas.
AGRADECIMIENTOSDurante los estudios de doctorado Martha Iraís Camacho Hernández contó con el apoyo económico del Consejo Nacional de Ciencia y Tecnología (CONACYT) (Número de becario 226066) para la elaboración del presente trabajo. Este trabajo fue financiado por los donativos 178033 del CONACYT e IN206412 de la Dirección General de Asuntos del Personal Académico, UNAM (PAPIIT-UNAM). Martha Iraís Camacho Hernández agradece la asistencia técnica de la M. en C. Claudia Rodríguez Rangel.