Fusarium verticillioides es el principal hongo patógeno que afecta la productividad del maíz en el mundo. Este hongo penetra a la planta por distintas rutas e infecta raíces, tallo y mazorca. El patógeno produce varias toxinas en el tejido y en los granos del maíz, lo que disminuye su calidad. Las fumonisinas son las toxinas mayoritarias excretadas por el hongo. Un grupo de genes forma el locus FUM en el cromosoma 1 de F. verticillioides y codifica las enzimas responsables de la síntesis de las fumonisinas. Sin embargo, la cantidad de fumonisina producida es altamente variable entre cepas del hongo. La regulación de la síntesis es muy compleja y depende de factores ambientales y nutricionales, así como de múltiples vías de señalización que ejercen tanto regulación positiva como negativa. Las fumonisinas son consideradas factores de virulencia, ya que su producción se asocia con una mayor capacidad de infección de F. verticillioides en plántulas de maíz. Sin embargo, este papel no es claro en la infección y pudrición de la mazorca. En maíz, las fumonisinas tienen tres blancos moleculares que son la esfinganina N-acil transferasa, la ATPasa de protones de membrana plasmática y las β-1,3-glucanasas básicas. Las tres enzimas tienen funciones fisiológicas relevantes y participan en la respuesta de defensa de la planta.
Fusarium verticillioides is the main fungal pathogen that affects the productivity of maize worldwide. The fungus penetrates the plant by different routes and infects roots, stem and cob. The pathogen produces several toxins in tissue and corn kernels, which affect their quality. Fumonisins are the major toxins produced by this fungus. The ability to produce them depends on the presence of several genes encoding the enzymes responsible for biosynthesis. The regulation of the synthesis is very complex and depends on environmental and nutritional factors, as well as multiple signaling pathways. This is reflected by the high variability in fumonisin production among F. verticillioides strains. Fumonisins are virulence factors because their production is associated with a greater capacity to infect maize seedlings. However, this role is not clear for ear infection and rotting. In maize, fumonisins have three molecular targets: sphinganine N-acyl-transferase, plasma membrane proton ATPase and the basic β-1,3-glucanases. These three enzymes have important physiological functions and also participate in the plant defense response against fungal pathogens.
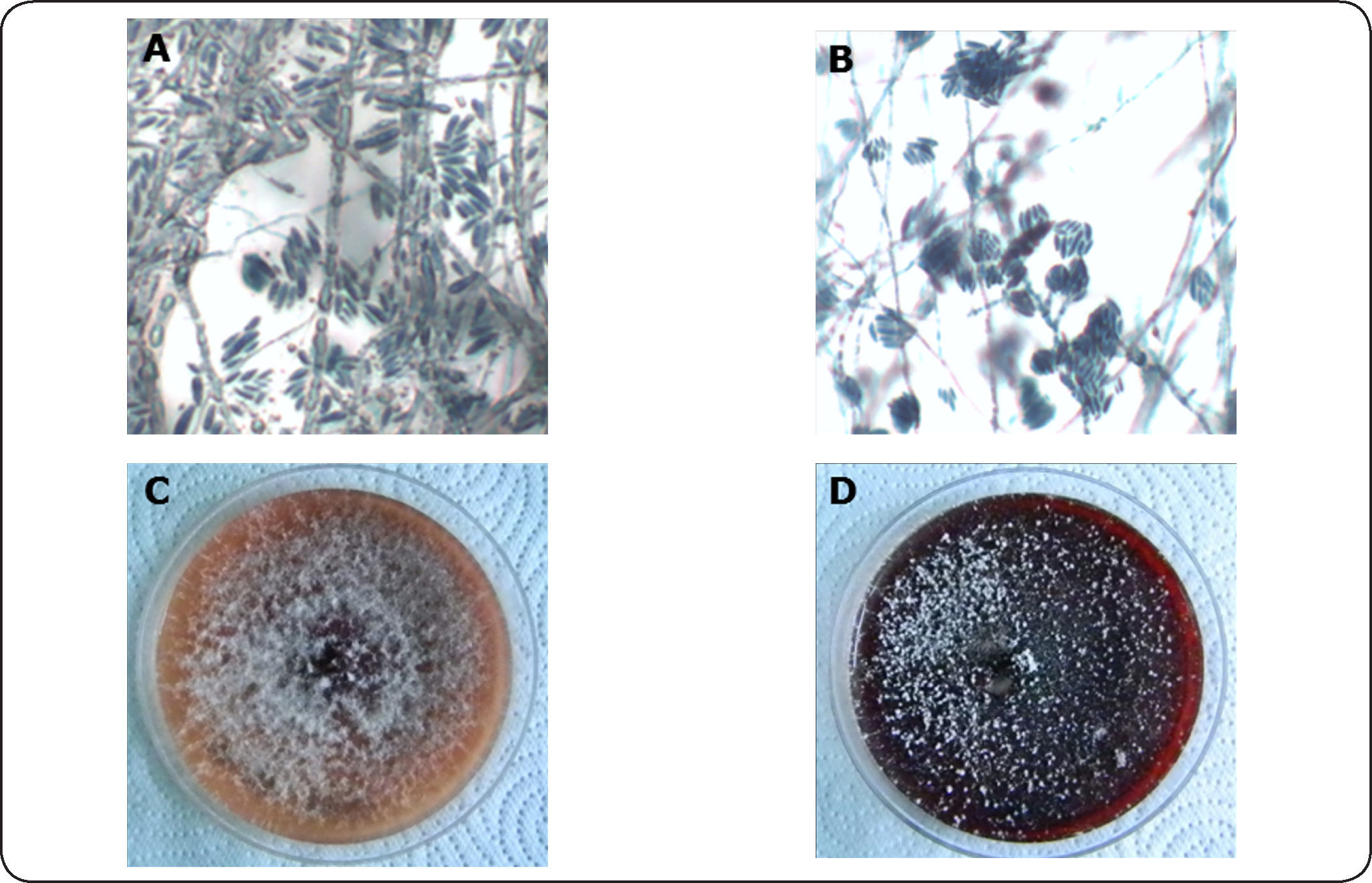
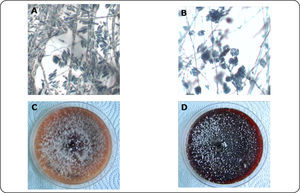
Fusarium verticillioides es un ascomiceto perteneciente a la subdivisión Deuteromycota, que agrupa a aquellos hongos en los que no hay descrita una fase sexual o, bien, ésta es muy rara1. F. verticillioides cae en esta última categoría, porque sí presenta una fase sexual llamada teleomorfo, o forma perfecta, muy difícil de encontrar en la naturaleza y se requieren condiciones especiales para observarla in vitro. La forma teleomórfica recibe otro nombre de género y especie: para F. verticillioides es Gibberella moniliformis, que es heterotálico, ya que el apareamiento ocurre entre colonias de distintos grupos. En el estado anamorfo, o de reproducción asexual, hay abundante producción de microconidias; éstas son células ovaladas con la base aplanada y agrupadas en cadenas (Fig. 1A y 1B). Algunas cepas también generan macroconidias con apariencia larga y delgada, y con cinco o seis septos. Muestran dos células: una apical, que es curva, y otra basal, en forma de pie. Este tipo de conidias se producen con estructuras que aparentan racimos denominados esporodoquios. La especie no produce clamidoconidias, pero con frecuencia las células contenidas en una hifa engrosada son confundidas como tales. Las características y la morfología de la colonia de esta especie varían de acuerdo con el medio de cultivo. Por ejemplo, en agar papa-dextrosa el micelio es blanco, al inicio, y forma pigmentos que van desde gris hasta violeta (Fig. 1C y 1D). En cambio, en algunos cultivos ya envejecidos, la hifa del hongo produce melanina para conformar estructuras llamadas esclerocios2.
La taxonomía de Fusarium es sumamente compleja. De ahí que haya sido tema de debate durante muchos años, porque el concepto de especies ha cambiado dentro de un género, dependiendo de los grupos de investigadores. Un trabajo nodal en la taxonomía de este género fue el tratado de Wollenweber & Reinking (1935)3, en el que los autores identificaron 65 especies agrupadas en 16 secciones. Cada sección incluía especies con características comunes, y algunas como F. verticillioides, F. thapsinum, F. proliferatum y F. subglutinans pertenecen a la sección Liseola. Además, la única diferencia entre F. verticillioides y F. proliferatum es que en esta última las cadenas de microconidias son más cortas que en la primera4.
La especie F. verticillioides se distribuye por todo el mundo, y con alta frecuencia es aislada del maíz, prácticamente de cualquier órgano de la planta. Es el principal patógeno del cultivo y limitante de la productividad porque ocasiona pérdidas cuantiosas que varían año con año. Se le conoce como un patógeno necrótrofo por la capacidad que tiene de causar la muerte del tejido hospedero y, luego, sobrevive como saprofito en el rastrojo. Sin embargo, durante los periodos tempranos de la infección el hongo adquiere una fase biotrofa, al grado de que puede sobrevivir como endófito en la semilla y en el tallo de las plantas sin causar daños visibles. Cuando las condiciones ambientales son favorables, infecta los tejidos de la planta y es capaz de provocar pudrición en órganos como la raíz, el tallo y la mazorca. Tal circunstancia resulta de la compleja interacción entre varios factores como son la virulencia de la cepa, el genotipo y la etapa del desarrollo del maíz, así como las condiciones ambientales5–7. El clima caliente y húmedo favorece la pudrición de la mazorca durante el periodo de llenado de grano8–10.
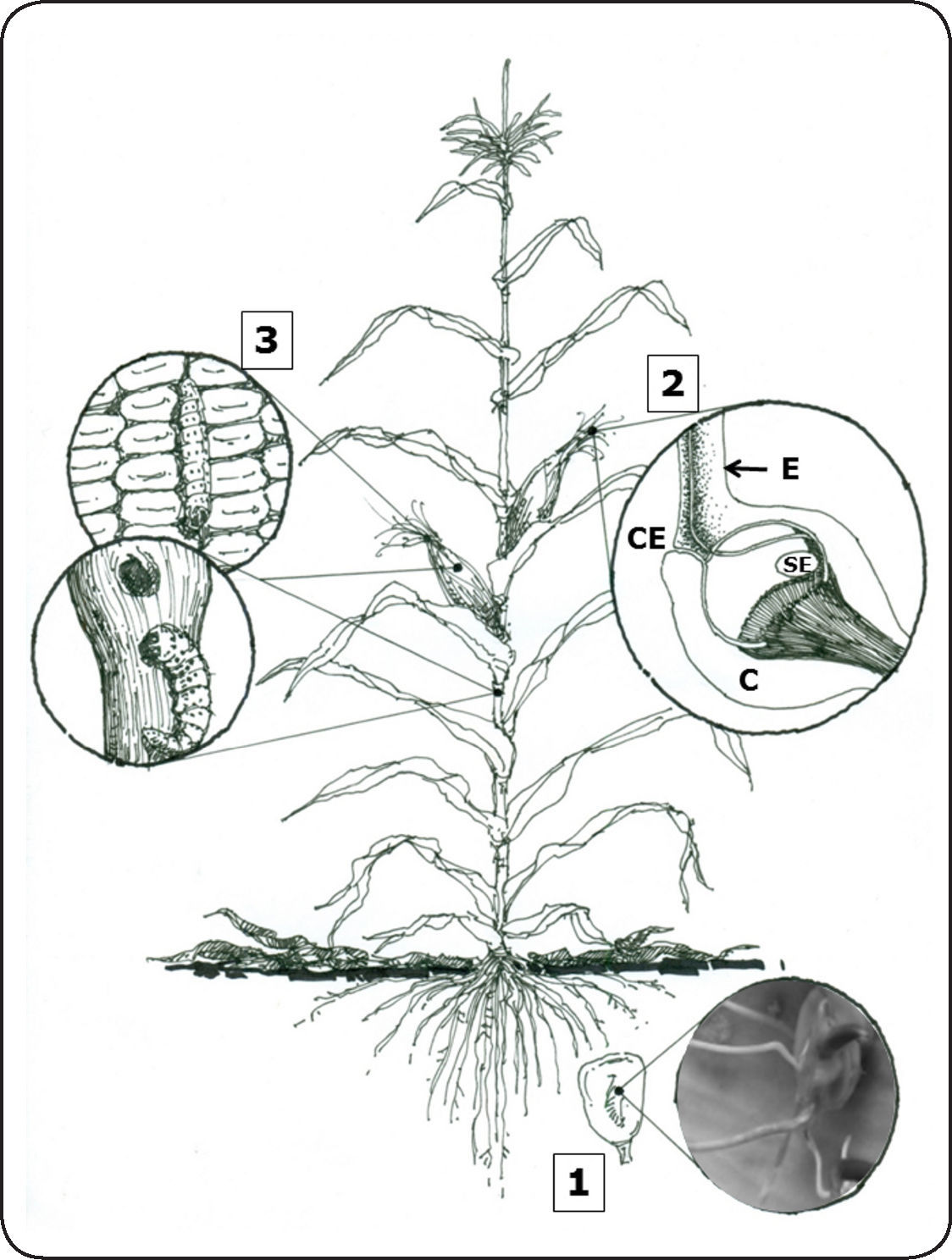
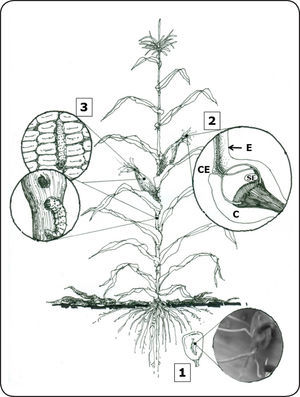
Rutas de entrada y colonización del patógenoUno de los aspectos que favorece la infección y la alta incidencia de F. verticillioides en el maíz es que el hongo utiliza múltiples rutas de entrada a la planta para colonizar distintos tejidos y, de esa manera, causa diversas enfermedades a lo largo de su desarrollo (Figura 2). A continuación se describen las principales rutas de infección:
- 1.
Infección sistémica de las plántulas. Ocurre durante y desde la germinación de la semilla, y a lo largo del establecimiento de la plántula. Como el hongo sobrevive –ya sea en la semilla o en el suelo–, se encuentra estratégicamente posicionado para infectar a la planta. F. verticillioides penetra de forma directa el pericarpio y a las células de la epidermis de la raíz tres días después de que se siembran las semillas inoculadas. Las hifas colonizan las células del parénquima del escutelo y llegan hasta el córtex. Sin embargo, la colonización de la endodermis y de las regiones vasculares ocurre en raras ocasiones11. Entre 25 y 30 días, las raíces y el mesocotilo ya se hallan colonizados y pueden mostrar síntomas de pudrición, dependiendo de la cantidad de inóculo y de factores ambientales. En el tallo no hay muchas hifas, de ahí que la infección puede cursar de manera asintomática hasta ciertos tejidos12. Aunque el hongo es capaz de translocarse por el tallo y llegar a la nueva mazorca en desarrollo; el único sitio que parece limitar su paso es el tejido de transición entre la corona de la plántula y el tallo5,13.
- 2.
Infección de la mazorca por medio del estigma. La vía más común para que F. verticillioides infecte a la mazorca es a través del estigma. Lo anterior sucede cuando el inóculo aéreo y las conidias transportadas por el agua de lluvia se depositan en el estigma. De esa forma se facilita el acceso a las células del pericarpio y la hifa del hongo crece en la superficie de la cutícula para poder acceder al grano, a través de la parte inferior del canal estilar, incluso en ausencia de lesiones mecánicas7.
- 3.
Infección del tallo y la mazorca por daño mecánico. Al alimentarse, varios insectos –plagas del maíz– horadan las mazorcas y los tallos de la planta. Este daño mecánico funciona como ruta de entrada para las conidias de F. verticillioides. Además, hay insectos que actúan como vectores del hongo, ya sea dispersándolo a lo largo de la superficie de la planta hacia los granos –como Ostrinia spp., el gusano barrenador– o, bien, transportándolo a través de grandes distancias –como el gusano de la raíz (Diabrotica sp.)–. Otros vectores descritos son el gusano elotero –en sus fases de larva y de adulto–, los trips y los gorgojos. La función de vector se apoya en el hecho de que el hongo sobrevive en los órganos externos de los insectos mencionados14,15. Otras evidencias que favorecen el papel de los insectos en la incidencia y severidad de la infección por F. verticillioides son: 1) el control de trips con insecticida, que reduce la población de insectos y la enfermedad16; 2) el maíz genéticamente modificado, que produce la proteína CryIa(b)–la cual confiere resistencia al gusano barrenador europeo–, tiene menor incidencia y severidad de pudrición de la mazorca provocado por F. verticillioides13.
Rutas de entrada de Fusarium verticillioides a la planta de maíz. 1. Infección sistémica de plántulas. El hongo sobrevive en la semilla o en el suelo de donde accede a la plántula e infecta las raíces. 2. Infección a través del estigma. Las conidias del hongo son depositadas en el estigma (E) y penetran a través de la parte inferior del canal estilar (CE). C: carpelo, SE: saco embrionario. 3. Infección a través de heridas. El hongo accede al tallo y/o a la mazorca a través de lesiones mecánicas causadas por insectos al alimentarse (Ver detalles en el texto).
Evidentemente las rutas de infección mencionadas no son excluyentes y en el campo las plantas son atacadas a través de una o más de estas vías y por distintas cepas del patógeno.
Micotoxinas: un arsenal químicoA diferencia de otros hongos que son estrictamente biotrofos, F. verticillioides no genera estructuras especializadas que faciliten la entrada al tejido y a las células. Sin embargo, es capaz de producir cantidades importantes de enzimas líticas y toxinas que contribuyen al proceso infeccioso. Entre las micotoxinas que sintetiza la especie se hallan el ácido fusárico, la fusarina C, las naftoquinonas, la moniliformina y las fumonisinas. Estas últimas son las más abundantes17–20. La presencia de esos compuestos en productos agrícolas causa gran preocupación, debido a los efectos que ocasionan cuando animales y humanos los consumen. Lo anterior ha fomentado la investigación en torno a los efectos, el modo de acción y el metabolismo de esta micotoxina, así como al desarrollo de métodos analíticos para su detección y cuantificación en maíz y productos derivados de éste21,22. Otro aspecto relevante de la biología de las fumonisinas es su posible papel en la virulencia de F. verticillioides, mismo que se revisará más adelante.
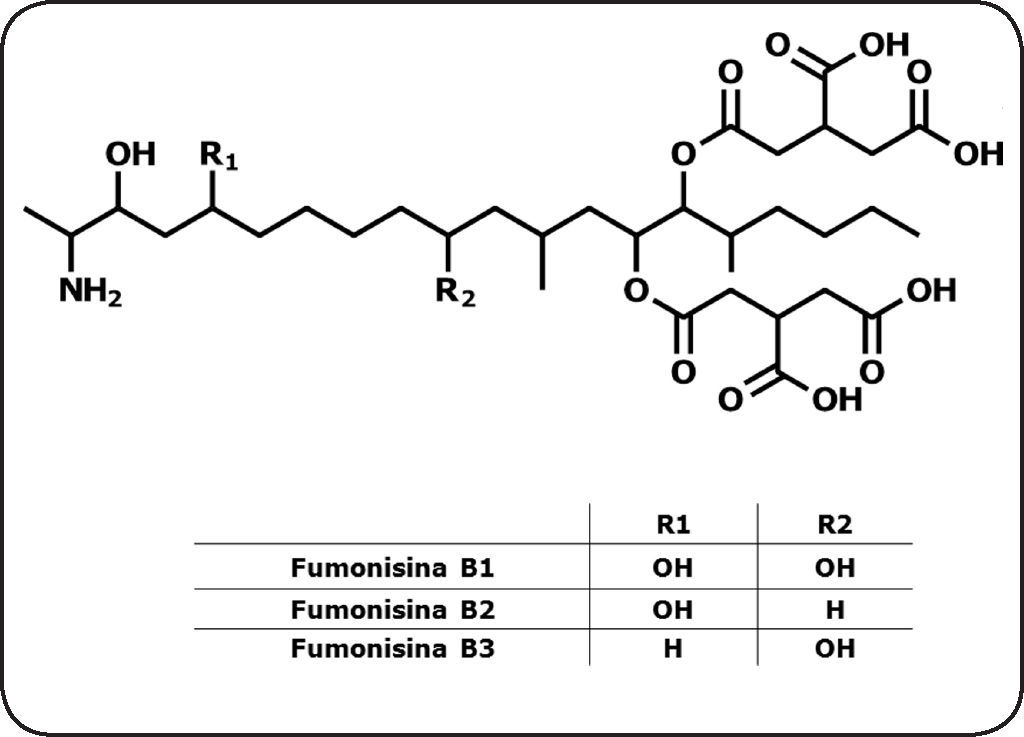
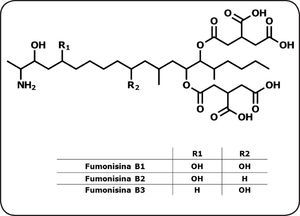
Las fumonisinas, una familia diversa de toxinasEn 1988, un grupo de investigadores sudafricanos aislaron y purificaron las fumonisinas de cultivos de F. verticillioides cuando buscaban el agente causal de la leucoencefalomalacia equina, que se asociaba con el consumo de maíz mohoso23. Ese mismo año se dilucidó la estructura química de las toxinas24 y, desde entonces, se han descrito más de 60 moléculas relacionadas estructuralmente con la fumonisina25,26. Sin embargo, sólo ciertas cepas del hongo producen muchas de esas moléculas y en condiciones particulares de cultivo. Las fumonisinas más abundantes de incidencia natural son las del grupo B, derivadas de la mayoría de las cepas de F. verticillioides. Las fumonisinas B contienen un esqueleto lineal de 20 carbones, con un amino en el C-2 y residuos de ácido tricarboxílico esterificados en C-14 y C-15 (Figura 3). Estos compuestos difieren por la presencia o la ausencia de un grupo hidroxilo en los C-5 y C-10. Dentro de esta familia predominan las fumonisinas B1, B2 y B3, pero la B1 (FB1) conforma más del 75% del total de las fumonisinas; asimismo, es la más estudiada27,28. Los niveles de producción de la toxina FB1 son muy variables entre las cepas de F. verticillioides, ya que algunas de ellas no la sintetizan, o bien, lo hacen a niveles muy bajos; en cambio, otras generan grandes cantidades de la toxina. La Tabla I ilustra esa diversidad, pues recopila varios estudios con cepas aisladas en distintas regiones geográficas, las que presentan variaciones de hasta tres órdenes de magnitud en los niveles de FB1.
Comparación de los niveles de producción de fumonisinas entre diferentes cepas de F. verticillioides aisladas de diversas fuentes
| No. de cepas | Origen de las cepas | Medio de producción de fumonisinas | Rango de producción de fumonisinas |
| 40 | Colección de cultivos del RINDMRC, Sudáfrica34 | Embriones de maíz | 20 - 7100mg/g |
| 34 | Semillas de maíz, México35 | Maíz quebrado | 10 - 5810mg/g |
| 51 | Mazorcas de maíz, Irán36 | Maíz quebrado | 197 - 9661mg/g |
| 67 | Mazorcas de maíz, México37 | Arroz estéril | 0.1 - 4047mg/g |
| 79 | Morogo, Sudáfrica38 | No reportan | 114 - 38860ng/g |
| 12 | Semillas de cereales39 | Semillas de sorgo esterilizadas | 1.92 - 6.05mg/g |
| 16 | Espárragos, China40 | Maíz quebrado | 25 - 3850mg/g |
| 84 | Mazorcas de maíz, Alemania41 | Maíz quebrado | Hasta 21mg/g |
| 43 | Mazorcas de maíz, India42 | Embriones de maíz estériles | 133 - 1617mg/g |
| 16 | Mazorcas y rastrojo de maíz, Brasil43 | Maíz quebrado | 2.41 - 3996mg/g |
| 35 | Mazorcas de maíz, España44 | Medio de composición definida | 0.8 - 199ppm |
| 100 | Mazorcas de maíz, Brasil45 | Arroz estéril | 0.2 - 762mg/g |
| 26 | Embriones de maíz, Italia46 | Harina de maíz | 0.11 - 82mg/kg |
| 25 | Mazorcas de maíz, Uganda47 | Semillas de maíz esterilizadas | 19 - 100mg/kg |
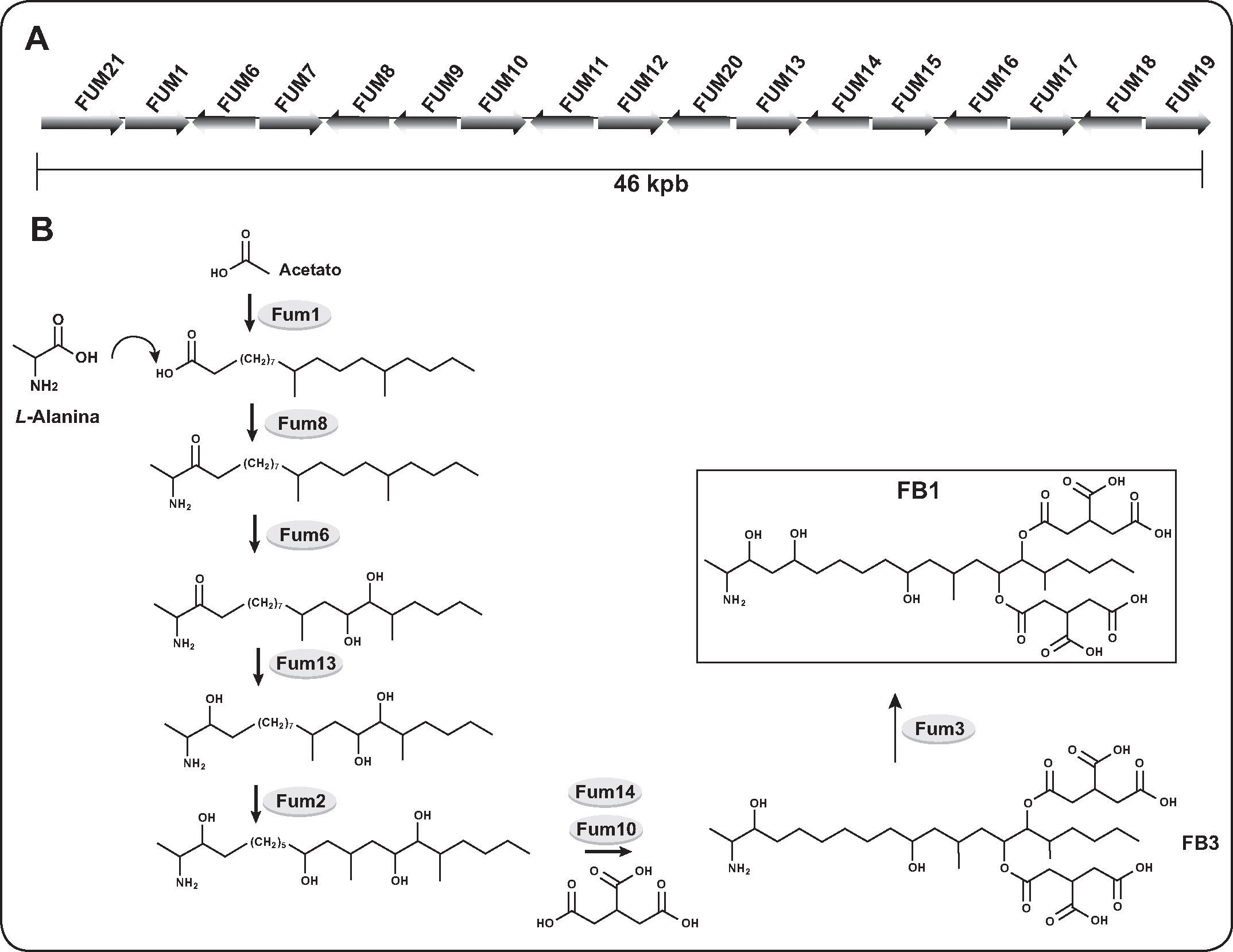
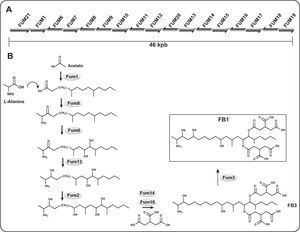
La capacidad de sintetizar fumonisinas depende de la presencia de una serie de genes, agrupados en una región de 46kpb en el cromosoma 1 de F. verticillioides y que forman el locus FUM29–31. Los genes codifican las enzimas involucradas en la síntesis de las micotoxinas y de otras proteínas que median la secreción y la resistencia a las mismas.
El análisis de la secuencia de los productos de los genes del locus FUM permitió predecir las funciones de estos últimos. También facilitó el diseño de experimentos para comprobar dichas funciones mediante el análisis funcional y la generación de cepas con mutación en alguno de los genes. El trabajo fructificó en la dilucidación de la ruta biosintética de las fumonisinas32. Estas últimas se sintetizan a partir de unidades de acetato para formar un policétido lineal dimetilado, que se condensa con el aminoácido L-alanina, seguido de hasta cinco reacciones de oxigenación y dos esterificaciones. El primer paso es catalizado por una policétido sintasa (PKS), codificada por el gen FUM1 (Figura 4). Se trata de una enzima modular que tiene varios dominios catalíticos: β-cetoacil sintasa, aciltransferasa y proteína acarreadora de acilos, responsables de la extensión de la cadena del policétido33. Hacia abajo del gen FUM1 se ubican otros genes que codifican enzimas participantes en la síntesis de fumonisinas. El producto del gen FUM8 es una aminotranferasa que acarrea el grupo amino de la alanina al policétido de 18 carbonos, por medio de la condensación descarboxilativa. Después ocurren oxidaciones en las posiciones C-14 y C-15, posiblemente por la acción del producto del gen FUM648. El intermediario 3-ceto se reduce a un grupo hidroxilo por una reductasa codificada por el gen FUM140,49.
Los productos de los genes FUM7, FUM10, FUM11 y FUM14 participan en la esterificación de los ácidos tricarboxílicos. Es probable que estos últimos provengan de derivados del ácido cítrico –como el ácido aconítico–, pero aún no se demuestra de manera concluyente33,50. El gen FUM11 determina un transportador de tricarboxilatos, mismo que podría estar involucrado en la transferencia de sustratos a través de los diferentes compartimentos celulares51. Además de los genes estructurales, en el locus FUM se hallan los genes FUM19 y FUM21. El primero codifica un transportador del tipo ABC, que podría actuar en la excreción de la toxina para evitar su acumulación en la célula del hongo52. El producto de FUM21 es un factor de transcripción del tipo Zn(II)-2Cys6, regulador de la expresión de los genes estructurales del locus. La función de este gen se describe más adelante53.
En la naturaleza sobreviven cepas de F. verticillioides incapaces de sintetizar fumonisinas porque tienen una mutación en el gen FUM1 o, bien, carecen del locus FUM29,54. También ocurren mutaciones en otros genes del locus, como aquellos que codifican las oxigenasas responsables de la hidroxilación en C-10 y C-5 del esqueleto; lo anterior provoca que no produzcan FB1 y, entonces, acumulan FB2 y FB328.
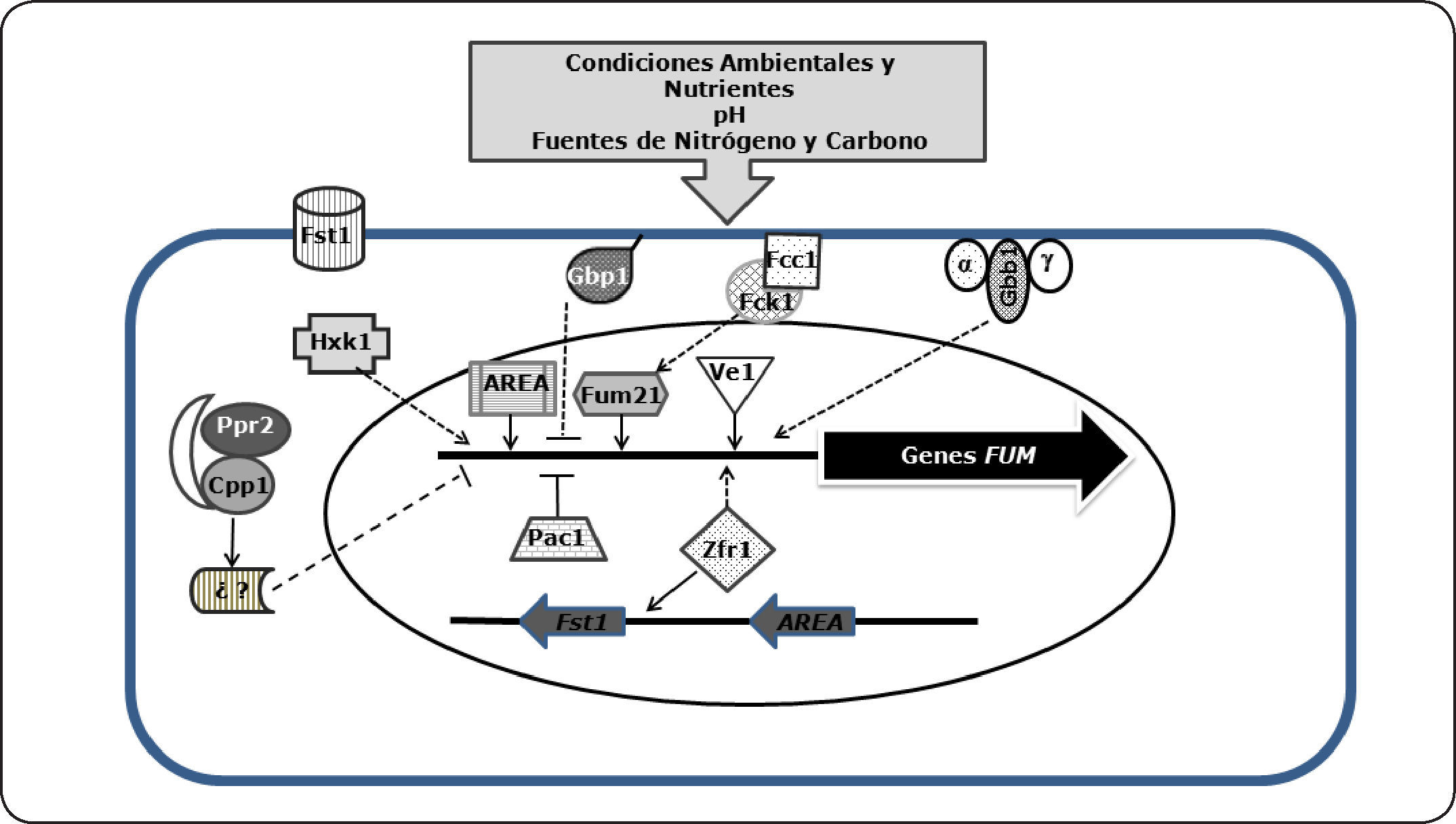
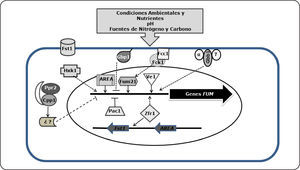
Regulación de la biosíntesis de fumonisinasComo lo ilustra la Tabla I, la producción de fumonisinas por distintas cepas de F. verticillioides es muy variable y los rangos pueden abarcar hasta tres órdenes de magnitud, aún cuando las cepas crezcan bajo las mismas condiciones en un sustrato natural –como maíz– o en un medio de cultivo de composición definida. Factores ambientales –porejemplo, pH, disponibilidad de aguay nutrientes–también regulan la síntesis de fumonisinas. Asimismo, hay genes fuera del locus FUM que participan, a distintos niveles, en las vías de señalización que conducen a la expresión de los genes del locus FUM y a la generación de fumonisinas55,56 (Figura 5).
Regulación de la síntesis de fumonisinas. La figura resume los reguladores positivos y negativos de la expresión de los genes FUM y la síntesis de fumonisinas e indica su posible localización en la célula. Las flechas continuas indican un efecto positivo mientras que las líneas truncadas un efecto negativo. Las líneas y flechas discontinuas indican una vía que no se ha caracterizado completamente. (Ver detalles en el texto).
El pH influye en la síntesis de fumonisinas; hay una marcada producción de la toxina en pH ácido (4.5), en contraste con el pH alcalino, mayor a 8. La proteína Pac1 de F. verticillioides tiene una alta identidad global con otros homólogos de hongos que poseen funciones de activación transcripcional en respuesta al pH ambiental. El gen PAC1 actúa como represor de la síntesis de fumonisina, pues la mutante en éste produce más toxina que la cepa silvestre, tanto en granos de maíz como en un medio sintético amortiguado a pH ácido (4.5). El gen FUM1 es un blanco potencial de este regulador porque en la cepa mutante hay niveles mayores del transcrito57.
La fuente de nitrógeno constituye un factor nutricional que influye en la síntesis de fumonisinas, ya que el amonio reprime la producción de la toxina. La relación C:N también afecta la síntesis: si ésta es baja ocurre la supresión. Cuando F. verticillioides crece en granos de maíz en estadios tempranos de desarrollo, con bajo contenido de almidón, se da una pobre generación de fumonisina58. El gen AREA de F. verticillioides codifica la proteína que contiene una región altamente conservada entre los reguladores del metabolismo de nitrógeno y que incluye un dominio de unión a la caja GATA en los promotores. Las cepas de F. verticillioides con mutación en el gen AREA producen menores cantidades de la toxina, por lo que este gen es un regulador positivo de la síntesis de fumonisina59.
También el tipo de carbohidratos presentes en los granos de maíz influye en la producción de fumonisina. Por ejemplo, la cantidad de esta toxina es muy baja en un medio de cultivo cuya única fuente de carbono es la amilosa. Sin embargo, aumenta de manera significativa cuando el hongo crece en amilopectina o dextrina; esta última es producto de la hidrólisis de la amilopectina. Del mismo modo, la transcripción de los genes FUM8 y FUM12 aumenta durante el desarrollo del grano, conforme se acumula amilopectina y alcanza un máximo en el estado dentado58. HXK1 es otro gen que participa en la percepción de azúcares y contribuye en la regulación de la síntesis de fumonisinas. Codifica una hexocinasa, enzima del metabolismo primario que participa en el crecimiento, el desarrollo y la patogénesis. La mutación de HXK1 afecta el crecimiento del hongo en presencia de varias fuentes de carbono como fructosa, glucosa, sacarosa o maltotriosa y también ocurre la reducción del 80% en la síntesis de la fumonisina B160.
El análisis de mutantes en el gen FST1, que codifica un transportador de carbohidratos, también apoya el papel de los azúcares en la síntesis de FB1. Las cepas con mutación en FST1 no se ven afectadas en el crecimiento ni en la colonización del grano, pero sí en la producción de FB161. Es posible que la percepción o toma de carbohidratos sea un factor que contribuya en la biosíntesis de la micotoxina. La expresión del gen FST1 se halla controlada por el factor transcripcional Zfr1, que es un regulador positivo de la síntesis de fumonisinas y entre sus blancos podrían estar incluidos los genes del locus FUM. Las cepas mutantes del gen ZFR1 muestran crecimiento y desarrollo normal en granos de maíz, pero menor nivel de fumonisina: apenas un 10% con respecto a la cepa silvestre62. Asimismo, el factor transcripcional Sda1 –requerido para el catabolismo del sorbitol– participa negativamente en la regulación de la síntesis de fumonisina. La cepa mutante en este gen produce mayor cantidad de FB1 que la cepa silvestre y es incapaz de crecer en sorbitol como única fuente de carbono63. Otro factor transcripcional que regula positivamente la síntesis de fumonisinas es el producto del gen FUM21. Las cepas de F. verticillioides con mutación en FUM21 producen muy poca fumonisina y alcanzan niveles bajos del transcrito de los genes FUM1 y FUM8, los que son esenciales para la síntesis de la micotoxina53. Fum21 podría unirse al promotor del gen FUM1 que tiene sobrerrepresentada la secuencia CGGATA, donde la triada CGG es reconocida por los factores transcripcionales del tipo Zn(II)-2Cys6. Asimismo, la mutación de esta secuencia cis en el promotor de FUM1 causa menor transcripción del gen cuando el hongo crece in planta o in vitro64.
Cascadas de señalización que regulan la síntesis de fumonisinasLa percepción del medio ambiente y los nutrientes que resultan en la expresión de genes del locus FUM y en la síntesis de fumonisinas requiere de una señalización celular. Hay varios genes cuyos productos participan en estas rutas de señalización y regulan la producción de la micotoxina. Entre ellos se encuentra FCC1, el que codifica una proteína tipo ciclina C pues contiene tres dominios conservados de ciclinas: una caja de ciclina, una región rica en PEST y una caja de destrucción. FCC1 se expresa de manera constitutiva durante el crecimiento y es un regulador positivo de la síntesis de fumonisina, pues cepas mutantes en este gen presentan reducción en la expresión del gen FUM1 y en los niveles de FB1. Parece que FCC1 participa en la señalización de la percepción ambiental, ya que cuando la mutante crece en medio mínimo a pH 3 la conidiación y producción de FB1 son restablecidas65. El modo de acción de las ciclinas es a través de su interacción física con una cinasa dependiente de ciclina (CDK). El gen FCK1 codifica la proteína que contiene un motivo de unión a ciclina y un dominio de cinasa Ser/Thr homólogo a otras CDKs. La protetína Fck1 forma un complejo con Fcc1 y la mutación del gen FCK1 también resulta en menor producción de FB1. Para definir la vía en la que participa el complejo Fcc1/Fck1 es necesario descubrir el blanco de esta cinasa. Es posible que FCK1 actúe directamente sobre algún regulador transcripcional del cluster FUM –como FUM21–, o bien, sobre un regulador global de la expresión génica, y los efectos en la expresión de genes FUM sean secundarios66.
Otras vías de señalización importantes en hongos filamentosos –asociados con virulencia y metabolismo secundario– son aquellas en las que participan las proteínas G. El gen GBP1 de F. verticillioides codifica una proteína de 368 aminoácidos, con alta similitud a las proteínas G monoméricas de hongos filamentosos. El gen se expresa fuertemente durante la biosíntesis de FB1 y su mutación causa un incremento discreto (58%) en la producción de FB1, con respecto a la cepa silvestre. Se asocia con la elevada expresión de los genes FUM1 y FUM8 y los datos indican que GBP1 es un regulador negativo de la biosíntesis de FB155.
La transducción de señales, mediada por las proteínas G heterotriméricas, también participa en la regulación de la síntesis de fumonisinas. Las cepas mutantes de F. verticillioides en el gen GBB1, que codifica la subunidad β de una proteína G heterotrimérica, producen 14 veces menos FB1 que las cepas silvestres, y en las primeras ocurre la reducción sustancial de la expresión de los genes FUM1 y FUM8. Lo anterior revela que la vía de señalización en la que participa la proteína G regula positivamente la síntesis de FB1. Esta ruta de señalización podría ser específica de la síntesis de la micotoxina, ya que parámetros de desarrollo –como el crecimiento radial y la masa de micelio– no cambian con respecto a la cepa silvestre67.
Debido a que la fosforilación/desfosforilación de proteínas es clave en la mayoría de las cascadas de señalización, también se ha estudiado el papel de proteínas fosfatasas en la regulación de la biosíntesis de fumonisinas. El gen CPP1 codifica la subunidad catalítica de la fosfatasa 2A de F. verticillioides y los niveles de transcrito de este gen se incrementan en las cepas mutantes que producen menos FB1. La actividad represora se confirmó, ya que cepas mutantes en este gen presentan una elevación en la expresión de genes FUM y de producción de FB1, con respecto a la cepa silvestre68. Dado que las fosfatasas de proteínas tienen especificidad amplia –que depende, en parte, de la subunidad regulatoria–, también se ha investigado el papel de los genes que codifican esta subunidad. El genoma de F. verticillioides contiene dos genes: PPR1 y PPR2; ambos codifican subunidades regulatorias y el análisis de mutantes reveló funciones diferenciales entre ellas, pues solamente en la mutante PPR2 aumenta la síntesis de FB1, similar a lo que se observa con la mutante CPP1. Los resultados sugieren que las dos subunidades regulatorias tienen acciones distintas, que inciden sobre el desarrollo y la producción de FB169.
Regulación epigenética de la síntesis de fumonisinasComo en otros eucariontes, en el control de la expresión genética del metabolismo secundario de los hongos también contribuye el estatus de la cromatina, a través de la acetilación/ desacetilación de histonas. En presencia de tricostatina A –un inhibidor de la desacetilasa de histonas–, suben los niveles de transcrito de los genes FUM1 y FUM21 y, en menor grado, de FUM8, así como los de las fumonisinas. Los resultados son consistentes con el hecho de que el grado de acetilación de las histonas en los genes FUM1 y FUM21 es mayor en condiciones de inducción de síntesis de FB1. Lo anterior confirma que la remodelación de la cromatina juega un papel claro y diferencial en la regulación de los genes FUM70.
Esta regulación epigenética también se sustenta en la función de la proteína LaeA, la que tiene actividad de metiltransferasa y contribuye al control de la biosíntesis de esterigmatocistina en Aspergillus nidulans71. La enzima se encuentra en el núcleo y ahí su actividad es regulada por su interacción con las proteína “velvet”, las que, a su vez, controlan el desarrollo y el metabolismo secundario, altamente conservados en hongos. En F. verticillioides, el homólogo FvVE1 es esencial para la producción de las toxinas, ya que la mutación suprime por completo la síntesis de fumonisinas. Además, FvVE1 es necesario para la expresión del gen FUM21 y otros genes estructurales del locus FUM72.
Asociación entre la producción de FB1 y la virulencia en maízDebido a que las fumonisinas se consideran metabolitos secundarios, en un principio se asumió que la FB1 se producía durante la fase tardía de la interacción Fusarium-maíz, es decir, en la etapa saprofítica del hongo. Sin embargo, evidencias recientes muestran que la expresión de los genes FUM y la síntesis de fumonisina ocurren en los periodos tempranos de la infección in planta73–75 e, incluso, durante la fase endofítica en la plántula de maíz8.
El papel de la FB1 como elemento de virulencia en la infección por F. verticillioides se ha debatido durante muchos años. Un factor de virulencia es una molécula producida por un patógeno, el cual incrementa su capacidad para causar enfermedad al interferir con funciones específicas de la célula hospedera y, entonces, promueve la colonización del microorganismo en el tejido vegetal. Las pruebas para sustentar su papel en la virulencia son: 1) evidencias bioquímicas del efecto fitotóxico de la fumonisina en células y tejidos de maíz, y 2) evidencias genéticas que describen el fenotipo de cepas de F. verticillioides; estas últimas tienen una limitada o nula capacidad de producir fumonisina.
Evidencias bioquímicas del papel de la fumonisina en la virulenciaVarios trabajos documentan los efectos fitotóxicos de la FB1 en distintos tejidos de maíz y diversas etapas del desarrollo. En cultivos de callos de maíz, una dosis de FB1 13μM causa la reducción del 50% en su crecimiento76, y hasta 75% de inhibición en la elongación radicular de semillas de maíz durante la germinación77. En plántulas de maíz tratadas con las concentraciones de 0.1, 1, 10 y 100μM de FB1, la toxina provoca la disminución en la longitud de la raíz y el tallo, según la cantidad de toxina. Con las dosis más altas ocurre hasta 80% de inhibición del crecimiento de la raíz y 95% del tallo78. La FB1, aplicada en el agua de riego a una concentración 29μM, ocasiona la reducción del 23% en la altura del tallo y del 59% en el peso de la raíz, así como la aparición de lesiones necróticas en las hojas74. Aparentemente, esos efectos dependen del modo de aplicación de la micotoxina, ya que cuando la FB1 se asperja en plántulas de maíz, no se observan los mismos síntomas de fitotoxicidad79.
Evidencias genéticas del papel de la fumonisina en la virulenciaPara estudiar la contribución de las fumonisinas en la virulencia de F. verticillioides se han utilizado cepas que varían en la producción de la toxina e, inclusive, variantes incapaces de sintetizarla. También, se han incluido cepas con una mutación en el gen FUM1, incapaces de generar la micotoxina.
Se aprovecha el ciclo sexual del hongo y una cruza realizada entre dos cepas: una fum1+ con otra fum1-, genera una progenie con amplio rango de virulencia y de capacidad de sintetizar fumonisinas. En ensayos en plántulas de maíz, sólo las cepas productoras de fumonisina son virulentas y aquellas que no sintetizan la toxina son incapaces de infectar a las plantas6. Los estudios apoyan la hipótesis de que la generación de fumonisinas es necesaria para la virulencia en plántulas de maíz. Sin embargo, su papel en la virulencia no se ha extrapolado al evaluar la pudrición del tallo. Las cepas de F. verticillioides, con cantidades variables de fumonisina, también causan lesiones de diversas magnitudes en el mismo tejido. Sin embargo, no existe correlación entre la capacidad de producir fumonisinas in vitro y la severidad de la enfermedad80.
En otro estudio comparativo entre cepas de F. verticillioides que generan o no distintas fumonisinas, se evaluó la capacidad del hongo de causar infección y pudrición de mazorcas. Las cepas se inocularon por el canal estilar y todas las cepas que no producen FB1 fueron capaces de infectar y causar pudrición de manera similar a la cepa productora de las tres micotoxinas81. Del mismo modo, en un estudio distinto se comparó una cepa de F. verticillioides productora de FB1 con otra cepa isogénica mutante, cuya sola diferencia es que tiene interrumpido el gen FUM1 y, por eso, no produce fumonisinas. Ensayos en campo muestran que la cepa mutante posee un comportamiento similar a la cepa silvestre en su habilidad para infectar las mazorcas y causar su pudrición. La evidencia confirma que las fumonisinas son dispensables para causar infección y pudrición de la mazorca82.
En contraste con el estudio anterior, la transformación con el locus completo FUM de cepas que no lo contienen dentro de su genoma, aporta evidencia genética robusta sobre el papel fisiológico de la fumonisina en la virulencia de F. verticillioides. La especie Fusarium musae se halla estrechamente relacionada con F. verticillioides, pero es incapaz de infectar el maíz y no produce fumonisina. La complementación de esta especie con una secuencia genómica que contiene el locus FUM íntegro genera una cepa productora de FB1 capaz de colonizar plántulas de maíz, causando todos los síntomas de la infección: lesiones necróticas, atrofia y blanqueamiento del tejido54.
Las evidencias presentadas sugieren que las fumonisinas sí contribuyen a la virulencia en los procesos de infección y colonización de plántulas de maíz, pero son dispensables para la infección y pudrición del tallo y la mazorca. Es importante resaltar, sin embargo, que para todos los ensayos de pudrición en el tallo y la mazorca se utilizan métodos de inoculación muy agresivos, como la inyección de las conidias directamente en el tejido o a través del estigma. Lo anterior impide evaluar la capacidad del hongo patógeno para superar barreras físicas y otras respuestas inducidas de la planta hospedera. Nuevas evidencias que apoyan el papel de la FB1 en la virulencia de F. verticillioides son la alta incidencia de cepas toxigénicas en tejidos de maíz sintomáticos y los niveles elevados de FB1 presentes en tejidos de maíz83,84.
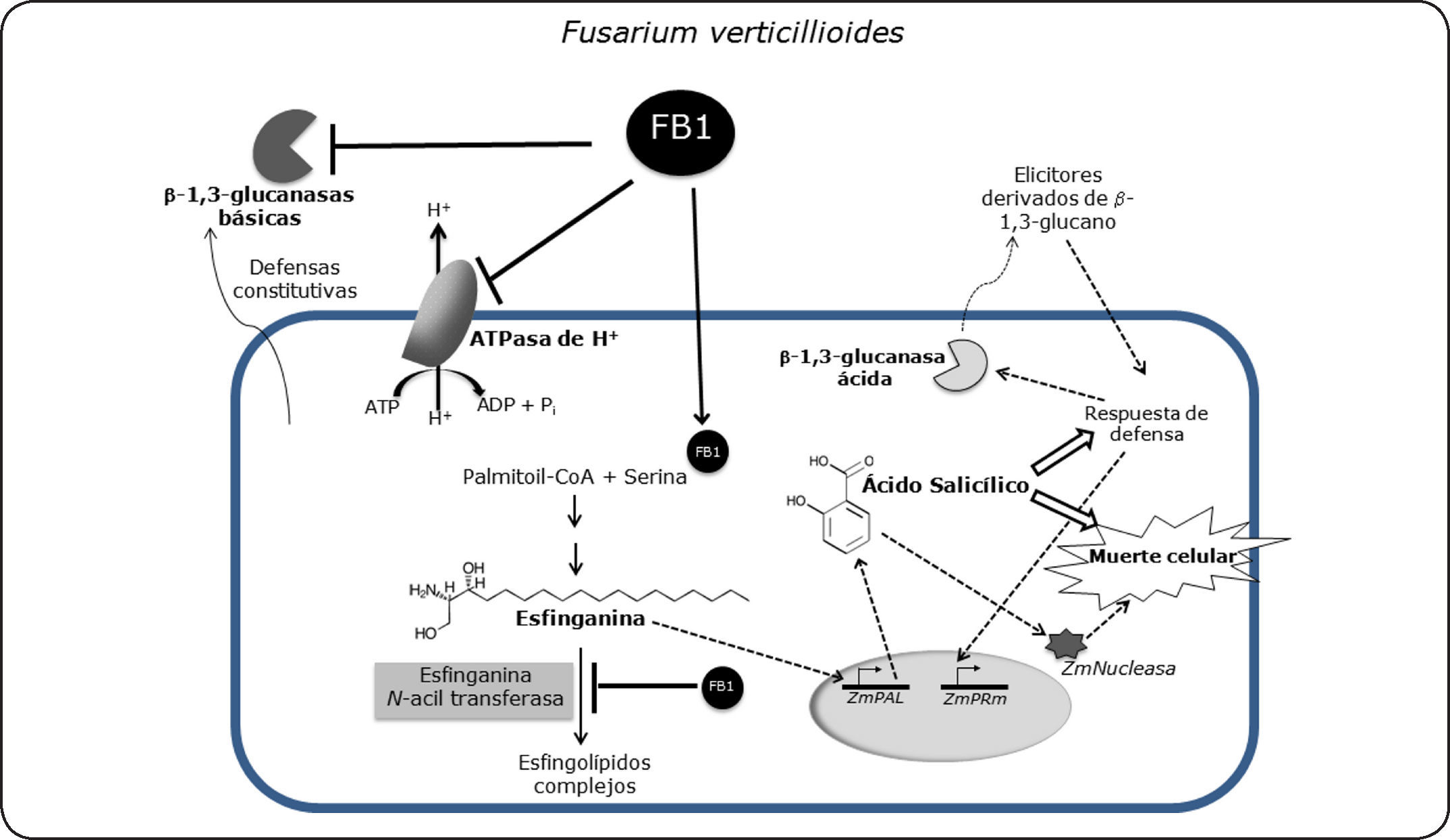
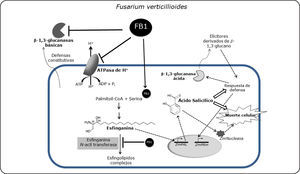
Blancos moleculares de la fumonisina B1El principal modo de acción de la toxina FB1 es la inhibición de la enzima esfinganina N-acil transferasa, la cual participa en la biosíntesis de novo de esfingolípidos. La enzima cataliza la reacción de condensación entre la base esfingoidea de cadena larga (BCL) esfinganina (ESN) y palmitoil Co-A, para generar ceramida; de ahí que su inhibición desencadena la acumulación de esfinganina y otras BCL85. El incremento y el desbalance de estos lípidos bioactivos explican muchos de los efectos de la FB1 en células animales86,87. En plantas, la FB1 también inhibe la esfinganina N-acil transferasa y causa acumulación de BCL88–90. Además, en maíz la FB1 tiene otros dos blancos moleculares: la ATPasa de protones de membrana plasmática91 y las β-1,3-glucanasas básicas75. A continuación se muestran con mayor detalle estos efectos y su posible papel en la virulencia de F. verticillioides en maíz.
1. La esfinganina N-acil transferasa como blanco celular de la FB1Los esfingolípidos son moléculas anfifílicas cuya estructura fundamental se conforma con una base de cadena larga (BCL), la cual es un aminoalcohol de cadena hidrocarbonada (2-amino-1,3- hidroxialcano). Hay gran diversidad en la estructura de BCLs, ya que pueden contener insaturaciones en las posiciones C4-C5 o C8-C9 y/o hidroxilación en la posición C4. Los esfingolípidos son componentes esenciales del sistema de endomembranas en plantas y otros eucariontes, pues constituyen más del 40% de los lípidos de la membrana plasmática92,93. Además de proporcionar integridad estructural, la evidencia reciente revela que los esfingolípidos muestran funciones multifacéticas. Por ejemplo, se hallan enriquecidos en las balsas lipídicas o microdominios membranales –regiones de membrana altamente ordenadas, importantes para la organización y función de las proteínas de señalización en la superficie de las células vegetales, para el tráfico transmembranal y tráfico intracelular–94,95. Asimismo, los esfingolípidos y sus intermediarios biosintéticos son mediadores de procesos celulares en plantas, por ejemplo, la muerte celular programada y la transducción de señales dependientes del ácido abscísico (ABA)96–100.
La biosíntesis de novo de los esfingolípidos complejos comienza con la formación de la BCL en el retículo endoplásmico a partir de la condensación de la serina con palmitoil-CoA, para formar la 3-cetoesfinganina. Esta molécula sufre una reducción y la esfinganina generada se acila con un ácido graso activado por CoA para producir ceramida. La esfinganina N-aciltransferasa, enzima blanco de la toxina FB1, cataliza la reacción. La inhibición causa la acumulación de BCL, principalmente esfinganina y fitoesfingosina (PSN), que son las más abundantes en células vegetales (Figura 6). La aplicación de FB1 10μM en embriones de maíz ocasiona el incremento de hasta seis veces en los niveles de ESN y PSN a las 48 horas, que es el mismo lapso en el que ocurren la degradación del ADN genómico, la muerte del tejido y la producción de ácido salicílico (AS). Esta última es una fitohormona que activa diferentes vías de señalización, mismas que pueden desembocar en muerte celular, como aquella que se observa en la reacción de hipersensibilidad, característica de las reacciones de defensa en las plantas. Tanto la FB1 como la ESN y el AS inducen la activación de una nucleasa en tejidos de maíz, que puede ser la responsable de la degradación del ADN genómico durante los eventos de muerte celular. Los resultados establecen que la FB1 provoca la acumulación de BCL. Lo anterior, activa alguna vía que conduce a la muerte celular y en la que participa el AS; además, provoca la activación de diversas hidrolasas, entre ellas, la nucleasa89. Debido a que la toxina FB1 activa vías de señalización de defensa en maíz, la inducción de éstas con la consecuente muerte celular del tejido vegetal favorece al hongo, que es un buen saprofito.
Blancos moleculares de la fumonisina en células de maíz. La FB1 secretada por el hongo durante la infección ejerce acción inhibitoria en tres blancos moleculares en la planta hospedera: la ATPasa de H+, la esfinganina N-acil transferasa y las β-1,3-glucanasas básicas. La inhibición en la esfinganina N-acil transferasa causa acumulación de BCLs que activa la vía del SA. El SA induce a su vez la actividad de una isoforma ácida de β-1,3-glucanasa, probablemente responsable de la generación de elicitores derivados del glucano. También el SA induce la actividad de nucleasas que contribuyen a la degradación del ADN genómico y muerte celular. Finalmente, la FB1 podría inhibir directamente la actividad de las isoformas básicas de β-1,3 glucanasas en el espacio extracelular facilitando la colonización. Flechas sólidas: indican activación, inducción o acumulación de compuestos o transcritos, mientras que la flechas no continuas representan interacciones hipotéticas.
Efectos similares también suceden en plantas de maíz irrigadas con una solución de FB1 28μM pues induce la aparición de lesiones necróticas en las hojas, reducción en el tamaño de la planta, así como de la masa radicular. De igual manera, los niveles de PSN y ESN aumentan 3 y 8 veces, respectivamente, en relación con las plantas no tratadas74. Muchos de los efectos se reproducen cuando se inoculan las plantas de maíz con cepas de F. verticillioides productoras de fumonisinas. La severidad de los síntomas se correlaciona con la cantidad de FB1 detectada en la raíz, así como con los niveles de esfinganina y fitoesfingosina en el tejido vegetal74,75,90.
El efecto sistémico que se observa por la irrigación con FB1 o infección por F. verticillioides se puede explicar por qué los niveles de esfinganina y fitoesfingosina, y sus derivados fosforilados, son translocados a las hojas de las plantas90. Entonces, es posible que los síntomas –como deformación y lesiones necróticas en las hojas– se deban a la presencia y al desbalance de las BCL en este tejido. Lo anterior también explicaría por qué no se observan estos síntomas por aspersión de la micotoxina directamente en las hojas79.
2. La ATPasa de H+ de membrana plasmática como blanco celular de la FB1La ATPasa de H+ es una enzima membranal que transporta protones del citoplasma al apoplasto; hidroliza ATP para energizar este transporte. Su función es fundamental para mantener un potencial membranal negativo y un gradiente transmembranal de pH, el que se requiere para la elongación del tejido y otros procesos fisiológicos101.
La FB1 inhibe in vitro la actividad de la ATPasa de H+, aislada de vesículas de membrana plasmática de embriones de maíz con 24 horas de germinación. De acuerdo con los datos cinéticos, la inhibición es de naturaleza no competitiva y reversible con una Ki de 17.5μM (Figura 6). Se halla asociada con dos situaciones: la disminución in vivo en la elongación radicular del 44% y 47% a 10 y 40μM de FB1, respectivamente, y con la reducción de hasta el 78% en la acidificación del medio91. La inhibición de esta enzima podría contribuir a acortar la elongación de la raíz y el tallo, observada en plantas infectadas con F. verticillioides o tratadas con FB1.
Además de la acidificación del espacio apoplástico, la ATPasa de H+ también participa en la respuesta de defensa de las plantas contra microorganismos. La enzima actúa en la percepción de algunos patógenos fúngicos pues se activa en los primeros minutos posteriores al tratamiento con ciertas moléculas derivadas de hongos102. Asimismo, la ATPasa de H+ interactúa en la membrana con otras proteínas involucradas en la respuesta de defensa103. Debido a la importancia de la ATPasa de H+ en la fisiología de la planta y en su defensa, constituye un blanco contra el cual varios patógenos han evolucionado para sintetizar moléculas que interfieran con su actividad101.
3. Las β-1,3-glucanasas como blanco celular de la FB1Las β-1,3-glucanasas son enzimas con actividad hidrolítica que se inducen durante la respuesta de defensa de las plantas, principalmente ante el ataque de hongos filamentosos. El blanco de las enzimas es el glucano, el polisacárido estructural más importante de la pared celular fúngica, que representa entre el 50%-60% del peso seco. Además de esta actividad que inhibe el crecimiento del hongo, las glucanasas liberan de la pared celular oligosacáridos que actúan como elicitores y activan respuestas de defensa104,105.
La fumonisina B1 modula la actividad de tres β-1,3-glucanasas de maíz mediante dos mecanismos independientes (Figura 6). Experimentos in vitro demuestran que la FB1 exógena inhibe la actividad de dos β-1,3-glucanasas básicas con una IC50 de 53μM. In vivo, la FB1 induce la actividad de una β-1,3-glucanasa ácida. Esta misma enzima se activa también con un análogo del ácido salicílico (AS). Lo anterior sugiere que una vía de señalización, mediada por el AS, se induce con la FB1, probablemente precedida por la acumulación de bases esfingoideas. La infección por F. verticillioides en tejidos de maíz causa efectos similares en la actividad de las β-1,3-glucanasas ácidas y básicas, que se correlacionan con la expresión de genes FUM y la producción de FB1 in vivo75.
ConclusionesDe acuerdo con la evidencia generada hasta ahora, es razonable deducir que la FB1 es un factor de virulencia de F. verticillioides: existe una relación positiva entre el desarrollo de síntomas en plántulas de maíz, la presencia de la toxina y la acumulación de BCL. La FB1 inhibe la biosíntesis de novo de esfingolípidos y genera el desbalance en los niveles endógenos de estos importantes metabolitos, específicamente, en la acumulación de bases esfingoideas de cadena larga. Lo anterior conduce a cascadas de señalización que derivan en muerte celular, por lo que F. verticillioides puede tomar ventaja para proliferar en un estado parasítico. La FB1 tiene blancos moleculares en diferentes compartimentos celulares, hecho que podría ser suficiente para generar un escenario en el cual las respuestas de defensa de la planta son suprimidas o evadidas, facilitando la colonización del hongo necrótrofo.
El trabajo de investigación del autor responsable Javier Plasencia está apoyado por el Centro Internacional de Mejoramiento de Maíz y Trigo (Convenio IMIC). Asimismo, se agradece el apoyo de los proyectos CONACYT (50503-Z) y DGAPA-PAPIIT (IN220010). Se agradece al Mtro. Felipe de la Torre por la elaboración de la Figura 2.