Los hongos endófitos habitan en las plantas sin causar síntomas aparentes de enfermedad. La estrecha relación que existe entre el endófito y su planta hospedera se considera de gran importancia, ya que el hongo es capaz de producir metabolitos bioactivos, así como modificar los mecanismos de defensa de su hospedera, permitiendo e incrementando la sobrevivencia de ambos organismos. Estudios recientes demuestran la enorme capacidad que tienen los hongos endófitos para producir compuestos activos que le confieren protección a su hospedera contra el ataque de patógenos y herbívoros, constituyendo una nueva vía para la obtención de diversos precursores o moléculas novedosas de utilidad en la agricultura y en la medicina. En este trabajo se describen diferentes aspectos relacionados con los hongos endófitos, abarcando su definición, descubrimiento, clasificación, interacción con su hospedera, papel ecológico, ejemplos de metabolitos secundarios bioactivos, así como estrategias metodológicas para su obtención. Por último, se presentan algunos resultados recientes, de estudios realizados en nuestro grupo de trabajo mostrando que los hongos endófitos son una fuente potencial de metabolitos secundarios bioactivos.
Endophytic fungi are microorganisms that live inside plant tissues without causing disease symptoms. In most cases, their relationship with the host plant is considered beneficial because the endophyte is able to produce bioactive metabolites that the host can use as defense mechanisms, and this allows survival of both organisms. Recent studies have demonstrated that the endophytic fungus confers protection to the host plant against attack by pathogens and herbivores. Since they have the ability to benefit the host plant, it is reasonable to think that the diverse bioactive compounds produced by the endophyte might exhibit potential applications in agriculture and medicine, and also serve as a source of inspiration for the discovery of new and more active molecules. In this paper, some aspects regarding endophytic fungi are described: definition, discovery, classification, interactions with their host plants, ecological role, selected examples of bioactive metabolites, host selection strategy, and methodological strategies for their isolation. Finally, we show some recent results of our research, which demonstrate that endophytic fungi are promising sources of new bioactive secondary metabolites.
La palabra ‘endófto’ etimológicamente significa ‘dentro de la planta’ (endon: dentro, phyton: planta). En un principio, el término endófito se refería a cualquier organismo que colonizara el interior de los tejidos de las plantas, pero fue Wilson en 19951 quien restringió el término únicamente a microorganismos, refiriéndose sólo a bacterias y a hongos que no provocan daño aparente a la planta hospedera. Actualmente, este término se refere a bacterias, hongos, algas e insectos2-5, en donde los hongos son los microorganismos que se han aislado con mayor frecuencia como endófitos6.
Los hongos endófitos se definen como microorganismos que pasan la mayor parte o todo su ciclo de vida colonizando los tejidos de la planta hospedera, sin causar daño evidente. El ‘endoftismo’ se refere a una asociación de costo-beneficio no obstructiva, asintomática y transitoria, definida por localización (no por función), y que se e stablece dentro de los tejidos vivos de la planta hospedera2-6. Los hongos endófitos se han encontrado en todas las plantas (pastos, algas, musgos y plantas vasculares), desde las que habitan en el ártico hast a los trópicos, así como en los campos agrícolas. De todos los ecosistemas del Planeta Tierra, los bosques templados y tropicales presentan una gran biodiversidad de plantas y éstas parecen albergar también una cantidad significativa de hongos endófitos7,8.
Descubrimiento e historia de los hongos endófitosEl término ‘endófito’ lo propuso de Bary en 18669 y los primeros registros de la presencia de hongos endófitos provienen del a ño 1898, en donde los investigadores for mu la ron la hipótesis de que los cuadros toxicológicos observados en animales, se debían al consumo de semillas o partes aéreas de los pastos Lolium temulentum, L. arvense, L. linicolum y L. remotum (Poaceae) infectados con hongos Clavicipitáceos (familia del ergot)10. Sin embargo, no se dio continuidad a esta suposición hasta que Bacon en 1977, relacionó la presencia del hongo Neotyphodium coenophialum a la alta incidencia de una intoxicación del ganado denominada “síndrome de verano”, debida al consumo de pastos de la especie Festuca arundinaceae (Poaceae). En los años 80, Funk describió la resistencia al ataque de insectos en los pastos infectados con endófitos11 y en 1988, Clay12 propuso que varios hongos endófitos Clavicipitáceos son mutualistas que defienden a la hospedera del ataque de herbívoros. Posteriormente, varios investigadores de múltiples disciplinas como químicos, ecólogos, botánicos y micólogos se han dedicado al estudio de estos organismos8.
En la actualidad el interés por estos microorganismos ha aumentado enormemente debido a que son productores de metabolitos secundarios novedosos y con diversa actividad biológica.
Clasificación de los hongos endófitosLos hongos endófitos son un grupo muy diver so y polifilét ico que habitan en diversas partes de las plantas. La mayoría pertenecen al phylum Ascomycota, aunque también se han encontrado en los Basidiomycota, Zygomycota y Oomycota13.
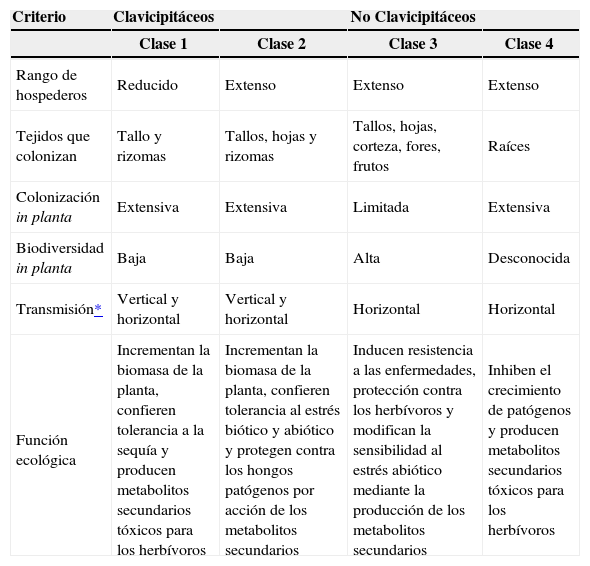
Históricamente los hongos endófitos se han clasificado en Clavicipitáceos y no Clavicipitáceos, basados en su filogenia e historia de vida3,6,14,15. Rodríguez y colaboradores2 (2009) los clasifican tomando en cuenta su taxonomía, sus plantas hospederas, su evolución y sus funciones ecológicas. En esta clasificación se conservan los grupos Clavicipitáceos y no Clavicipitáceos, y este último se divide en tres clases (Cuadro I).
Grupos y clases de hongos endófitos.
| Criterio | Clavicipitáceos | No Clavicipitáceos | ||
|---|---|---|---|---|
| Clase 1 | Clase 2 | Clase 3 | Clase 4 | |
| Rango de hospederos | Reducido | Extenso | Extenso | Extenso |
| Tejidos que colonizan | Tallo y rizomas | Tallos, hojas y rizomas | Tallos, hojas, corteza, fores, frutos | Raíces |
| Colonización in planta | Extensiva | Extensiva | Limitada | Extensiva |
| Biodiversidad in planta | Baja | Baja | Alta | Desconocida |
| Transmisión* | Vertical y horizontal | Vertical y horizontal | Horizontal | Horizontal |
| Función ecológica | Incrementan la biomasa de la planta, confieren tolerancia a la sequía y producen metabolitos secundarios tóxicos para los herbívoros | Incrementan la biomasa de la planta, confieren tolerancia al estrés biótico y abiótico y protegen contra los hongos patógenos por acción de los metabolitos secundarios | Inducen resistencia a las enfermedades, protección contra los herbívoros y modifican la sensibilidad al estrés abiótico mediante la producción de los metabolitos secundarios | Inhiben el crecimiento de patógenos y producen metabolitos secundarios tóxicos para los herbívoros |
Los Clavicipitáceos son los endófitos que colonizan los pastos, mientras que los no Clavicipitáceos colonizan las plantas no vasculares, helechos, coníferas y angiospermas 2,8. Existen diversos estudios relativos a los hongos endófitos de las zonas templadas, no obstante, la información sobre los endófitos de zonas tropicales aún representa un objeto potencial de estudio, ya que se tiene información muy limitada al respecto2,8. Asimismo, se conoce relativamente poco de la naturaleza de la interacción entre las plantas leñosas y sus endófitos foliares, a pesar de su abundancia y gran diversidad, particularmente en regiones tropicales, donde se ha planteado que cada hoja representa un mosaico de diversas especies de hongos endófitos2,14. Dreyfuss y colaboradores16 estimaron que debe haber aproximadamente 1.3 millones de especies de hongos endófitos por descubrir.
Relación hongo endófito-planta hospederaLa relación entre los hongos endófitos y su planta hospedera puede ir desde el mutualismo hasta la patogénesis 2,4,5. En estas relaciones ambos organismos producen metabolitos secundarios potencialmente tóxicos. El hongo endófito produce factores de virulencia, como exoenzimas y metabolitos fitotóxicos, mientras que la planta produce defensas, tanto mecánicas como bioquímicas3. En consecuencia, para que ambos organismos coexistan se establece entre ellos una relación de antagonismo balanceado, que depende de la virulencia del hongo y de las defensas de la planta, las cuales varían y son influenciadas por los factores ambientales y por la etapa de desarrollo de ambos organismos. Cuando los factores de virulencia del hongo y las defensas de la planta están en equilibrio se establece u na relación endofítica y, por el contrario, cuando se presenta la senescencia del hospedero o se encuentra bajo estrés, el balance se torna a favor del hongo y éste se expresa como patógeno, presentándose los síntomas de enfermedad3,6.
Papel ecológico de los hongos endófitosLos hongos endófitos usualmente toman nutrientes y protección de su hospedera y algunos de ellos en retribución pueden desempeñar un papel mutualista, ya que pueden beneficiarla al inducir su crecimiento, al aumentar su tolerancia al estrés y al producir metabolitos secundarios con amplia diversidad estructural que le brindan protección y resistencia contra herbívoros y/o microorganismos fitopatógenos2,4,5,17.
Un hongo endófito puede producir metabolitos secundarios que inhiben a un patógeno en particular o a otros hongos endófitos. Sin embargo, puede no inhibir a otros organismos de su mismo entorno15. Algunos hongos endófitos inducen los efectos alelopáticos de su hospedera a través de la producción de metabolitos secundarios o aleloquímicos, es decir, influyen sobre el crecimiento y desarrollo de otras especies que crecen a su alrededor y que usualmente son competidores por el espacio y nutrientes4,5. Incluso se ha visto que ciertos hongos endófitos producen los precursores o los metabolitos secundarios con actividad biológica, cuya síntesis se le había atribuido a la planta4,18,19. Esto se ha observado principalmente en las interacciones entre los hongos endófitos y los pastos, sin embargo, en plantas leñosas (árboles o arbustos) se ha comprobado en escasas ocasiones3,14,18.
Se ha observado que los hongos endófitos pueden contribuir a la protección de su hospedera contra factores bióticos (patógenos y herbívoros) y abióticos (estrés salino, térmico, presencia de metales, etc.), por medio de tres mecanismos:
- 1)
Directos: pormedio de enzimas y /o metabolitos secundarios con actividad anti-patógeno, producidos directamente por el hongo endófito.
- 2)
Indirectos: consisten en la inducción o incremento de la expresión de mecanismos de defensa químicos o fisiológicos intrínsecos a su planta hospedera.
- 3)
Ecológicos: se llevan a cabo por ocupación del nicho ecológico, hiperparasitismo y predación14,17.
Un ejemplo de mecanismo de defensa directo contra los patógenos de la hospedera es la producción de compuestos orgánicos volátiles (VOCs, por sus siglas en inglés) del hongo endófito Muscodor yucatanensis, aislado de Bursera simaruba (Burseraceae). Los extractos orgánicos derivados del medio de cultivo y del micelio de M. yucatanensis y, principalmente, la mezcla de VOCs que produce, son letales para los fitopatógenos Alternaria solani, Rhizoctonia sp., Phytophthora capsici y Phytophthora parasitica. Algunos de los VOCs identificados son: octano, 2-pentilfurano, cariofileno, aromadendreno, derivados del naftaleno, entre otros20,21.
El segundo mecanismo de protección a las hospederas es evidenciado en la investigación realizada por Waller y colaboradores (2005)22, en donde demostraron que la resistencia en la cebada (Hordeum vulgare, Poaceae) al ataque de microorganismos patógenos es debida a la colonización de las raíces por el endófito Piriformospora indica. En las plantas inoculadas con el endófito e infectadas con los patógenos Fusarium culmorum KF 350 y Cochliobolus sativus fue menor la pérdida de la biomasa y la severidad de la enfermedad causada por estos microorganismos. Los efectos positivos observados están relacionados con la inducción de niveles más altos del antioxidante ascorbato, presente en las raíces y mediado por acción del endófito P. indica. Este antioxidante puede proteger a la hospedera de la muerte celular22,23.
El último mecanismo de protección está bien ilustrado con una cepa no patógena de Fusarium oxysporum, denominada Fo47, la cual inhibe al patógeno F. oxysporum f. sp. radicislycopersici y reduce los síntomas de la pudrición de la raíz en el tomate (Solanum lycopersicum, Solanaceae). La inoculación en plantas de tomate de una carga de esporas 50 veces mayor que la del patógeno, asegura que las esporas de F. oxysporum Fo47 compitan con F. oxysporum f. sp. radicis-lycopersici por la misma fuente de carbono, lo que reduce la disponibilidad de nutrientes para este último microorganismo. Estas cepas de Fusarium presentan estrategias similares de colonización. En consecuencia, F. oxysporum Fo47 puede ocupar y reducir el número de sitios adecuados para la fijación de esporas y la colonización del patógeno F. oxysporum f. s p. radicis-lycopersici, por lo que resulta en un menor número de lesiones sintomáticas24.
Los mecanismos de protección hacia las hospederas pueden actuar de manera simultánea bajo diversas condiciones de estrés23.
Los hongos endófitos, además de interactuar con su hospedera, interactúan entre ellos dentro de la planta. Estas interacciones interespecíficas (entre distintas especies de hongos) están regidas por: a) mecanismos físicos o directos, como son las interacciones entre hifas, la interferencia hifal (micoparasitismo) y el contacto de micelio, y b) mecanismos químicos o indirectos, los cuales se dan por la producción de compuestos solubles, algunos metabolitos primarios, metabolitos secundarios, enzimas o por compuestos volátiles efectivos a distancia que limitan el crecimiento de las hifas del competidor14,15,18,25-28. Estos mecanismos han sido evidenciados en algunas interacciones en cultivos in vitro donde los hongos antagonistas producen metabolitos secundarios con propiedades antifúngicas o muestran una clara interferencia. En la actualidad, son escasos los estudios que establecen cuál es el modo de acción y cuáles son los compuestos antimicrobianos implicados en las interacciones interespecíficas dentro de las comunidades fúngicas en la naturaleza25,29-32. Por lo tanto, el estudio químico y biológico de estas interacciones conduce al descubrimiento de metabolitos secundarios bioactivos estructuralmente diversos y novedosos, por lo que este recurso constituye una fuente prometedora de moléculas potencialmente útiles para su uso en la agricultura, la medicina y la industria. Además, mediante estos estudios es posible seleccionar especies útiles como agentes de control biológico4,5,21,31,32.
Metabolitos secundarios derivados de hongos endófitosysuaplicaciónenagroquímicayfarmaciaLos metabolitos secundarios aislados de hongos endófitos poseen una gran diversidad química y algunos de ellos presentan esqueletos base no reportados en otras fuentes naturales. Así por ejemplo, los alcaloides lolina y sus derivados, que comprenden una familia de compuestos pirrolizidínicos, presentan un núcleo base de 2-oxa-6-azatriciclo[4.2.1.03,7] nonano; los indoloditerpénicos tipo lolitrem, que consisten en sistemas heterocíclicos de 8 anillos fusionados; los indoloditerpénicos paspalitrem, de 7 anillos y los alcaloides del ergot tipo ergoclavina y ergopeptina constituyen metabolitos secundarios biológicamente activos, exclusivos de hongos endófitos Clavicipitáceos3-6,19,33.
También se han encontrado muchos compuestos novedosos que presentan núcleos heterocíclicos complejos, producidos por hongos de diferentes ambientes, como los alcaloides espiroquinazolínicos, los alcaloides isoindólicos fusionados con un macrociclo como son las quetoglobosinas y las citocalasinas. Además, se han aislado diversos anhidropéptidos pirazodiónicos, ciclopéptidos y lipociclopéptidos con actividad biológica3-6,19,33.
En la literatura se encuentra reportado un número considerable de compuestos de origen policétido, incluyendo aquéllos que se encuentran ampliamente distribuidos en todos los taxones de hongos, como los que han sido aislados exclusivamente de hongos endófitos. Muchos consisten en macrólidos, así como en diversos compuestos aromáticos como bencenos, naftalenos, antracenos, piranos, furanos, benzofuranos, cromanos, xantanos, oxepanos y dépsidos3-6,19,33.
Los hongos endófitos también producen metabolitos secundarios con estructuras terpénicas novedosas y exclusivas. Los chokoles A-K son compuestos que presentan un esqueleto monoterpénico de ciclofarnesano. El guanacastano tiene un esqueleto base tricíclico de los compuestos denominados guanacastepenos, ambos compuestos son exclusivos de hongos e ndófitos. Del mismo modo, se han aislado compuestos con estructuras comunes, pero reportadas únicamente en endófitos, por ejemplo tricotecenos, eudesmanos, calamenos, fusiococanos y diterpenos tipo sordarina. Los esteroides que más se han re portado son los de esqueleto de ergostano3-6,19,33.
Asociada a la diversidad estructural de los metabolitos secundarios biosintetizados por los hongos endófitos, sobreviene su pluralidad funcional y su aplicación3-6,19,34. Un claro ejemplo de la importancia de estos compuestos como fuente potencial de fármacos está representado por el taxol, un diterpeno aislado del tejo del Pacífico (Taxus brevifolia, Taxaceae)33, que se utiliza en el tratamiento de cáncer de ovario y de mama, además de otras aplicaciones en enfermedades proliferativas de los tejidos4. Su elevado costo lo hace disponible sólo a ciertos sectores de la población35. A principios de los años 90, Stierle y colaboradores (1993)36 sugirieron que los tejidos vegetales de T. brevifolia podrían albergar microorganismos endófitos que sintetizaran taxol. Posteriormente, Strobel y colaboradores (1993)37 aislaron de esta especie vegetal el hongo endófito Taxomyces andreanae que tiene la capacidad de sintetizar taxol. En estudios posteriores, se encontraron otras especies de microorganismos aislados de coníferas capaces de producir taxol, como Pestalotiopsis microspora38,39, Periconia sp., Fusarium solani, Alternaria sp. y Aspergillus sp.40-42
Por otro lado, debido a la compleja interacción que se establece entre los hongos endófitos y su planta hospedera, entre distintas especies de hongos endófitos, y otras especies invasoras como otros hongos, oomicetos y bacterias, se ha puesto atención no sólo en el papel ecológico que pueden desempeñar los metabolitos secundarios producidos por los hongos endófitos en dichas interacciones, sino en las aplicaciones de estos compuestos para el desarrollo de agroquímicos como nematicidas, fungicidas, insecticidas y herbicidas4,6. Así por ejemplo, el estudio biodirigido del extracto orgánico del hongo endófito Phomopsis phaseoli, aislado de un árbol tropical no identificado que crece en la Guyana Francesa, permitió el aislamiento del ácido 3 - hidroxipropiónico, un compuesto con actividad nematicida contra Meloidogyne incognita43.
Por otra parte se aislaron dos policétidos de la familia de los dépsidos, la uredinina A y el 4-[(2,4-dihidroxi-3,6-dimetilbenzoil)oxi]-2-hidroxi-3,6-dimetilbenzoato de 3-hidroxi-2,5-dimetilfenilo, del hongo Cladosporium uredinicola, un endófito de la guayaba (Psidium guajava, Rosaceae). Ambos dépsidos presentan actividad herbicida inhibiendo el flujo de electrones del agua al metilviológeno, actuando como inhibidores de la reacción de Hill en tilacoides de espinaca44.
Edenia gomezpompae, un endófito de las hojas de Callicarpa acuminata (Verbenaceae), produce varios compuestos con potencial antifúngico, incluyendo las preusomerinas EG1, EG2 y EG3 y las palmarumicinas CP2, CP17 y CP18. Las preusomerinas inhiben significativamente el crecimiento de varios endófitos de su misma planta hospedera, así como el de diversos microorganismos fitopatógenos de importancia económica, como F. oxysporum, Rhizoctonia sp, A. solani, P. capsici y P. parasitica25,45,46.
La investigación sobre endófitos de pastos han demostrado que pueden defender a su hospedera del at a que de herbívoros por medio de compuestos con actividad insecticida y antialimentaria. Existen estudios que han demostrado que los alcaloides tipo lolina son efectivos contra los áfidos Rhopalosiphum padi47, los heterópteros Oncopeltus faciatus48, el coleóptero Popillia japonica49 y el lepidóptero Spodoptera frugiperda50. Debido a su baja toxicidad en los mamíferos, se están desarrollando métodos sintéticos para su venta como insecticidas comerciales51.
Diversos compuestos aislados de hongos endófitos presentan actividad antibacteriana, contra bacterias Gram positivas, Gram negativas y micobacterias. Por citar un ejemplo, en el estudio realizado por Zhao y colaboradores (2012)52, se reportaron dos compuestos con esa actividad, obtenidos del endófito Gliomastix murorum Ppf8, aislado de Paris polyphylla var. yunnanensis (Trilliaceae): un esterol el ergosta-5,7,22-trien-3-oly un benzofurano el 2,3 - dihidro-5- hidroxi-á.á a,a-dimetil-2-benzofuranometanol. Ambos compuestos presentaron valores de CI50 entre 55.65 a 145.36 µg/mL contra Escherichia coli, Pseudomonas lachrymans, Bacillus subtilis y Staphylococcus haemolyticus52. Por otra parte, en un estudio realizado por Rukachaisirikul en 200853, se reportó una amida novedosa, la fomoenamida, que presenta actividad antifímica contra Mycobacterium tuberculosis cepa H37Ra. Este compuesto se obtuvo del endófito Phomopsis longicolla aislado a partir del árbol Garcinia dulcis (Clusiaceae).
Cabe destacar que lo sestud ios sobre hongos endófitos también aportan conocimientos sobre metabolitos secundarios aislados de hongos de diferentes fuentes, reportados con funciones biológicas distintas. Para citar un ejemplo, la fumigaclavina C es un alcaloide tipo clavina que fue originalmente aislado y reportado por Cole y colaboradores en 197754 como una micotoxina alimentaria de Aspergillus fumigatus. Posteriormente, Pinheiro y colaboradores en 201255 reportaron la actividad antimicrobiana de este compuesto, obtenido a partir del extracto acetoetílico de una especie endófita no identificada de Aspergillus aislado de la planta medicinal Bauhinia guianensis (Fabaceae). La fumigaclavina C es activo contra E. coli, P. aeruginosa, S. aureus y B. subtilis.
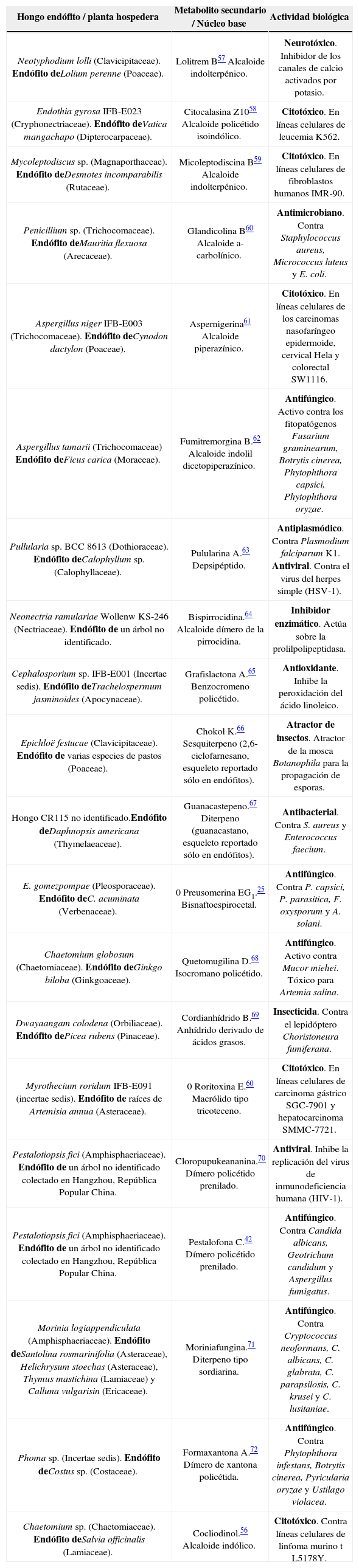
En el Cuadro II se presentan ejemplos selectos de metabolitos secundarios con actividad biológica aislados de hongos endófitos.
Ejemplos selectos de metabolitos secundarios con actividad biológica aislados de hongos endófitos.
| Hongo endófito / planta hospedera | Metabolito secundario / Núcleo base | Actividad biológica |
|---|---|---|
| Neotyphodium lolli (Clavicipitaceae). Endófito deLolium perenne (Poaceae). | Neurotóxico. Inhibidor de los canales de calcio activados por potasio. | |
| Endothia gyrosa IFB-E023 (Cryphonectriaceae). Endófito deVatica mangachapo (Dipterocarpaceae). | Citotóxico. En líneas celulares de leucemia K562. | |
| Mycoleptodiscus sp. (Magnaporthaceae). Endófito deDesmotes incomparabilis (Rutaceae). | Citotóxico. En líneas celulares de fibroblastos humanos IMR-90. | |
| Penicillium sp. (Trichocomaceae). Endófito deMauritia flexuosa (Arecaceae). | Antimicrobiano. Contra Staphylococcus aureus, Micrococcus luteus y E. coli. | |
| Aspergillus niger IFB-E003 (Trichocomaceae). Endófito deCynodon dactylon (Poaceae). | Citotóxico. En líneas celulares de los carcinomas nasofaríngeo epidermoide, cervical Hela y colorectal SW1116. | |
| Aspergillus tamarii (Trichocomaceae) Endófito deFicus carica (Moraceae). | Antifúngico. Activo contra los fitopatógenos Fusarium graminearum, Botrytis cinerea, Phytophthora capsici, Phytophthora oryzae. | |
| Pullularia sp. BCC 8613 (Dothioraceae). Endófito deCalophyllum sp. (Calophyllaceae). | Antiplasmódico. Contra Plasmodium falciparum K1. Antiviral. Contra el virus del herpes simple (HSV-1). | |
| Neonectria ramulariae Wollenw KS-246 (Nectriaceae). Endófito de un árbol no identificado. | Inhibidor enzimático. Actúa sobre la prolilpolipeptidasa. | |
| Cephalosporium sp. IFB-E001 (Incertae sedis). Endófito deTrachelospermum jasminoides (Apocynaceae). | Antioxidante. Inhibe la peroxidación del ácido linoleico. | |
| Epichloë festucae (Clavicipitaceae). Endófito de varias especies de pastos (Poaceae). | Atractor de insectos. Atractor de la mosca Botanophila para la propagación de esporas. | |
| Hongo CR115 no identificado.Endófito deDaphnopsis americana (Thymelaeaceae). | Antibacterial. Contra S. aureus y Enterococcus faecium. | |
| E. gomezpompae (Pleosporaceae). Endófito deC. acuminata (Verbenaceae). | Antifúngico. Contra P. capsici, P. parasitica, F. oxysporum y A. solani. | |
| Chaetomium globosum (Chaetomiaceae). Endófito deGinkgo biloba (Ginkgoaceae). | Antifúngico. Activo contra Mucor miehei. Tóxico para Artemia salina. | |
| Dwayaangam colodena (Orbiliaceae). Endófito dePicea rubens (Pinaceae). | Insecticida. Contra el lepidóptero Choristoneura fumiferana. | |
| Myrothecium roridum IFB-E091 (incertae sedis). Endófito de raíces de Artemisia annua (Asteraceae). | Citotóxico. En líneas celulares de carcinoma gástrico SGC-7901 y hepatocarcinoma SMMC-7721. | |
| Pestalotiopsis fici (Amphisphaeriaceae). Endófito de un árbol no identificado colectado en Hangzhou, República Popular China. | Antiviral. Inhibe la replicación del virus de inmunodeficiencia humana (HIV-1). | |
| Pestalotiopsis fici (Amphisphaeriaceae). Endófito de un árbol no identificado colectado en Hangzhou, República Popular China. | Antifúngico. Contra Candida albicans, Geotrichum candidum y Aspergillus fumigatus. | |
| Morinia logiappendiculata (Amphisphaeriaceae). Endófito deSantolina rosmarinifolia (Asteraceae), Helichrysum stoechas (Asteraceae), Thymus mastichina (Lamiaceae) y Calluna vulgarisin (Ericaceae). | Antifúngico. Contra Cryptococcus neoformans, C. albicans, C. glabrata, C. parapsilosis, C. krusei y C. lusitaniae. | |
| Phoma sp. (Incertae sedis). Endófito deCostus sp. (Costaceae). | Antifúngico. Contra Phytophthora infestans, Botrytis cinerea, Pyricularia oryzae y Ustilago violacea. | |
| Chaetomium sp. (Chaetomiaceae). Endófito deSalvia officinalis (Lamiaceae). | Citotóxico. Contra líneas celulares de linfoma murino t L5178Y. |
Una de las grandes ventajas que representa la disponibilidad de un sinnúmero de microorganismos endófitos capaces de sintetizar un fármaco o un agroquímico potencial, es evitar la necesidad de cultivar o colectar especies vegetales silvestres, así como reducir el costo de producción de los principios activos56. De la misma forma, se ha propuesto que estos metabolitos podrían ser utilizados para desarrollar agroquímicos de origen natural, que serían menos perjudiciales para el hombre y para el medio ambiente que los compuestos químicos sintéticos que actualmente se utilizan en la agricultura, ya que los productos naturales pueden interactuar con blancos moleculares específicos, afectar procesos fisiológicos particulares y presentar menores índices de bioacumulación4.
Estrategias de selección de hospederas útiles para el aislamiento de hongos endófitosLos antecedentes y consideraciones anteriores, aunados a la gran diversidad de especies vegetales existentes a nivel mundial, así como a la capacidad que tienen algunos hongos endófitos de mejorar los mecanismos de resistencia de su hospedera y de protegerla del ataque de posibles enemigos, han permitido establecer estrategias de selección de plantas hospederas que incrementen la posibilidad de aislar hongos endófitos capaces de producir metabolitos secundarios bioactivos. Estos criterios incluyen4,73:
- 1.
Plantas sin síntomas de enfermedad que crecen rodeadas de otras plantas infectadas por diversos patógenos o atacadas por herbívoros (criterio ecológico), las cuales pueden estar colonizadas por endófitos productores de metabolitos secundarios con propiedades antimicrobianas e insecticidas.
- 2.
Plantas que crecen en áreas de alta biodiversidad y que, por lo tanto, pueden alojar endófitos igualmente biodiversos.
- 3.
Plantas que tienen antecedentes entnobotánicos, que se relacionan con algún uso específico o aplicaciones relacionadas a los intereses de la investigación, como son las plantas con uso en la medicina tradicional (criterio etnomédico).
- 4.
Plantas con estrategias especiales para su supervivencia o que crecen en ambientes únicos.
- 5.
Plantas endémicas que poseen una longevidad inusual, o que han ocupado extensiones de tierra poco convencionales.
Para el descubrimiento de metabolitos secundarios de microorganismos endófitos, se ha aplicado en repetidas ocasiones la estrategia metodológica que se indica a continuación: en primer lugar, se realiza la selección de las hospederas, de acuerdo con los criterios mencionados y se lleva a cabo el aislamiento de los hongos endófitos34,73,75,76. La caracterización taxonómica de los endófitos puros se lleva a cabo mediante el análisis detallado de sus características macro y microscópicas, así como mediante el empleo de técnicas moleculares modernas77. A continuación se realiza la preselección de los microorganismos, mediante un criterio ecológico, principalmente con base en las interacciones planta-microorganismo4,17,78 y microorganismo-microorganismo21,25,79,80. En múltiples ocasiones, la observación de este tipo de interacciones ha constituido un punto de partida para la preselección de especies fúngicas como una fuente valiosa de principios bioactivos21,25,81.
En segundo lugar, es necesario realizar cultivos en pequeña escala, con la finalidad de establecer las condiciones óptimas de crecimiento de los organismos fúngicos objeto de estudio.
Posteriormente, se preparan los extractos del medio de cultivo y del micelio21,25. A continuación, se realizan pruebas biológicas preliminares, las cuales consisten en la determinación del efecto biológico de los extractos orgánicos derivados del medio de cultivo y del micelio, mediante la utilización de bioensayos sencillos y de fácil implementación. Entre los más utilizados para detectar posibles agroquímicos se encuentran los ensayos de germinación y de crecimiento radicular de diversas especies de semillas21,25,82 y el ensayo para detectar inhibidores y promotores del crecimiento de plantas, mediante el empleo de Lemna minor (Araceae)83. La determinación del potencial antifúngico se realiza mediante la medición del efecto de los extractos sobre el crecimiento de diversos microorganismos fitopatógenos de importancia económica21,25, mientras que para evidenciar el efecto insecticida y nematicida se utilizan bioensayos sobre diferentes artrópodos y nematodos para observar actividad tóxica, ovicida, y/o repelente84.
Por otra parte, para encontrar metabolitos secundarios con aplicación terapéutica, existen ensayos para evidenciar actividad antimicrobiana, empleando métodos comunes como el de difusión en disco, el de dilución en agar y la prueba de inhibición sobre el crecimiento radial de microorganismos patógenos para los humanos21,25,85-87. Sobre diferentes líneas celulares tumorales, para comprobar acción anticancerígena88. Para comprobar actividad antiinfamatoria se realizan pruebas sobre diferentes líneas celulares y la prueba de enema en oreja de ratón89. Para demostrar actividad antidiabética se trabaja con ratones90,91 y, por último, mediante la infección de células por virus y el método de difusión en pozo con una suspensión de células virales, se logra observar la actividad antiviral92. Cabe destacar que estas pruebas son sólo una muestra representativa de los principales bioensayos utilizados y de la actividad biológica puesta en evidencia.
Estas evaluaciones preliminares permiten detectar extractos naturales apropiados para la obtención de agentes terapéuticos o agroquímicos4,5. En general, los extractos que demuestran respuestas positivas en los ensayos de fitoinhibición o como inhibidores del crecimiento de microorganismos, se consideran candidatos adecuados para la realización de otras pruebas biológicas dirigidas a un blanco de acción específico en la fisiología o en el metabolismo vegetal o de los microorganismos, respectivamente17,44.
Una vez seleccionados los extractos activos se aíslan los principios bioactivos mediante estudios químicos biodirigidos. Este proceso permite la obtención de los metabolitos secundarios con actividad biológica21,25,72. Los compuestos naturales activos puros se identifican y, por último, éstos son sometidos a ensayos biológicos adicionales con la finalidad de explorar de manera más detallada su posible aplicación como fármacos o agroquímicos comerciales13,25,44,74. En el caso particular de los agroquímicos potenciales, se realizan pruebas de invernadero sobre especies vegetales cultivables o sobre malezas para determinar la actividad de tipo pre y postemergente87.
Finalmente, es necesario determinar la toxicidad de los compuestos bioactivos y para ello se han desarrollado pruebas preliminares sobre los crustáceos Artemia salina y Daphnia magna93,94, así como la muerte celular de macrófagos, utilizando líneas celulares95. Posteriormente, es necesario verificar la toxicidad en mamíferos, en cuyo caso se trabaja inicialmente con ratones y cobayos, para posteriormente dar inicio a las pruebas clínicas en pacientes y personas sanas96,97.
En este contexto, se muestran a continuación los resultados obtenidos a nivel de extractos orgánicos de hongos endófitos con potencial antagónico, aislados de las hojas de plantas seleccionadas bajo un criterio ecológico, y colectadas en una zona de alta biodiversidad como lo es la ‘Reserva Ecológica de la Biósfera Sierra de Huautla’ (REBIOSH), ubicada en Morelos, México. Esta investigación se realiza actualmente en nuestro grupo de trabajo y está enfocada principalmente en la obtención de metabolitos secundarios con potencial fitotóxico y antimicrobiano con posible aplicación sobre el control de malezas, hongos verdaderos y oomicetos fitopatógenos.
Para lograr este objetivo, se aislaron hongos endófitos73,76 de las hojas sanas de 11 plantas pertenecientes a las familias Burseraceae, Celastraceae, Euphorbiaceae, Fabaceae, Labiatae y Piperaceae, obteniendo un total de 4310 aislamientos de hongos endófitos, de los cuales se han conseguido 183 morfotipos puros a la fecha, que poseen potencial antagónico sobre el crecimiento de otras poblaciones de hongos endófitos que emergían al mismo tiempo durante las etapas de aislamiento y purificación. Estos resultados muestran claramente que las plantas en estudio se encuentran colonizadas por un amplio número de hongos endófitos, y confirman que el criterio de selección empleado, es decir, plantas que crecen en áreas de gran diversidad biológica y que no presentan ningún daño por patógenos o herbívoros, constituyen una buena estrategia para aislar una gran cantidad y diversidad de endófitos4,74.
Con el propósito de obtener los metabolitos secundarios producidos por los hongos endófitos y comprobar que poseen potencial antimicrobiano y fitotóxico, de los 183 endófitos puros, se eligieron 75 para su cultivo, los cuales inhibieron significativamente el crecimiento de otros endófitos en las interacciones antagónicas observadas durante la etapa de purificación. Los hongos seleccionados se cultivaron en pequeña escala bajo diferentes condiciones, utilizando como medio de crecimiento, caldo papa dextrosa (1 L), incubando en condiciones estáticas y en agitación (15 días a 200 rpm), en medios sólidos empleando agar papa dextrosa (10 cajas de Petri de 10 cm) y en medio a base de arroz (300 g), incubado estáticamente por un periodo de 30 días, con fotoperiodo de luz artificial-obscuridad 12:12 h, a temperatura ambiente. Transcurrido el periodo de incubación, se obtuvieron los extractos orgánicos del medio de cultivo y micelio para los cultivos en medio líquido y de medio-micelio para los cultivos en medio sólido y arroz. El potencial antimicrobiano y fitotóxico, de los extractos orgánicos obtenidos se determinó cuantitativamente sobre el crecimiento de microorganismos fitopatóge nos y sobre la longitud de la raíz de plantas modelo, utilizando el método de dilución en agar21,25,98,99.
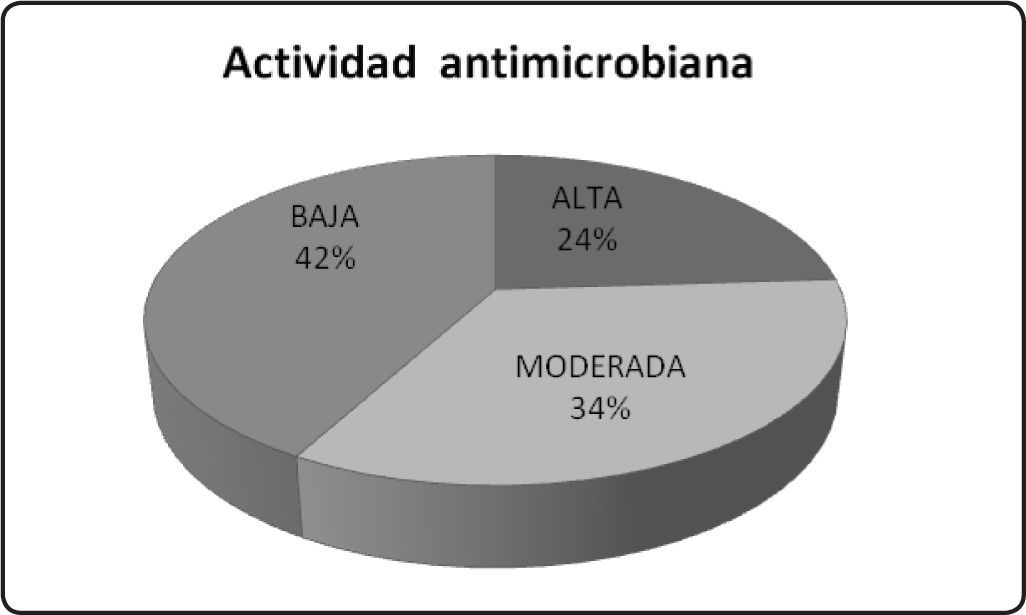
De los de 75 endófitos cultivados en pequeña escala, se evaluó la actividad antimicrobiana de los extractos orgánicos con los mayores rendimientos. En la Gráfica 1 se muestra el potencial antimicrobiano de 36 extractos orgánicos sobre el crecimiento de cinco microorganismos fitopatógenos con importancia económica, dos hongos verdaderos (Alternaria solani y Fusarium oxysporum) y sobre tres oomicetos (Pythium aphanidermatum, Phytophthora parasitica y Phytophthora capsici). El efecto de inhibición provocado por cada uno de los extractos fúngicos evaluados sobre el crecimiento de los microorganismos de prueba, se agrupan en alto, moderado y bajo, según su actividad antimicrobiana mostrada, donde bajo corresponde a inhibiciones del 1-24%, moderado del 25-50% y alto del 51-100%, de acuerdo con los intervalos establecidos en nuestro grupo de trabajo. El 42% tuvo actividad baja, el 34% presentó actividad moderada y el 24% exhibió actividad alta.
Estos resultados demuestran que los metabolitos secundar ios biosintetizados por más del 50% de los hongos endófitos evaluados, poseen actividad antimicrobiana de moderada a alta. Por lo que son considerados como candidatos idóneos en la búsqueda de nuevos compuestos de origen natural, con actividad antimicrobiana, útiles en la agricultura moderna y que además posiblemente tengan un papel en la protección de su hospedera contra patógenos y herbívoros.
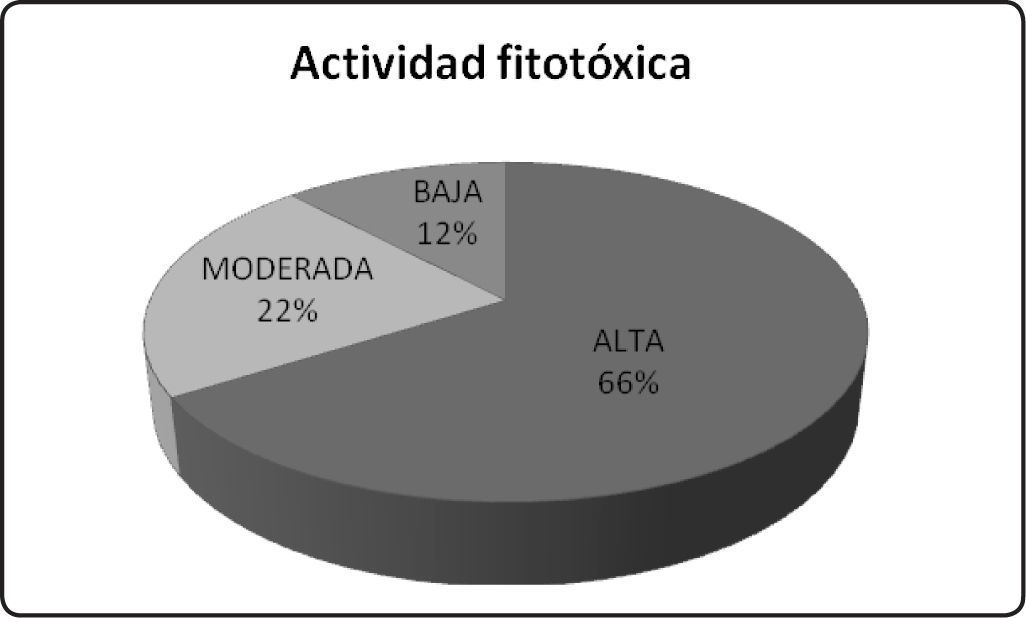
Con respecto ala actividad fitotóxic a en la Gráfica 2 se muestra el efecto inhibitorio de 70 extractos orgánicos sobre la longitud de la raíz de las semillas de dos plantas modelo, Amaranthus hypochondriacus (Amaranthaceae) y Solanum lycopersicum (Solanaceae). De nueva cuenta, el porcentaje de inhibición provocado por cada uno de los extractos orgánicos evaluados sobre el crecimiento de la raíz de las plantas de prueba se agrupan en alto, moderado y bajo, según su actividad fitotóxica mostrada, donde bajo cor responde a inhibiciones del 1-24%, moderado del 2 5 -50% y alt o del 51-10 0 %, d e acuerdo con los intervalos establecidos en nuestro grupo de trabajo. El 12% de los extractos evaluados tuvo actividad fitotóxica baja, el 22% present ó activid ad mode rada y el 60% mostró actividad alta. Estos datos demuestran que la mayoría de los hongos endófitos aislados de plantas de la REBIOSH son excelentes productores de compuestos con actividad fitotóxica, útiles para el desarrollo de agentes herbicidas alternativos a los usados hoy en día. Por otra parte, es posible que estos compuestos también contribuyan en la defensa de su planta hospedera, protegiéndola de la invasión de algunas plantas o malezas que habitan en su comunidad y a su vez pueden ser necesarios para su sobrevivencia dentro de su planta hospedera.
En el presente trabajo se pone en evidencia que los hongos endófitos representan candidatos idóneos, para la investigación y obtención de compuestos bioactivos.
ConclusionesDesde el descubrimiento de los hongos endófitos como productores de metabolitos secundarios tóxicos contra herbívoros, comenzó un amplio estudio que agrupa a investigadores de diversas áreas con el fin de conocer varios aspectos de los endófitos, entre ellos la producción de metabolitos bioactivos útiles para la humanidad.
Con los ejemplos proporcionados podemos demostrar la importancia del estudio de los hongos endófitos y su potencial para la obtención de compuestos bioactivos. Sin embargo, falta todavía mucha investigación que nos proporcione información sobre la toxicidad y seguridad de los metabolitos secundar ios para que puedan ser utilizados como agentes agroquímicos o como fármacos. Asimismo, es necesario realizar estudios sobre el papel que estos metabolitos puedan tener en la naturaleza y en la protección hacia su hospedera.
Agradecemos a la Universidad Nacional Autónoma de México (UNAM), a través del Instituto de Química, por el apoyo para la realización de los estudios sobre hongos endófitos de plantas de México y al Consejo Nacional de Ciencia y Tecnología (CONACYT), por el apoyo financiero otorgado a través del proyecto 81017.