Analizar la prevalencia del Síndrome Metabólico (SM) y sus componentes en niños y adolescentes del continente Americano.
MétodoLa recopilación de la información se tomó de artículos científicos de los años 2008 al 2016 que aparecen en las bases de datos PubMed, Europe PMC y SciELO. Se incluyeron estudios que muestran datos cuantitativos de los componentes del SM en niños y/o adolescentes entre 4 y 19 años de edad.
ResultadosSe analizaron 23 estudios realizados en 12 países del continente americano, de los cuales sólo 3 consideraron el factor edad. Los componentes del SM más prevalentes fueron la obesidad y las dislipidemias. Mientras que los menos prevalentes fueron hiperglicemia e hipertensión. La hipoalipoproteinemia, la hipertensión y el SM fueron más frecuentes en hombres que en mujeres. Pocos estudios analizaron factores de riesgo para el SM.
ConclusiónLa presencia del SM y sus componentes en niños y adolescentes americanos es variable. La variabilidad es también observada en países de otros continentes. Esta revisión evidencia la necesidad de definir los criterios de diagnóstico del SM en niños y jóvenes, y la urgencia de diseñar estrategias de prevención de las alteraciones metabólicas en edades tempranas, involucrando la participación de la familia, la sociedad y las instituciones públicas.
To analyze the prevalence of Metabolic Syndrome (MS) and its components in children and adolescents in American continent.
MethodsInformation was collected from scientific papers published from 2008 to 2016 in PubMed, Europe PMC, and SciELO databases. Only those studies showing quantitative data from MS components in 4-19 years old children and adolescents were included.
ResultsTwenty-three studies in 12 countries in American continent were analyzed, only three studies considered age factor. Obesity and dyslipidemias were highly prevalent; while hyperglycemia and hypertension had a low prevalence. Hypoalipoproteinemia, hypertension and MS were more frequent in males than in females. Few studies analyzed risk factors for MS.
ConclusionSimilarly, to other continents, the presence of MS and its components in American children and adolescents is variable. This review shows the necessity to have clear diagnostic criteria for MS in children and adolescents, as well as the urgency to get preventive strategies for metabolic alterations at young age, involving family, society, and public institutions.
El Síndrome Metabólico (SM) es una combinación de presión arterial alta, obesidad abdominal, dislipidemias, intolerancia a la glucosa y/o resistencia a la insulina, así como un aumento de moléculas pro-inflamatorias1,2. Su diagnóstico en niños y adultos suele hacerse con el mismo criterio, reunir al menos 3 de los componentes ya descritos, aunque con ciertas variaciones en los puntos de corte2,3. Así como en los adultos, el SM en niños es un factor de riesgo para el desarrollo de diabetes mellitus 2 (DM2), hipertensión, enfermedades cardiovasculares y daño renal1,2. Además, la presencia del SM en la pubertad puede condicionar la fertilidad durante la edad adulta y está asociado a la presencia de ciclos menstruales irregulares y ovario poliquístico4,5. El impacto del SM en la salud reproductiva de los niños ha sido poco estudiada, sin embargo, en hombres adultos la obesidad se asocia con infertilidad, hipogonadismo, niveles bajos de testosterona, bajo conteo espermático e incluso un deterioro en el desarrollo embrionario que aumenta la tasa de aborto6.
La raza, es un factor que influye fuertemente en el desarrollo del SM a edades tempranas. Así, niños y jóvenes hispanos, africanos y asiáticos tienen una mayor prevalencia del SM que los no hispanos2. Otro factor importante, es el estado de la salud materna durante el desarrollo intrauterino del feto que puede influir en los cambios epigenéticos y en el desarrollo de alteraciones metabólicas en los hijos7. En niños y adolescentes con predisposición genética o epigenética, una buena nutrición y actividad física podrían retardar el desarrollo o evolución de las alteraciones metabólicas1. Dado que los niños, y en menor medida los jóvenes, dependen aún de la familia, las alteraciones metabólicas a esta edad se relacionan con los cambios en la alimentación y por actividades de los padres que favorecen el consumo de alimentos procesados con alto contenido en carbohidratos, grasa y sal1. Por ello, la obesidad parental se considera un predictor de la obesidad de los hijos8.
Los adolescentes son un grupo de gran interés en las políticas de salud pública, debido a que en esta etapa de la vida se desarrollan actitudes y prácticas de comportamiento relacionadas con la salud, que tienen alta posibilidad de permanecer durante toda la vida9, determinándose así el estatus de salud que los adolescentes tendrán en la edad adulta10. Se ha mostrado que más de la mitad de las muertes relacionadas con las enfermedades crónicas están asociadas a comportamientos, que comienzan durante la adolescencia, y son difíciles de cambiar11, como el consumo de tabaco, alcohol, mala calidad de la alimentación y falta de actividad física12. Por otro lado, la pubertad y la adolescencia son dos etapas complejas de la vida. Los jóvenes buscan su autonomía y prestan mayor atención a su apariencia por lo que un aumento de peso o un deterioro, son factores para reducir su autoestima, el aislamiento y la fatiga, así como la presencia de episodios depresivos1.
Por todo lo anteriormente descrito, consideramos que existe la necesidad de conocer cuál es la tendencia general de las alteraciones metabólicas en los niños y adolescentes de los distintos países del continente Americano, con el objetivo de denotar su magnitud, describir las prevalencias del SM, las causas, factores de riesgo y sus componentes.
MÉTODOLa recopilación de la información se tomó de artículos científicos de los años 2008 al 2016 contenidos en las bases de datos PubMed, Europe PMC y SciELO. Los criterios de integración de los artículos fueron: que éstos se enfocaran en niños y/o adolescentes entre 4 a 19 años de edad, y mostraran datos cuantitativos sobre los componentes del SM, como niveles de obesidad y sobrepeso, hipertensión arterial, hiperglucemia y dislipidemias, e información sobre la prevalencia del SM.
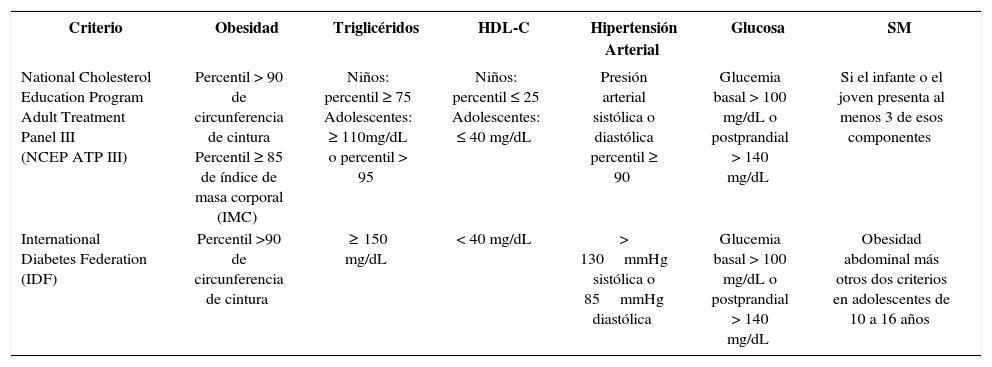
En la presente revisión se incluyeron 23 estudios que consideraron los criterios propuestos por la National Cholesterol Education Program Adult Treatment Panel III (NCEP ATP III)13 y por la Federación Internacional de la Diabetes (IDF, por sus iniciales en inglés)14 presentados en la Tabla I.
Criterios de evaluación del SM en niños y adolescentes.
| Criterio | Obesidad | Triglicéridos | HDL-C | Hipertensión Arterial | Glucosa | SM |
|---|---|---|---|---|---|---|
| National Cholesterol Education Program Adult Treatment Panel III (NCEP ATP III) | Percentil > 90 de circunferencia de cintura Percentil ≥ 85 de índice de masa corporal (IMC) | Niños: percentil ≥ 75 Adolescentes: ≥ 110mg/dL o percentil > 95 | Niños: percentil ≤ 25 Adolescentes: ≤ 40 mg/dL | Presión arterial sistólica o diastólica percentil ≥ 90 | Glucemia basal > 100 mg/dL o postprandial > 140 mg/dL | Si el infante o el joven presenta al menos 3 de esos componentes |
| International Diabetes Federation (IDF) | Percentil >90 de circunferencia de cintura | ≥ 150 mg/dL | < 40 mg/dL | > 130mmHg sistólica o 85mmHg diastólica | Glucemia basal > 100 mg/dL o postprandial > 140 mg/dL | Obesidad abdominal más otros dos criterios en adolescentes de 10 a 16 años |
Los datos reportados son el resultado del análisis de 23 artículos que cumplieron con los criterios de inclusión, y que corresponden a 12 países de América: Argentina15–18, Brasil19, Canadá20,21, Chile22–24, Colombia25–27, Ecuador28, Estados Unidos de América (EUA)29, Guatemala30, México31–34, Paraguay35, Perú36 y Venezuela37. Del total de estudios analizados, solamente 21 trabajos mostraron prevalencias generales de obesidad abdominal, 18 de ellos tuvieron prevalencias de hiperglucemia, otros 18 indicaron las prevalencias de hipertrigliceridemia, 19 las prevalencias de hipoalfalipoproteinemia (HDL-C bajo), 20 más midieron prevalencias de hipertensión arterial, y 18 analizaron prevalencias del SM. Solamente un estudio mostró resultados por grupos étnicos y sólo 12 diferenciaron las prevalencias por género. Todos los estudios reportaron datos de muestras urbanas, excepto el de Ochoa-Avilés que se refiere a los jóvenes de áreas rurales.
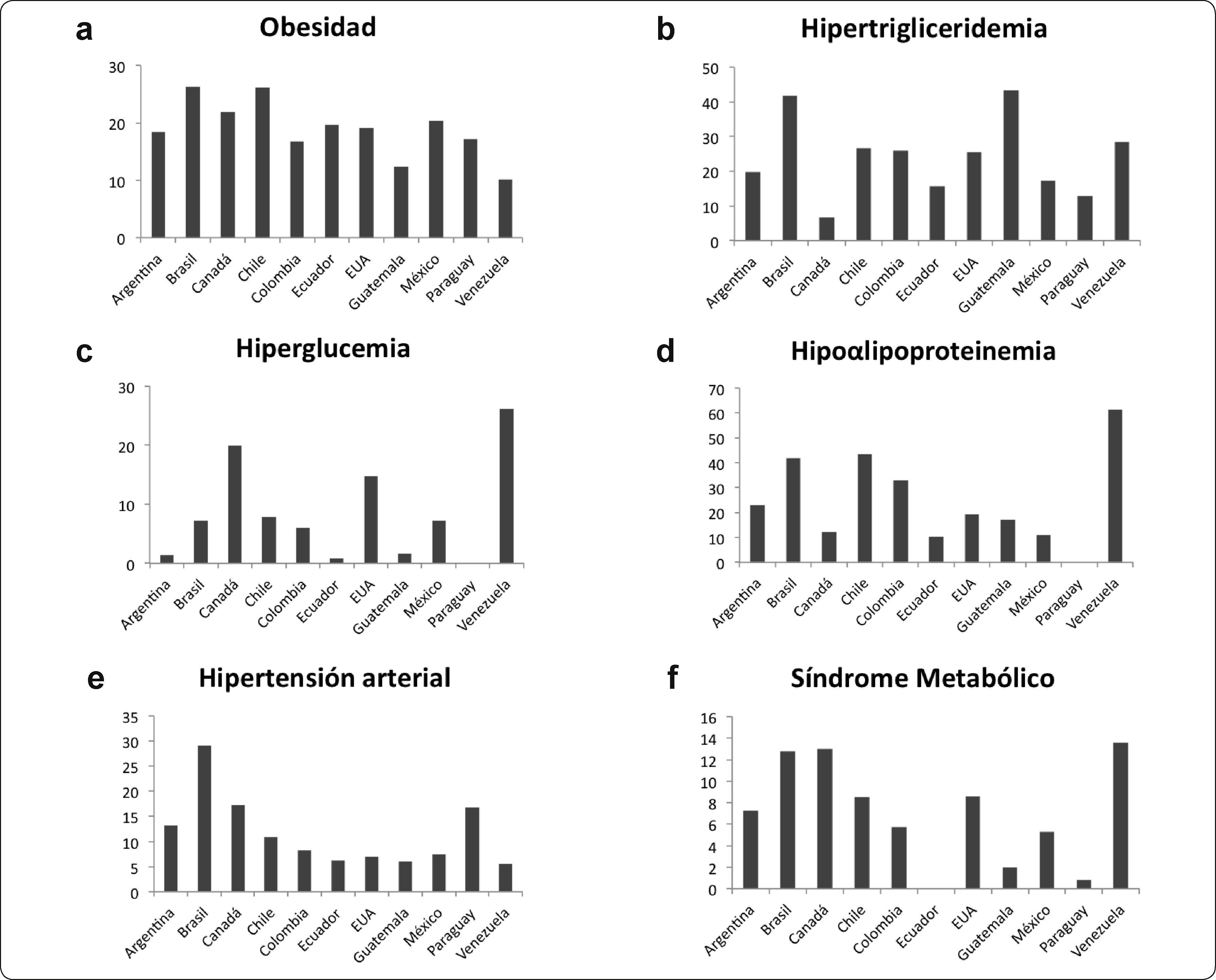
El análisis de las prevalencias del SM y sus componentes en niños y adolescentes del continente americano fueron elevadas, casi una cuarta parte presentaron niveles bajos de HDL-C, aproximadamente una quinta parte con niveles de triglicéridos elevados y obesidad abdominal, además uno de cada 10 niños y adolescentes presentaron tensión arterial elevada, alrededor del 7% con hiperglucemia y SM. De manera general, los componentes más prevalentes fueron la obesidad y las dislipidemias (hipertrigliceridemia y HDL-C); mientras que, la hiperglicemia y la hipertensión mostraron una menor prevalencia (Figuras 1a-f).
Prevalencias (%) del SM y sus componentes en niños y adolescentes americanos. Los valores graficados corresponden a los valores reportados en los estudios analizados; excepto para países como Argentina, Brasil, Colombia y México donde se graficó el promedio de los valores reportados en los estudios.
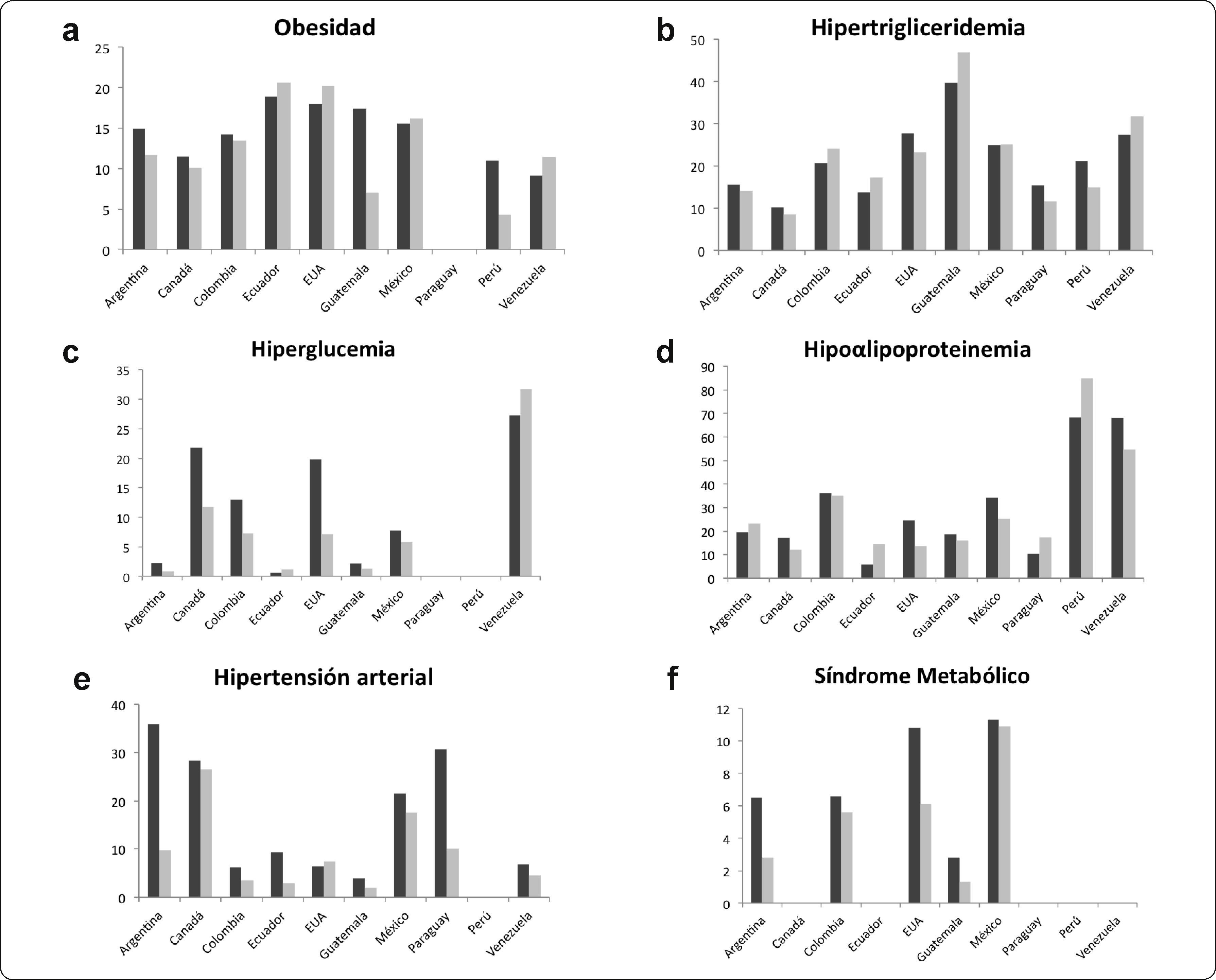
La comparación de los componentes de SM entre géneros fue realizada en 12 estudios. Los hombres presentaron mayores porcentajes del SM, HDL-C, hiperglucemia e hipertensión arterial (Figuras 2a-f). En 16 estudios se analizaron factores asociados con las variables metabólicas como son obesidad, antecedentes familiares, el lugar de residencia, peso al nacimiento y dieta. Sólo en 3 estudios se analizaron los datos por rango de edad (Tabla II).
Prevalencias (%) del SM y sus componentes en niños y adolescentes americanos clasificados por género: hombres (barras negras) y mujeres (barras grises). Los valores graficados corresponden a los valores reportados en los estudios analizados; excepto para países como Argentina, Brasil, Colombia y México donde se graficó el promedio de los valores reportados por lo estudios.
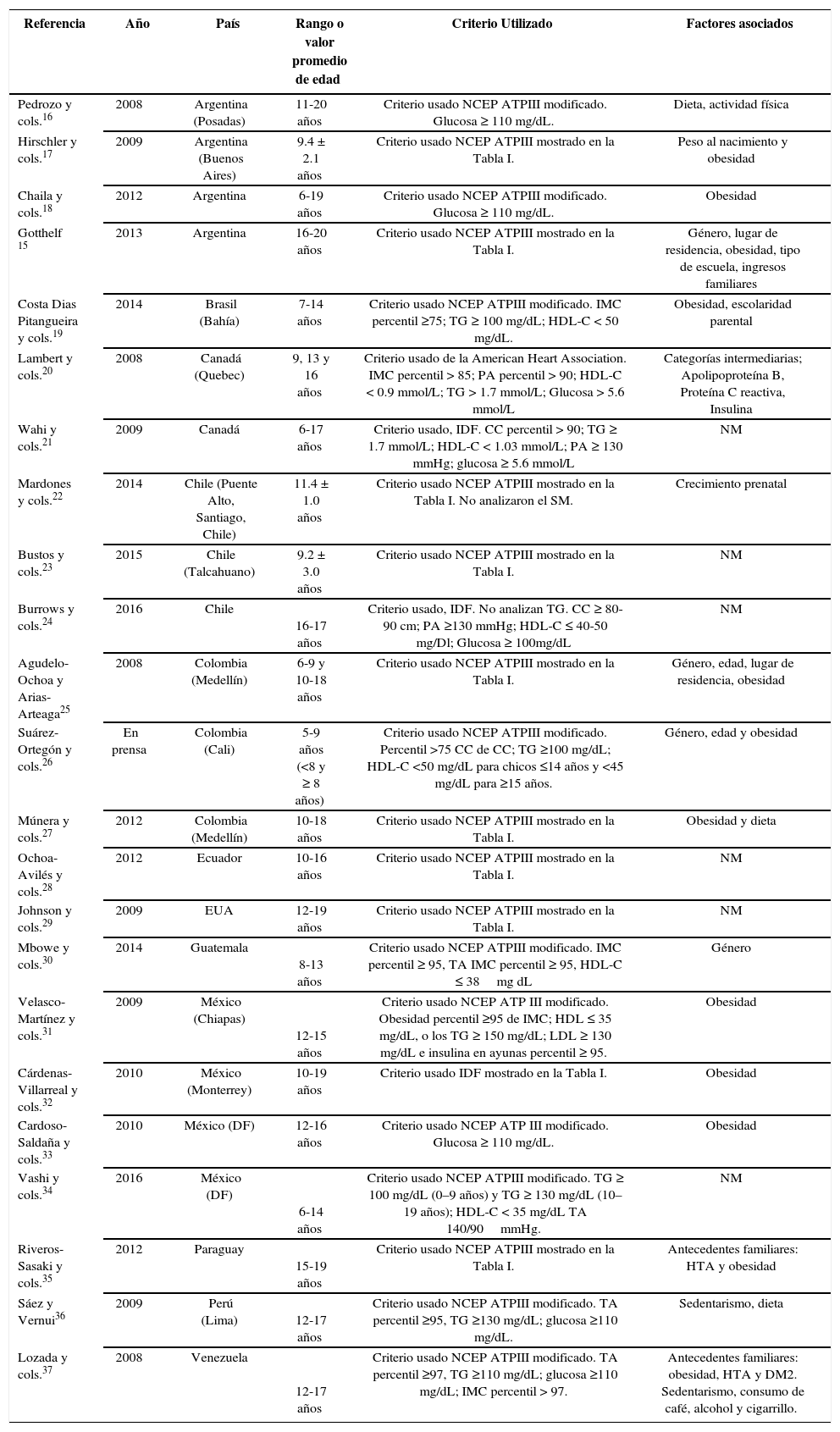
Criterios usados para el diagnóstico de SM en niños y adolescentes de América y los factores relacionados. Abreviaturas: índice de masa corporal, IMC; triglicéridos, TG; presión arterial, PA; circunferencia de cintura, CC; hipertensión, HTA; no mencionado en el artículo, NM.
| Referencia | Año | País | Rango o valor promedio de edad | Criterio Utilizado | Factores asociados |
|---|---|---|---|---|---|
| Pedrozo y cols.16 | 2008 | Argentina (Posadas) | 11-20 años | Criterio usado NCEP ATPIII modificado. Glucosa ≥ 110 mg/dL. | Dieta, actividad física |
| Hirschler y cols.17 | 2009 | Argentina (Buenos Aires) | 9.4 ± 2.1 años | Criterio usado NCEP ATPIII mostrado en la Tabla I. | Peso al nacimiento y obesidad |
| Chaila y cols.18 | 2012 | Argentina | 6-19 años | Criterio usado NCEP ATPIII modificado. Glucosa ≥ 110 mg/dL. | Obesidad |
| Gotthelf 15 | 2013 | Argentina | 16-20 años | Criterio usado NCEP ATPIII mostrado en la Tabla I. | Género, lugar de residencia, obesidad, tipo de escuela, ingresos familiares |
| Costa Dias Pitangueira y cols.19 | 2014 | Brasil (Bahía) | 7-14 años | Criterio usado NCEP ATPIII modificado. IMC percentil ≥75; TG ≥ 100 mg/dL; HDL-C < 50 mg/dL. | Obesidad, escolaridad parental |
| Lambert y cols.20 | 2008 | Canadá (Quebec) | 9, 13 y 16 años | Criterio usado de la American Heart Association. IMC percentil > 85; PA percentil > 90; HDL-C < 0.9 mmol/L; TG > 1.7 mmol/L; Glucosa > 5.6 mmol/L | Categorías intermediarias; Apolipoproteína B, Proteína C reactiva, Insulina |
| Wahi y cols.21 | 2009 | Canadá | 6-17 años | Criterio usado, IDF. CC percentil > 90; TG ≥ 1.7 mmol/L; HDL-C < 1.03 mmol/L; PA ≥ 130 mmHg; glucosa ≥ 5.6 mmol/L | NM |
| Mardones y cols.22 | 2014 | Chile (Puente Alto, Santiago, Chile) | 11.4 ± 1.0 años | Criterio usado NCEP ATPIII mostrado en la Tabla I. No analizaron el SM. | Crecimiento prenatal |
| Bustos y cols.23 | 2015 | Chile (Talcahuano) | 9.2 ± 3.0 años | Criterio usado NCEP ATPIII mostrado en la Tabla I. | NM |
| Burrows y cols.24 | 2016 | Chile | 16-17 años | Criterio usado, IDF. No analizan TG. CC ≥ 80-90 cm; PA ≥130 mmHg; HDL-C ≤ 40-50 mg/Dl; Glucosa ≥ 100mg/dL | NM |
| Agudelo-Ochoa y Arias-Arteaga25 | 2008 | Colombia (Medellín) | 6-9 y 10-18 años | Criterio usado NCEP ATPIII mostrado en la Tabla I. | Género, edad, lugar de residencia, obesidad |
| Suárez-Ortegón y cols.26 | En prensa | Colombia (Cali) | 5-9 años (<8 y ≥ 8 años) | Criterio usado NCEP ATPIII modificado. Percentil >75 CC de CC; TG ≥100 mg/dL; HDL-C <50 mg/dL para chicos ≤14 años y <45 mg/dL para ≥15 años. | Género, edad y obesidad |
| Múnera y cols.27 | 2012 | Colombia (Medellín) | 10-18 años | Criterio usado NCEP ATPIII mostrado en la Tabla I. | Obesidad y dieta |
| Ochoa-Avilés y cols.28 | 2012 | Ecuador | 10-16 años | Criterio usado NCEP ATPIII mostrado en la Tabla I. | NM |
| Johnson y cols.29 | 2009 | EUA | 12-19 años | Criterio usado NCEP ATPIII mostrado en la Tabla I. | NM |
| Mbowe y cols.30 | 2014 | Guatemala | 8-13 años | Criterio usado NCEP ATPIII modificado. IMC percentil ≥ 95, TA IMC percentil ≥ 95, HDL-C ≤ 38mg dL | Género |
| Velasco-Martínez y cols.31 | 2009 | México (Chiapas) | 12-15 años | Criterio usado NCEP ATP III modificado. Obesidad percentil ≥95 de IMC; HDL ≤ 35 mg/dL, o los TG ≥ 150 mg/dL; LDL ≥ 130 mg/dL e insulina en ayunas percentil ≥ 95. | Obesidad |
| Cárdenas-Villarreal y cols.32 | 2010 | México (Monterrey) | 10-19 años | Criterio usado IDF mostrado en la Tabla I. | Obesidad |
| Cardoso-Saldaña y cols.33 | 2010 | México (DF) | 12-16 años | Criterio usado NCEP ATP III modificado. Glucosa ≥ 110 mg/dL. | Obesidad |
| Vashi y cols.34 | 2016 | México (DF) | 6-14 años | Criterio usado NCEP ATPIII modificado. TG ≥ 100 mg/dL (0–9 años) y TG ≥ 130 mg/dL (10–19 años); HDL-C < 35 mg/dL TA 140/90mmHg. | NM |
| Riveros-Sasaki y cols.35 | 2012 | Paraguay | 15-19 años | Criterio usado NCEP ATPIII mostrado en la Tabla I. | Antecedentes familiares: HTA y obesidad |
| Sáez y Vernui36 | 2009 | Perú (Lima) | 12-17 años | Criterio usado NCEP ATPIII modificado. TA percentil ≥95, TG ≥130 mg/dL; glucosa ≥110 mg/dL. | Sedentarismo, dieta |
| Lozada y cols.37 | 2008 | Venezuela | 12-17 años | Criterio usado NCEP ATPIII modificado. TA percentil ≥97, TG ≥110 mg/dL; glucosa ≥110 mg/dL; IMC percentil > 97. | Antecedentes familiares: obesidad, HTA y DM2. Sedentarismo, consumo de café, alcohol y cigarrillo. |
Comparando las prevalencias del SM en niños y adolescentes de América, encontramos que existe una importante variabilidad entre los países, siendo las prevalencias menores del 6.0% para países como Argentina, Colombia, Guatemala, México y Paraguay. Mientras que las mayores prevalencias fueron para Brasil, Canadá y Venezuela (>12.0%). Esta variabilidad es encontrada también en países de otros continentes como es el caso de China con prevalencia del SM baja en niños de primaria con 3.5%38. Otro país es Turquía, donde se ha reportado una prevalencia del SM de 2.3% en adolescentes de 10-19 años39 o de 2.5-4.4% en niños de primaria y secundaria dependiendo del método de diagnóstico utilizado40. De igual manera, Irán tiene una prevalencia del SM de 5.3% en niños de 6 a 11 años41, de 6.5% en adolescentes entre 15 a 18 años42, y de 4.4% en adolescentes de 10-18 años43. Mientras que las prevalencias del SM altas han sido reportadas en países como Italia (niños y adolescentes de 6 a 14 años con 13.0%)44.
Las altas prevalencias del SM y sus componentes encontradas en niños y jóvenes del continente americano como ya se mencionó están relacionadas con cambios en la alimentación, estilo de vida, actividad física y nivel socioeconómico. A continuación haremos referencia a la importancia de cada factor.
Influencia del género. En lo que concierne a las diferencias entre hombres y mujeres, encontramos un patrón donde los hombres tuvieron mayores prevalencias del SM y de algunos de sus componentes como la hiperglucemia, la hipertensión arterial y el HDL-C bajo, particularmente en México, Canadá, Colombia y EUA. Otros autores también han reportado que los hombres tienen mayor prevalencia del SM que las mujeres45. Además, las adolescentes tienen mayores niveles de insulina que los varones46. Ésto podría ser útil para el control de la glucemia, aunque puede favorecer la resistencia a la insulina. Si bien las mujeres jóvenes suelen ser más sedentarias que los hombres, estos últimos fuman e ingieren más alcohol lo que favorece la presencia de alteraciones metabólicas45.
Dieta. La ingesta calórica alta y el mayor consumo de carbohidratos en los adolescentes son asociados con el aumento de triglicéridos y HDL-bajo47. La ingesta calórica alta, el bajo contenido vitamínico y mineral de los alimentos consumidos favorecen la aparición de alteraciones metabólicas a edad temprana. La deficiencia de vitaminas A y D, zinc (Zn), y magnesio (Mg) han sido un factor de riesgo asociado al SM y alteraciones metabólicas en niños y adolescentes38,48. Cambios en la dieta son particularmente importantes para muchos países de América latina, porque favorecen el sobrepeso y la obesidad. Por ejemplo, entre 1964 y 1996, se ha incrementado drásticamente el consumo de grasas. Así, la energía requerida en la dieta proveniente de grasas pasó del 16 a1 28% en Brasil, del 19 a1 24% en México y del 21 a1 24% en el Caribe. Respecto al colesterol disponible en la comida, éste aumentó casi tres veces en México y dos veces en Brasil49. El aumento en el consumo de bebidas azucaradas también es uno de los problemas en la transición alimentaria. En EUA y México, la mayor parte del azúcar de la dieta proviene de las bebidas azucaradas50, en EUA, entre el 55.0 al 70.0% de su consumo ocurre en el hogar y sólo del 7.0 al 15.0% en la escuela51. Respecto a la obesidad abdominal, alrededor del 17% de los adolescentes del continente americano presentan esta alteración, siendo un problema de salud pública que se ha incrementado de manera alarmante en las últimas décadas. Por ejemplo, en el periodo de 1980 a 2008, la prevalencia de obesidad general en adolescentes de EUA aumentó del 5 al 18%, existiendo grupos étnicos con cifras significativamente mayores. La obesidad general de los adolescentes varones con ascendencia hispana incrementó del 14.0 al 26.8% y en las mujeres del 13.4 al 17.4%52. En los países en desarrollo, las poblaciones con ingreso elevado tienden a presentar prevalencias de obesidad y sobrepeso más altas53. Esto es debido a que han adoptado estilos de vida comparables a las poblaciones de los países desarrollados, consumiendo más calorías en la dieta y realizando menos actividad física. Por su parte, en los países con bajos ingresos, la falta de acceso a las infraestructuras deportivas, educación, alimentación adecuada y recursos que les permitan reducir el riesgo de ganar peso y sus consecuencias metabólicas agrava la situación54. Aunado a la dieta, las actitudes y estilos de alimentación son importantes. Por ejemplo, los franceses, en comparación con los estadounidenses, consumen frecuentemente productos frescos, planean la comida y su preparación, comen juntos, comen menos y más lentamente55, reflejándose en menor peso corporal y dislipidemias.
Actividad física. La actividad física moderada y vigorosa evita el desarrollo del SM, incluso más que la reducción calórica56. Considerando este factor, los niños y adolescentes americanos tienen poca actividad física como lo muestran algunos estudios. En Canadá, menos del 10.0% de los jóvenes y niños siguen la recomendación de realizar al menos 60 minutos de actividad física al día57. En los EUA, en el año 2006, se reportó que el 61.5% de los adolescentes entre 9 a 13 años de edad participaban en actividades físicas fuera de la escuela58. En el año 2008, en las escuelas públicas mexicanas, se reportó que sólo un tercio de los jóvenes (28.0%) cumplen con los requisitos de actividad física59. Por su parte, en países europeos, los varones de 12.5 a 17.5 años de edad hacen en promedio 70 minutos de actividad moderada a vigorosa a la semana vs. las mujeres que realizan 50 minutos. Por ello, más del 55.0% de los varones cumplen con las recomendaciones de 60 minutos de actividad física moderada a vigorosa al día vs. el 25.0% de las mujeres. Así, se ha mostrado que varones con índice de masa corporal (IMC) alto realizan menos actividad física60. La cultura es un factor decisivo en la realización de actividad física. Por ejemplo, los franceses dedican más tiempo a caminar (1.6% de su tiempo) que los estadounidenses (0.6% de su tiempo). Los estadounidenses tienden a preferir los deportes de intensidad elevada, lo que trae consigo mayor probabilidad de lesiones y periodos de sedentarismo prolongados55.
Antecedentes familiares, peso al nacimiento y hábitos familiares. La hiperglucemia y la hipertensión tienen una clara relación con la herencia genética de los individuos61,62. La presión arterial y la hiperglicemia, así como las dislipidemias también dependen del peso al nacimiento, que refleja como fue el desarrollo intrauterino de los individuos. Así, un peso al nacimiento alto o bajo se consideran factores de riesgo para el desarrollo del SM en la niñez y la adolescencia. El peso al nacimiento puede correlacionarse con la presión diastólica, glucosa sérica, lipoproteína de baja densidad (LDL-C), obesidad y HDL-C63. La obesidad y las dislipidemias también dependen del entorno familiar en el que vive un individuo. Esto es importante particularmente en los niños y jóvenes, los cuales son cautivos de los hábitos de alimentación y actividad física que realizan sus padres1.
Esta revisión, tuvo algunas limitaciones como lo es la carencia de datos específicos por grupos de edad, las diferencias en los criterios metodológicos para medir el SM y sus componentes, y la disparidad en la representatividad de las muestras poblacionales estudiadas, lo que dificultó poder profundizar en el análisis comparativo entre las prevalencias de las enfermedades metabólicas en jóvenes de las distintas regiones y países de América. Desafortunadamente, los estudios incluidos en esta revisión no coincidieron con las edades analizadas ni con los criterios para considerar infancia y adolescencia. Muchos de ellos incluso analizaron niños y adolescentes como un solo grupo, lo que dificulta dilucidar el impacto de las hormonas sexuales en la aparición de los componentes del SM. En cierta medida, parte de esta confusión se debe a los criterios utilizados en el diagnóstico del SM, los cuales están basados en lo que ocurre en adultos y no en estudios pediátricos2, sin embargo, a pesar de las limitaciones, el análisis realizado nos permitió evaluar la prevalencia del SM y sus componentes en los países del continente americano y compararlos con países de otros continentes. Esto podría ayudar a resaltar la importancia de implementar políticas públicas diferenciadas a la cultura y origen que permitan promover la salud y el bienestar de las poblaciones de jóvenes americanos. Para ello, se requiere facilitar el acceso a alimentos saludables y a un costo accesible, así como a la infraestructura deportiva que incentive la adopción de un estilo de vida saludable. Al mismo tiempo, esta revisión apoya la necesidad de realizar estudios epidemiológicos en niños y adolescentes específicos para cada edad, y criterios de diagnóstico del SM y sus componentes más claros.
CONCLUSIONESEl presente artículo muestra que la prevalencia del SM y sus componentes en diversos países del continente americano es variable, dependiendo de cada país. Hay países con prevalencias pequeñas, pero hay otros con prevalencias altas. Esta variabilidad también es observada en países de otros continentes, por lo que posiblemente se deba a la diferencia en los hábitos alimenticios y cuidados de la salud que cada país tiene, pero también podría depender de la diversidad de criterios utilizados en el diagnóstico y puntos de corte para los componentes del SM. Por lo que la presente revisión permite observar la falta de consenso entre los investigadores y las instituciones responsables de establecer los criterios de detección.
Este estudio forma parte del Programa de Salud promovido por la Estación Científica La Maliche, Universidad Nacional Autónoma de México-Universidad Autónoma de Tlaxcala. Los autores agradecen la excelente asistencia de Laura García.