Agresión y efectos condicionados en el síndrome de abstinencia a los opiáceos
Aggression and effects conditioned by the opiate abstinence syndrome
RODRIGUEZ-ARIAS, M.; AGUILAR CALPE, M.a A., y MIÑARRO LOPEZ, J.
Áera de Psicobiología. Facultad de Psicología. Universitat de Valencia. Valencia.
Correspondencia:
Dr. J. MIÑARRO LÓPEZ.
Área de Psicobiología.
Facultad de Psicología.
Universitat de Valencia.
Avda. Blasco Ibáñez, 21.
346010 Valencia.
e-mail: Jose.Minarro©uv.es
RESUMEN: Objetivo: en el presente trabajo se estudió el efecto que sobre las conductas agonísticas producia la abstinencia a la morfina en ratones macho, tratándose de determinar en un segundo estudio si el ambiente asociado con la abstinencia a la morfina afectaba a las conductas agresivas.
Material y métodos: se estudió la aparición de conductas agresivas en ratones que se encontraban en abstinencia tanto espontánea como inducida por naloxona (1 mg/kg). En el segundo estudio los animales experimentaron tresabstinencias en uno de dos ambientes diferentes (A o B) y 15 días después, cuando los animales estuvieron completamente libres de droga, se llevó a cabo un test de agresion en el ambiente A.
Resultados: todos los animales que sufrieron abstinencia presentaron un incremento significativo en las conductas de ataque y amenaza, no observándose diferencias en la intensidad de la agresión entre los grupos. Adicionalmente, la experiencia de 3 abstinencias a la morfina inducidas por naloxona producía un incremento significativo de la agresion, no observándose, sin embargo, que este incremento fuera dependiente del contexto.
Conclusiones: la abstinencia a la morfina produce un incremento significativo de las conductas agresivas, observable incluso en animales postdependientes.
PALABRAS CLAVE: Abstinencia a la morfina. Agresión. Condicionamiento ambiental. Ratones.
ABSTRACT: Objective: in the present work, the effect of morphine withdrawal on agonistic behaviour was evaluated in male mice and in a second experiment, the relationship between a context associated with naloxone-induced morphine withdrawal and aggressive behaviours was studied.
Material and methods: aggression was evaluated in two different circumstances: during either spontaneous or naloxone-induced withdrawal (1 mg/kg). In the second study, animals experimented three withdrawals in one of two different environments (A or B) and 15 days afterwards, when the animals were completely drug-free, an aggression test was carried out in environment A.
Results: all withdrawn animals presented an increase in attack and threat behaviours, but no differences in the intensity of aggression were observed between groups. Additionally, experience of three naloxone induced morphine withdrawals produced a significant, non context-dependent increase in aggression.
Conclusions: morphine withdrawal produces an increase in aggressive behaviours even in post-dependent animals.
KEY WORDS: Morphine withdrawal. Aggression. Context conditioning. Mice.
Introducción
La adicción es un patrón conductual de abuso de una sustancia, caracterizado por una necesidad muy intensa de su consumo que sólo se frena con su ingesta (uso compulsivo). La obtención y búsqueda de la sustancia de abuso se convierte en el principal objetivo, y en muchos casos si se produce una interrupción en su aporte se desencadena un síndrome de abstinencia.
El síndrome de abstinencia a la morfina puede ser definido como un conjunto de signos y síntomas generales que se producen en animales dependientes de morfina por la privación de la droga o bien por la inducción farmacológica mediante la administración de antagonistas opiáceos. Se caracteriza por la aparición de una serie de síntomas somáticos (temblor, diarrea, sudoración, etc.) y otros conductuales, tales como un incremento de las conductas agonísticas y motoras1, asociándose componentes emocionales tales como la irritabilidad y la disforia2. La mayoría de los narcóticos opiáceos, entre ellos la morfina, muestran una intensidad máxima de los signos generales de la retirada entre 24 y 72 horas después de la última administración3-5.
La abstinencia precipitada con la administración de naloxona es normalmente más dramática e intensa que la espontánea y está limitada a la duración de la actividad del antagonista6. En roedores dependientes la administración de naloxona induce un síndrome de abstinencia en pocos minutos (de 3 a 5), apareciendo rápidamente los primeros síntomas, los cuales van intensificándose progresivamente hasta alcanzar un pico máximo hacia los 30 minutos7. Posteriormente inician un descenso lento y constante, hasta los 120 minutos en que reaparece el efecto de la morfina, al tener ésta una vida media mayor que la naloxona8.
Existen datos que apoyan la existencia de una doble vía en la expresión de los síntomas físicos y motivacionales en el síndrome de abstinencia a los opiáceos (9). El locus coeruleus y la sustancia gris periacueductal juegan un papel importante en la aparición y desarrollo de los síntomas físicos de abstinencia10-13. En lo relativo a los síntomas motivacionales las estructuras anatómicas más destacadas en el desarrollo de la abstinencia a opiáceos son el N. Acc. y el ATV6,14,15.
La agresión espontánea exhibida en la abstinencia a la morfina es un efecto específico de este narcótico y no se han encontrado resultados similares en el tratamiento crónico con barbitúricos, anfetaminas o haloperidol16. Estudios previos realizados en nuestro laboratorio han puesto de manifiesto que una dosis de 2,5 mg/kg/día de morfina durante 14 días provoca un aumento significativo de la conducta agresiva ya a las 24 horas de abstinencia, alcanzando valores máximos a las 48 horas5. Durante la retirada de morfina los roedores adquieren la posición de boxeador, listos en todo momento para iniciar la lucha y con el único requisito necesario para hacerlo de la presencia de un oponente. Durante el encuentro agonístico éstos emiten vocalizaciones y demuestran un «ensañamiento» con su coespecífico, al que ocasionan lesiones importantes. Siendo interesante señalar que la posición de sumisión adoptada por el animal subordinado no conduce, como es habitual, a una reducción de la hostilidad hacia él expresada5. Los efectos motores durante la abstinencia han sido relacionados con un aumento en la liberación de dopamina a nivel del estriado17, el N. Acc.18 y el ATV19. Sin embargo, el aumento de la conducta agonística no se ha relacionado con alteraciones de los sistemas de neurotransmisión en ninguna de estas estructuras.
Diversos estudios han observado que los síntomas de abstinencia asociados a un estímulo contextual pueden ocurrir incluso en personas que están sin consumir opiáceos (abstinentes) durante mucho tiempo20, 21 debido a un posible condicionamiento de estas situaciones. En ratas y en humanos estímulos ambientales asociados con la ausencia de opiáceos actúan como un estímulo condicionado Pauloviano, provocando respuestas condicionadas de abstinencia22 que pueden tener significados motivacionales en la dependencia a la droga23, 24.
En voluntarios mantenidos con metadona, una abstinencia precipitada por naloxona, se emparejó con la presentación de un tono o un olor condicionado durante 12 ensayos. Tras esto se observó una reacción de abstinencia tras la presentación del estímulo condicionado, en este caso apareado con una inyección de salino20. La abstinencia condicionada también ha sido observada en animales de laboratorio 30 días después de haber quitado el pellet de morfina. La repetida exposición a un estímulo condicionado en ausencia de abstinencia inducida por naloxona sirve para extinguir una abstinencia condicionada22, 25-27.
La abstinencia condicionada puede también ser observada en las respuestas motivacionales de la abstinencia. Animales inyectados con salino presentan más signos de abstinencia cuando éste se administra en un ambiente asociado con síntomas de abstinencia previos25, 28. La habilidad de la naloxona para alterar la respuesta operante en ratas morfino-dependientes puede ser condicionada clásicamente, aunque una inyección de naloxona sola sea incapaz de provocar una respuesta de abstinencia en ratas postdependientes29. Del mismo modo utilizando el paradigma de aversión condicionada, que asemeja en cierta medida la situación clínica de la abstinencia condicionada, la inyección de un antagonista opiáceo en diferentes áreas cerebrales de ratas morfino-dependientes produce la aversión del ambiente asociado a una sola inyección1.
En el presente trabajo se pretende observar si la abstinencia a la morfina induce un incremento en la agresión, y más concretamente si esta agresión es diferente en cuanto a su intensidad o forma de presentación en función del tipo de abstinencia espontánea o inducida por naloxona. Igualmente se intentó determinar si un ambiente asociado con la abstinencia a la morfina inducida por naloxona afectaba a las conductas agresivas o sociales en ratones postdependientes. Para ello ratones dependientes de la morfina experimentaron 3 abstinencias en 1 de 2 ambientes diferentes (A o B) y 15 días después, cuando los animales estuvieron completamente libres de droga, se llevó a cabo un test de agresión en el ambiente A.
Material y métodos
Los datos presentados en este trabajo están basados en diversos experimentos realizados en nuestro laboratorio que han estudiado la relación entre la conducta agresiva y el síndrome de abstinencia a la morfina30, 31.
Sujetos
Se utilizaron un total de 240 ratones albinos macho de la cepa OF.1 de 42 días de edad a su llegada al laboratorio (laboratorios Criffa, Barcelona). Los animales fueron alojados bajo condiciones estándar de laboratorio: temperatura constante (21° C), ciclo de luz invertido (luz blanca apagada de 7:30 a 19:30 h) y comida y agua disponibles ad libitum, excepto durante los test conductuales. La mitad de ellos, 60 en cada uno de los experimentos, fueron alojados individualmente en cajas de plástico transparentes (24 * 13,5 * 13 cm) y empleados como animales experimentales. Los restantes fueron alojados en grupos de 5 para ser usados como oponentes estándar, siendo anosmiados temporalmente por un lavado intranasal con sulfato de zinc al 4% el día antes del test32. Este tipo de oponente fue usado porque es capaz de provocar ataque, pero nunca inicia tal conducta, ya que no puede percibir las feromonas presentes en la orina de los animales experimentales, lo cual es considerado la clave para inducir la conducta agresiva en ratones con un sentido normal del olfato33, 34.
Los animales utilizados en el presente estudio lo han sido de acuerdo con las leyes y regulaciones locales, regionales y nacionales. El procedimiento usado es equivalente a los recomendados por los documentos Policy on Human Care and Use of Laboratory Animals (USPHS) y Guide for the Care and Use of Laboratory Animals (NIH), ambos de EE. UU.
Procedimiento
Fármacos
En este experimento se han utilizado clorhidrato de morfina, 2,5 mg/kg (laboratorios Alcaliber, Toledo), naloxona clorhydrate, 1 mg/kg (Abelló, Madrid) y suero fisiológico (NaCl 0,9%). Los fármacos se diluyeron en suero fisiológico (0,1 mg/ml) y fueron administrados intraperitonealmente. El volumen de inyección fue proporcional al peso del ratón (1 ml de disolución por 100 g de peso).
Inducción de la dependencia a la morfina
En el primer experimento, tras los 28 días de aislamiento y durante los siguientes 14 días, en 2 de los grupos (n = 15) se indujo la dependencia a la morfina por la inyección diaria (8:00) de 2,5 mg/kg de morfina. Una vez establecida la dependencia, un grupo sufrió una abstinencia de 48 h, recibiendo una inyección de suero fisiológico en el segundo día (MOR/V). El último día de administración de morfina, el otro grupo recibió una inyección de naloxona (MOR/Nal). Los 2 grupos de ratones controles recibieron 14 inyecciones de suero fisiológico. El último día un grupo recibió suero fisiológico (V/V) y el otro una inyección de naloxona (V/Nal).
En el experimento de condicionamiento los animales experimentales fueron aleatoriamente distribuidos en 6 grupos de 10 animales cada uno. Durante el tratamiento crónico, 3 de los grupos recibieron suero fisiológico durante todo el proceso y la dependencia a la morfina se indujo en los otros 3 grupos mediante la inyección intraperitoneal de dosis crecientes de morfina (15, 30 y 60 mg/kg) 2 veces al día (9:00 y 20:00) durante 3 días. Desde el cuarto día en adelante, los animales recibieron la dosis más alta de morfina durante seis días más.
Procedimiento de condicionamiento
En el segundo experimento, el proceso de condicionamiento comenzó el cuarto día (tratamiento agudo) empleando dos ambientes diferentes: A, una caja de metacrilato transparente, con serrín, luz blanca y sin ruido de fondo; y B, una caja de cartón, sin serrín, sin luz y con sonido de fondo (metrónomo). Durante estos 6 días e inmediatamente después de la inyección de naloxona (1 mg/kg) o salino los animales se introdujeron alternativamente en cada ambiente durante 20 minutos. Durante este proceso de condicionamiento, la morfina fue administrada con el mismo horario, por tanto la inyección de naloxona o salino ocurría siempre tras la dosis de morfina de las 9:00 h. Los grupos se constituyeron de la siguiente forma: un grupo control, S-SaSb (S: animales que reciben suero fisiológico durante todo el tratamiento crónico; Sa: administración de salino en el ambiente A; Sb: administración de salino en el ambiente B; y cinco grupos experimentales, S-NaSb (Na: administración de naloxona en ambiente A), S-SaNb, M-SaSb (M: animales que reciben morfina durante todo el tratamiento crónico), M-NaSb y M-SaNb.
El proceso de condicionamiento se diseñó de forma que el último día en los grupos apropiados se administró naloxona. Al final del proceso de condicionamiento se suspendió la administración de morfina y los animales permanecieron libres de cualquier tratamiento durante 15 días. Tras este período se llevó a cabo el test de agresión en el ambiente A.
Encuentros sociales
La conducta del ratón se evaluó 30 minutos después de la última inyección (vehículo o neuroléptico) en el caso del primer experimento, y a los 15 días de la última inyección en el experimento de condicionamiento. Durante 10 minutos un animal experimental y un oponente estándar se enfrentan en un área neutral. Todos los test se llevaron a cabo con luz blanca entre la segunda y la quinta hora de la fase de oscuridad. Antes del encuentro los animales tuvieron un minuto de adaptación separados por medio de una barrera de plástico.
Análisis conductual
Las cintas de los encuentros fueron analizadas usando un ordenador (PC) y un programa (Brain et al, 1989) que facilita la estimación de los tiempos distribuidos en 11 categorías de conducta. Cada categoría incluye una serie de diferentes posturas y elementos. En el presente trabajo sólo se mencionaran los resultados referidos a las conductas agresivas y motoras, por tanto las conductas presentadas serán: amenaza, ataque e inmovilidad. Una descripción más detallada de estas categorías conductuales puede ser encontrada en Brain et al (1989) y Rodríguez-Arias et al (1998). Adicionalmente la latencia de ataque también fue evaluada.
Análisis estadístico
En el primer experimento las diferencias entre el ve-hículo y los grupos experimentales fueron analizadas utilizando el test de doble cola de la U de Mann-Whitney. En el segundo experimento se realizó en primer lugar el test no paramétrico de Kruskal-Wallis para evaluar la varianza de las medidas conductuales utilizando la media de los tiempos de cada categoría conductual. Posteriormente se llevaron a cabo comparaciones post-hoc para contrastar la conducta de los diferentes grupos de tratamiento.
Resultados
Agresión inducida por el síndrome de abstinencia a la morfina
En la tabla I se muestran las medianas (con rangos) de los tiempos acumulados en las categorías conductuales estudiadas. El tiempo empleado en amenaza y ataque se incrementó significativamente durante la abstinencia espontánea a la morfina (MOR/V frente a V/V, amenaza p < 0,002 y ataque p < 0,02), así como también en la abstinencia inducida (MOR/Nal frente a V/Nal, p < 0,002). La latencia de ataque sólo disminuyó significativamente en la abstinencia inducida a la morfina (MOR/Nal frente a V/Nal, p < 0,002).
Tabla I. Tiempo acumulado en segundos (medianas y rangos) en las diferentes categorías conducturales para los grupos V/V (vehículo/vehículo), MOR/V (morfina/vehículo), V/Nal (vehículo/naloxona) y MOR/Nal (morfina/naloxona). | ||||
| V/V | MOR/V | V/Nal | MOR/Nal | |
| Amenaza | 56 | 122* | 33 | 125** |
| (0-89) | (58-171) | (0-80) | (96-180) | |
| Ataque | 35 | 70* | 34 | 85** |
| (0-81) | (8-151) | (0-73) | (47-145) | |
| Inmovilidad | 0 | 0 | 0 | 0 |
| (0-9) | (0-3) | (0-5) | (0-4) | |
| Latencia de | 197 | 93 | 285 | 73** |
| ataque | (62-600) | (12-600) | (56-600) | (6-280) |
| Diferencias con respecto a su correspondiente grupo control con el test «U» de Mann-Whitney: * p < 0,02. ** p < 0,002. | ||||
Los niveles de agresión observados en los 2 grupos vehículos son similares, presentando medias comparables en ataque y amenaza. Este hecho sugiere que el nivel de agresión no se afecta por la administración de 1 mg/kg de naloxona. El nivel de agresión producido por la abstinencia espontánea o inducida por naloxona también fue similar, mostrando ambos grupos (MOR/V y MOR/Nal) un incremento significativo de las conductas agresivas comparado con los vehículos. Además sólo en estos grupos se observaron signos físicos de abstinencia como piloerección o temblor de patas.
Por último, ningún tipo de abstinencia a opiáceos estudiada afecta al tiempo que los animales pasan en la conducta de inmovilidad.
Efecto del condicionamiento ambiental en la agresión inducida por la abstinencia a la morfina
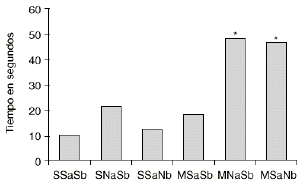
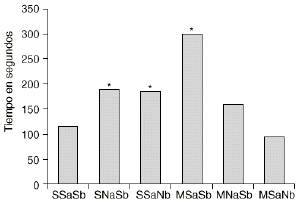
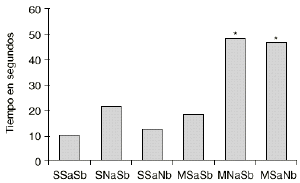
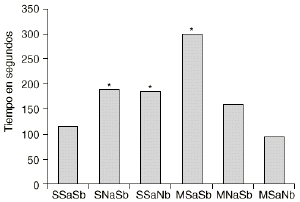
En las figuras 1 y 2 se detallan las medias de los tiempos acumulados en las categorías conductuales de ataque y latencia de ataque. Los 2 grupos de animales que sufren una abstinencia a la morfina inducida por naloxona (M-NaSb y M-SaNb) muestran un incremento significativo del tiempo dedicado a la conducta de ataque con respecto a los controles (S-SaSb) y al grupo S-SaNb (p < 0,005 y p < 0,01, respectivamente). El grupo control (S-SaSb) y el M-SaNb presentan una latencia de ataque más corta que los otros 2 grupos salinos (S-NaSb y S-SaNb) y que el grupo M-SaSb (p < 0,05). Igualmente los animales M-NaSb atacan más rápidamente que el grupo M-SaSb (p < 0,02).
Figura 1. Efecto del condicionamiento ambiental en la agresión inducida por la abstinencia a la morfina. Medias del tiempo empleado en la conducta de ataque Ataque por los grupos SSaSb (salino en tratamiento crónico, salino en ambiente A y salino en ambiente B), SNaSb (salino en tratamiento crónico, naloxona en ambiente A y salino en ambiente B), SSaNb (salino en tratamiento crónico, salino en ambiente A y naloxona en ambiente B), MSaSb (morfina en tratamiento crónico, salino en ambiente A y salino en ambiente B), MNaSb (morfina en tratamiento crónico, naloxona en ambiente A y salino en ambiente B) y MSaNb (morfina en tratamiento crónico, salino en ambiente A y naloxona en ambiente B). Diferencias con respecto al grupo SSaSb en el análisis post-hoc (*) p < 0,005.
Figura 2. Efecto del condicionamiento ambiental en la agresión inducida por la abstinencia a la morfina. Medias del tiempo empleado en realizar el primer ataque (latencia de ataque) por los grupos SSaSb (salino en tratamiento crónico, salino en ambiente A y salino en ambiente B), SNaSb (salino en tratamiento crónico, naloxona en ambiente A y salino en ambiente B), SSaNb (salino en tratamiento crónico, salino en ambiente A y naloxona en ambiente B), MSaSb (morfina en tratamiento crónico, salino en ambiente A y salino en ambiente B), MNaSb (morfina en tratamiento crónico, naloxona en ambiente A y salino en ambiente B) y MSaNb (morfina en tratamiento crónico, salino en ambiente A y naloxona en ambiente B). Diferencias con respecto al grupo SSaSb en el análisis post-hoc (*) p < 0,05.
Discusión
En primer lugar en este trabajo hemos constatado que la abstinencia a la morfina espontánea o inducida por naloxona produce un incremento en las conductas agresivas. Ambos grupos en abstinencia presentaron un incremento significativo de amenaza y ataque comparado con los vehículos. Podemos, por tanto, sugerir que la abstinencia a la morfina produce un estado de agresividad que sólo podría ser atribuido a la abstinencia al opiáceo. Al no observarse diferencias entre los grupos vehículo de abstinencia natural (MOR/V) y espontánea (MOR/Nal) también podemos afirmar que la intensidad de la agresión no parece estar influida por el mecanismo de producción de la abstinencia a la morfina. Nuestros resultados ponen de manifiesto que aunque existan marcadas diferencias entre estos 2 tipos de abstinencia, la agresión observada es similar en ambos casos.
La abstinencia inducida por naloxona presenta marcadas diferencias con respecto a la espontánea. La primera es más desadaptativa35 y no existe unanimidad con respecto a los cambios producidos en el sistema dopaminérgico tras la abstinencia inducida por naloxona36,37. El sistema dopaminérgico mesolímbico juega un papel importante en los estados disfóricos asociados con la abstinencia a la morfina37, y numerosos estudios14,38-41 han encontrado una disminución de los niveles extracelulares de la DA en diversas áreas del sistema mesolímbico, fundamentalmente en el N. Acc, durante la abstinencia espontánea a la morfina. Aunque muchos autores también han observado esta disminución durante la abstinencia inducida por naloxona14,42-44, otros no han obtenido estos resultados12,36.
Es bien sabido que los antagonistas dopaminérgicos típicos como el haloperidol disminuyen marcadamente las conductas agonísticas8,35,43,45-49, observándose también en algunos estudios que estos antagonistas disminuyen marcadamente la agresión inducida por la abstinencia a la morfina16,50. Sin embargo, en otros trabajos se ha observado que estos fármacos incrementan los síntomas de abstinencia inducida por naloxona15,51 o no la afectan52. En un reciente trabajo realizado en nuestro laboratorio30 hemos constatado que 3 antagonistas DA (SCH 23390, haloperidol y raclopride) contrarrestan el incremento de agresión inducido por la abstinencia, tanto espontánea como inducida, a la morfina. Sin embargo, el efecto del SCH 23390 y del haloperidol fue más potente cuando la abstinencia se producía por la inyección de naloxona, lo cual parece sugerir que la forma en que se produce la abstinencia a la morfina puede modular de forma diferente al sistema dopaminérgico, ya que en la inducida por naloxona se potencia el efecto antiagresivo de los neurolépticos que bloquean al receptor dopaminérgico D1, no ocurriendo lo mismo en la abstinencia espontánea.
Una vez estudiada la aparición de agresión en el síndrome de abstinencia a la morfina, en un segundo estudio se intentó esclarecer si esta conducta podía ser condicionada clásicamente. Se ha observado un incremento de las conductas agresivas en ratones postdependientes (libres de morfina) 15 días después del último ensayo de condicionamiento. El ataque se incrementó significativamente en los animales que sufrieron 3 abstinencias independientemente del lu-gar donde ellas ocurrieron. Los grupos M-NaSb y M-SaNb presentaron 48 y 45 segundos, respectivamente, en conducta de ataque, significativamente más alto que los 20 segundos presentados por el grupo M-SaSb que puede ser considerado como su control. De acuerdo con estudios previos, en el primer estudio se ha establecido que un incremento en la conducta agresiva se presenta durante la abstinencia aguda a la morfina30,50,53. En el presente trabajo mostramos que este estado puede también ser producido cuando los animales están abstinentes de morfina. Es decir, la experiencia de tres abstinencias inducidas por naloxona produce un incremento a largo plazo de las reacciones agresivas en ratones postdependientes.
Otros autores han observado abstinencia condicionada al contexto a los signos físicos25, 28 y también a los aspectos motivacionales de la abstinencia a la morfina, tales como el deterioro de la respuesta operante 29. Sin embargo, el presente estudio no demuestra una abstinencia condicionada al contexto en el incremento de la agresión observada en ratones post-dependientes, ya que los animales que sufren la abstinencia inducida por naloxona en el mismo ambiente en el cual tiene lugar el test de agresión (grupo M-NaSb) presentan un tiempo similar en la conducta de ataque que el grupo M-SaNb, que sufre las abstinencias en un ambiente diferente. Como consecuencia no se ha observado una agresión inducida por abstinencia condicionada. El hecho de que el incremento en la agresión se observe sólo en los animales que han sufrido abstinencia inducida por naloxona indica que este tipo de abstinencia induce un incremento general, no específico del contexto, de la agresión en ratones postdependientes. Por el contrario, la abstinencia espontánea no parece afectar al nivel de agresión ya que los animales que pertenecen al grupo M-SaSb sufren este tipo de abstinencia sin desarrollar ningún incremento en sus conductas de amenaza o ataque. Este hecho podría explicarse por diversas circunstancias, en primer lugar, este tipo de abstinencia es menos desadaptativa o sería para los animales30; en segundo lugar, los animales solo sufren una abstinencia espontánea, no 3 como en el caso de la inducida por naloxona, y finalmente el período de desintoxicación podría ser demasiado largo para detectar los efectos de este tipo de abstinencia. Por tanto, el papel de la abstinencia espontánea no parece ser relevante en la explicación del alto nivel de agresión exhibido por los ratones de los grupos M-NaSb y M-SaNb. De estos resultados podemos sugerir que la experiencia de la abstinencia inducida por naloxona es el factor determinante de la agresión más elevada observada en estos ratones postdependientes.
En conclusión, el presente trabajo ofrece una clara evidencia de que la abstinencia a la morfina induce un estado específico de agresión, independientemente de cómo se ha producido ésta. La agresión observada es de intensidad similar tanto en la abstinencia espontánea como en la inducida por naloxona. Nuestros resultados también han mostrado que la abstinencia a opiáceos inducida por naloxona produce un incremento en las conductas agresivas no dependiente del ambiente, ya que en nuestras condiciones experimentales el impacto de la dependencia a la morfina y de las 3 abstinencias inducidas es tan profundo que modifica intensamente la conducta de los animales de tal forma que el ambiente no puede ser discriminativo.
Bibliografía
1. Altman J, Everitt R J, Glautier S, Markou A, Nutt D, Oretti R, Phillips GD, Robbins TW. The biological, social and clinical bases of drug addiction: Commentary and debate. Psychopharmacology 1996;125:285-345.
2. Martin del Campo AF, Dowson J, Herbert J, Paykel ES. Effects of naloxone on diurnal rhythms in mood and endocrine function: a dose response study in man. Psychopharmacology 1994;114:583-90.
3. Gianutsos G, Drawbaugh RB, Hynes MD, Lal H. Methods in narcotic research. New York: Decker; 1975. p. 293-309.
4. Kantak KM, Miczek KA. Social, motor and autonomic signs of morphine withdrawal: diferential sensitivities to catecholaminergic drugs. Psychopharmacology 1988; 96:468-76.
5. Espert R. Efectos de la retirada de morfina sobre la conducta agonística en ratones macho. Tesis doctoral. Universidad de Málaga; 1991.
6. Stinus L, Le Moal M, Koob GF. Nucleus accumbens and amygdala are possible substrates for the aversive stimulus effects of opiate withdrawal. Neuroscience 1990;37:767-73.
7. Schnur P. Acute morphine dependence in the hamster. Pharmacol. Biochem. Behav 1991;38:711-3.
8. Strain EC, Preston KL, Liebson IA, Bigelow GE. Precipitated withdrawal by pentazocine in methadone maintained volunteers. J Pharmacol Exp Ther 1993;267:624-34.
9. Bozath MA, Wise RA. Neural substrates of opiate reinforcement. Prog Neuro-Psychoph Biol Psychiat 1983;7:569-73.
10. Maldonado R. Stinus L, Gold L, Koob GF. Role of different brain structures in the expression of the physical morphine withdrawal syndrome. J Pharmacol Exp Ther 1992;261:669-77.
11. Harris GC, Williams JT. Sensitization of locus coeruleus neurons during withdrawal from chronic stimulants and antidepresants. J. Pharmacol Exp Ther 1992; 261:476-83.
12. Silverstone PH, Done C, Sharp T. In vivo monoamine release during naloxone-precipitated morphine withdrawal. Neuro Report 1993;4: 1043-5.
13. Cappendijk S, De Vries R, Dzoljic M. Excitatory amino acid receptor antagonists and naloxone-precipitated withdrawal syndrome in mor-phine-dependent mice. Eur. Neuropsychopharmacol. 1993; 3: 111-116.
14. Koob GF, Maldonado R, Stinus L. Neural substrates of opiate withdrawal. Trend. Neurosci 1992;15:186-91.
15. Harris GC, Aston-Jones G. Involvement of D2 dopamine receptors in the nucleus accumbens in the opiate withdrawal syndrome. Nature 1994;371:155-7.
16. Gianutsos G, Lal H. Narcotic analgesics and aggression. Mod Probl Pharmacopsychiatry 1978;13:114-38.
17. Iwamoto E, Ho IK, Way L. Elevation of dopamine during naloxone-precipitated withdrawal in morphine dependent mice and rats. J Pharmacol Exp Ther 1993;187:558-67.
18. Joyce EM, Iversen SD. The effect of morphine applied locally to mesencephalic dopamine cell bodies on spontaneous motor activity in the rat. Neurosci. Lett. 1979; 14: 207-212.
19. Latimer LG, Duffy P, Kalivas PW. µ opioid receptor involvement in enkephalin activation of dopamine neurons in ventral tegmental area. J Pharmacol Exp Ther 1987;241:328-37.
20. O''Brien CP, Testa T, O''Brien J, Brady JP, Wells B. Conditioned narcotic withdrawal in humans. Science 1977;195:1000-2.
21. Teasdale J. Conditioned abstinence in narcotic addicts. Int J Addict 1973;8:273-92.
22. O''Brien CP, Ehrman RN, Ternes JW. Behavioral analysis of drug dependence. New York: Academic Press; 1986. p. 329-56.
23. O''Brien C. Experimental analysis of conditioning factors in human narcotic addiction. Pharmacol Rev 1975;27:533-43.
24. O''Brien C, Childress A, McLellan A, Ehrman R, Ternes J. NIDA. Research Monographic 84. Ray B A; 1988. p. 44-61.
25. Schnur P. Conditioned morphine withdrawal in the hamster. Psychopharmacology 1992;107:517-22.
26. Goldberg SR, Schuster CR. Conditioned suppression by a stimulus associated with nalorphine in morphine-dependent monkeys. J Exp Anal Behav 1967;10:235-42.
27. Wikler A, Pescor FT, Miller D, Norrel H. Persistent potency of a secondary (conditioned) reinforcer following withdrawal of morphine from physically dependent rats. Psychopharmacologia 1971;20:203-117.
28. Schnur P, Wainwright M. Conditioned withdrawal in environments associated with the preference or absence of morphine. Pharmacol Biochem Behav 1992;41:543-6.
29. Baldwin H A, Koob G. Rapid induction of conditioned opiate withdrawal in the rat. Neuropsychopharmacol 1993;8:15-21.
30. Rodríguez-Arias M, Pinazo J, Miñarro J, Stinus L. Effects of SCH 23390, raclopride and haloperidol on morphine withdrawal-induced aggression in male mice. Pharmacol. Biochem. Behav 1999;64:123-30.
31. Felip CM, Rodríguez-Arias M, Espejo E F, Miñarro J, Stinus L. Naloxone-induced opiate withdrawal produces long-lasting and contextindependent changes in aggressive and social behaviors of post-dependent male mice. Behav. Neurosci (enviado).
32. Rodríguez-Arias M, Miñarr, J, Aguilar MA, Pinazo J, Simón VM. Effects of risperidone and SCH 23390 on isolation-induced aggression in male mice. Eur Neuropsychopharm 1998;8:95-103.
33. Mugford RA, Nowell NM. Pheromones and their effects on aggresion in mice. Nature. 1970;226:967-8.
34. Brain PF, Benton D, Childs G, Parmigiani S. The effect of the opponent in test of murine aggression. Behav Processes 1981;6:319-28.
35. Bechara A, Nader K, Van der Kooy D. Neurobiology of withdrawal motivation: evidence for two separate aversive effects produced in morphine-naive versus morphine-dependent rats by both naloxone and spontaneous withdrawal. Behav Neurosci 1995;109:91-105.
36. Crippens D, Robinson TE. Withdrawal from morphine or amphetamine: different effects on dopamine in the ventral-medial striatum studied with microdialysis. Brain Res 1994;650:56-62.
37. Di Chiara G. Psychobiology of the role of dopamine in drug-abuse and addiction. Neurosci Res Commun 1995;17:133-43.
38. Acquas E, Carboni E, Di Chiara G. Profound depression of mesolimbic dopamine release after morphine withdrawal in dependent rats. Eur. J Pharmacol 1991;193:133-4.
39. Acquas E, Di Chiara G. Depression of mesolimbic dopamine transmission and sensitization to morphine during opiate abstinence. Neurochem 1992;58:1620-5.
40. Stinus L, Cador M, LeMoal M. Interaction between endogenous opioids and dopamine within the nucleus accumbens. Ann N Acad Sci 1992; 654:254-73.
41. Diana M, Pistis M, Muntoni M, Gessa G. Profound decrease of mesolimbic dopaminergic neuronal activity in morphine withdrawn rats. J Pharmacol Ex The 1995;272:781-5.
42. Di Chiara G, North RA. Neurobiology of opiate abuse. TIPS 1992;131:185-193.
43. Schnur P, Espinoza M, Flores R. Context-specific sensitization to naloxone-precipiated withdrawal in hamtersÝ: effect of pimozide. Pharmacol. Biochem Behav 1994;48:791-7.
44. Spanagel R, Almeida O, Bartl C, Shippenberg TS. Endogenous kopioid systems in opiate withdrawal role in aversion and accompanying changes in mesolimbic dopamine release. Psychopharmacology 1994;115:121-7.
45. Corbett R, Hartman H, Kerman LL, Woods A, Strupczewski JT, Helsey GC, et al. Effects of atypical antipsychotic agents on social behavior in rodents. Pharmacol Biochem Behav 1993;45:9-17.
46. Nader K, Bechara A, Roberts DCS, Van Der Kooy D. Neuroleptics block high-but not low-dose heroin place preference: futher evidence for a two system model of motivation. Behav Neurosci 1994;108:1128-38.
47. Aguilar MA, Rodríguez-Arias M, Miñarro J, Simón V. Time course of the effects of haloperidol on agonistic behavior in male mice. Psico-thema 1994;6:191-6.
48. Rodríguez-Arias M, Miñarro J. Efectos de la morfina y el haloperidol sobre la conducta agonística en ratones macho. Psicothema. 1996;8: 351-8.
49. Rodríguez-Arias M, Miñarro J, Simón VM. Interaction of morphine and haloperidol on agonistic and motor behavior of male mice. Pharmacol Biochem Beha. 1997;58:153-8.
50. Lal H, O''Brien J; Pur, SK. Morphine withdrawal aggression: sensitization by amphetamines. Psychopharmacology 1971;22:217-23.
51. Brent PJ; Chah, LA. Enhancement of opiate withdrawal response by antipsychotic drugs in guinea-pigs is not mediated by sigma binding sites. Eur Neuropsychopharm 1993;3:23-32.
52. Ballard TM, McAllister KH. Acutely administerd clozapine does not modify naloxone-induced withdrawal jumping in morphine-dependent mice. Pharmacol Biochem Behav 1999;62:285-90.
53. Tidey JW, Miczek KA. Morphine withdrawal aggression: modification by D1 and D2 receptor agonists. Psychopharmacology 1992; 108:177-84.