El carcinoma urotelial vesical constituye una causa frecuente de mortalidad entre los tumores genitourinarios en Colombia. La cistoprostatectomía radical es el manejo estándar del carcinoma urotelial vesical musculoinvasivo (CUMI). Sin embargo una supervivencia a 5años de alrededor del 50% hace necesarias herramientas como la neoadyuvancia con quimioterapia, que ha demostrado una mejoría en la supervivencia general y libre de enfermedad. Se realizó la presente revisión con el objetivo de comparar la mortalidad general y la supervivencia libre de enfermedad en pacientes con CUMI en quienes el manejo incluyó neoadyuvancia con gemcitabina-cisplatino (GC) contra metotrexato-vinblastina-adriamicina-cisplatino (MVAC) y que posteriormente fueron llevados a cistoprostatectomía radical.
Materiales y métodosSe realizó una búsqueda sistemática de la literatura disponible desde 1980 a 2014 identificando experiencias clínicas con pacientes con carcinoma urotelial vesical musculoinvasivo, llevados a cistoprostatectomía radical, donde se comparaba la neoadyuvancia con el esquema GC versus neoadyuvancia con MVAC, teniendo como referencia la mortalidad general y la supervivencia libre de enfermedad. Posterior a ello se realizó la evaluación de sesgo de los artículos y extracción de datos por evaluadores independientes. Se realizaron técnicas de metaanálisis en los casos posibles, dependiendo de la heterogeneidad observada. Los datos se procesaron con el programa estadístico Stata versión 12.
ResultadosSe incluyeron 6 experiencias clínicas no aleatorizadas, con 184 pacientes asignados al esquema GC y 228 pacientes en el grupo con MVAC. No se encontraron diferencias estadísticamente significativas en mortalidad global, con OR: 2,23 (IC95%: 0,87-5,67), mortalidad cáncer-específica para el esquema GC del 50%, contra el 61% para el esquema MVAC (p=0,48) y en respuesta patológica completa, con OR: 1,34 (IC95%: 0,79-2,29). Se evidenció una mayor probabilidad de recaída entre los pacientes llevados al esquema GC, con OR: 2.73 (IC95%: 1,1-6,75).
ConclusionesLa evidencia disponible respecto a la neoadyuvancia con gemcitabina-cisplatino vs metotrexato-vinblastina-adriamicina-cisplatino es limitada y carece de experiencias aleatorizadas. La tendencia observada establece resultados oncológicos similares con los 2 esquemas de quimioterapia.
Bladder urothelial carcinoma is a frequent cause of death among genitourinary tumours in Colombia. Radical cystoprostatectomy is the standard management of muscle invasive bladder urothelial carcinoma (CUMI). Unfortunately, 5-year survival is around 50%, therefore neoadjuvant chemotherapy regimens have been suggested. It has been demonstrated that using neoadjuvant chemotherapy increases overall and disease-free survival. This systematic review included CUMI patients, who received neoadjuvant chemotherapy and subsequent radical cystectomy. Overall mortality and disease-free survival were compared between CUMI patients treated with gemcitabine-cisplatin (GC) or methotrexate-vinblastine-adriamycin-cisplatin (MVAC) neoadjuvant regimens.
Materials and methodsThis systematic review was performed using the available literature from 1980 to 2014 to identify clinical studies. Studies had to include patients with muscle invasive bladder urothelial carcinoma, who underwent radical cystoprostatectomy, and that compare overall mortality and disease-free survival of GC neoadjuvant versus MVAC scheme. Bias assessment and data extraction was performed by independent evaluators. Meta-analysis techniques were performed where possible, depending on the observed heterogeneity. The data were processed using Stata version 12 statistical program.
ResultsSix non-randomised clinical studies were included. There were 184 patients assigned to a GC scheme and 228 patients in the MVAC group. No significant statistically differences were found in overall mortality with OR: 2.23 (95%CI: 0.87-5.67), cancer specific mortality for GC was 50% compared to MVAC 61% (P=.48), and complete disease response, OR: 1.34 (95%CI: 0.79-2.29). Higher relapse likelihood among patients with GC scheme was found, OR: 2.73 (95%CI: 1.1-6.75).
ConclusionsThe available evidence comparing neoadjuvant regimes such as gemcitabine-cisplatin vs methotrexate-vinblastine-adriamycin-cisplatin is limited and lacks randomised studies. The evidence provides similar results with both cancer neoadjuvant chemotherapy regimens.
En Colombia, durante el año 2012 fallecieron 1.982 personas debido a tumores genitourinarios no prostáticos, y hubo 1.852 casos de mortalidad por igual causa durante el año 2011. Esto constituye una tasa de mortalidad de 4,25 y 4,02 casos por cada 100.000 habitantes, respectivamente1. Dentro de este tipo de tumores, el carcinoma urotelial vesical fue una causa frecuente de mortalidad, según estadísticas locales2,3.
La cistoprostatectomía radical constituye una herramienta básica en el manejo de los tumores vesicales musculoinvasivos, que corresponden a cerca del 30% de los casos. Sin embargo, sus resultados no son los mejores4,5. Con una supervivencia general a 5años que oscila alrededor del 50%5,6, se generan hipótesis sobre la necesidad de manejos complementarios. Diversas estrategias a través de análisis multivariados han buscado caracterizar de forma óptima el riesgo de recurrencia y la supervivencia libre de enfermedad asociada7-9, con el objetivo del desarrollo de nuevos enfoques.
En la actualidad la neoadyuvancia con quimioterapia, asociada a la cistoprostatectomía radical, constituye una herramienta útil que ha demostrado una mejoría en la supervivencia general y en la supervivencia libre de enfermedad2,10-14. El esquema tradicional de quimioterapia neoadyuvante está conformado por metotrexato, vinblastina, adriamicina y cisplatino (MVAC), con resultados positivos10,15-21, surgido a partir de diversas experiencias clínicas previas de enfermedades metastásicas22,23.
A pesar de los resultados obtenidos con el uso de la neoadyuvancia, su uso no ha sido difundido. Diversos factores explican su poca utilización, como lo son el impacto clínico observado, el retardo del manejo quirúrgico, los efectos secundarios no deseados y criterios subjetivos del médico tratante24. Igualmente, la pobre adherencia a las guías de manejo debe ser considerada25-27. Esto ha motivado la búsqueda de esquemas quimioterapéuticos neoadyuvantes alternativos, donde si los resultados oncológicos se mantienen, disminuyan la toxicidad secundaria.
Utilizando nuevamente la experiencia del manejo de la enfermedad metastásica, se propone en la actualidad el uso del esquema gemcitabina y cisplatino (GC)23,28,29. Dicho esquema debería tener iguales resultados oncológicos al esquema tradicional pero con menores efectos secundarios. Diversas experiencias han comparado los 2 esquemas mencionados11,30,31. Sin embargo, la evidencia actual es limitada y el clínico fundamenta la decisión del uso de GC en los estudios con enfermedad metastásica.
Se realizó la presente revisión con el objetivo principal de comparar la mortalidad general y la supervivencia libre de enfermedad en pacientes con carcinoma urotelial vesical musculoinvasivo en quienes el manejo incluyó neoadyuvancia con GC y posteriormente son llevados a cistoprostatectomía radical, contra el esquema tradicional de neoadyuvancia que incluye MVAC y posteriormente la cistoprostatectomía radical. Adicionalmente se busca realizar comparaciones entre los 2 esquemas de neoadyuvancia respecto a los cambios histopatológicos observados en los pacientes llevados a cistoprostatectomía radical y se exploran los efectos secundarios encontrados con los 2 esquemas.
Materiales y métodosPartiendo de la pregunta de investigación que involucró como referencia pacientes con carcinoma urotelial vesical musculoinvasivo, en quienes se realizó neoadyuvancia con GC y posteriormente son llevados a cistoprostatectomía radical, comparados con los pacientes donde el esquema de neoadyuvancia utilizado fue MVAC y teniendo como parámetro de referencia el resultado expresado como la mortalidad general y supervivencia libre de enfermedad, se realiza una búsqueda sistemática de la literatura universal. Se utilizó como guía la herramienta publicada por la Colaboración Cochrane32.
Se realizó la búsqueda en las bases de datos Pubmed, Embase y Central. Las palabras clave utilizadas fueron: bladder cancer or urotelial carcinoma of bladder, or transitional cell carcinoma of bladder and neoadjuvant treatment or radical cistectomy or neadjuvant chemotherpy or cisplatin or gemcitabine. Igualmente se utilizaron sus combinaciones, en el título y en el resumen, para facilitar la búsqueda de artículos relevantes. No se realizaron restricciones de idioma ni de año de publicación. La fecha límite de búsqueda fue marzo de 2014.
En caso de encontrar varios artículos con referencia a la misma población de estudio, se seleccionó el reporte actualizado de mejor calidad.
Se seleccionaron estudios controlados que involucraban experiencias clínicas donde se comparaba directamente los 2 esquemas quimioterapéuticos neoadyuvantes descritos. Los pacientes debían tener diagnóstico histopatológico de carcinoma urotelial vesical musculoinvasivo, deberían ser llevados a cistoprostatectomía radical y se debería tener reporte de mortalidad general, supervivencia libre de enfermedad, recurrencia de la enfermedad, cambios histopatológicos y efectos secundarios no deseados. Se excluyeron experiencias que involucraban características histopatológicas diferentes, esquemas de adyuvancia o uso de otros tratamientos como la radioterapia externa u otros agentes quimioterapéuticos como parte del tratamiento. Se exploraron las referencias de los diferentes artículos con el objetivo de encontrar literatura adicional. Los artículos escritos en idioma diferente al inglés fueron traducidos para el manejo adecuado de sus datos.
Evaluación de los artículosLa extracción de la información de los artículos fue llevada a cabo por 2 autores independientes, y en caso de controversia se requirió un tercer evaluador (JP, CV, JD). Los datos de identificación tenidos en cuenta en los artículos considerados elegibles fueron: apellido del autor principal, año, país del trabajo, número absoluto de casos y controles, edad media y tiempo de seguimiento. Los resultados principales, como la mortalidad general y la supervivencia libre de enfermedad, fueron manejados como resultados binarios. Los resultados secundarios, como cambios histopatológicos y efectos secundarios severos, se manejaron igualmente como resultados binarios. Fueron consideradas como medidas de asociación y sobrevida hazard ratios, riesgos relativos, odds ratios, y como medidas de presión, sus respectivos intervalos de confianza (IC).
El análisis de la calidad de los artículos elegibles fue realizado con la ayuda de la herramienta para evaluación de sesgo de grupo Cochrane32. Cada artículo tuvo 2 evaluadores urólogos (CV, JD, WF, WD, CG) y las controversias fueron resueltas por un tercer valuador independiente (JP).
Análisis estadísticoSe realizó una descripción general de los estudios incluidos. Se describen las características de los pacientes de estudio respecto a edad, seguimiento y asignación.
Los resultados a evaluar fueron supervivencia global, supervivencia cáncer-específica, recaída, respuesta total o parcial.
Para evaluar el efecto del esquema de quimioterapia adyuvante, fueron consideradas diferentes variables de estudio. Se recogieron los datos de riesgo relativo y riesgo hazard para cada artículo; en los casos no disponibles, se utilizaron los valores absolutos para cada variable en cada uno de los 2 subgrupos. Dichos valores fueron consignados en un formato preestablecido.
Con dichas tablas se construyen los diagramas de bosque (forest plot) y sus tablas de ponderación, para obtener razones de oportunidad (OR) individuales y combinadas.
El análisis de la heterogeneidad presente entre los artículos del estudio fue realizado con la prueba de Chi cuadrado y el coeficiente de heterogeneidad I2. Para el manejo de datos se utilizó el modelo de efectos aleatorios, con la metodología de Der-Simonian y Laird, por la diferencia de las poblaciones motivo de estudio. Se definió heterogeneidad significativa si p<0,05 o I2>50%. Igualmente se realizó la representación gráfica de Galbraith para el análisis de heterogeneidad.
Se llevaron a cabo análisis de sensibilidad para controlar posibles divergencias secundarias al diseño de los estudios, igualmente bajo método de efectos aleatorios.
Los sesgos de publicación fueron evaluados a través del diagrama de embudo (funnel plot) y los test de Begg y Egger. Los análisis a 2 colas, con p<0,05, fueron considerados estadísticamente significativos.
En el procesamiento de la información se utilizó el programa estadístico Stata versión 12 (Stata Corp 2012) y el RevMan 5.2 de la Colaboración Cochrane (actualización 5.2.11, Cochrane Informatics and Knowledge Management Department).
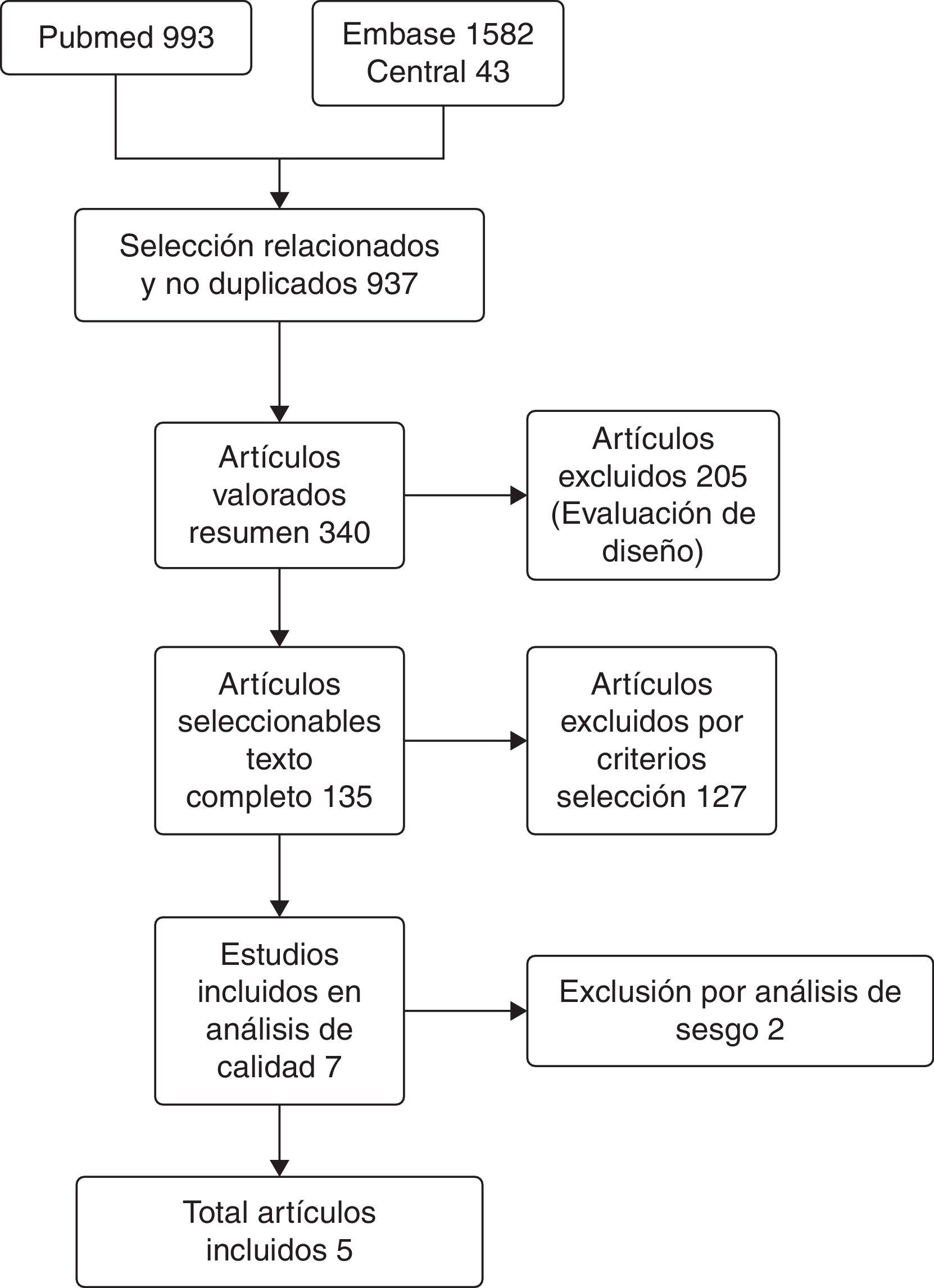
ResultadosComo resultado de la búsqueda sistemática descrita previamente, se localizaron cerca de 1.500 artículos. Luego de descartar artículos no relevantes por casos duplicados, temas no relacionados y evento de estudio sin interés, se consideró una base de 937 trabajos elegibles. Tras evaluaciones posteriores por metodología, pertinencia, cumplimiento de criterios de inclusión y exclusión, se obtuvieron finalmente 5 artículos28,30,31,33,34. La evolución de la selección de los artículos pertinentes se representa en la figura 1.
Estos 5 trabajos constituyen experiencias clínicas no aleatorizadas. No se encontraron experimentos clínicos aleatorizados en la literatura, donde se comparara la neoadyuvancia con GC contra MVAC. Los estudios incluidos, en general tienen temporalidad histórica, con una excepción34, lo cual es tenido en cuenta en la evaluación de los artículos. La mayoría de ellos provienen de centros de referencia en Estados Unidos.
Es notable la fecha de publicación reciente de los estudios incluidos. El trabajo con mayor tiempo de publicación tiene 6años33. Esto obedece al poco tiempo de evaluación del esquema neoadyuvante GC, las pocas experiencias y que son parte de la justificación de la presente revisión.
La tabla 1 muestra una descripción general de la literatura evaluada.
Características generales de los estudios incluidos
| Estudio | Año | Origen | Diseño | Pacientes incluidos (n) | Estadificación patológica | Seguimiento (meses) | Quimioterapia (ciclos) | Tiempo a cistectomía (semanas) |
|---|---|---|---|---|---|---|---|---|
| Yeshchina et al.31 | 2012 | USA-U. Columbia | ENA-Retrospectivo | 61 | T2-T4ANO-N2MO | 27,5 | ND | ND |
| Adrian et al.30 | 2013 | USA-USC | ENA-Retrospectivo | 116 | T2-T4N0M0 | 56,5 | 4 | 15 |
| Sumanta et al.34 | 2012 | USA-CHCCC | ENA-Prospectivo | 46 | T2-T4NO-N3MO | 28,7 | 2A4 | 4 |
| Dash et al.33 | 2008 | USA-MSKCC | ENA-Retrospectivo | 96 | T2-T4AN0-N1M0 | 36,15 | 4 | 19 |
| Kaneko et al.28 | 2011 | Japón Saiseikai | ENA-Retrospectivo | 31 | T2-T4NO-N2MO | 39,6 | 2 | 11 |
Las experiencias incluidas involucraron un total de 412 pacientes asignados a neoadyuvancia. Entre los pacientes asignados al esquema GC se encontraron 184 pacientes, y 228 pacientes en el grupo con esquema MVAC.
La tabla 2 muestra las características generales de los pacientes incluidos.
Características generales de los pacientes incluidos
| Estudio | Grupo de edad | GCPacientes incluidos (n) | Seguimiento (meses) | Grupo MVAC (edad) | Pacientes incluidos (n) | Seguimiento (meses) | Desenlaces evaluados |
|---|---|---|---|---|---|---|---|
| Yeshchina et al.31 | 66 | 16 | 25 | 63 | 45 | 30 | Toxicidad, mortalidad, cambios patológicos |
| Adrian et al.30 | 67 | 58 | 25 | 63 | 58 | 88 | Recurrencia, mortalidad, cambios patológicos |
| Sumanta et al.34 | 68 | 24 | 28,7 | 60 | 22 | 28,7 | Cambios patológicos |
| Dash et al.33 | 64 | 42 | 24,2 | 63 | 54 | 48,1 | Recurrencia, cambios patológicos |
| Kaneko et al.28 | 69 | 22 | 23,7 | 62 | 9 | 55,5 | Recurrencia, mortalidad, cambios patológicos |
Se puede observar que los pacientes no fueron asignados en forma aleatorizada, sino como lo indican varios de los trabajos, a criterio del médico tratante. En consecuencia, la distribución no es homogénea. Este evento es esperado por la temporalidad del diseño de los estudios; sin embargo, constituye una aceptable aproximación a la práctica clínica.
En general se involucran personas mayores a 60años dentro del estudio, y el seguimiento está alrededor de los 24meses. Aunque este es un tiempo corto de acuerdo a la patología y la intervención de estudio, esta es toda la evidencia disponible actualmente.
Respecto a los desenlaces tenidos en cuenta para evaluar la intervención, los estudios no tienen reporte uniforme. Algunos de ellos hacen referencia a supervivencia general y supervivencia cáncer-específica. Sin embargo, otros realizan énfasis en los cambios patológicos como elemento subrogado pronóstico.
A continuación se realiza una comparación general entre los esquemas GC y MVAC respecto a los desenlaces definidos.
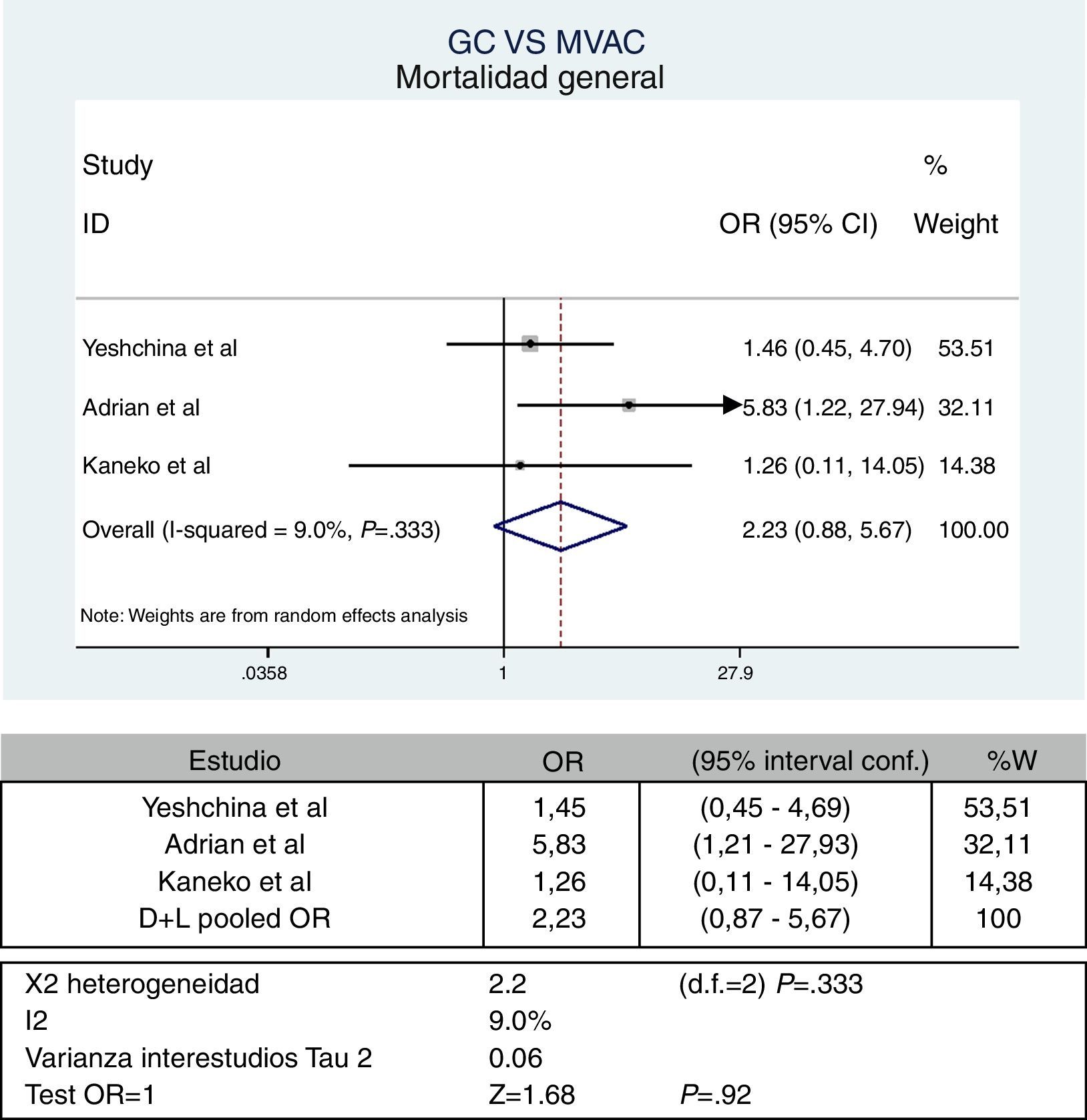
Mortalidad general-supervivencia generalSolo 3 experiencias reportan dicho desenlace28,30,31. El manejo de datos se realiza como valores binarios. La figura 2 corresponde al metaanálisis general.
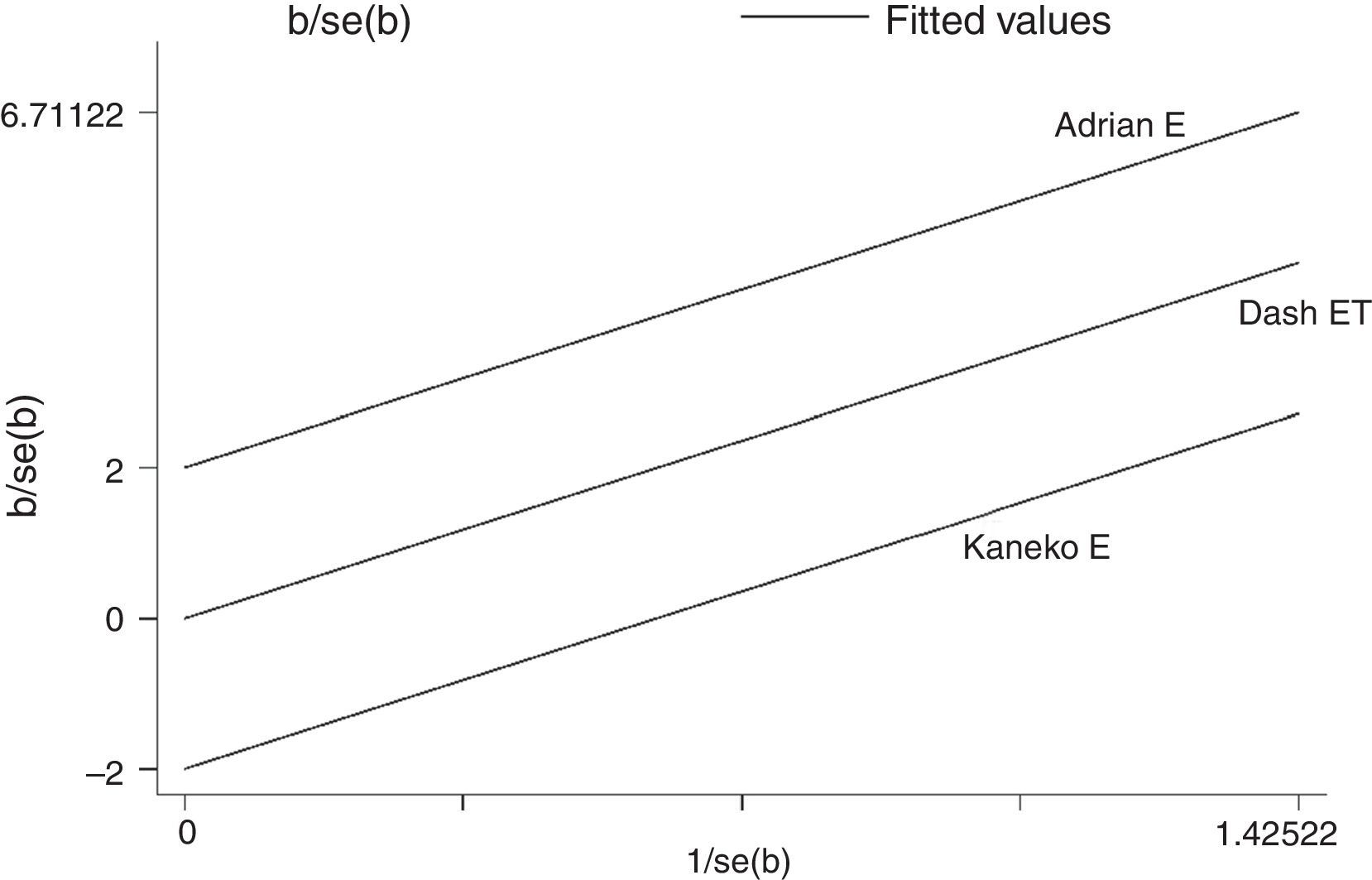
Se puede observar con un OR: 2,23 (IC95%: 0,87-5,67), con el cual no se puede establecer una diferencia estadísticamente significativa entre los 2 esquemas. La heterogeneidad encontrada no es significativa; sin embargo, se pone de manifiesto con la curva de Galbraith (fig. 3).
El análisis de sensibilidad mostrado en la figura 4 evidencia una tendencia consistente entre los estudios involucrados. Sin embargo existe variabilidad importante en el resultado a consecuencia de las características muestrales.
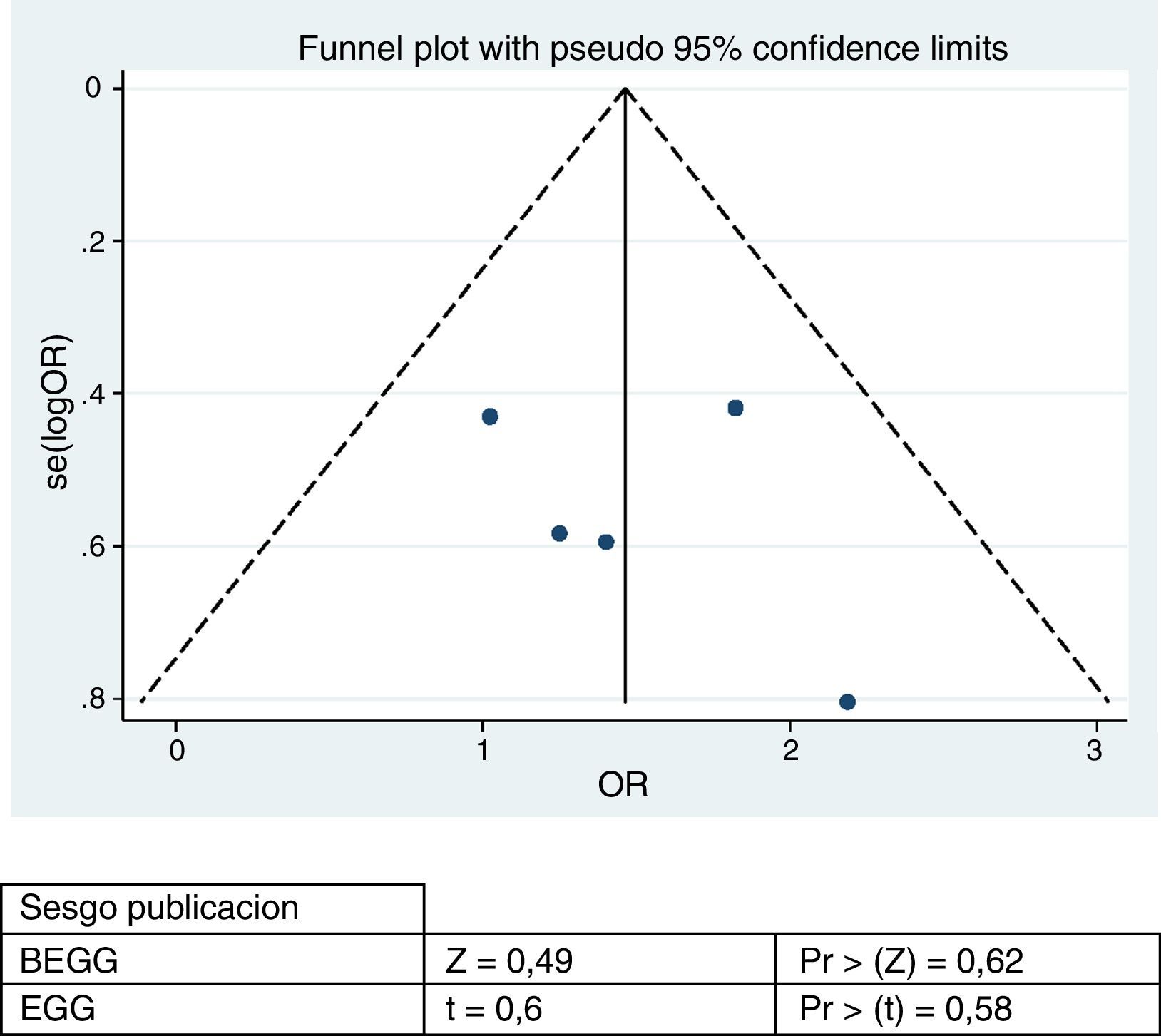
Respecto a la evaluación de sesgos de publicación, se realiza la prueba de Egger y Begg, sin encontrar un sesgo importante. Sin embargo, la representación gráfica muestra la variabilidad consecuencia del número bajo de estudios (fig. 5).
Mortalidad cáncer-específicaSolo un trabajo documenta dicho desenlace. La experiencia desarrollada por Yeshchina et al.31 mostró una mortalidad cáncer-específica para el esquema GC del 50%, y del 61% para el esquema MVAC. Sin embargo, dicho valor no alcanzó una diferencia estadísticamente significativa (p=0,48).
Con esta evidencia disponible no se puede determinar en forma adecuada el impacto del esquema GC; sin embargo, es una tendencia preliminar que no favorece ningún esquema en particular.
Recurrencia de la enfermedadTres estudios hacen la descripción de dicho desenlace28,30,33. Las descripciones mencionan recaídas locales, compromiso linfático y metástasis viscerales. Por el tamaño de la muestra, no se puede establecer un patrón de recaída.
Nuevamente se manejan valores binarios para comparar la probabilidad de recaída entre los 2 esquemas (fig. 6).
La razón de oportunidad combinada de los estudios muestra una tendencia a encontrar mayor probabilidad de recaída entre los pacientes llevados al esquema GC. Esto está dado por un OR combinado de 2,73 (IC95%: 1,1-6,75). Sin embargo, la precisión de la medición no es óptima, lo cual no permite tener un concepto definitivo.
El análisis de heterogeneidad no mostró una variación significativa entre los estudios. Sin embargo la evaluación gráfica, pone de manifiesto la variabilidad por los pocos estudios (fig. 7).
El análisis de sensibilidad no documenta una tendencia diferente con la exclusión de ninguno de los estudios evaluados (fig. 8).
Posteriormente, la evaluación estadística de sesgo de publicación no mostró una tendencia estadísticamente significativa, documentada con las pruebas de Egger y Begg (fig. 9).
Respuesta patológica completaDiversos estudios hacen énfasis en este tema, basados en el valor pronóstico que tiene la estadificación pT0 en la patología encontrada con la cistoprostatectomía radical. Esta revisión encontró 5 artículos con referencia al tema28,30,31,33,34.
Se tienen en cuenta la cantidad de pacientes que fueron estadificados como pT0 posterior al procedimiento definitivo (cistoprostatectomía). Con dichos valores se realiza el metaanálisis y se obtiene un OR combinado.
La figura 10 muestra un OR combinado de 1,34 (IC95%: 0,79-2,29), que sin alcanzar una estadísticamente significativa, sugiere que este desenlace se da en similar proporción entre los 2 esquemas de quimioterapia.
No se encontró una heterogeneidad significativa entre los estudios. Sin embargo, es persistente la variabilidad, a consecuencia del bajo número de artículos incluidos (fig. 11).
El estudio de sensibilidad da un valor particular al trabajo desarrollado por Dash et al.33 y que coincide con la metodología y el diseño empleados en este estudio. Igualmente existe una tendencia general y uniforme entre los estudios La figura 12 representó dicho análisis.
El estudio de los posibles sesgos de publicación no encuentra una diferencia estadísticamente significativa de acuerdo a las pruebas de Begg y Egger (fig. 13).
Respuesta patológica parcialEn este aspecto se evalúa en la patología definitiva la presencia de tumor residual, <pT2. Dicha variable fue reportada por 5 de los 6 estudios incluidos.
Los datos obtenidos se manejaron como valores binarios. Se construye el diagrama de bosque respectivo, donde no se evidencia que alguno de los 2 esquemas tenga mayor frecuencia este desenlace. El OR obtenido fue 1,41, con IC95% de 0,89 a 2,23, no documentando una significación estadística por la precisión (fig. 14).
La heterogeneidad encontrada no es significativa estadísticamente y se confirma con la gráfica de Galbraith (fig. 15).
El análisis de sensibilidad nuevamente muestra una tendencia uniforme en el resultado obtenido por cada uno de los estudios, aunque con gran variabilidad por el número de pacientes incluidos en las experiencias (fig. 16).
El estudio de posibles sesgos de publicación no evidenció la presencia de los mismos, de forma estadísticamente significativa (fig. 17).
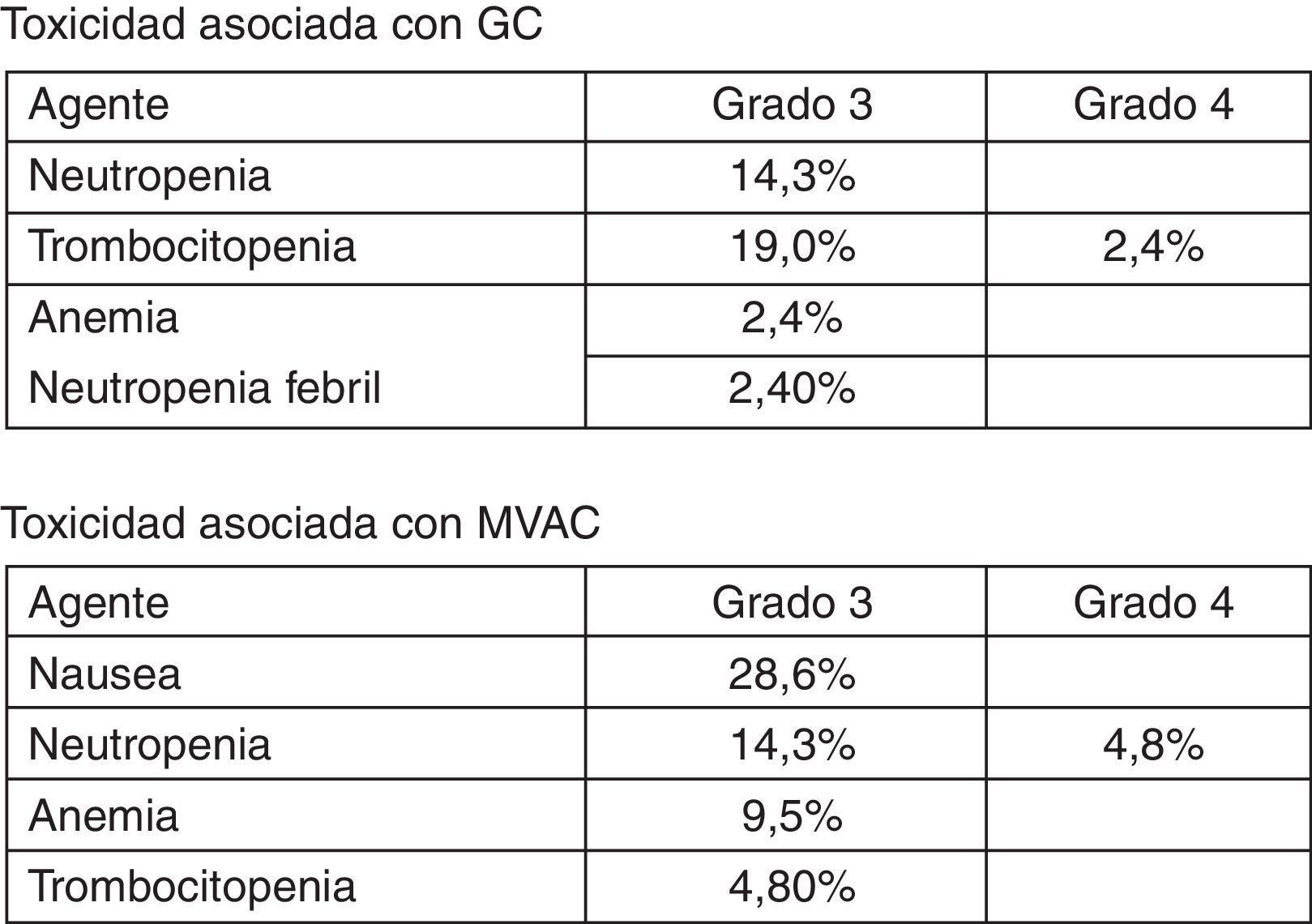
ToxicidadSolo se realiza una descripción de la toxicidad en el trabajo de Yeshchina et al.31. En este caso se muestra una frecuencia mayor de la toxicidad asociada al esquema MVAC.
Se evalúan los eventos observados de acuerdo al National Cancer Institute Common Toxicity Criteria Version 4.0. Comparativamente se presentan los eventos de toxicidad 3 y 4 con los 2 esquemas (fig. 18).
Nuevamente la evidencia disponible no permite fijar un concepto favorable en algún sentido a través del metaanálisis. Con la información disponible solo se puede «sugerir» mayor toxicidad con el esquema MVAC, sin poder documentarlo adecuadamente.
Análisis de sesgoEl análisis de sesgos fue realizado por 2 evaluadores, los cuales eran expertos temáticos, con capacitación metodológica. El análisis de riesgo de sesgo por dominios evidencia, en la mayoría de los estudios, alto riego de los mismos, lo que se podría explicar por la falta de cegamiento de los participantes y del evaluador, que es esperado por incluir estudios retrospectivos. El diseño de los estudios genera incertidumbre sobre el efecto de los sesgos en los resultados; se requieren estudios aleatorizados, doble ciego, para disminuir el riesgo y poder evaluar de mejor manera los efectos.
Los estudios reportan varios desenlaces sin tener claridad en las censuras de quimioterapia, y esto es un sesgo importante de reporte. En todos los trabajos incluidos se consideró que los pacientes cumplieron los protocolos de quimioterapia completa y se les realizó cirugía; en consecuencia, podría estar sobrestimándose el efecto de la quimioterapia. El impacto en el análisis ponderado debería ser menor, dado que los 2 grupos de comparación tienen el mismo inconveniente.
En el anexo (ver material adicional), se muestra el esquema de análisis de sesgo de cada uno de los artículos incluidos.
DiscusiónEl estándar de manejo para el cáncer urotelial de vejiga musculoinvasivo es la cistectomía radical35; sin embargo, la evidencia sugiere una tasa de supervivencia alrededor del 50% a 5años5,6. Esto ha motivado la búsqueda de nuevas estrategias de manejo. En la actualidad, la neoadyuvancia con agentes quimioterapéuticos constituye una herramienta complementaria útil, dado su impacto en la supervivencia15,16.
El esquema tradicional de agentes quimioterapéuticos lo constituye la combinación de metotrexato, vinblastina, adriamicina y cisplatino35. Sin embargo, como consecuencia de los resultados encontrados en experiencias con la enfermedad metastásica, se utiliza en reemplazo, con frecuencia, el esquema con la combinación de gemcitabina y cisplatino29, aunque sin tener evidencia suficiente para ello28. Este estudio realizó una revisión de la literatura disponible que comparase la eficacia clínica de los 2 esquemas.
Respecto a los estudios comparativos encontrados, expuestos en la tabla 1, se encuentra una evidencia limitada a experiencias no aleatorizadas y con análisis retrospectivos en la mayoría de los casos. Este tipo de trabajos constituye una posible fuente de sesgo, pero como se menciona en varios de ellos, la posibilidad de realizar un experimento aleatorizado es remota31,34.
Otras de las limitaciones encontradas son la demora en el tiempo para la realización del procedimiento quirúrgico, los seguimientos cortos, la pobre compliance con el tratamiento, y en especial el limitado número de pacientes incluidos. A pesar de los favorables resultados obtenidos con la quimioterapia demostrados en múltiples estudios, en Estados Unidos solo es utilizada en un rango del 11,3 al 16,8%27. La razón de esta baja implementación es que la quimioterapia lleva a un retraso en la realización de cistectomía radical, lo que puede traer peores resultados oncológicos; a esta demora debe sumarse el tiempo que se puede alargar la terapia neoadyuvante por la presencia de efectos secundarios de la misma, todo esto concordante con los hallazgos encontrados de los estudios incluidos.
El riesgo de sesgo establecido por los evaluadores puede ser definido como alto, dada la falta de aleatorización y de cegamiento. Igualmente existen posibles sesgos de reporte por la falta de información respecto a las censuras con quimioterapia. Sin embargo, como se ha mencionado en diferentes partes de este trabajo, esta es la evidencia disponible (experiencias no aleatorizadas), y sobre ellas el clínico basa la determinación de una conducta. La falta de experiencias aleatorizadas es una falencia para el clínico, pero este trabajo permite una herramienta de medicina basada en la evidencia, para la toma de decisiones objetivas.
A pesar de no encontrar experimentos aleatorizados, se buscó describir unos valores ponderados respecto a las variables de estudio definidas, con la evidencia disponible, teniendo presente que con dichos esquemas quimioterapéuticos existen amplias experiencias previas, como en el caso del esquema MVAC, que se utiliza desde hace 20años36, y los resultados encontrados fueron consistentes.
Respecto a la mortalidad general con los 2 esquemas, solo 3 trabajos reportan este resultado28,30,31. El análisis comparativo ponderado de los 2 esquemas quimioterapéuticos adyuvantes no mostró una diferencia estadísticamente significativa (OR: 2,23; IC95%: 0,87-5,67). Los análisis complementarios mostraron unos resultados consistentes entre los estudios, aunque están sujetos a gran variabilidad por las características del muestreo.
La mortalidad cáncer-específica solamente fue reportada por uno de los trabajos31. En dicha experiencia, el esquema GC fue del 50%, y del 61% para el esquema MVAC. Sin embargo, dicho valor no alcanzó una diferencia estadísticamente significativa (p=0,48).
Respecto a la recurrencia de la enfermedad posterior a la neoadyuvancia y la cistectomía radical, fueron reportados diferentes eventos, por 3 experiencias28,30,33. Allí se encontró una discreta tendencia a tener mayor número de recurrencias entre los pacientes que recibieron el esquema GC (2,73; IC95%: 1,1-6,75). Sin embargo, la variabilidad observada con el análisis de sensibilidad dificulta dicha apreciación. De igual manera los reportes son heterogéneos y no se puede establecer un patrón clínico de recurrencia.
Diversos trabajos llaman la importancia, dado el valor pronóstico, de la respuesta completa posterior al uso de la quimioterapia neoadyuvante13,37,38. En este caso, 5 experiencias reportaron dicho resultado28,30,31,33,34. El análisis ponderado de los artículos incluidos no documentó una diferencia estadísticamente significativa al comparar la respuesta patológica completa (pT0) o parcial (estadio>pT0) entre los 2 esquemas de quimioterapia, y se obtuvo un OR combinado de 1,34 (IC95%: 0,79-2,29).
De igual manera, el análisis ponderado de los estudios que reportaron los hallazgos patológicos28,30,31,33,34 mostró un OR combinado de 1,41 (IC95%: 0,89-2-23) para la respuesta patológica parcial. Con dichos valores no se puede establecer la superioridad de ninguno de los 2 esquemas respecto a los elementos pronósticos de dicha variable.
Finalmente, la presencia de toxicidad solo fue reportada por una de las experiencias incluidas31, sin posibilidad de realizar un análisis ponderado. En dicho trabajo se muestra una tendencia a encontrar mayor toxicidad entre los pacientes llevados al esquema MVAC; sin embargo, las características metodológicas no permiten concluir dicho evento. La práctica clínica se fundamenta en las comparaciones realizadas entre los 2 esquemas pero en pacientes con enfermedad metastásica38.
Conclusiones- •
La evidencia disponible, que compara el uso de neoadyuvancia con los esquemas MVAC vs GC, en pacientes llevados a cistoprostatectomía radical, está constituida por experiencias no aleatorizadas y con análisis retrospectivo en la mayoría de los casos. Dicha evidencia aporta una información limitada, dadas las características de diseño de los estudios, número de pacientes incluidos y tiempos de seguimiento.
- •
El análisis de la literatura no permite establecer una diferencia estadísticamente significativa entre los 2 esquemas de quimioterapia neoadyuvante motivo de estudio, respecto a las variables de sobrevida, cambios histopatológicos y toxicidad.
- •
Se requieren estudios con mejores características metodológicas que permitan establecer una selección objetiva del esquema de quimioterapia neoadyuvante en pacientes con carcinoma vesical urotelial, muscular invasivo y que son llevados a cistoprostatectomía radical
Nivel de evidencia I.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.