Ciertas enfermedades prevenibles con vacunas, como la enfermedad neumocócica invasiva (ENI), la neumonía y la otitis media (OM) son causadas por Streptococcus pneumoniae. Las vacunas neumocócicas conjugadas (VNC) han contribuido de manera considerable a reducir la carga de la enfermedad neumocócica. La evidencia bibliográfica publicada indica que la VNC con la proteína D de Haemophilus influenzae y la VNC de 13 valencias tienen un impacto comparable sobre la carga de la enfermedad neumocócica. Esta opinión ha sido emitida por entidades independientes y reconocidas de salud pública como la Organización Mundial de la Salud (OMS) y la Organización Panamericana de la Salud (OPS). El efecto neto se ve limitado por el reemplazo continuo de serotipos no incluidos en las formulaciones. Los estudios centrados en serotipos concretos deberían reconocer que el objetivo principal de la vacunación con las VNC es reducir la carga global de la enfermedad, independientemente de los serotipos contenidos en la formulación.
Certain vaccine-preventable diseases such as invasive pneumococcal disease (IPD), pneumonia, and otitis media (OM) are caused by Streptococcus pneumoniae. Pneumococcal conjugate vaccines (PCVs) have significantly contributed to reduce the burden of pneumococcal disease. The evidence from published literature indicates that the pneumococcal Haemophilus influenzae protein D conjugate vaccine and the 13-valent PCV have similar impact against pneumococcal disease burden. This opinion has been adopted by independent recognized public health entities such as the World Health Organization and the Pan American Health Organization. The net effect is limited by the continuous replacement of serotypes not contained in the formulations. The studies focusing on specific serotypes should recognize that the main goal of the vaccination with PCVs is to reduce the overall burden of disease regardless the serotypes already contained into formulation.
La bacteria Streptococcus pneumoniae (S. pneumoniae) causa una serie de enfermedades invasivas como meningitis, bacteriemia, sepsis, neumonía bacteriémica y enfermedades mucosales no invasivas, como neumonía sin bacteriemia, otitis media (OM) y sinusitis1-3. Este patógeno coloniza principalmente la nasofaringe de lactantes y niños pequeños, y se transmite por medio de gotas respiratorias1,3. En la actualidad se han descrito más de 90 serotipos, de los cuales de 6a 11se consideran responsables de más del 70% de la enfermedad neumocócica invasiva (ENI)1.
La ENI es una carga para la salud pública, con tasas de incidencia y mortalidad mayores en los niños de<2 años y los adultos >65 años1,4,5. En 2010, la incidencia global de la ENI en Europa fue de 5,2/100.000, con 18,5 casos por 100.000 niños<1 año4. La incidencia de la ENI en los países en desarrollo es aún más alta, con una incidencia anual estimada de ENI entre los niños de África de 62,6/100.0006.
S. pneumoniae es la principal bacteria responsable de la neumonía adquirida en la comunidad (NAC), que a menudo da lugar a ingresos hospitalarios e intervenciones quirúrgicas. Además, es responsable del 78% de las neumonías lobares en niños1. En 2015, se estimó que en todo el mundo habían ocurrido aproximadamente 8,9 millones de episodios de neumonía en niños ≤ 5 años de edad, de los cuales 3,5 millones se consideraron graves7. De las 257.000 muertes estimadas en todo el mundo, las proporciones más altas ocurrieron en Asia y África7.
Más del 80% de los niños<3 años sufren al menos un episodio de OM aguda (OMA) y el 40% experimenta más de 6episodios antes de cumplir 7 años8. A pesar de ser menos grave que las otras enfermedades neumocócicas, la OMA altera las actividades diarias de los niños y sus familias, y es responsable de cuantiosos gastos en salud y consumo de antibióticos9.
En la actualidad, existen 2tipos de vacunas antineumocócicas: las de polisacáridos y las conjugadas. Las primeras, disponibles desde principios de la década de 1980, contienen 23 serotipos (polisacáridos) neumocócicos (VNP23). Sin embargo, proporcionan una inmunogenicidad escasa en los niños<2 años y no producen respuesta anamnésica a ninguna edad1.
La unión de polisacáridos de S. pneumoniae con una proteína portadora inmunógena dio lugar a las vacunas conjugadas actuales1, que aumentan la respuesta inmunitaria, en especial en los niños<2 años, e inducen memoria inmunológica1. Entre todas las vacunas neumocócicas conjugadas (VNC), la de 7 valencias (VNC7), que incluía 7 polisacáridos neumocócicos (4, 6B, 9V, 14, 18C, 19F y 23F) conjugados con una variante no tóxica del toxoide diftérico material de reacción cruzada 197 (CRM197), fue la primera que se introdujo en los programas de inmunización10. La VNC7 fue reemplazada de forma gradual por las nuevas vacunas conjugadas de 10 y 13 valencias1.
La VNC con la proteína D de Haemophilus influenzae (H. influenzae) (vacuna neumocócica conjugada con la proteína D de Haemophilus influenzae [PHiD-CV]; Synflorix; GSK, Bélgica), contiene 10 polisacáridos neumocócicos (1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F y 23F), 8de los cuales están conjugados por separado con la proteína D derivada de H. influenzae no tipificable1,10. Los otros 2se conjugan con los toxoides tetánico (18C) y diftérico (19F). En la actualidad, PHiD-CV está indicada para la inmunización frente a la ENI, la neumonía y la OMA causada por S. pneumoniae en lactantes y niños<5 años1.
La VNC de 13 valencias (VNC13) contiene 13 polisacáridos neumocócicos (1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F y 23F) conjugados de manera individual con CRM197 (VNC13; Prevenar 13; Pfizer, EE. UU.)1,10. Sus indicaciones son la inmunización frente a la ENI, la neumonía y la OMA causadas por S. pneumoniae en lactantes, niños, adolescentes y adultos1.
La Organización Mundial de la Salud (OMS) recomienda la inclusión de PHiD-CV y VNC13 en los calendarios anuales de vacunación infantil1. Desde 2009, muchos países las han introducido en sus programas de vacunación infantil. De ahí la necesidad de disponer de datos comparados sobre el impacto de ambas vacunaciones en poblaciones distintas o en las mismas poblaciones en periodos diferentes, en la toma de decisiones sobre los programas de vacunación.
Los parámetros de evaluación del comportamiento de una vacuna deben considerar el contexto de implementación de la estrategia de vacunación. Por tanto, definimos, eficacia como los resultados de salud evaluados en condiciones ideales de aplicación medidos mediante ensayos clínicos controlados11, efectividad como los resultados de salud obtenidos en condiciones reales de aplicación de la vacuna, medidos mediante estudios epidemiológicos, analíticos observacionales, de casos y controles, cohortes prospectivas o cohortes indirectas e impacto de los resultados de salud en una población vacunada en una determinada área geográfica medidos mediante estudios descriptivos de tendencia de antes y después11 (los estudios observacionales no analíticos de cohortes suficientemente amplias y de horizonte temporal suficientemente largo se considerarán a efectos de este artículo como estudios de impacto).
Hay un número limitado de datos comparativos sobre el impacto de PHiD-CV o VNC13. Por tanto, es difícil evaluar las complejidades de la efectividad vacunal e impacto basándose solo en los casos y serotipos aislados10. Los objetivos de este estudio fueron poner en contexto los datos de impacto de las actuales VNC disponibles, así como revisar la posición de los organismos internacionales con respecto a las conclusiones y las recomendaciones del uso de las VNC para reducir la carga de la enfermedad neumocócica.
Material y métodosPara preparar este manuscrito, una revisión narrativa no sistemática de la literatura fue llevada a cabo a través de la base de datos de Medline vía PubMed para identificar los artículos que evaluaban el impacto de PHiD-CV y VNC13 en niños ≤ 18 años publicados del 1 de enero del 2013 al 28 de febrero del 2019 (día de la última búsqueda), combinando los siguientes términos: pneumococcal conjugate vaccine, PCV13, 13-valent pneumococcal conjugate vaccine, PCV10, 10-valent pneumococcal conjugate vaccine, PHiD-CV, 10-valent pneumococcal non-typeable Haemophilus influenzae protein D conjugate vaccine, invasive pneumococcal disease, invasive disease, pneumonia, community-acquired pneumonia, otitis media, acute otitis media. Los artículos resultantes de esta búsqueda están incluidos en las tablas 1-4. Los artículos elegibles incluyeron publicaciones de análisis de vigilancia basada en laboratorio antes y después del uso de las vacunas, análisis de series temporales y estudios observacionales de cohorte prospectivas o retrospectivas de base poblacional. Para la comparación de algunos resultados finales para los que no se dispone de estudios de impacto, se utilizaron estudios de casos y controles y de cohortes que evalúan efectividad, no impacto, como «proxy» del impacto. Se excluyeron publicaciones reportando estudios piloto, protocolos, estudios preclínicos y análisis de costo-efectividad, portación nasofaríngea, estudios en modelos animales y aquellos cuyo objetivo era la vacunación en la población adulta. Cartas al editor, editoriales, comentarios, opiniones y artículos evaluando solo coberturas vacunales también fueron excluidos. Otros documentos técnicos o científicos fueron obtenidos a través del buscador de Google.
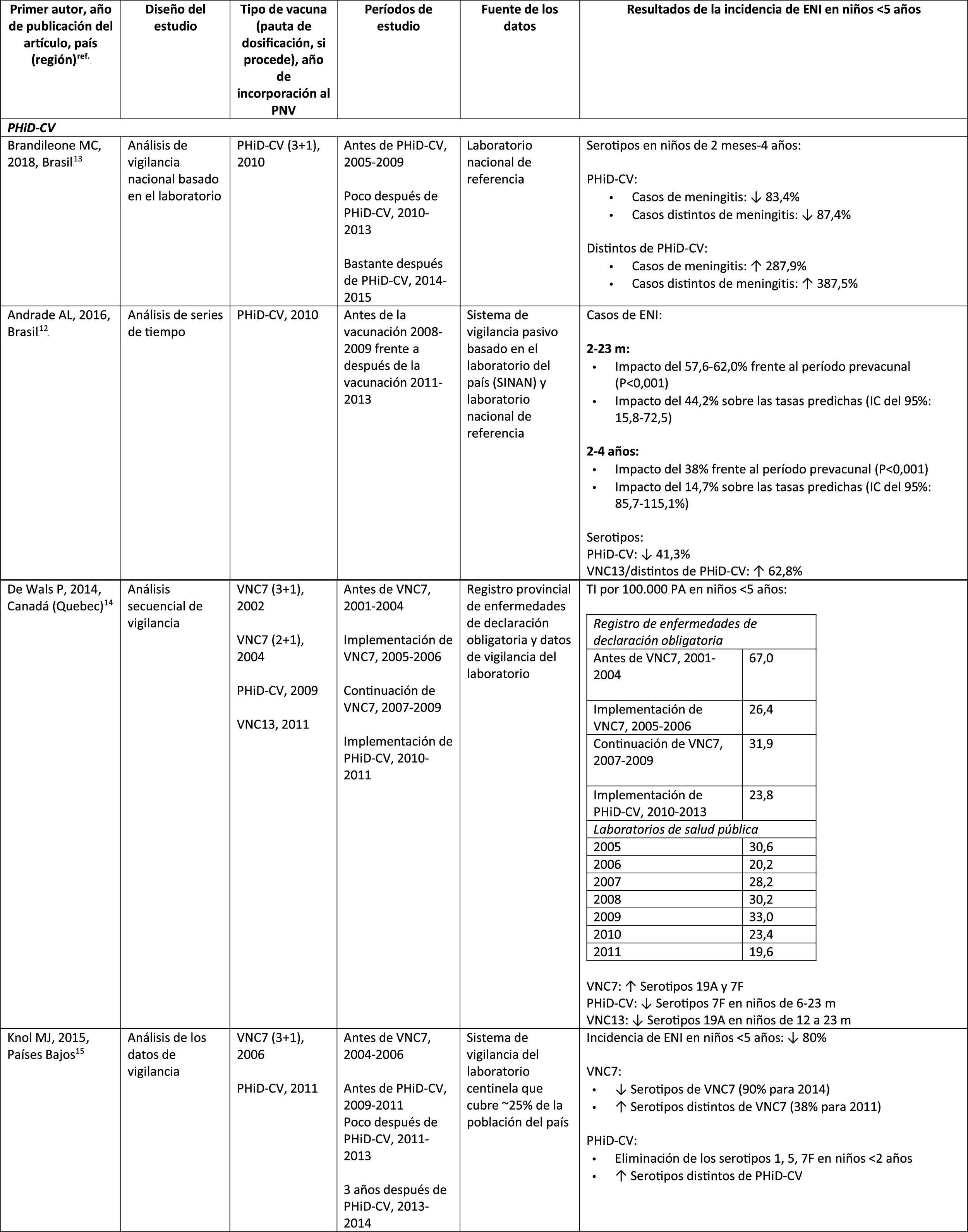
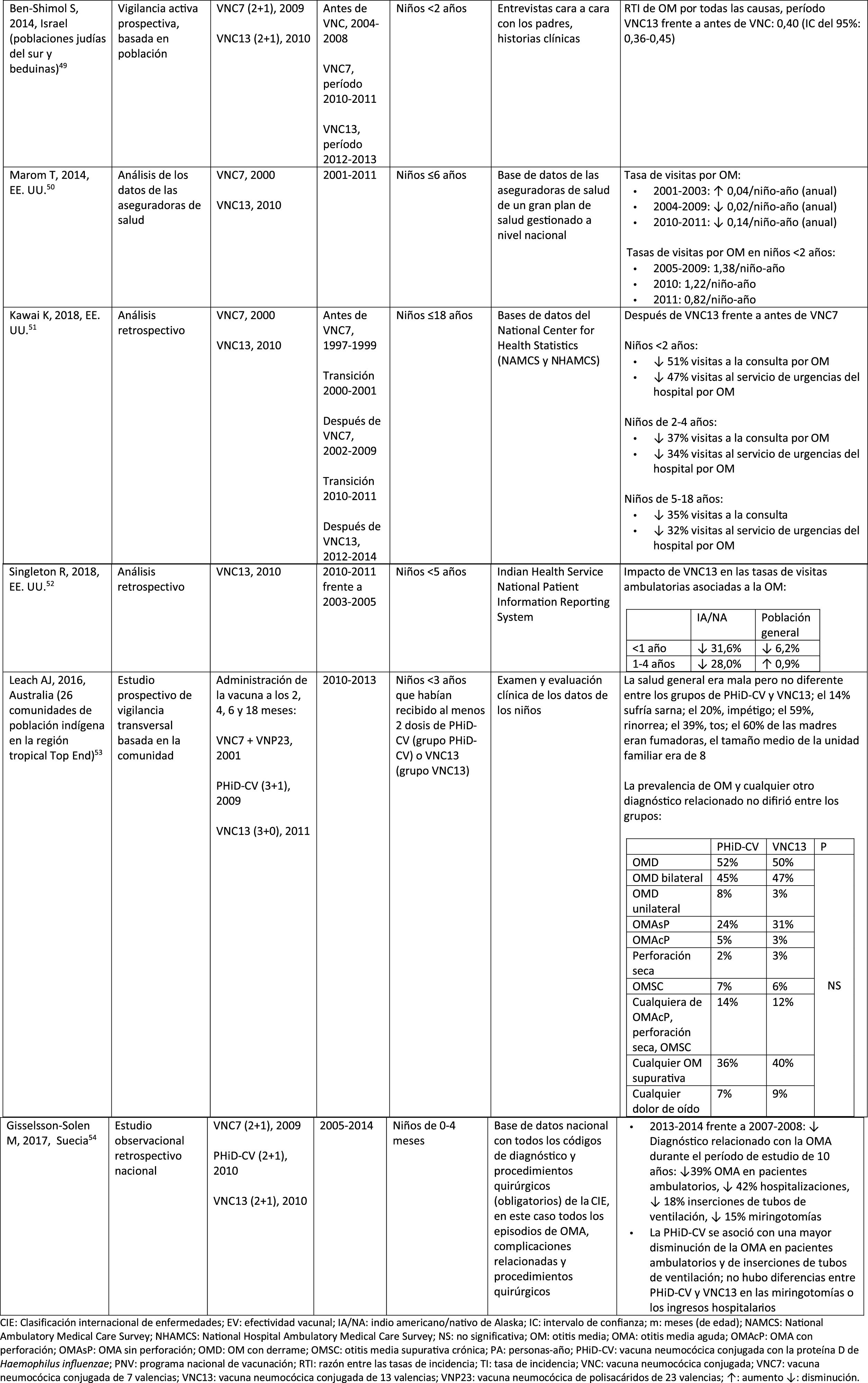
Impacto de PHiD-CV y VNC13 en la incidencia de ENI en niños < 5 años
CDC: Centers for Disease Control and Prevention (Centros para el control y la prevención de enfermedades) de EE. UU.; EE. UU.: Estados Unidos; ENI: enfermedad neumocócica invasora; EV: efectividad vacunal; IC: intervalo de confianza; m: meses (de edad); PA: personas-año; PHiD-CV: vacuna neumocócica conjugada con la proteína D de Haemophilus influenzae; PNV: programa nacional de vacunación; ref.: referencia; RTI: razón entre las tasas de incidencia; R.U.: Reino Unido; SINAN: Sistema nacional brasileño de vigilancia de enfermedades no contagiosas; TI: tasa de incidencia; VNC: vacuna neumocócica conjugada; VNC7: vacuna neumocócica conjugada de 7 valencias; VNC13: vacuna neumocócica conjugada de 13 valencias; ↑: aumento; ↓: disminución.
a Condados seleccionados en California, Colorado, Georgia, Maryland, Nueva York, Oregón, Tennessee y estados de Connecticut, Minnesota, Nuevo México.
b A.P. Bolzano, A.P. Trento, Emilia-Romagna, Friuli-Venezia Giulia, Lombardia, Piemonte, Veneto.
c Se ha utilizado muy poco en España28.
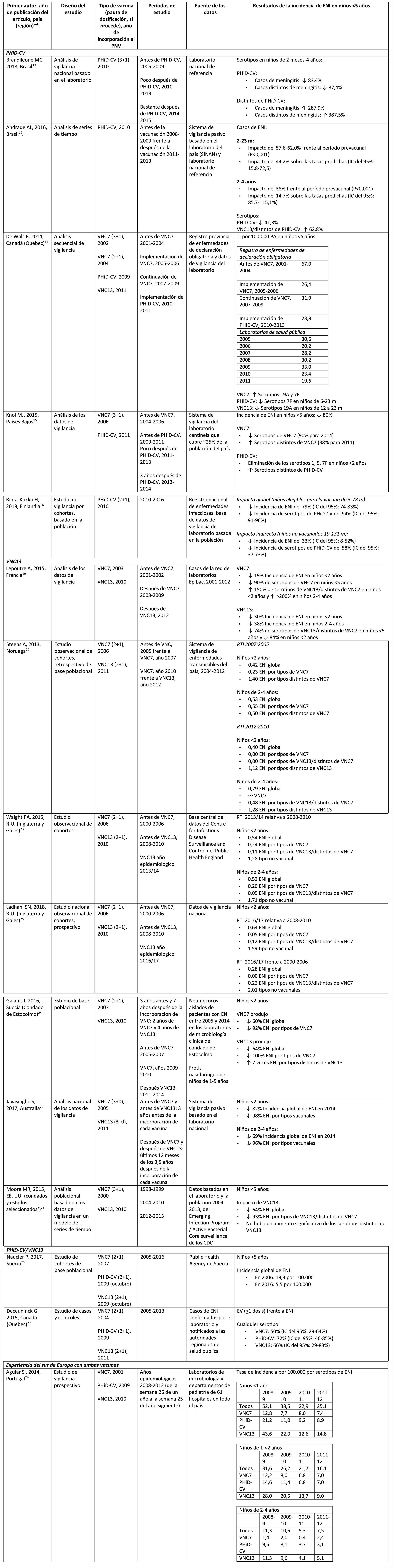
Impacto de PHiD-CV y VNC13 en la neumonía
ENI: enfermedad neumocócica invasora; IC: intervalo de confianza; PA: personas-año; PHiD-CV: vacuna neumocócica conjugada con la proteína D de Haemophilus influenzae; PNV: programa nacional de vacunación; RTI: razón entre las tasas de incidencia; VNC: vacuna neumocócica conjugada; VNC7: vacuna neumocócica conjugada de 7 valencias; VNC13: vacuna neumocócica conjugada de 13 valencias; ↑: aumento ↓: disminución.
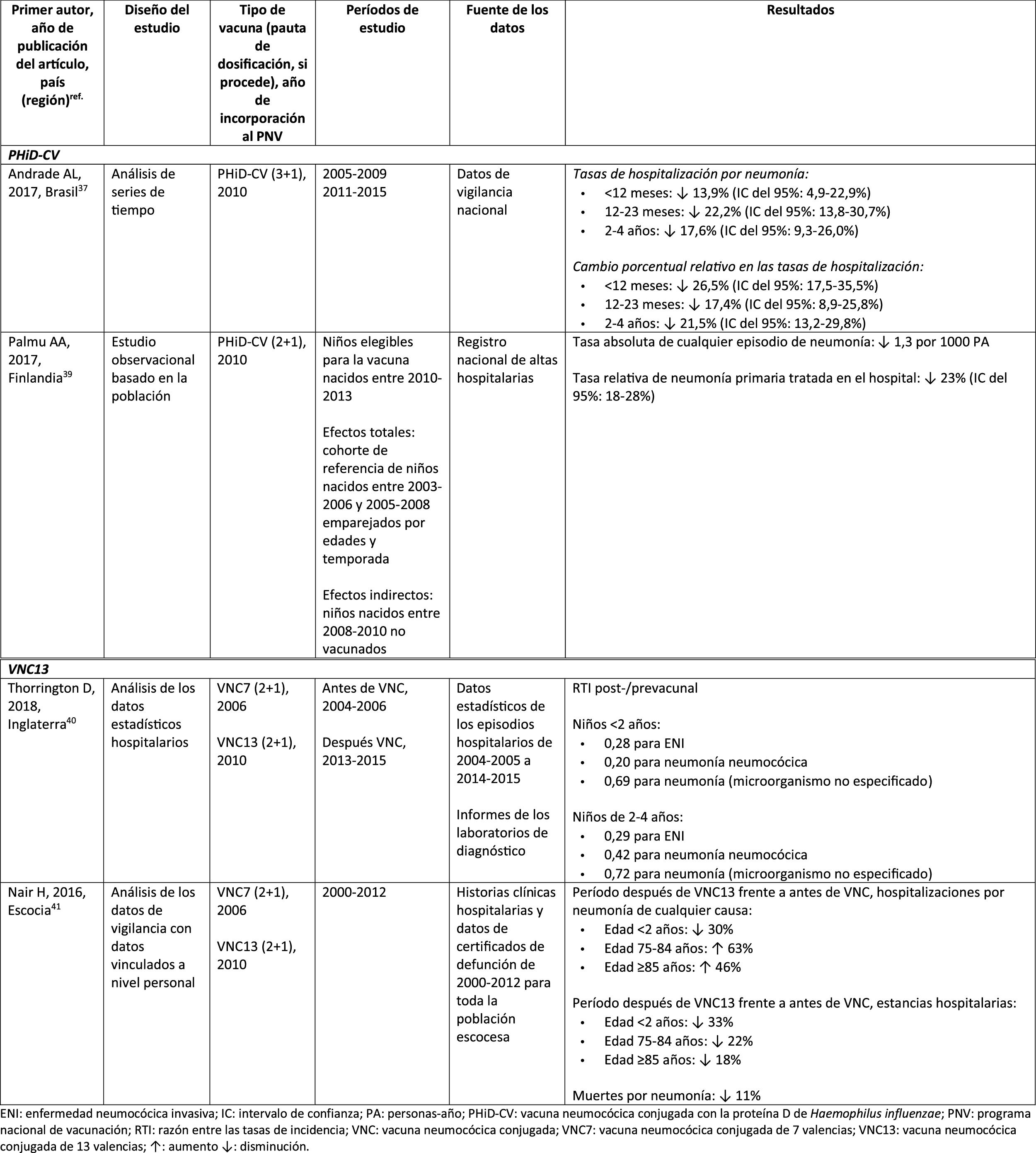
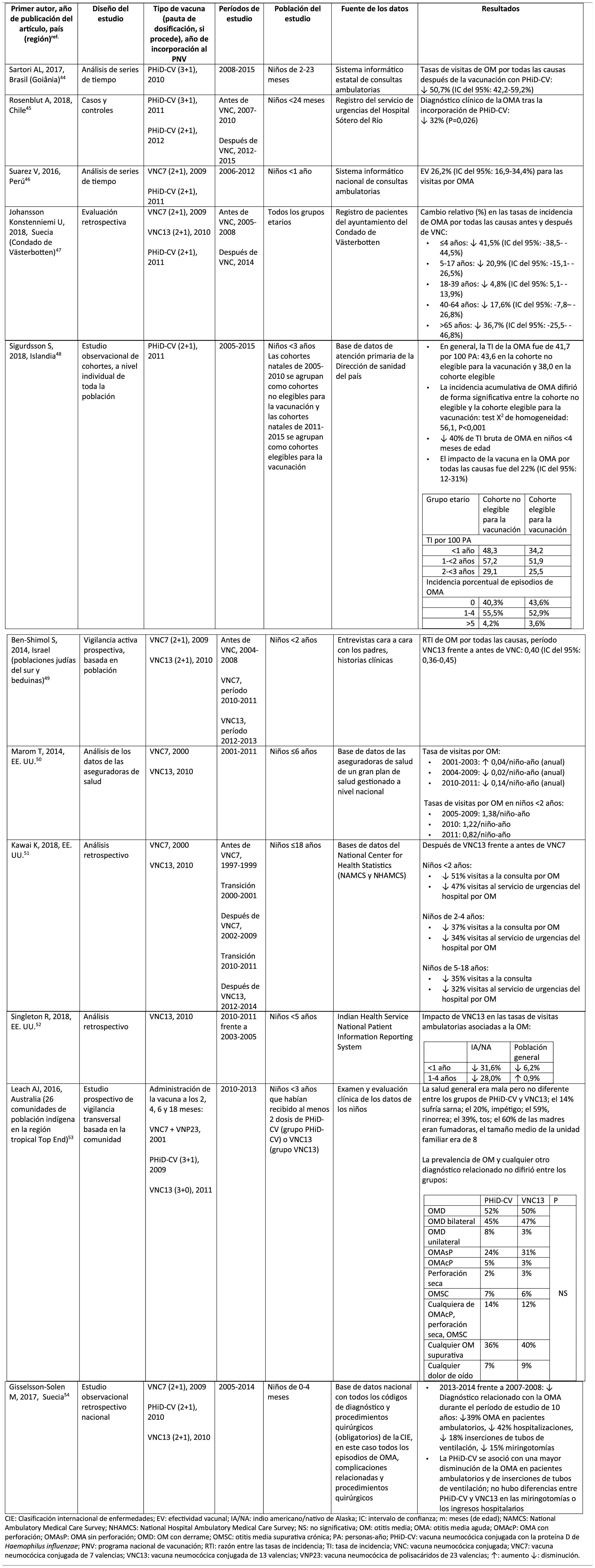
Impacto de PHiD-CV y VNC13 en la OMA
CIE: Clasificación internacional de enfermedades; EV: efectividad vacunal; IA/NA: indio americano/nativo de Alaska; IC: intervalo de confianza; m: meses (de edad); NAMCS: National Ambulatory Medical Care Survey; NHAMCS: National Hospital Ambulatory Medical Care Survey; NS: no significativa; OM: otitis media; OMA: otitis media aguda; OMAcP: OMA con perforación; OMAsP: OMA sin perforación; OMD: OM con derrame; OMSC: otitis media supurativa crónica; PA: personas-año; PHiD-CV: vacuna neumocócica conjugada con la proteína D de Haemophilus influenzae; PNV: programa nacional de vacunación; RTI: razón entre las tasas de incidencia; TI: tasa de incidencia; VNC: vacuna neumocócica conjugada; VNC7: vacuna neumocócica conjugada de 7 valencias; VNC13: vacuna neumocócica conjugada de 13 valencias; VNP23: vacuna neumocócica de polisacáridos de 23 valencias; ↑: aumento ↓: disminución.
Protección cruzada de PHiD-CV frente a los serotipos 19A y 6A en niños vacunados
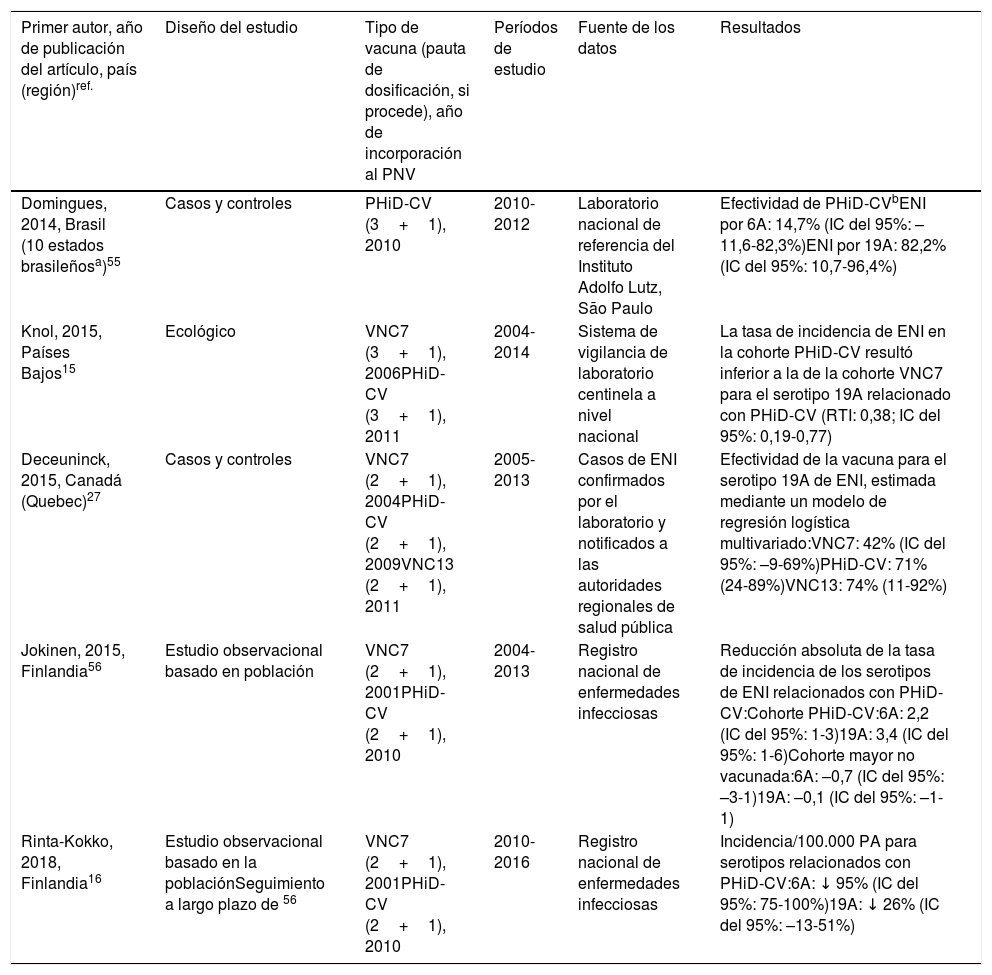
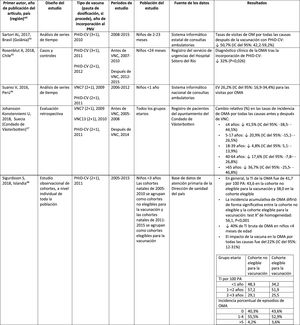
| Primer autor, año de publicación del artículo, país (región)ref. | Diseño del estudio | Tipo de vacuna (pauta de dosificación, si procede), año de incorporación al PNV | Períodos de estudio | Fuente de los datos | Resultados |
|---|---|---|---|---|---|
| Domingues, 2014, Brasil (10 estados brasileñosa)55 | Casos y controles | PHiD-CV (3+1), 2010 | 2010-2012 | Laboratorio nacional de referencia del Instituto Adolfo Lutz, São Paulo | Efectividad de PHiD-CVbENI por 6A: 14,7% (IC del 95%: –11,6-82,3%)ENI por 19A: 82,2% (IC del 95%: 10,7-96,4%) |
| Knol, 2015, Países Bajos15 | Ecológico | VNC7 (3+1), 2006PHiD-CV (3+1), 2011 | 2004-2014 | Sistema de vigilancia de laboratorio centinela a nivel nacional | La tasa de incidencia de ENI en la cohorte PHiD-CV resultó inferior a la de la cohorte VNC7 para el serotipo 19A relacionado con PHiD-CV (RTI: 0,38; IC del 95%: 0,19-0,77) |
| Deceuninck, 2015, Canadá (Quebec)27 | Casos y controles | VNC7 (2+1), 2004PHiD-CV (2+1), 2009VNC13 (2+1), 2011 | 2005-2013 | Casos de ENI confirmados por el laboratorio y notificados a las autoridades regionales de salud pública | Efectividad de la vacuna para el serotipo 19A de ENI, estimada mediante un modelo de regresión logística multivariado:VNC7: 42% (IC del 95%: –9-69%)PHiD-CV: 71% (24-89%)VNC13: 74% (11-92%) |
| Jokinen, 2015, Finlandia56 | Estudio observacional basado en población | VNC7 (2+1), 2001PHiD-CV (2+1), 2010 | 2004-2013 | Registro nacional de enfermedades infecciosas | Reducción absoluta de la tasa de incidencia de los serotipos de ENI relacionados con PHiD-CV:Cohorte PHiD-CV:6A: 2,2 (IC del 95%: 1-3)19A: 3,4 (IC del 95%: 1-6)Cohorte mayor no vacunada:6A: –0,7 (IC del 95%: –3-1)19A: –0,1 (IC del 95%: –1-1) |
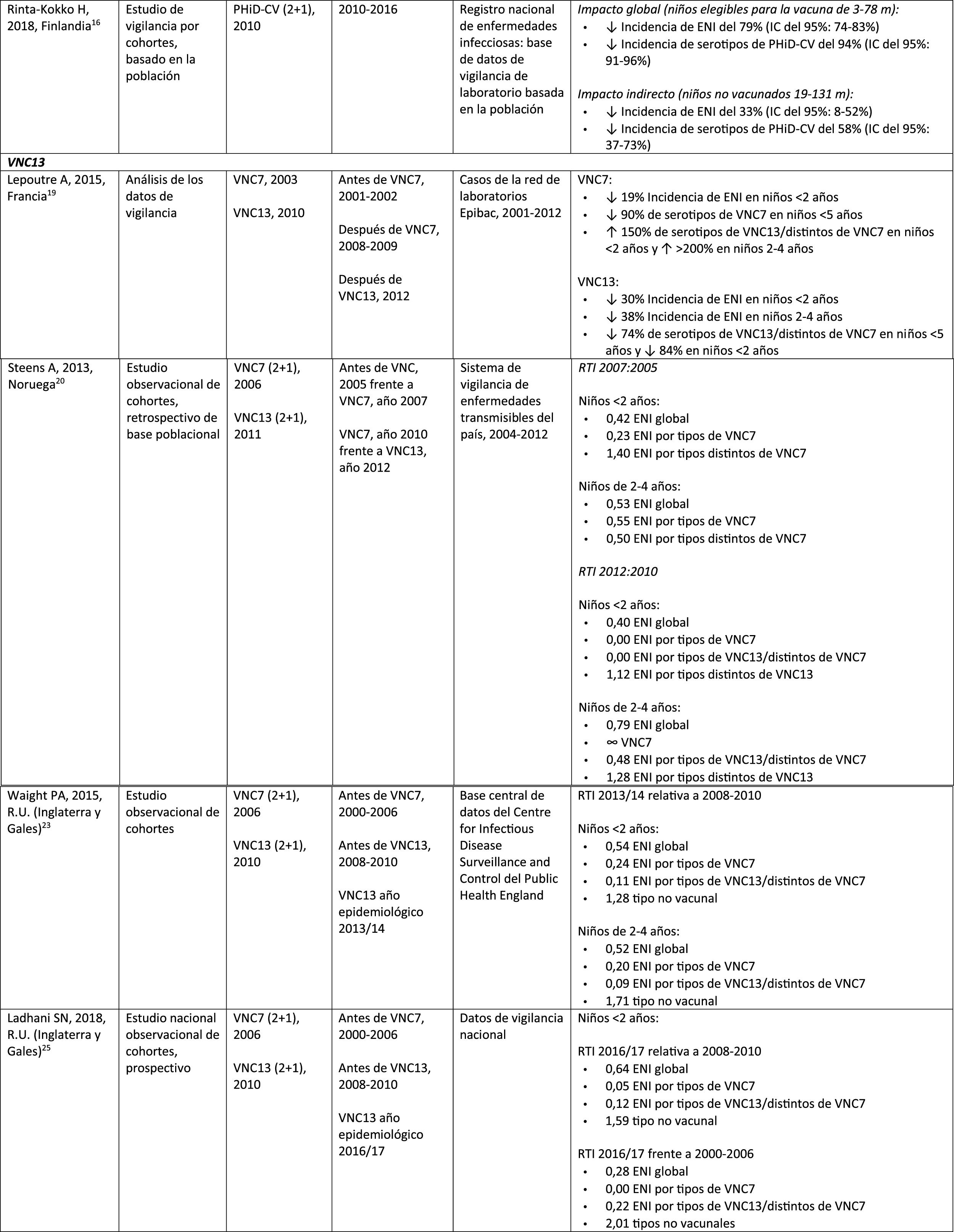
| Rinta-Kokko, 2018, Finlandia16 | Estudio observacional basado en la poblaciónSeguimiento a largo plazo de 56 | VNC7 (2+1), 2001PHiD-CV (2+1), 2010 | 2010-2016 | Registro nacional de enfermedades infecciosas | Incidencia/100.000 PA para serotipos relacionados con PHiD-CV:6A: ↓ 95% (IC del 95%: 75-100%)19A: ↓ 26% (IC del 95%: –13-51%) |
ENI: enfermedad neumocócica invasiva; IC: intervalo de confianza; m: meses (de edad); PA: personas-año; PHiD-CV: vacuna neumocócica conjugada con la proteína D de Haemophilus influenzae; RTI: razón entre las tasas de incidencia; VNC: vacuna neumocócica conjugada; VNC7: vacuna neumocócica conjugada de 7 valencias; VNC13: vacuna neumocócica conjugada de 13 valencias.
En Brasil, según un análisis de serie temporal, 3años después de su incorporación en 2010, la PHiD-CV tuvo un impacto sobre los casos de ENI en niños<4 años, particularmente sobre los serotipos contenidos en la vacuna, mientras que habían aumentado los serotipos no contenidos en la vacuna12. Del mismo modo, en un estudio posterior de vigilancia por laboratorio se comunicó que, 5años después de la introducción de PHiD-CV, los serotipos contenidos en la vacuna habían disminuido de forma considerable, cambiando así el perfil de los serotipos restantes que causan la ENI13. Otro hallazgo importante consistió en que, 3años después de la introducción de PHiD-CV, se encontró un impacto sustancial sobre los serotipos contenidos en la vacuna en la población no vacunada (18-64 y ≥ 65 años), lo que denota inmunidad de grupo13. Los serotipos 19A, 6C y 3, que se habían incrementado de manera sustancial en todos los grupos de edad, fueron las principales causas de las ENI restantes en Brasil13.
En un estudio de Canadá se observó un impacto en la incidencia global de ENI (sobre todo por los serotipos 7F y 19A) en niños<5 años expuestos a PHiD-CV14.
En los Países Bajos, donde se implementó VNC7 en 2006 y se sustituyó por PHiD-CV en 2011, hubo un impacto del 80% de reducción sobre la incidencia global de la ENI en niños<5 años15.
En un estudio de cohortes de Finlandia en niños de ≤ 6,5 años se demostró que, 6años después de la incorporación de PHiD-CV en 2010, hubo un impacto del 79% de reducción sobre la incidencia de la ENI global, con un 94% de reducción en la incidencia de los serotipos incluidos en la vacuna16. Hubo un impacto del 40% de reducción sobre la incidencia de la ENI (de 6,3 a 3,8 por 100.000 personas/año), debido sobre todo a la disminución relativa del 95% en la incidencia del serotipo 6A; el impacto sobre la reducción de la incidencia del serotipo 19A no alcanzó significación estadística16.
En 2018, en un breve informe belga se indicaba que, tras el cambio de VNC13 a PHiD-CV, la incidencia de ENI relacionada con el serotipo 19A se había multiplicado por 10entre los niños de ≤ 2 años17. Sin embargo, este análisis se basó en datos de tipificación de un solo año y no en varios años de vigilancia. Además, los autores no tuvieron en cuenta el aumento similar de la ENI observado antes del cambio ni tampoco consideraron la disminución en la incidencia de la ENI en niños<1 año asociada con PHiD-CV18.
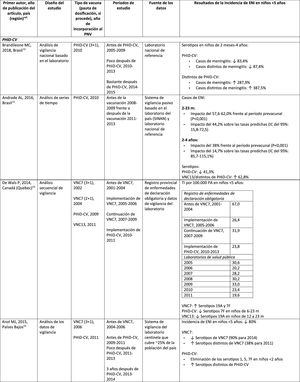
Impacto de VNC13 en poblaciones distintasEn un estudio realizado en Francia se comprobó que, 2años después de la incorporación de VNC13, que reemplazó a VNC7 en 2010, hubo un impacto en la incidencia de la ENI global y de la ENI por los serotipos de VNC13 distintos de VNC719. Sin embargo, el período prevacunal era corto y no permitió una evaluación adecuada de las tendencias prevacunales19.
En un estudio observacional retrospectivo noruego basado en la población se observó un impacto en la incidencia global de la ENI, en especial en niños<2 años (60%, de 20 a 8,1 por 100.000), 2años después de la incorporación de VNC1320.
Investigadores de los EE. UU. utilizaron un modelo de series temporales para comparar la incidencia real frente a la esperada si la VNC13 no hubiera reemplazado nunca a la VNC721. Señalaron que la VNC13 habría tenido un impacto del 64% de reducción sobre la incidencia global de la ENI en los niños<5 años. Una limitación de este estudio es que, según el modelo, la incidencia de ENI debida a los serotipos de VNC13/distintos de VNC7 seguiría aumentando después de la incorporación de VNC1321.
En un estudio realizado en Australia se compararon períodos equivalentes de 3,5 años después de la incorporación de VNC7 y de VNC1322. Los autores describieron un impacto del 11% de reducción sobre la incidencia global de ENI en todas las edades después de incorporar VNC13, comparado con el período anterior a VNC13. Al comparar períodos equivalentes de VNC7, el impacto resultó del 42%. Tras la incorporación de VNC13, se demostró que solo el impacto en la incidencia de ENI debida al serotipo 19A tenía una magnitud similar a la observada después de la implementación de VNC722.
En 2estudios, uno de Inglaterra y Gales23 y otro de Suecia24, se evaluó el impacto de VNC13 durante los primeros 4años después de su incorporación (2010). En el estudio de Inglaterra y Gales se comunicó un impacto del 32% de reducción sobre la incidencia global de ENI en todos los grupos etarios, en comparación con el período anterior a VNC13. Hubo un impacto del 69% de reducción sobre la incidencia de ENI debida a los serotipos de VNC13/distintos de VNC7 y la mayor reducción ocurrió en niños<5 años de edad (91% en niños de 2-4 años y 89% en niños<2 años)23. Con respecto a los serotipos adicionales específicos de VNC13, hubo un impacto significativo de reducción sobre la incidencia de los serotipos 1, 6A, 7F y 19A en todos los grupos etarios (en niños de<5 años, los descensos alcanzaron el 91%, 100%, 91% y 91%, respectivamente) pero el serotipo 3 mostró fluctuaciones anuales y solo se redujo de forma significativa en los grupos etarios de 5–64 años (59%) y >65 años (44%)23. En el estudio de Suecia se observó un impacto estadísticamente significativo sobre la incidencia global de ENI en niños<2 años, en comparación con el período anterior a VNC7 y un impacto no estadísticamente significativo en comparación con el período posterior a VNC724. En consonancia con el estudio de Inglaterra y Gales, hubo un impacto sobre la incidencia de ENI por todos los serotipos de VNC13, excepto la del serotipo 3, que se elevó. Entre los serotipos que disminuyeron, solo el 7F lo hizo de modo significativo en el período posterior a VNC13, en comparación con el período posterior a VNC724.
Siete años después de la incorporación de VNC13 en Inglaterra y Gales, la incidencia de ENI era solo un 7% más baja (razón entre las tasas de incidencia [RTI] 0,93; intervalo de confianza [IC] del 95%: 0,89-0,97) que en el período anterior a VNC13 (10,13 por 100.000)25. Las grandes reducciones de ENI con VNC13 que se lograron 4años después de la incorporación de la vacuna se vieron afectadas por el rápido aumento (RTI: 1,97; IC del 95%: 1,86-2,09) en la incidencia de ENI por serotipos no incluidos en VNC13 (7,97 por 100.000)25. Los serotipos 8, 12F y 9N representaron el 40% del total de la ENI25.
Comparación del impacto de PHiD-CV y VNC13 en una misma poblaciónEn un estudio poblacional de cohortes realizado en Suecia se comparó la incidencia de la ENI por serotipos específicos antes y después de la incorporación de PHiD-CV y VNC13 en 200926. Ambas vacunas se asociaron con un impacto (83% de reducción) del serotipo 6A. No hubo impacto positivo sobre el serotipo 3 con ninguna de las vacunas. El serotipo 19A alcanzó una incidencia de 1,1 por 100.000 habitantes en los niños<5 años en los condados donde se usó PHiD-CV frente a ningún caso en los que emplearon VNC13. El impacto de las 2vacunas sobre la incidencia global de ENI no resultó estadísticamente diferente (comparación de RTI: 1,00; IC del 95%: 0,89-1,12)26.
En un estudio canadiense se evaluó la efectividad de las 3VNC en casos confirmados en el laboratorio de niños ≤ 5 años mediante la revisión de sus registros de vacunación27. La efectividad sobre la ENI global fue del 72% con PHiD-CV, del 66% con VNC13 y del 50% con VNC7; la efectividad contra el serotipo 19A fue del 71, el 74 y el 42%, respectivamente27.
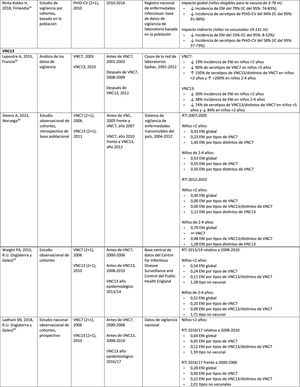
Experiencia con ambas vacunas en el sur de EuropaLa evidencia actual de los datos de vigilancia del sur de Europa sugiere un impacto sobre la incidencia de la ENI tras incorporar las vacunas conjugadas28.
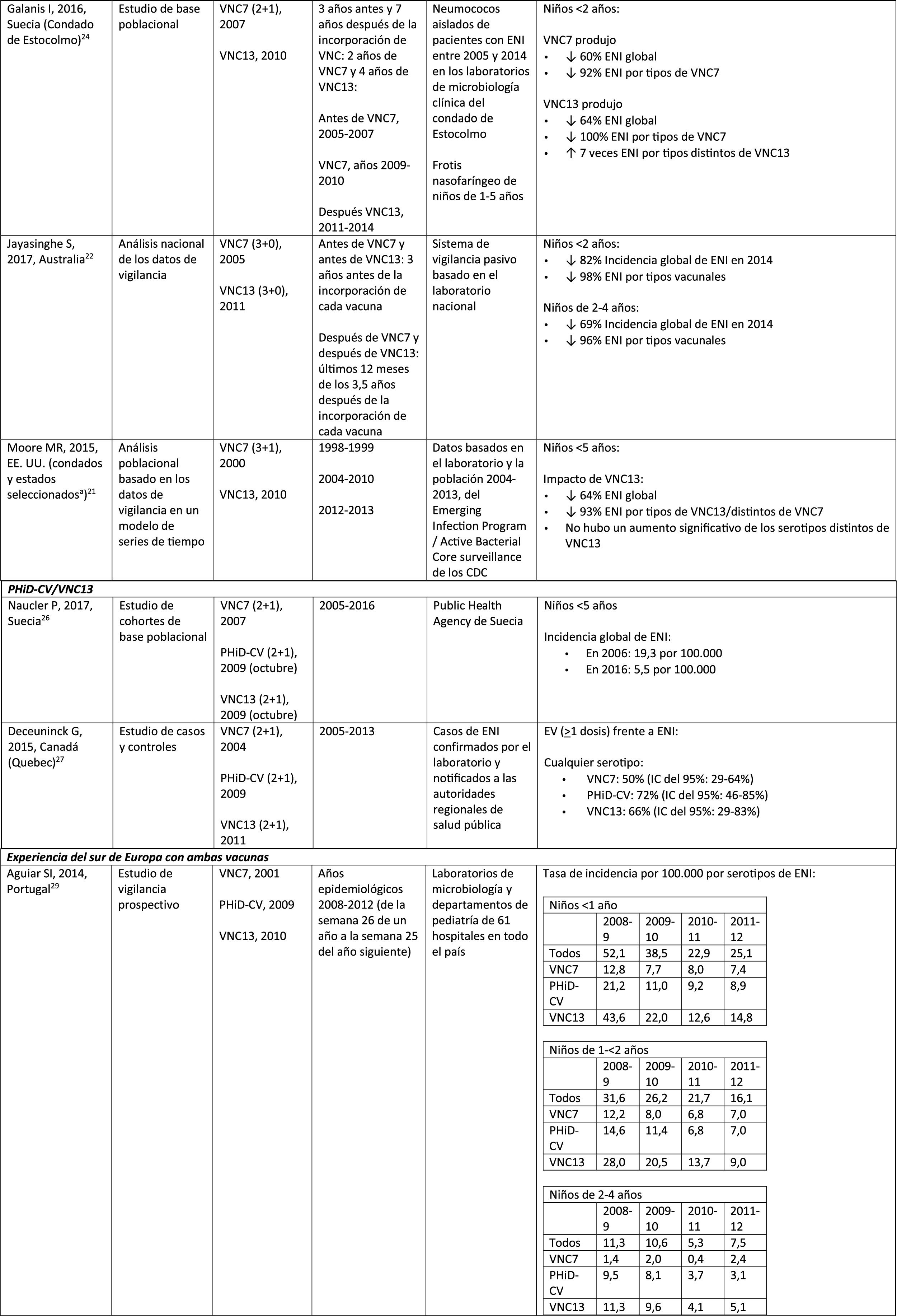
En Portugal, en un estudio de vigilancia activa hubo un impacto significativo de reducción sobre la incidencia global de ENI en niños<5 años al comparar el período anterior a PHiD-CV y posterior a VNC13 (2009 y 2010, respectivamente)29.
En Italia, la evidencia revela que la incorporación de VNC13 tuvo un impacto significativo de reducción sobre la incidencia de ENI en los niños<5 años30 y que el programa general de vacunación con VNC resultó altamente efectivo31.
En España, en un estudio realizado en Madrid se comunicó un impacto de reducción sobre la incidencia global de ENI tras la incorporación de VNC1332. Entre los serotipos vacunales, el más prevalente fue el serotipo 3. Sin embargo, estos resultados se encuentran limitados por la ausencia de datos de períodos anteriores a VNC732.
En Cataluña, un estudio reciente demostró un impacto del 26,2% de reducción sobre la ENI global en el período de uso de VNC13 con una cobertura de vacunación intermedia en niños de<2 años (64%). El mayor impacto de reducción fue observado en los niños de 2 a 4 años de edad (44,5%)33.
En un análisis de vigilancia de Navarra con datos basados en la población activa se evaluó el impacto de VNC13 3años después de su incorporación en sustitución de VNC734. El estudio mostró un impacto sobre la incidencia de ENI en los niños<5 años. Hubo un impacto del 81% de reducción sobre la incidencia de ENI causada por los serotipos de la vacuna.
En un estudio de vigilancia prospectiva de Mallorca se examinó la evolución de los casos de ENI en niños <15 años que requirieron hospitalización después de la llegada de las VNC al mercado privado35. El estudio mostró un impacto en ≥ 50% debido a la reducción significativa en la incidencia de ENI por los serotipos vacunales incluidos en PHiD-CV y VNC1335. Aunque en el estudio se incluyeron todos los ingresos hospitalarios pediátricos motivados por una ENI en el período 2008-2010, las conclusiones se ven limitadas por el pequeño número de pacientes incluidos (66 casos de ENI a todas las edades, solo 25 entre niños ≤ 2 años)35.
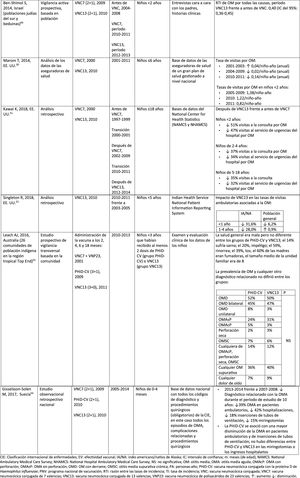
NeumoníaImpacto de PHiD-CV en poblaciones distintasEn una revisión del 2016 sobre el impacto en la incorporación de PHiD-CV al programa brasileño de vacunación infantil en 2010 se extrajeron 8informes demostrando un impacto de reducción de PHiD-CV sobre NAC del 40%, un impacto de reducción entre el 12,7 y el 28,7% sobre las tasas de hospitalización por neumonía y un impacto de reducción del 16,9% en niños de 2-23 meses en comparación con la mortalidad secundaria a otras causas respiratorias36.
En 2017, en un análisis de series temporales de los datos nacionales de vigilancia por ingreso hospitalario en Brasil después de la incorporación de PHiD-CV se observaron disminuciones significativas en las tasas de hospitalización por neumonía en todos los grupos etarios hasta una edad de 49 años, que variaron entre el 13,9 y el 22,2%. El impacto de PHiD-CV en la reducción de la hospitalización de los niños <5 años osciló entre el 17,4 y el 26,5%37.
El impacto de PHiD-CV en la reducción de los casos de neumonía también se detectó en 2estudios finlandeses, los primeros estudios del impacto nacional basados en la población para documentar los efectos directos e indirectos de la vacunación sistemática con PHiD-CV entre los niños aptos para la vacunación y los no vacunados38,39. Después de la incorporación de PHiD-CV en 2010, estos estudios revelaron un impacto sustancial en la reducción del total de casos de neumonía y de la neumonía tratada en el hospital entre niños que reunían los requisitos para recibir la vacuna y entre niños mayores no vacunados39.
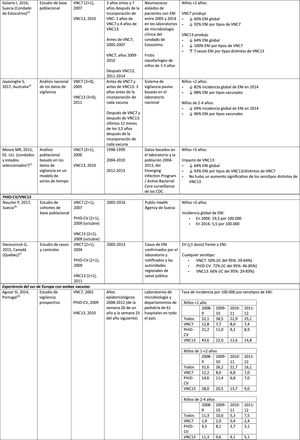
Impacto de VNC13 en poblaciones distintasEn un estudio realizado en Inglaterra, en el que se utilizaron los datos de todos los ingresos hospitalarios, se comparó la incidencia de las variables de la enfermedad neumocócica específica en un período de 24 meses previo a la VNC7 (2004-2006) frente al período posterior a la VNC13 (2013-2015)40. Se observaron reducciones relativas de la neumonía neumocócica en todos los grupos etarios, con independencia de la presencia de factores de riesgo. En el caso de la neumonía de causa no especificada, se registraron descensos entre los niños <15 años y el impacto máximo del 34% de reducción se dio en los <2 años40.
En un estudio escocés se estimó un impacto del 30% de reducción sobre las tasas de hospitalización por neumonía por cualquier causa en niños <2 años tras la incorporación de VNC13 en 2010, en comparación con el período anterior a VNC7 (2006). Sin embargo, las tasas correspondientes aumentaron entre los adultos >75 años. Las muertes por neumonía y hospitalización por neumonía neumocócica disminuyeron en todos los grupos etarios41.
Comparación del impacto de PHiD-CV y VNC13 en la misma poblaciónEn una revisión sistemática de estudios de países de Latinoamérica y el Caribe se analizó el impacto de la vacunación en niños <5 años42. Sin embargo, en ninguno de los estudios incluidos se comparó el impacto de PHiD-CV y VNC13, y existía un alto grado de heterogeneidad que impedía realizar un metaanálisis42. La revisión mostró un impacto entre el 8,8 y el 37,8% de reducción para la neumonía confirmada por radiografía, y entre el 7,4 y el 20,6% de reducción para la neumonía clínica. Los resultados variaron con la edad, la definición de caso y el tipo de vacuna42. En conjunto, esta revisión sistemática no reveló una superioridad de una vacuna sobre la otra con respecto a las hospitalizaciones por ENI, la neumonía y la meningitis en niños <5 años42.
En una revisión sistemática y un metaanálisis de los estudios publicados entre 2000 y 2016 se observó que tanto PHiD-CV como VNC13 ejercieron un impacto significativo reduciendo las tasas de hospitalización por neumonía clínica en niños <24 meses en un 16% (RTI: 0,84; IC del 95%: 0,78-0,90) con PHiD-CV y en un 29% (RTI: 0,71, IC del 95%: 0,70-0,72) con VNC1343.
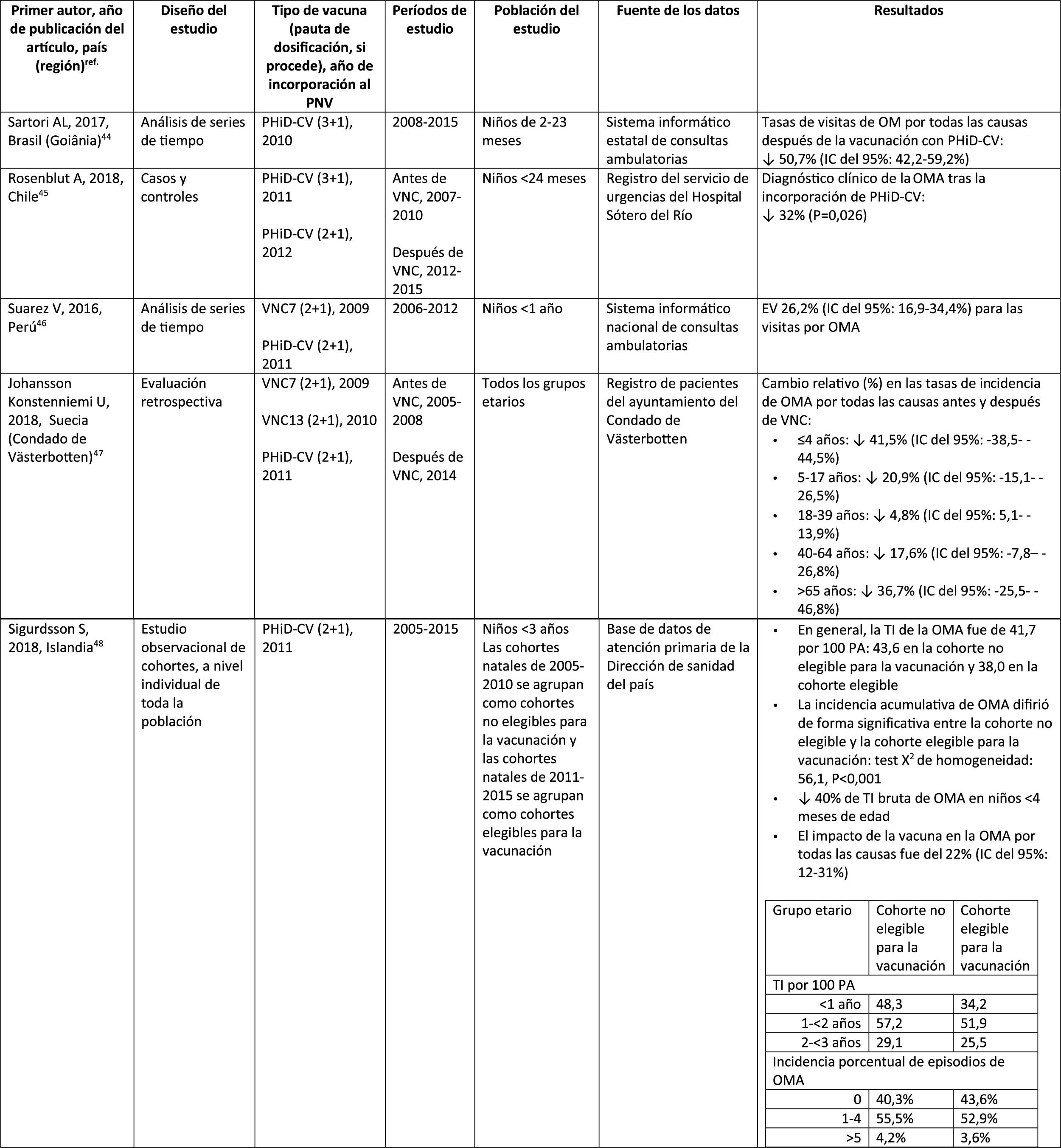
Otitis media agudaImpacto de PHiD-CV en poblaciones distintasEn un análisis de series temporales, efectuado en el municipio de Goiânia en Brasil, se estimó que el impacto de PHiD-CV sobre la OM por cualquier causa era del 43,0% de reducción (IC del 95%: 41,4-44,5%) entre los niños de 2 a 23 meses44.
En un estudio de Chile, en el que se evaluó la frecuencia de la OMA en niños <24 meses atendidos en el servicio de urgencias de un hospital, se halló una efectividad del 32% (p=0,026) de la OMA tras la implementación de PHiD-CV en el programa nacional de vacunación chileno45.
En Perú, las tasas de visitas ambulatorias por OMA entre los niños <1 año disminuyeron de manera significativa, lo que se corresponde con un impacto combinado (VNC7 y PHiD-CV) de reducción del 26,2% (IC del 95%: 16,9-34,4%)46.
En Suecia (condado de Västerbotten), donde se reemplazó VNC7 por VNC13 en 2010 y por PHiD-CV en 2011, hubo un impacto significativo de reducción sobre la incidencia de la OMA por todas las causas en niños ≤ 4 años (41,5%, IC del 95%: –38,5-44,5%) tras la incorporación de las VNC47.
En un estudio realizado en Islandia se comparó la incidencia de OMA por todas las causas en niños <3 años antes y después de la incorporación de PHiD-CV (2011) y se demostró que PHiD-CV tuvo un impacto significativo al reducir la OMA por todas las causas48. PHiD-CV disminuyó de forma significativa la frecuencia de los 2primeros episodios y la incidencia de la OMA en todos los grupos etarios. La mayor disminución de la incidencia se produjo en los niños <4 meses (40%, IC del 95%: 31-49%), un grupo etario demasiado joven para la vacunación, lo que sugiere la existencia de inmunidad de grupo48.
Impacto de VNC13 en poblaciones distintasEn 2014, 2estudios, uno de Israel49 y otro de EE. UU.50, revelaron un impacto sustancial de VNC13 en la OM. En el estudio israelí se notificó un impacto del 60% de reducción en la incidencia de OM por todas las causas tras la incorporación de VNC13 (2010), en comparación con el período anterior a VNC7 (2009)49. En el estudio de los EE. UU. se comprobó un impacto sobre las consultas pediátricas por OM, en particular entre los niños <2 años, tras la incorporación de VNC13 (2010)50.
En 2018, se publicaron 2estudios estadounidenses más, uno sobre las visitas ambulatorias asociadas a la OM51 y otro sobre casos de OM en niños indígenas americanos/nativos de Alaska (IA/NA)52. En el estudio sobre las visitas ambulatorias anuales por OM hubo un impacto significativo de las visitas a la consulta médica (35-51% de reducción), así como de las visitas al servicio de urgencias (32-47% de reducción), en particular en los niños <2 años, durante el período posterior a la incorporación de VNC13 (2012-2014), en comparación con el periodo anterior a VNC7 (1997-1999)51. En el estudio de niños IA/NA se indicó que las visitas ambulatorias por OM habían disminuido después de la incorporación de VNC13. Entre los lactantes IA/NA, la tasa de visitas ambulatorias por OM después de la incorporación de VNC13 (2010-2011) fue de 130,5 por 100 lactantes/año, cifra 1,6 veces superior a las tasas de visitas entre la población lactante de los EE. UU.52.
Comparación del impacto de PHiD-CV y VNC13 en la misma poblaciónLos datos de vigilancia de una población de niños indígenas australianos <3 años con una prevalencia alta de OM mostraron que la salud general y la salud auditiva eran estadísticamente similares, con independencia de la administración de PHiD-CV o VNC1353. La prevalencia de OM supurativa fue estadísticamente similar entre las cohortes de PHiD-CV y VNC13 en cualquiera de los grupos etarios de <12 meses, 1-<2 años y 2-<3 años53.
En un estudio observacional de Suecia, en el que se evaluaron los diagnósticos relacionados con la OMA en niños de 0-4 años durante un período de 10 años, que cubrían la etapa anterior y posterior a la introducción de las VNC, se observó que, en el año 2014, la razón de riesgo de los episodios ambulatorios de OMA y de la inserción de tubos de ventilación se había reducido en un 25% y en un 22%, respectivamente, en los condados donde se usó PHiD-CV en comparación con aquellos donde se empleó VNC13 (p <0,001)54.
Protección cruzadaProtección cruzada de PHiD-CV frente al serotipo 19A en niños vacunadosEn un estudio sobre cepas neumocócicas aisladas de niños brasileños durante los 2primeros años después de la comercialización se demostró protección cruzada con PHiD-CV y su efectividad frente al serotipo 19A55.
En un estudio en los Países Bajos sobre los datos de vigilancia que cubrían los períodos anteriores a VNC7 (2004-2006) y posteriores a PHiD-CV (2011-2014) no se llegó a ninguna conclusión sobre la protección cruzada frente al serotipo 19A15. Aunque hubo un impacto con PHiD-CV sobre la incidencia de ENI relacionada con el serotipo 19A en comparación con la cohorte VNC7, este no fue distinto del registrado para la ENI causada por los serotipos no relacionados con la vacuna15.
En ese mismo año (2015) se publicó un estudio canadiense, en el que PHiD-CV sustituyó VNC7 en 2009 y VNC13 sustituyó a PHiD-CV en 2011; en él se informaba de la protección cruzada de PHiD-CV frente a la ENI por serotipo 19A, tras un análisis de los datos obtenidos durante un período de 8años desde la etapa de VNC7 hasta la posterior a VNC1327.
Además, un estudio finlandés sugirió que después de 3años de la incorporación de PHiD-CV había protección cruzada frente a la ENI por serotipo 19A en niños aptos para la vacunación56. Sin embargo, el seguimiento a largo plazo de este estudio (6 años tras la incorporación de PHiD-CV) no reveló ningún impacto significativo de PHiD-CV sobre la ENI causada por el serotipo 19A16. La edad de los niños se asoció con el período del calendario, ya que los casos de ENI relacionados con 19A se registraron principalmente en niños mayores y ocurrieron al final del período de seguimiento. Esto podría deberse a un aumento de la presión ejercida por la infección por 19A y/o a un posible efecto inicial de protección cruzada causado por el componente 19F de PHiD-CV, que disminuyó gradualmente con la edad, lo que explicaría que los niños vacunados fueran susceptibles frente a la ENI por 19A. Sin embargo, no se obtuvieron conclusiones dado el limitado número de casos y la tendencia secular de los casos de 19A16.
Protección cruzada de PHiD-CV frente al serotipo 6AEn algunos estudios se señala una posible protección cruzada de PHiD-CV frente a 6A. No obstante, la evidencia actual es heterogénea. Los primeros datos posteriores a la comercialización no revelaron ninguna protección cruzada de la PHiD-CV frente al serotipo 6A55. Sin embargo, la muestra del estudio solo contenía 24 casos de ENI relacionados con 6A y, por lo tanto, estos resultados deben interpretarse con cautela55.
Los datos finlandeses de los 3años posteriores a la incorporación de PHiD-CV indicaron una protección cruzada, con impacto sobre la incidencia de ENI debida al serotipo 6A en la cohorte de niños elegibles para la vacunación56. Los datos a largo plazo confirmaron la protección cruzada frente al serotipo 6A, con un impacto significativo (95% de reducción) sobre la incidencia de ENI relacionada con 6A16. De cualquier forma, no es posible concluir que ocurra una protección indirecta frente a 6A, ya que el número de casos en niños mayores no elegibles era demasiado pequeño para sostener tal afirmación16.
Protección cruzada de VNC13 frente a 6CSe ha propuesto la protección cruzada de VNC13 frente a 6C debido al serotipo 6A incluido en la vacuna, pero en general la evidencia existente resulta contradictoria. El análisis de muestras de suero de niños un mes después de su primovacunación con VNC7 o VNC13 puso de manifiesto una respuesta al serotipo 6C significativamente diferente entre las cohortes de VNC7 y VNC13, lo cual sugiere que la mayor parte de la respuesta cruzada funcional a 6C estaba mediada por el serotipo 6A de la vacuna VNC13, suposición respaldada asimismo por la mayor correlación hallada entre los serotipos 6A y 6C que entre los serotipos 6B y 6C (r de la correlación de Pearson: 0,78 y 0,21, respectivamente)57.
En un estudio noruego se evaluaron los cambios en la incidencia de ENI tras la sustitución de VNC7 por VNC13 y se detectó una disminución en la incidencia de la ENI relacionada con el serotipo 6C, lo que hace pensar en una protección cruzada20. Por el contrario, en otro estudio, en el que también se comparó la incidencia de ENI por serotipos entre los períodos de VNC7 y VNC13, no se observaron cambios significativos en la incidencia de ENI relacionada con el serotipo 6C23.
Inmunidad de grupo y reemplazo de serotiposLos estudios a largo plazo sobre el impacto de las VNC en la ENI, la neumonía y la OMA han mostrado inmunidad de grupo, pero también un aumento de los serotipos no relacionados con las VNC16,24,25,40,47,48,58,59. En un análisis de todos los ingresos hospitalarios de Inglaterra antes y después de la incorporación de las VNC se observó un impacto significativo de reducción sobre los casos de neumonía neumocócica en sujetos de alto riesgo40. Sin embargo, la neumonía por microorganismos no especificados se incrementó en sujetos de alto riesgo con una edad> 65 años (razón bruta entre los casos: 2,96), lo que revela una susceptibilidad frente a los serotipos que reemplazaron a los de VNC1340.
Del mismo modo, en un análisis de los datos de vigilancia obtenidos a lo largo de 17 años, en Inglaterra y Gales se constató que la vacunación con VNC7 y VNC13 proporcionaba inmunidad de grupo frente a ENI. Sin embargo, la ENI debida a los serotipos no incluidos en la VNC13 se duplicó desde la incorporación de VNC7 (de 3,85 a 7,97 por 100.000)25.
En un estudio sueco se observó el efecto protector indirecto para adultos y niños24. Sin embargo, no se evidenció inmunidad de grupo para las personas mayores; el 68% de los casos de ENI en esta población fueron causados por serotipos no incluidos en la VNC1324.
Antes de la incorporación de PHiD-CV en Finlandia, las hospitalizaciones por neumonía de cualquier causa aumentaron entre los adultos con una tasa anual del 2,4%60. Después de la incorporación de PHiD-CV, la neumonía por todas las causas empezó a disminuir con una tasa anual del 4,7% y se registró un descenso significativo del 6,7% entre los sujetos ≥ 65 años, lo que sugiere inmunidad de grupo gracias al programa de vacunación infantil60.
En el análisis de series temporales de Brasil, la vacunación con PHiD-CV se asoció, 5 años después de su introducción, a inmunidad de grupo entre las cohortes no elegibles de 10-49 años37.
DiscusiónLa evidencia generada a la fecha tanto de PHiD-CV como de VNC13 demuestra el impacto global proveído por estas vacunas contra la ENI, la neumonía y la OM una vez incluidas dentro de los programas nacionales de inmunización en distintos escenarios geográficos61. Este impacto es producto de la reducción de la enfermedad producida por los serotipos incluidos en cada una de las formulaciones más aquellos serotipos relacionados. Puede observarse un incremento variable de la enfermedad por tipos no vacunales y variar dependiendo del contexto geográfico. No obstante, el efecto neto en la cohorte elegible vacunada ha sido demostrado61.
Actualmente, faltan datos comparativos sobre el impacto de PHiD-CV y VNC13 en el total de enfermedades neumocócicas. A pesar de todos los estudios mencionados con anterioridad, parece difícil establecer las diferencias entre estas 2vacunas por una serie de razones. Los sistemas de vigilancia no solo difieren entre los distintos países, sino también entre regiones de un mismo país12,14,20,21,34. A pesar de que la OMS recomienda que el conjunto de datos de vigilancia debería incluir un período que comenzara al menos 2años antes y terminara 5años después de la incorporación de la VNC1, muchos estudios solo proporcionan una información a muy corto plazo que no permite extraer conclusiones claras y sólidas sobre el impacto global de las vacunas62. Hay que tener en cuenta la variabilidad que pueden introducir otros factores de confusión como un aumento de las notificaciones de casos dada una mayor sospecha clínica de la enfermedad luego por la inclusión de las vacunas y los cambios en la definición de caso a lo largo del tiempo sobre la incidencia de la enfermedad16,20,22,34. Otras razones que impiden comparar estos estudios son las diferencias en la epidemiología de la enfermedad y en los métodos diagnósticos (uso de reacción en cadena de la polimerasa en lugar de cultivo), que varían según la zona geográfica o el período de tiempo12,20,22,34. Algunos aspectos que también limitan la posibilidad de establecer comparaciones son las diferencias en la cobertura vacunal, la heterogeneidad en el diseño de los estudios, las diferencias en la prevalencia de comorbilidad y otros factores de riesgo según los países22,24,28 y el hecho que la revisión no haya sido sistemática.
Por los motivos citados, las comparaciones más fiables se obtienen a través de revisiones sistemáticas42,43 y de estudios, como los secuenciales realizados en Quebec para comparar la efectividad de VNC7, PHiD-CV y VNC13 administradas una tras otra27, o el estudio comparativo del impacto de PHiD-CV y VNC13 sobre la ENI en la población sueca26. Gracias a su sistema estable de vigilancia en toda la nación y a la posibilidad de que los 21 condados nacionales elijan por separado la vacuna que desean utilizar, en Suecia26 se ha podido realizar una evaluación en el mundo real sobre el impacto del uso simultáneo de PHiD-CV y VNC13, cuyos resultados respaldan el estudio de Quebec27, en el sentido de que no hay diferencias en el impacto de ambas VNC sobre la incidencia global de ENI y la hospitalización asociada.
En las revisiones de la evidencia existente realizadas por la OMS y la Organización Panamericana de la Salud (OPS) no se encontró evidencia de superioridad de una vacuna sobre otra en niños <5 años y ambos organismos recomendaron la inclusión de las VNC en los programas de vacunación infantil en todo el mundo63,64.
ConclusionesLas VNC han demostrado un impacto sobre la ENI, la neumonía y la OM en diferentes escenarios geográficos. Dada la heterogeneidad en las estrategias de implementación de la vacunación, coberturas vacunales, formas de informe de casos, resulta difícil evaluar la magnitud del impacto sobre la carga de enfermedad neumocócica para cada vacuna. Datos comparativos han sugerido la no superioridad de una vacuna sobre la otra con respecto al impacto sobre la ENI global. Este concepto ha sido adoptado por organismos internacionales independientes como la OMS y la OPS. Es, por tanto, el impacto sobre la enfermedad neumocócica global lo que verdaderamente importa más allá de los serotipos contenidos en las formulaciones.
La figura 1 resume el contexto, los resultados y el impacto de esta revisión bibliográfica para los profesionales de la salud.
DeclaraciónMarcas comercialesSynflorix es una marca comercial del grupo de compañías GSK.
Prevenar 13 es una marca comercial de Wyeth LLC.
FinanciaciónGlaxoSmithKline Biologicals SA patrocinó la revisión bibliográfica y el desarrollo y publicación del manuscrito.
AutoríaTodos los autores participaron en el diseño o en la implementación de la revisión bibliográfica o en el análisis y la interpretación de esta revisión, así como en la elaboración de este manuscrito. Todos los autores tuvieron acceso completo a los datos y aprobaron el manuscrito final. Todos los autores aceptaron responsabilizarse de todos los aspectos del trabajo de modo que cualquier cuestión relacionada con la exactitud o integridad de cualquier parte del artículo fuera investigada y resuelta de forma apropiada. El trabajo descrito se llevó a cabo de conformidad con las recomendaciones del ICMJE para la realización, presentación, edición y publicación de artículos académicos en revistas médicas. El autor a quien debe dirigirse la correspondencia asumió la responsabilidad de presentar el manuscrito final para su publicación.
Conflicto de interesesXMPP ha participado como experto en el Comité Asesor del grupo de compañías GSK y ha pronunciado conferencias para este grupo. JNG, AE y JLGR son empleados del grupo de compañías GSK. JNG y AE tiene acciones del grupo de compañías GSK. BT era empleado del grupo de compañías GSK cuando se efectuó la revisión bibliográfica y se elaboró este manuscrito. JCDM y XSL no refieren ningún conflicto de interés.
En nombre de GSK, los autores desean agradecer a la plataforma Business & Decision Life Sciences la asistencia editorial y la coordinación del manuscrito. Grégory Leroux coordinó el desarrollo del manuscrito y el apoyo editorial. Los autores también agradecen a Athanasia Benekou (Business & Decision Life Sciences, en nombre de GSK) su ayuda para la redacción del manuscrito.