Staphylococcus aureus es el principal agente causante de mastitis bovina en Argentina y en el mundo. Esta bacteria ocasiona infecciones crónicas que generan importantes pérdidas a los productores y la industria lechera. El objetivo de este artículo es caracterizar los mecanismos que intervienen en la infección causada por S. aureus en la glándula mamaria bovina, evaluando dos aspectos diferentes del proceso infeccioso: por un lado, lo vinculado con la respuesta inmune innata por parte del hospedador, y por otro, la capacidad de la bacteria para evadir el sistema inmune e interactuar con diferentes tipos celulares. La exploración de la interacción de S. aureus con el sistema inmune de la glándula mamaria bovina permitirá identificar blancos para delinear nuevas alternativas preventivas o curativas, que contribuyan a evitar o eliminar las infecciones causadas por este organismo.
Staphylococcus aureus is the pathogen most frequently isolated from bovine mastitis worldwide, causing chronic intramammary infections that limit profitable dairying. The objective of this article is to characterize the mechanisms involved in S. aureus mammary gland infections considering two different aspects of the infectious process; on the one hand, the aspects involved in the host innate immune response and on the other hand, the capacity of this organism to evade the immune system and interact with different cell types. The exploration of S. aureus interactions with the immune response of bovine mammary gland will help identify targets to outline new preventive or curative alternatives for intramammary infections caused by this organism.
La mastitis bovina es una de las enfermedades más importantes que afecta mundialmente a la industria láctea. Ocasiona grandes pérdidas económicas debido al deterioro de la calidad de la leche, al aumento de costos directos e indirectos por tratamientos antibióticos de casos clínicos y al descarte temprano de animales71. Dentro de los patógenos contagiosos causantes de mastitis, Staphylococcus aureus es el agente etiológico más prevalente tanto en Argentina20 como en otros países de gran desarrollo lechero93. La infección por S. aureus comienza con un episodio subclínico o clínico agudo, generalmente evoluciona hacia la cronicidad y puede persistir a lo largo de toda la vida del animal73. La eficacia de curación en casos crónicos luego del tratamiento con antibióticos es baja y no existe una terapia efectiva para eliminar por completo la infección del cuarto mamario afectado13. Entre otros factores, se considera que el éxito limitado de la terapia con antibióticos está dado por la habilidad de S. aureus de evadir la respuesta inmune del hospedador y sobrevivir dentro de diferentes tipos de células de la glándula mamaria (GM) por un largo período sin causar una inflamación clínica4,32,36.
Numerosos artículos de revisión han demostrado que la patogenicidad de S. aureus es un proceso complejo y multifactorial, resultado de la acción combinada de más de 50 factores de virulencia que son expresados coordinadamente durante las diferentes fases de la infección en distintos órganos y hospedadores28,29,83,84,94 (colonización, evasión de las defensas del hospedador, multiplicación y diseminación bacteriana). En las infecciones intramamarias (IIM), la patogénesis y la propagación de S. aureus dependen de la expresión de los factores de virulencia de la bacteria24,55,61,89, del medio ambiente70 y del hospedador, lo que en conjunto determina la frecuencia y gravedad de las infecciones. En relación con el establecimiento y la persistencia de la infección por S. aureus en la GM bovina, se ha postulado que esta se asocia con una respuesta inmune deficiente mediada por factores de origen bacteriano y del hospedador12,13, y se ha destacado el rol fundamental de la respuesta inmune innata frente a este patógeno65,67,68.
El sistema de defensa de la GM contra los patógenos causantes de mastitis está mediado por factores inmunológicos innatos y adquiridos asociados a este tejido, que actúan en forma coordinada. La eficiencia de estos mecanismos resulta determinante de la resistencia a nuevas infecciones65,76,77. En la presente actualización se caracterizan los mecanismos que intervienen en la infección causada por S. aureus en la GM bovina evaluando aspectos que involucran la respuesta inmune innata del hospedador y la capacidad de la bacteria para evadirla y persistir en diferentes tipos celulares. Un mayor entendimiento de la interacción de S. aureus con el sistema inmune de la GM bovina permitirá identificar blancos para delinear nuevas alternativas preventivas o curativas tendientes a evitar o eliminar las infecciones y a minimizar las pérdidas por esta enfermedad.
Mecanismos de la respuesta inmune en la glándula mamariaLos mecanismos de la respuesta inmune en la GM bovina involucran diversos factores físicos, celulares y moleculares, que se engloban dentro de la inmunidad innata y adaptativa. La inmunidad innata constituye la primera línea de defensa durante las etapas tempranas de la interacción con el organismo. Es el factor clave determinante del establecimiento, la progresión y la gravedad de la infección, así como del desarrollo de la respuesta inmune adaptativa1. Dependiendo de la eficiencia de estos mecanismos, los patógenos pueden ser eliminados en cuestión de minutos u horas después de la invasión. Si esto ocurre, no se producirán cambios notables en la función de la GM o en la calidad de la leche88.
Los componentes del sistema de defensa innato de la GM incluyen barreras físicas, como el esfínter del pezón; barreras químicas, como la queratina del canal del pezón; factores solubles como la lactoferrina (Lf); lisozima; proteínas del complemento; citoquinas y quimioquinas. Además, existen elementos celulares que incluyen macrófagos, células dendríticas (CD), mastocitos, neutrófilos, eosinófilos y células asesinas naturales65 (NK). La inmunidad específica o adaptativa se orquesta en poblaciones celulares que reconocen antígenos particulares de los patógenos y está mediada por linfocitos B, a través de la síntesis de anticuerpos, y por linfocitos T, en forma directa o a través de la síntesis de factores solubles. Esta respuesta tiene la particularidad de ser más efectiva luego de cada exposición al patógeno y su activación secundaria mediada por linfocitos T y B permitiría su eliminación77.
Reconocimiento del patógeno e iniciación de la respuesta inmune innataEl contacto de las bacterias que ingresan a la GM con las células del sistema inmune presentes en la leche y con las células epiteliales que recubren los conductos excretores desencadena la inducción de la respuesta inmune innata, la cual constituye la primera línea de defensa contra los patógenos causantes de mastitis88. Una respuesta inmune rápida y efectiva se basa en el reconocimiento precoz de los patógenos potenciales3,27,63. La respuesta inmune innata se inicia cuando receptores de reconocimiento de patrones (pattern recognition receptors [PRR]) específicos, presentes en la superficie o dentro de las células del hospedador, se unen a moléculas particulares de las bacterias, denominadas patrones moleculares asociados a patógenos (pathogen associated molecular patterns [PAMP]). Estos patrones moleculares constituyen un conjunto de moléculas conservadas y compartidas por grupos diversos de microorganismos y están presentes en su superficie o se liberan cuando los microorganismos se replican o degradan81. Los PRR se expresan en los leucocitos de la leche y en las células epiteliales de la GM80.
Los receptores tipo toll (toll like receptors [TLR]) forman parte de los PRR, son proteínas estructuralmente relacionadas que reconocen diferentes PAMP e inducen la producción de factores secretados, como citoquinas3. Los receptores TLR2 y TLR4 están particularmente involucrados en infecciones bacterianas, se activan sobre todo en respuesta a las infecciones con bacterias gram positivas y gram negativas, respectivamente81. La unión del ligando al TLR estimula la activación del factor de transcripción nuclear-κB (nuclear factor κB [NF-κB]) y de quinasas activadas por mitógenos (mitogen-activated protein kinases [MAPK]), lo que conduce a la producción de importantes mediadores de la inmunidad innata tales como interleuquina (IL) -6, IL-12, IL-18, interferón (IFN)-α e IFN-γ. Concomitantemente, la señalización por TLR induce la expresión de moléculas coestimuladoras esenciales para la iniciación de la respuesta inmune adaptativa, como B7.1 (CD80) y B7.2 (CD86), que son proteínas de superficie expresadas por células presentadoras de antígeno (APC). La presencia de estas moléculas coestimuladoras y la presentación de los componentes antigénicos microbianos activan las células T CD4+ requeridas para iniciar la respuesta inmune adaptativa81.
Todas las vías de transducción de señales de TLR activan finalmente el NF-κB2. La vía dependiente de MyD88 (proteína de diferenciación mieloide primaria) se asocia con la fase de respuesta temprana de NF-κB, mientras que la vía independiente de MyD88 se asocia con la fase de respuesta tardía de NF-κB34. Se ha determinado que la expresión de citoquinas durante la mastitis bovina se correlaciona con la activación de NF-κB44,91 y que la magnitud y duración de la respuesta de citoquinas depende del patógeno actuante9. En general, las bacterias gram negativas que expresan lipopolisacáridos (LPS) en su superficie, como los organismos coliformes, inducen una respuesta de citoquinas proinflamatorias rápida y de mayor magnitud que las bacterias gram positivas, como S. aureus88.
Factores determinantes de la respuesta diferenciada de citoquinas frente a distintos patógenosEn infecciones mamarias experimentales por Escherichia coli se ha observado un incremento en las concentraciones de IL-1β, INF-γ, IL-12, factor de necrosis tumoral alfa [tumor necrosis factor α (TNF-α)] e IL-8 en leche en las primeras 48 horas postinoculación; mientras que las últimas dos citoquinas no fueron detectadas tras la infección experimental por S. aureus. Esto sugiere que esta respuesta limitada favorecería el establecimiento de la infección por este organismo8. Sin embargo, los mecanismos determinantes de esa respuesta no han sido totalmente esclarecidos. En las IIM causadas por S. aureus, el TNF-α, la IL-1β y la IL-6 son las citoquinas proinflamatorias predominantes. Se han detectado transcriptos de ARNm de estas citoquinas en leche proveniente de vacas con IIM crónicas68,69 y con IIM agudas experimentales por S. aureus45, aunque la transcripción fue marcadamente menor a la observada frente a infecciones experimentales por E. coli45. Se observó un incremento en la transcripción de TNF-α en células de leche en mastitis clínica causada por S. aureus a las 24 horas postinoculación, con una fuerte disminución 8 horas más tarde5. Esta disminución coincidió con un incremento en la producción de IL-1β, la que se mantuvo elevada por 8 horas.
La expresión de citoquinas en cultivos primarios de células epiteliales mamarias bovinas (primary bovine mammary epithelial cells [pbMEC]) cocultivadas con E. coli inactivadas con calor se agrupa en una red regulatoria con una posición central de TNF-α e IL-1, mientras que en un entorno idéntico para S. aureus, estas citoquinas fueron reguladas negativamente. Ambas bacterias mostraron una regulación positiva de la IL-6, posiblemente debida a un mecanismo independiente de la vía de MyD88, ya que la anulación completa de esta vía de señalización del TLR en pbMEC no modificó la expresión de esta citoquina34. Por otra parte, en células cocultivadas con S. aureus inactivados con calor se observó una regulación positiva del IFN-β, también atribuida a una activación del NF-κB independiente de MyD88 34. El bloqueo o la falta de activación de la señalización del TLR mediante la vía dependiente de MyD88 por S. aureus en células epiteliales mamarias (CEM) bovinas podría ser la causa por la cual genes efectores claves en la respuesta inmune innata no se activan tempranamente luego de la IIM; este tipo de células predominan en la GM sana. Tales genes codifican la síntesis de enzimas bactericidas, como β-defensinas90 y óxido nítrico sintetasa inducible (inducible nitric oxid synthase [iNOS]), entre otros. Particularmente, la falta de activación de estos genes en las CEM podría explicar, en parte, la falla en la eliminación del patógeno observada en mastitis subclínicas persistentes causadas por bacterias gram positivas60.
Estudios recientes han demostrado que el cocultivo de CEM bovinas con S. aureus aislado de mastitis clínica afecta la activación NF-κB y da como resultado una expresión muy baja de ARNm de TNF-α44. Yang et al.91 examinaron la activación de los receptores de patógenos TLR2 y TLR4 por ligandos derivados de S. aureus. Estos investigadores observaron que el cocultivo de pbMEC con E. coli y S. aureus inactivados por calor inducían la expresión de genes codificantes de IL-8 y TNF-α; sin embargo, la inducción por parte de S. aureus fue un 5 % menor que la observada con E. coli. Esta respuesta disminuida en la expresión de citoquinas estuvo acompañada de una pérdida completa de la activación de NF-κB por S. aureus o ácido lipoteicoico (LTA) en pbMEC. Los citados autores concluyeron que la causa de la inadecuada respuesta inmune inducida por S. aureus no se debió a una alteración en la unión del TLR a su ligando, sino a una regulación negativa de la activación de NF-κB en pbMEC por el patógeno, lo que debilitó la respuesta inmune en la GM.
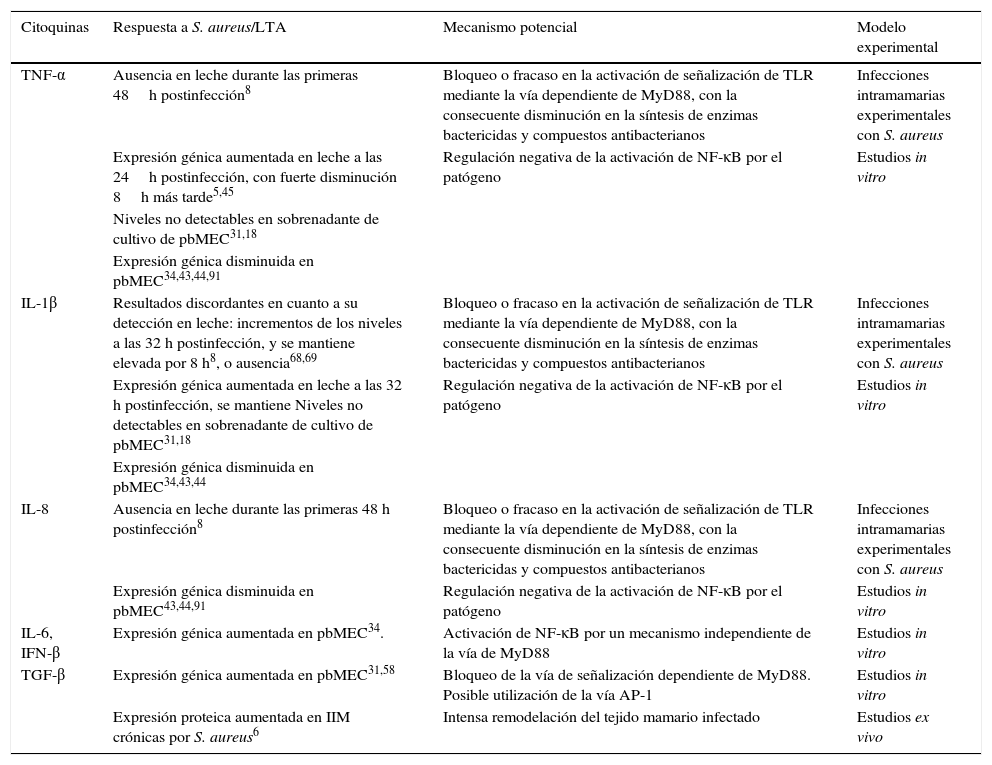
La falta de señalización del NF-κB por PAMP de S. aureus podría relacionarse con el incremento en la producción de factor transformante del crecimiento beta [transforming growth factor (TGF-β)] en la GM infectada con S. aureus, lo cual causaría el bloqueo de la vía de señalización dependiente de MyD88, tal como lo propone Naiki et al.57. Por otra parte, Gilbert et al.31 postulan que, a diferencia de E. coli, en pbMEC S. aureus utilizaría la vía de activación de la proteína de activación 1 (AP-1) en vez de NF-κB, induciendo una respuesta inmune más restrictiva que la de E. coli, con la consecuente disminución en la activación de genes involucrados en el reclutamiento de células y defensas inmunes locales. En la tabla 1 se resumen los mecanismos inducidos por S. aureus que determinan una respuesta diferenciada de citoquinas en la GM bovina.
Mecanismos inducidos por Staphylococcus aureus que conducen a una respuesta diferenciada de citoquinas en la glándula mamaria bovina, según estudios realizados in vivo e in vitro
| Citoquinas | Respuesta a S. aureus/LTA | Mecanismo potencial | Modelo experimental |
|---|---|---|---|
| TNF-α | Ausencia en leche durante las primeras 48h postinfección8 | Bloqueo o fracaso en la activación de señalización de TLR mediante la vía dependiente de MyD88, con la consecuente disminución en la síntesis de enzimas bactericidas y compuestos antibacterianos | Infecciones intramamarias experimentales con S. aureus |
| Expresión génica aumentada en leche a las 24h postinfección, con fuerte disminución 8h más tarde5,45 | Regulación negativa de la activación de NF-κB por el patógeno | Estudios in vitro | |
| Niveles no detectables en sobrenadante de cultivo de pbMEC31,18 | |||
| Expresión génica disminuida en pbMEC34,43,44,91 | |||
| IL-1β | Resultados discordantes en cuanto a su detección en leche: incrementos de los niveles a las 32 h postinfección, y se mantiene elevada por 8 h8, o ausencia68,69 | Bloqueo o fracaso en la activación de señalización de TLR mediante la vía dependiente de MyD88, con la consecuente disminución en la síntesis de enzimas bactericidas y compuestos antibacterianos | Infecciones intramamarias experimentales con S. aureus |
| Expresión génica aumentada en leche a las 32 h postinfección, se mantiene Niveles no detectables en sobrenadante de cultivo de pbMEC31,18 | Regulación negativa de la activación de NF-κB por el patógeno | Estudios in vitro | |
| Expresión génica disminuida en pbMEC34,43,44 | |||
| IL-8 | Ausencia en leche durante las primeras 48 h postinfección8 | Bloqueo o fracaso en la activación de señalización de TLR mediante la vía dependiente de MyD88, con la consecuente disminución en la síntesis de enzimas bactericidas y compuestos antibacterianos | Infecciones intramamarias experimentales con S. aureus |
| Expresión génica disminuida en pbMEC43,44,91 | Regulación negativa de la activación de NF-κB por el patógeno | Estudios in vitro | |
| IL-6, IFN-β | Expresión génica aumentada en pbMEC34. | Activación de NF-κB por un mecanismo independiente de la vía de MyD88 | Estudios in vitro |
| TGF-β | Expresión génica aumentada en pbMEC31,58 | Bloqueo de la vía de señalización dependiente de MyD88. Posible utilización de la vía AP-1 | Estudios in vitro |
| Expresión proteica aumentada en IIM crónicas por S. aureus6 | Intensa remodelación del tejido mamario infectado | Estudios ex vivo |
La evasión del reconocimiento de TLR ha recibido un creciente interés en los últimos años, aunque los estudios disponibles son escasos. Recientemente, se ha propuesto un nuevo mecanismo de escape de las defensas inmunes del hospedador por parte de S. aureus que involucra la interferencia con la vía de reconocimiento de las células inmunes92. Al respecto, se ha demostrado que la proteína SSL3, un superantígeno de S. aureus, bloquea la activación de TLR2 a través de la interacción extracelular directa con el receptor11. Particularmente, SSL3 se uniría al dominio extracelular del TLR2 e inhibiría la producción de TNF-α por parte de macrófagos murinos en respuesta a la estimulación con S. aureus inactivado por calor, peptidoglicanos (PGN) o lipopéptidos. Este nuevo mecanismo de evasión descripto incrementa el conocimiento actual sobre la interacción bacteria-hospedador y abre nuevos caminos para el estudio de la patogenia de la mastitis bovina causada por este patógeno. En relación con el conocimiento actual sobre este tipo de exoproteínas de S. aureus aislados de IIM en bovinos, Smyth et al.78 examinaron la ocurrencia de 7 genes que codifican miembros de la familia de exoproteínas SSL, y observaron que todas las cepas analizadas contenían el locus ssl, con pequeñas variaciones en el número de genes ssl presentes.
Para examinar el posible rol de TLR2 en la respuesta celular, Watanabe et al.87 determinaron los niveles de fagocitosis y la consiguiente muerte de las bacterias fagocitadas por macrófagos obtenidos de ratones deficientes en TLR2 y en ratones wild type. Estos autores observaron que la fagocitosis de S. aureus y E. coli fue similar entre macrófagos provenientes de ambas cepas de ratones. Sin embargo, la supervivencia de S. aureus fagocitados, pero no de E. coli, disminuyó en mayor medida en los macrófagos deficientes en TLR2 en comparación con los wild type. Por otra parte, luego de la incubación de macrófagos de ratones wild type con S. aureus observaron incrementos en los niveles de las formas fosforiladas de tres MAPK (JNK, ERK1/ERK2 y p38). En cambio, en macrófagos provenientes de ratones deficientes en TLR2, los niveles de JNK fosforilados permanecieron bajos luego de la incubación con S. aureus, mientras que la activación de ERK1/ERK2 y p38 ocurrió normalmente. Estos resultados sugieren que de las tres MAPK, solo JNK se fosforila y activa en macrófagos estimulados con S. aureus en una manera dependiente de TLR2. Además, ambas cepas de ratones demostraron un nivel reducido de superóxido en los macrófagos que habían fagocitado a S. aureus. Estos investigadores proponen que tras reconocer a S. aureus, el receptor TLR2 activaría la quinasa JNK para suprimir la producción de superóxido, lo que conduciría a la prolongación de la vida de las bacterias en los fagosomas87. Sin embargo, se necesitan nuevos estudios que clarifiquen el mecanismo de regulación negativa en la producción de superóxido mediado por JNK en las bacterias fagocitadas.
Si los resultados obtenidos de los estudios mencionados se aplican a las IIM por S. aureus en bovinos, se podría inferir que la disminución de la habilidad de reconocer al patógeno, actuando sola o en combinación con una respuesta inmune reducida a la colonización bacteriana, podría contribuir a la habilidad de S. aureus para evadir la respuesta inmune innata del hospedador y favorecer su establecimiento en la GM.
Células que participan en la respuesta inmune innataLas células somáticas de la leche en GM sanas están compuestas principalmente por macrófagos, pero también incluyen linfocitos, neutrófilos y CEM75. La predisposición de la GM a la infección con diferentes patógenos podría estar influenciada por el número de células somáticas de la leche antes del contacto con el patógeno: bajos recuentos de células somáticas (RCS) podrían asociarse con mayor riesgo y gravedad de la mastitis. La tasa con la cual se incrementa o disminuye el número de células somáticas de la leche durante las IIM también difiere de acuerdo con el patógeno: E. coli induce altos RCS en forma rápida (> 500x103 células/ml) dentro de las 24 horas, que pueden caer a los niveles pre-infección a las 48 horas, mientras que S. aureus genera un incremento más gradual a lo largo de un período de 48 a 72 horas8.
Células epiteliales mamariasEn la GM sana, las CEM superan en número a cualquier otro tipo celular, por lo que la probabilidad de tomar contacto con los patógenos invasores es mayor. En un estudio reciente en cabras, Brenaut et al.16 investigaron la respuesta transcripcional in vivo de las CEM luego de la IIM experimental con S. aureus utilizando métodos no invasivos para obtener ARN. Las CEM reaccionaron durante las primeras 24–30 horas postinfección expresando una amplia batería de genes que codifican diferentes citoquinas proinflamatorias, quimioquinas y proteínas de fase aguda, lo cual destaca su rol en el inicio y el desarrollo del proceso inflamatorio16.
Como se mencionó, la inducción de las funciones inmunes en las CEM depende del patógeno con el cual estas interactúan. Escherichia coli activa la expresión de un amplio repertorio de genes, de modo que dentro de las 24 horas se incrementan en unas 1000 veces las concentraciones de ARNm de citoquinas claves (TNF-α, IL-1, IL-8), y aproximadamente 100 veces las concentraciones de ARNm de varios genes efectores de las defensas inmunes, como los que codifican β-defensinas, óxido nítrico sintetasa inducible (NOS2A) y amiloide sérico A3 33,90 (SAA3). En cambio, luego del contacto con S. aureus, la inducción de estos genes se ve disminuida44. Esto se debería, en parte, al impedimento de la cascada de señalización intracelular dependiente de MyD88, inmediatamente aguas abajo de los receptores transmembrana TLR2 y TLR4, ya que S. aureus imposibilitaría la formación de una plataforma estructural alrededor del dominio intracelular del TLR (TIR), necesaria para la unión de otros factores de la cascada de señalización intracelular48. Como consecuencia, S. aureus induce una reacción inmune en las CEM exclusivamente dominada por la IL-6, mientras que E. coli también activa citoquinas adicionales (IL-1 y TNF-α). La retroalimentación positiva que inducen IL-1 y TNF-α en la producción de citoquinas por las CEM está disminuida en la respuesta inmune desencadenada por S. aureus, lo cual podría favorecer el establecimiento de la bacteria en la GM34.
Gilbert et al.31 demostraron que la estimulación de pbMEC, tanto con LPS de E. coli como con sobrenadante de cultivo de S. aureus proveniente de mastitis bovina, no logró aumentar los niveles de IL-1β y TNF-α en sobrenadante de cultivo. En concordancia con estos hallazgos, se reportó que ciertos PAMP de Staphylococcus, como muramil dipéptido (MDP) y LTA, no lograron aumentar la producción de citoquinas proinflamatorias en sobrenadante de cultivo de pbMEC18. Sin embargo, se observó que MDP y LTA actuaron sinérgicamente para inducir la producción de varios factores quimiotácticos de neutrófilos secretados por las CEM, la cual fue dependiente de la activación de NF-κB18. En conjunto, estos estudios sugieren que las CEM podrían afectar diferencialmente la respuesta inflamatoria global en función de cómo reconocen y responden a los diferentes PAMP bacterianos. Por lo tanto, la gravedad y duración de la mastitis podría estar relacionada no solamente con la expresión de TLR, sino también con las vías de señalización inducidas por TLR que se activan en las CEM.
MacrófagosLos macrófagos constituyen el tipo celular predominante en leche de la GM bovina sana durante la lactancia; estos participan en la respuesta inmune innata y adquirida. Durante las IIM, los macrófagos están implicados en múltiples niveles y son indispensables para el reconocimiento y la eliminación de las bacterias causantes de mastitis. Más allá de la actividad como fagocitos profesionales, la habilidad de los macrófagos para secretar sustancias que faciliten la migración y actividad de otros tipos celulares sería la de mayor importancia en la respuesta innata de la GM76.
Durante el periparto se produce una alteración muy profunda de las capacidades funcionales de los macrófagos, que ha sido directamente relacionada con la incidencia de enfermedad. Aunque el número de macrófagos bovinos es alto en la última semana de gestación, la capacidad fagocítica de estas células decrece, posiblemente debido a la baja actividad opsónica en secreción mamaria y a una disminución de la IgM. Adicionalmente, la expresión de MHC-II por los macrófagos bovinos durante el periparto disminuye, lo cual podría contribuir a una pobre presentación de antígenos y dar como resultado una débil respuesta inmune específica de los linfocitos de la GM51.
Recientemente se demostró que la infección in vitro de macrófagos bovinos con S. aureus indujo su activación, tanto a través de la vía clásica como de la alternativa47. La activación alternativa del macrófago podría ser un mecanismo que contribuye a la persistencia intracelular de S. aureus en el curso de la inflamación mamaria en bovinos, ya que se ha propuesto que induciría la producción de IL-10 (citoquina antiinflamatoria) e inhibiría, en consecuencia, la vía clásica de activación del macrófago.
En un estudio realizado en tejido mamario proveniente de vacas en período de involución activa se observó un incremento del número de monocitos/macrófagos inmunomarcados con anti-CD14 en las GM de animales crónicamente infectados con S. aureus, en comparación con lo observado en glándulas no infectadas25. Esto indica que estas células podrían jugar un rol importante en las IIM causadas por este microorganismo, asociado a un intento de reparar el daño tisular durante la infección crónica.
NeutrófilosLos neutrófilos juegan un papel clave en las defensas de la GM, y su rápida movilización desde la sangre hacia la leche es crucial para prevenir la proliferación de bacterias de crecimiento rápido y la subsecuente mastitis aguda59.
El cambio a una población predominantemente neutrofílica en la GM ocurre luego del reconocimiento bacteriano y liberación de quimioatrayentes por parte de los macrófagos y CEM. Los neutrófilos eliminan al patógeno principalmente por fagocitosis y muerte intracelular empleando numerosos mecanismos antibacterianos: formación de trampas extracelulares de neutrófilos (NET), estallido respiratorio, péptidos antibacterianos y defensinas. Los neutrófilos activados liberan el material nuclear y el contenido de sus gránulos de manera similar a una red, que físicamente atrapa bacterias. Estas trampas contienen al patógeno y lo ubican en un entorno local con altas concentraciones de agentes antimicrobianos liberados por los neutrófilos, de esta manera aumentan las posibilidades de muerte bacteriana17. Las funciones fagocíticas y el estallido oxidativo de los neutrófilos se reducen drásticamente cuando toman contacto con la leche, debido a la ingestión de grasa y caseína54. Sin embargo, las funciones alternativas de los neutrófilos como la liberación de NET, no parecen verse afectadas por la presencia de leche49. Por lo tanto, los NET podrían constituir importantes mecanismos bactericidas durante las IIM49. En un estudio reciente sobre proteómica de leche proveniente de bovinos infectados con S. aureus, se detectó una alta concentración de proteínas intervinientes en la formación de NET, y se ha postulado que estos podrían tener relevancia funcional en las IIM por este patógeno66. Sin embargo, se necesitan más estudios para determinar si los NET en asociación con la grasa de la leche conservan su actividad antimicrobiana.
El reclutamiento de neutrófilos a la GM bovina varía en intensidad y rapidez de acuerdo con el agente infeccioso65. En mastitis bovinas experimentales subclínicas por S. aureus se demostró un reclutamiento moderado (> 106 células/ml) y tardío (entre 24 y 48 horas postinfección) de neutrófilos a las GM inoculadas, en coincidencia con el aislamiento del microorganismo de leche durante ese lapso68. En un estudio posterior, Riollet et al.69 determinaron que durante la infección crónica de la GM bovina por S. aureus, los neutrófilos constituyen el tipo celular predominante en leche, y representan el 55 % al 96 % del total de células. Si bien el número de neutrófilos durante la infección crónica se incrementa notablemente, su actividad se encuentra disminuida, lo cual se manifiesta por la menor expresión de moléculas de adhesión en su superficie69. Este tipo de respuesta podría favorecer el establecimiento de una IIM crónica durante la cual la inflamación y la migración leucocitaria continúan durante meses, con el consecuente daño al parénquima mamario.
Estudios in vitro en neutrófilos aislados de leche bovina demostraron que la producción de leucotoxinas (Luk) por parte de S. aureus puede contribuir a la evasión inmune en la GM14. Las Luk forman poros en los leucocitos, se inhibe así la fagocitosis y se favorece la persistencia de la bacteria en la GM. Se ha demostrado que la totalidad de los aislamientos de S. aureus de mastitis bovina poseen genes vinculados con la producción de γ-hemolisina (hlg), la gran mayoría para LukE/D y del 10 % al 50 % para LukM/LukF'-PV30. En neutrófilos aislados de leche bovina, LukM/LukF'-PV han demostrado ser las leucotoxinas más citotóxicas14. En la tabla 2 se resumen las funciones principales de las células que participan en la respuesta inmune innata en la GM bovina y los mecanismos potenciales que utiliza S. aureus para evadir la respuesta inmune celular.
Funciones principales de las células que participan en la respuesta inmune innata en la glándula mamaria (GM) y mecanismos potencialmente utilizados por Staphylococcus aureus para evadir la respuesta inmune celular
| Células | Funciones inmunes principales en la GM | Potenciales mecanismos de evasión |
|---|---|---|
| Células epiteliales mamarias (CEM) | Rol clave en el reconocimiento del patógeno y en el inicio y desarrollo del proceso inflamatorio | El contacto de S. aureus con la CEM imposibilitaría la formación de una plataforma estructural alrededor del dominio TIR del TLR, que alteraría la cascada de señalización intracelular48 |
| Capacidad de sintetizar y secretar citoquinas proinflamatorias, quimioquinas y proteínas de fase aguda | S. aureus induce en las CEM una reacción inmune dominada por la IL-634 | |
| Macrófagos | Fagocitosis y muerte intracelular de la bacteria | Activación de la quinasa JNK y supresión de la producción de superóxido por parte de los macrófagos que han fagocitado a S. aureus, lo que prolonga la vida de las bacterias en los fagosomas87 |
| Secreción de citoquinas y quimioquinas | Persistencia intracelular de la bacteria por activación alternativa del macrófago. Mecanismo posible: la inducción de la producción de IL-10 inhibiría la vía clásica de activación del macrófago47 | |
| Presentación antigénica en asociación con MHC-II | ||
| Neutrófilos | Fagocitosis y muerte intracelular de la bacteria | En infecciones crónicas por S. aureus: incremento significativo en el número de neutrófilos, pero disminución de su actividad, y menor expresión de moléculas de adhesión en su superficie69 |
| Secreción de factores antibacterianos | Las leucotoxinas de S. aureus forman poros en los leucocitos que inhiben la fagocitosis y favorecen la persistencia de la bacteria en la GM14,30 |
El microambiente de la GM sana contiene Lf, lisozima, factores del complemento, citoquinas, quimioquinas, inmunoglobulinas y otras moléculas solubles bactericidas y bacteriostáticas. Estos factores poseen una eficacia variable contra los diferentes patógenos causantes de mastitis de acuerdo con las diferentes etapas de la lactancia1.
LactoferrinaLa Lf es uno de los antimicrobianos más caracterizados de la GM bovina. Producida por las CEM y los leucocitos, la Lf es una proteína de unión al Fe con conocidas capacidades bacteriostáticas. En presencia de bicarbonato, la Lf puede secuestrar iones férricos libres presentes en leche y, por lo tanto, impedir el crecimiento de bacterias que tienen requerimientos de Fe, como estafilococos y bacterias coliformes1. Chaneton et al.21 analizaron la capacidad conjunta de la Lf y la β-lactoglobulina (β-LG) para inhibir el crecimiento de cepas de S. aureus aisladas de mastitis bovina y observaron que la coincubación de ambas proteínas a concentraciones fisiológicas con las bacterias redundó en una actividad antibacteriana aumentada, lo que sugiere un efecto inhibitorio aditivo de estas proteínas.
Numerosas especies causantes de mastitis han demostrado ser susceptibles a la Lf. Sin embargo, existe información divergente con respecto a la potencia y el espectro de acción de la Lf, y además, se han encontrado diferencias en la susceptibilidad a Lf entre aislamientos de una misma especie46. También se han hallado diferencias en cuanto al tipo de inhibición ejercida, ya que presenta actividad bactericida sobre algunas cepas de S. aureus mientras que parece ser bacteriostática sobre otras64.
LisozimaEntre los componentes de las defensas innatas, la lisozima ha mostrado un comportamiento particular en las IIM por S. aureus. De hecho, la actividad de la enzima se vio disminuida en leche proveniente de GM infectadas con S. aureus62. Esta disminución podría ser el resultado de un agotamiento precoz de la actividad enzimática asociado a una reducción en la actividad oxidativa de los neutrófilos58. Además, la actividad de la enzima podría estar influenciada por la cepa de S. aureus causante de la IIM72. Estudios recientes in vitro sugieren que la liberación de lisozima por parte de las CEM se comporta de manera dosis-dependiente y que se necesitan al menos 100 000 UFC/ml de S. aureus en la leche para desencadenar su producción94.
Proteínas del complementoEl sistema del complemento es un conjunto de proteínas presentes en suero y leche, sintetizadas principalmente por los hepatocitos, monocitos y macrófagos tisulares. La activación del sistema del complemento genera varios fragmentos proinflamatorios, de los cuales el fragmento C5 está especialmente asociado con la mastitis1.
Se ha demostrado que determinados componentes del complemento están asociados con la severidad de la mastitis. En un estudio reciente, se comprobó que C5a, en ausencia de otros factores estimulatorios, fue capaz de inducir la señalización de TLR4 en neutrófilos bovinos, y que eso ocasionó un aumento en la expresión génica de IL-879. La capacidad de componentes del complemento para iniciar la señalización de TLR4 podría contribuir a la gravedad de la mastitis y, posiblemente, a la resolución del proceso inflamatorio agudo. En infecciones experimentales por E. coli, el reclutamiento de neutrófilos a la GM coincide temporalmente con el aumento en la concentración de C5a e IL-8 en leche, las que actúan como potentes quimiotácticos. En cambio, en IIM experimentales por S. aureus, el componente C5a no fue detectado en leche durante las primeras 24 horas postinfección, pero sí mostró un aumento transitorio a las 32 horas postinfección. Asimismo, la infección experimental no indujo cambios en las concentraciones de IL-8 en leche8. Coincidentemente con esta respuesta inmune disminuida frente al patógeno, en infecciones experimentales por S. aureus se ha observado un reclutamiento tardío y bajo de neutrófilos a la GM, lo que podría favorecer el establecimiento de la infección68.
Los aislamientos de S. aureus de seres humanos expresan factores de virulencia adicionales, como el inhibidor estafilocócico del complemento [staphylococcal complement inhibitor (SCIN)], que bloquea la formación de C3b y protege a la bacteria de la fagocitosis por neutrófilos y proteínas inhibidoras de la quimiotaxis [chemotaxis inhibitor proteins of Staphylococcus aureus (CHIPS)]; estas últimas se unen al receptor de C5a, bloqueando la afinidad de unión del agonista. El bloqueo del receptor en la superficie de los neutrófilos interfiere con la quimiotaxis y extravasación desde la sangre al sitio de infección85. Kumagai et al.42 detectaron los genes scn y chp, que codifican las proteínas SCIN y CHIPS en cepas de S. aureus provenientes de mastitis bovina. Se necesitan nuevos estudios en esta área para revelar el significado de estas proteínas en la patogenia de la mastitis causada por S. aureus y su contribución en la evasión de la respuesta inmune.
Citoquinas y quimioquinasEl papel de las citoquinas y quimioquinas en la GM se ha estudiado intensamente en los últimos años. Si bien juegan un rol fundamental en la respuesta del hospedador a la infección, también pueden generar efectos deletéreos sobre aquel. Por lo tanto, existe un fino balance entre los efectos positivos y negativos de las citoquinas en el hospedador, que está establecido por la maduración, cantidad y ubicación de su expresión. La capacidad fisiológica e inmunomoduladora de las citoquinas es compleja, la mayoría tiene vidas medias muy cortas y pueden actuar en forma individual o interactuar con otras1.
Citoquinas proinflamatorias: Las dos citoquinas más importantes que claramente promueven la inflamación son la IL-1β y el TNF-α. Estas IL son mediadores claves de la respuesta inmune sistémica y local; no solo regulan la expresión de una amplia batería de genes incluyendo otras citoquinas, enzimas y proteínas de fase aguda, sino también de genes relacionados con la proliferación y la apoptosis. La IL-6 es la tercera citoquina proinflamatoria clave que media la respuesta de fase aguda en la inflamación, aunque también puede tener propiedades antiinflamatorias9.
Comparada con otras citoquinas, la respuesta de IL-1β frente a IIM experimentales ha mostrado ser altamente variable8,68. En el caso de IIM por bacterias gram positivas, la inducción de IL-1β estuvo retrasada en comparación con la observada en la infección por bacterias gram negativas38. Si bien la producción de ARNm de IL-1β ha mostrado estar regulada positivamente en células de leche aisladas de GM infectadas con S. aureus69, se han observado resultados discordantes en cuanto a la detección de la proteína en leche. Riollet et al.68 no detectaron esta citoquina en leche luego del desafío experimental con S. aureus; en cambio, Banneman et al.8 observaron un aumento en las concentraciones de IL-1β en leche luego de las 32 horas posdesafío con este organismo y estas se mantuvieron por 8 horas adicionales.
El TNF-α es una citoquina proinflamatoria producida por macrófagos, linfocitos, neutrófilos y células epiteliales7. A nivel local, el TNF-α promueve la activación endotelial, el reclutamiento y la posterior activación de leucocitos en el sitio de la infección, mientras que los efectos sistémicos incluyen la inducción de fiebre y de proteínas de fase aguda19. Como se ha mencionado anteriormente en la sección sobre reconocimiento del patógeno e iniciación de la respuesta inmune, durante la mastitis bovina causada por bacterias gram negativas se han detectado concentraciones elevadas de esta citoquina en sangre y leche8,68, mientras que las bacterias gram positivas o sin pared celular promueven una respuesta de TNF-α mínima o demorada38. A pesar de que aún se desconocen las causas de la falta de desarrollo de una respuesta temprana de TNF-α en las IIM en bovinos, Kauf et al.38 demostraron que el organismo no parecería regular negativamente a esta citoquina, ya que la infusión de LPS en cuartos mamarios infectados con S. aureus indujo una producción de TNF-α en concentraciones comparables con las de las infecciones por bacterias gram negativas. Respecto de las IIM crónicas por S. aureus, se ha observado por técnicas de inmunohistoquímica un incremento de los porcentajes de inmunomarcación de TNF-α y del número de monocitos/macrófagos CD14+ durante la involución mamaria activa, lo que indica que esta citoquina, en asociación con los monocitos/macrófagos, tiene una participación destacada en la respuesta inmune de las IIM persistentes durante el período de no lactación25. Son necesarios nuevos estudios para determinar la relación de esta citoquina con células del tejido mamario y otras citoquinas en IIM crónicas durante el período de involución.
La IL-6 es una citoquina con propiedades pro- y antiinflamatorias, y está implicada en aspectos que involucran tanto la respuesta inmune innata como la adaptativa, a través de su capacidad para inducir aumento de la temperatura, diferenciación de linfocitos B y la correspondiente producción de inmunoglobulinas, la activación de linfocitos T y el incremento de la respuesta proinflamatoria de los neutrófilos39. Se ha observado una mayor expresión de ARNm de IL-6 en células somáticas aisladas de leche proveniente de bovinos con mastitis adquiridas en forma natural69,82 o inducidas experimentalmente46 en comparación con células aisladas de leche de GM no infectadas. La abundancia relativa de estos transcriptos ha sido detectada tanto en vacas infectadas con E. coli como con S. aureus. Asimismo, se han observado incrementos en las concentraciones de la IL-6 en leche y sangre de vacas con mastitis adquiridas naturalmente35 e inducidas experimentalmente26.
Como se ha mencionado en secciones anteriores, estudios in vitro sugieren que la señalización inducida por la IL-6 domina la respuesta de las pbMEC a S. aureus inactivado por calor34; y que la rápida y elevada expresión de esta citoquina luego de la estimulación con la bacteria está acompañada de incrementos en las concentraciones de ARNm de IFN-β1 e IFN-β2. Se ha demostrado que el IFN-β inhibe la liberación de citoquinas proinflamatorias, como la IL-12, a través de un incremento de la síntesis de IL-10 en células mononucleares de sangre periférica en seres humanos86, y que este regularía en forma negativa al IFN-γ, con lo que se reduciría tanto la expresión de MHC-II sobre las APC37 como la expresión de moléculas de adhesión y metalopeptidasas de la matriz [matrix metallopeptidases (MMPs)]50. El desafío de las pbMEC con S. aureus no indujo la expresión de MHC o MMPs, ni de moléculas de adhesión intercelular [intercellular adhesion molecules (ICAMs), lo cual sustenta la teoría propuesta34.
Citoquinas antiinflamatorias: Las IL-4, IL-10, IL-13 y TGF-β suprimen la producción de citoquinas inflamatorias. Una de las IL antiinflamatorias más estudiada en la respuesta inmune en la GM es la IL-10. Esta IL tiene dos funciones principales: limitar la inflamación mediante la inhibición de la síntesis de citoquinas e influenciar sobre la naturaleza de la respuesta inmune adaptativa al afectar la capacidad de monocitos y macrófagos para presentar antígenos a los linfocitos T por regulación negativa de la expresión de moléculas del MHC-II56.
Se ha demostrado que la infección experimental con S. aureus no induce una respuesta significativa de IL-10 en la GM bovina8. Si bien se ha documentado la expresión de ARNm de IL-10 en células de leche proveniente de cuartos mamarios con infecciones crónicas por S. aureus69, la estimulación de pbMEC con S. aureus no logró aumentar los niveles de ARNm de dicha citoquina43, lo que sugiere que las CEM no serían la fuente de IL-10 en la leche durante la infección por S. aureus.
La IL-4 es una citoquina crítica que favorece el desarrollo de la respuesta celular Th274. Los transcriptos de esta citoquina no fueron detectados en leche de cuartos mamarios crónicamente infectados con S. aureus74. Por otra parte, la IL-13 no ha sido explorada en la GM bovina en infecciones por S. aureus.
El TGF-β, además de tener propiedades antiinflamatorias, regula un amplio espectro de actividades biológicas entre las que se incluyen el crecimiento y la diferenciación celular, la apoptosis, la migración celular, la angiogénesis y la producción de matriz extracelular52. Los genes de las tres isoformas de TGF-β (TGF-β1, TGF-β2 y TGF-β3) se expresan en la GM bovina53; sin embargo, solo el TGF-β1 y el TGF-β2 se han detectado en leche, con esta última como isoforma predominante22. Bannerman et al.10 demostraron que la IIM por S. aureus durante la mitad de la lactancia inducía un incremento en la producción de TGF-β1 y TGF-β2 en leche. Por otra parte, mediante infecciones experimentales de GM bovina durante la lactancia media y tardía utilizando diferentes cepas de S. aureus conocidas, como SCV, se ha demostrado que las concentraciones séricas de TGF-β1 pueden variar en relación con la cepa infectante40.
El TGF-β es un importante factor de diferenciación de células Th17, las cuales estimulan la respuesta inflamatoria durante infecciones que no son suficientemente controladas por la inmunidad Th1 o Th241. Las células reguladoras, que incluyen Treg y macrófagos M2, también producen TGF-β en humanos. Estas células colaboran en la prevención de los efectos adversos de la respuesta inmune prolongada o excesiva15. Estudios recientes han demostrado una mayor inmunoexpresión de TGF-β1, TGF-β2 TGF-β3 y de los receptores TGF-βR1 y TGF-βR3 en cuartos mamarios con infecciones crónicas por S. aureus comparados con cuartos mamarios no infectados, lo que sugiere una respuesta dirigida a limitar el alcance de la inflamación y lesión tisular generada por el proceso infeccioso crónico6.
Interferones: Los IFN constituyen una familia de citoquinas con funciones inmunes moduladoras. Los IFN de tipo I, como el IFN-α y el IFN-β, se expresan en todos los tipos de células, mientras que el IFN-γ es producido exclusivamente por los leucocitos y es el más estudiado en la inmunidad de la GM bovina. Recientemente Gilbert et al.31 demostraron una respuesta diferencial mayor en la activación de la vía del IFN tipo I luego de la estimulación de pbMEC con LPS de E. coli, y no observaron tal respuesta luego de la estimulación con sobrenadante de cultivo de S. aureus. En contraposición a estos resultados, otros estudios han demostrado la capacidad de S. aureus de activar genes dependientes de IFN34. Günther et al.34 postulan que la activación de genes dependientes de IFN también puede resultar de la estimulación autocrina/paracrina de las CEM por la IL-6, gatillando la vía de STAT3. Se detectó la sobreexpresión de genes dependientes de IFN luego de las 24 horas de exposición de pbMEC a S. aureus inactivado por calor, por lo cual la estimulación de genes dependientes de IFN podría ser un evento tardío en la interacción S. aureus/CEM, al contrario de lo que ocurre en la interacción E. coli/CEM31.
El IFN-γ promueve la diferenciación de células Th1 y suprime de forma concomitante la actividad de células Th2. Durante el curso de IIM experimentales por S. aureus se detectaron incrementos de las concentraciones de IFN-γ en leche y de la expresión cuantitativa de ARNm en células epiteliales, aunque en forma más tardía comparada con la infección por E. coli8,9,38,45,69. Es interesante destacar que las mayores concentraciones de IFN-γ se han detectado en IIM caracterizadas por una persistencia de la infección, y que estas elevadas concentraciones coincidieron con un mayor número de bacterias recuperadas de las GM infectadas en comparación con las GM no infectadas38. Esta característica puede reflejar un intento del huésped de intensificar las respuestas inmunes mediadas por células para erradicar a los patógenos que no son efectivamente eliminados por los mecanismos de defensa innatos en etapas más tempranas de la infección.
Estudios recientes han destacado la importancia del IFN tipo III (IFN-λ) en la regulación de citoquinas inflamatorias durante infecciones pulmonares causadas por S. aureus en humanos, sin embargo se desconoce la importancia de este tipo de IFN en IIM en bovinos23.
Quimioquinas: Constituyen una gran familia de citoquinas que estimulan la migración de leucocitos desde la sangre al sitio de la inflamación. La IL-8 o quimioquina CXCL8 ha sido la más estudiada en la GM bovina durante la respuesta inmune. Numerosos trabajos demuestran un aumento en la expresión cuantitativa de ARNm de CXCL8 en el tejido mamario y de la proteína CXCL8 en leche después de la infección con diferentes patógenos causantes de mastitis9.
Se ha señalado ya el rol de la IL-8 en las IIM por S. aureus en asociación con otros componentes de la inmunidad innata en diferentes secciones de la presente revisión. A modo de resumen, cabe aclarar que estudios realizados con diferentes cepas de S. aureus no han logrado detectar incrementos de IL-8 en leche luego de la IIM experimental8,68. Por otra parte, numerosos trabajos independientes con diferentes cepas de S. aureus han mostrado expresión disminuida o ausencia completa de ARNm de IL-8 en tejido mamario y en células de leche en respuesta a la infección experimental45,91.
Conclusión y perspectivas futurasEl conocimiento de los mecanismos de la respuesta inmune en la GM ha avanzado en forma significativa en los últimos años. Sin embargo, la mastitis bovina continúa siendo una enfermedad de alta prevalencia en los rodeos y con limitada respuesta a los tratamientos con antibióticos. Una respuesta óptima del hospedador contra los patógenos causantes de mastitis ocurre cuando los mecanismos inmunes están finamente regulados para lograr la eliminación del patógeno y el retorno del sistema inmune a la homeostasis. Aunque se ha avanzado mucho en la comprensión de la patogenia de la mastitis causada por S. aureus y los mecanismos que el microorganismo desarrolla para evadir la respuesta inmune del hospedador, aún existen áreas que no han sido exploradas. La mayoría de los estudios sobre persistencia de S. aureus en la GM han sido desarrollados in vitro en líneas celulares o en cultivos primarios de CEM, por lo que se necesitan nuevos estudios in vivo que permitan evaluar la respuesta inmune del hospedador frente a organismos con genotipos bacterianos definidos y caracterizados como de alta y baja adaptación a la GM, teniendo en cuenta los factores de virulencia más relevantes de las cepas estudiadas y la integridad de la respuesta inmune del hospedador. Los resultados que en el futuro se obtengan contribuirán a develar las complejas interacciones que determinan el establecimiento, la progresión y la cronicidad de las IIM causadas por S. aureus y, eventualmente, aportarán información para delinear alternativas superadoras que complementen los programas de prevención y control actuales.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo fue financiado por las siguientes fuentes: Proyecto PICT 2010 N° 872 (ANPCyP), PNSA 1115054 (INTA).