El factor masculino juega un rol en aproximadamente la mitad de las parejas que consultan por infertilidad. Múltiples patologías pre-testiculares, testiculares y post-testiculares pueden influir en el potencial fértil masculino. Un enfoque diagnóstico adecuado, permitirá identificar una causa específica en la mayoría de los casos. De esta forma se podrá ofrecer el tratamiento que otorga la mayor probabilidad de éxito. Diversas parejas con factor masculino severo, que en el pasado habrían tenido que utilizar semen de donante o considerar la adopción, han podido tener descendencia mediante la recuperación espermática a través de diferentes técnicas, asociada a inyección intracitoplasmática de espermatozoides. Sin embargo, existen situaciones en las cuales será imposible recuperar gametos viables y/o se transmitirán alteraciones genéticas a la descendencia. Una adecuada discusión entre el especialista y la pareja es esencial para decidir la mejor conducta en cada caso.
Male factor plays a role in about half of couples consulting for infertility. Multiple pre-testicular, testicular and post-testicular pathologies can influence male fertility potential. A suitable diagnostic approach will help to identify a specific cause in most cases and allow the specialist to offer a treatment that gives the highest probability of success. Several couples with severe male factor, which in the past would have had to use donor sperm or consider adoption, have been able to father children by sperm retrieval through different techniques combined with intracytoplasmic sperm injection. Conversely, there are situations in which it will be impossible to recover viable gametes and/or will be impossible not to pass genetic mutations to the offspring. Proper discussion between the specialist and the couple is essential to decide the best conduct in each case.
Infertilidad se define como la incapacidad de lograr un embarazo espontáneo después de un año de relaciones sexuales sin la utilización de métodos anticonceptivos. Aproximadamente 15% de las parejas consultan por esta causa (1). El factor masculino es el único responsable en el 20% de los casos, y contribuye a la infertilidad de pareja en el 50% de las ocasiones (2). Cuando se está frente a un factor masculino, casi siempre se observará una alteración cuantitativa o cualitativa de uno o más parámetros seminales.
La infertilidad masculina puede ser provocada por una variedad de condiciones. Algunas de ellas se pueden identificar y tratar, como el hipogonadismo hipogonadatrófo; otras se logran diagnosticar, pero no cuentan con un tratamiento específico, como alteraciones genéticas o atrofia testicular. En el 30-40% de los pacientes con alteraciones del espermiograma, el examen físico y las pruebas de laboratorio no logran objetivar una causa específica de la infertilidad, clasificando a estos pacientes como portadores de una infertilidad masculina idiopática (1). Las diferentes técnicas de recuperación espermática, que extraen gametos de diferentes regiones del sistema reproductor masculino, han logrado que parejas con factor masculino severo sin tratamiento específico puedan lograr embarazos y descendencia.
El objetivo de esta revisión es presentar la evidencia actual en relación al estudio del hombre infértil y el manejo específico de las causas más importantes que condicionan dicha infertilidad. El realizar un estudio completo de estos pacientes, permitirá al especialista (3):
- -
Tratar las alteraciones corregibles.
- -
Identificar las condiciones sin tratamiento específico, para ofrecer técnicas de reproducción asistida utilizando espermatozoides del paciente.
- -
Identificar las condiciones donde será imposible recuperar gametos masculinos viables, pudiendo ofrecer técnicas de reproducción asistida con semen de donante o adopción.
- -
Reconocer las enfermedades graves que pueden estar manifestándose como infertilidad.
- -
Diagnosticar alteraciones genéticas que puedan afectar la salud o potencial reproductivo de la descendencia.
Se debe realizar una evaluación del factor masculino cuando no se logra embarazo después de un año de relaciones sexuales sin protección. Dicha evaluación se debe realizar antes de un año si existen factores de riesgo para infertilidad masculina (ej. criptorquidia bilateral) o femenina (ej. edad mayor a 35 años) dentro de la pareja (3). La edad femenina es la variable más importante para lograr éxito en reproducción asistida (1,4). Los otros factores pronósticos son la duración de la infertilidad, si es primaria o secundaria, los tipos de alteraciones del espermiograma y el status de fertilidad del factor femenino (1).
Existen múltiples causas de infertilidad masculina, las que se presentan en la Tabla 1. Pueden ser congénitas o adquiridas. Secundarias a patología pre-testicular (eje hipotálamo-hipófisis-gónadas), testicular o post-testicular (desde testículo hasta conductos eyaculadores) (5). Se asume que la infertilidad idiopática está causada por múltiples factores, como alteraciones endocrinas, estrés oxidativo, alteraciones genéticas y epigenéticas (1).
Diagnóstico diferencial de la infertilidad masculina
| Causas pre-testiculares |
| Hipogonadismo hipogonadotrófo congénito |
| Patología hipofisiaria: tumores, enfermedades infiltrativas e |
| infartos |
| Patología suprarrenal: tumores e hiperplasia suprarrenal congénita |
| Infecciones sistémicas, incluyendo enfermedades virales y |
| tuberculosis |
| Neoplasias sistémicas |
| Abuso de esteroides anabólicos |
| Causas testiculares |
| Varicocele |
| Síndrome de Klinefelter |
| Microdeleciones del cromosoma Y |
| Tumores de células germinales |
| Tumores de células de Leydig o de células de Sertoli |
| Falla testicular idiopática |
| Daño vascular o traumático |
| Orquitis previa |
| Exposición a gonadotoxinas: quimioterapia, radiación, fármacos, |
| calor |
| Causas post-testiculares |
| Obstrucción epididimaria congénita, iatrogénica o postinflamatoria |
| Obstrucción de conductos deferentes congénita, iatrogénica o |
| postinflamatoria |
| Obstrucción de conductos eyaculadores |
| Disfunción sexual o eyaculatoria |
La evaluación básica del paciente que consulta por infertilidad incluye (3,5):
- 1.
Anamnesis médica y sexual.
- 2.
Examen físico.
- 3.
Dos espermiogramas.
En relación a los resultados encontrados en la evaluación básica, se podrá solicitar un estudio más avanzado, que puede incluir (3, 5):
- 4.
Perfil endocrinológico.
- 5.
Análisis de orina post-eyaculación.
- 6.
Ecotomografía testicular o transrectal.
- 7.
Evaluación genética.
- 8.
Pruebas especializadas.
La anamnesis tiene como objetivo identificar factores de riesgo o hábitos de comportamiento que pueden tener una repercusión sobre la fertilidad del paciente. Se debe investigar acerca de enfermedades previas o actuales, con énfasis en el sistema reproductor (criptorquidia, infecciones de transmisión sexual, entre otras) y respiratorio (infecciones respiratorias a repetición pueden estar reflejando fibrosis quística). Se debe preguntar acerca de cirugías previas, con especial énfasis en cirugía inguinal, retroperitoneal o genital (5).
Se debe conocer la historia reproductiva previa de los integrantes de la pareja y los hábitos sexuales actuales (frecuencia de relaciones sexuales y utilización de lubricantes). Alteraciones de la libido, disfunción eréctil y alteraciones de la eyaculación deben ser identificadas. Se deben revisar los fármacos y drogas utilizadas en el presente y pasado. Por último, se debe conocer acerca de exposiciones ambientales a tóxicos que puedan afectar la fertilidad del paciente (3,5).
2Examen físicoSe debe iniciar el examen físico con la inspección general del paciente, buscando alteraciones del hábito corporal, alteraciones de los caracteres sexuales secundarios, presencia de ginecomastia y/o cicatrices de cirugías previas. Se debe examinar el pene, incluyendo la posición del meato urinario y estigmas de infecciones de transmisión sexual. Se deben palpar los testículos, evaluando tamaño, consistencia o presencia de zonas induradas. Los epidídimos deben ser identificados, evaluando la presencia de dilatación, induración o dolor a la palpación (5).
Se deben identificar ambos conductos deferentes. La ausencia de ambos conductos puede estar en el contexto de agenesia congénita bilateral de conductos deferentes (CBAVD), manifestándose como azoospermia obstructiva. La ausencia de sólo uno de ellos puede reflejar alteraciones embrionarias del conducto mesonéfrico, lo que se asocia a agenesia renal ipsilateral. El examen debe finalizar con un tacto rectal, aprovechando de evaluar la indemnidad de los reflejos espinales a nivel sacro (3,5).
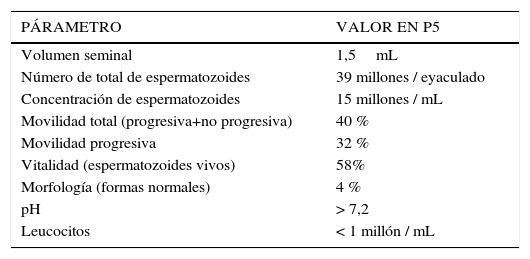
3Análisis seminalEl análisis de los parámetros seminales es la piedra angular de la evaluación andrológica del hombre que consulta por infertilidad. La metodología para procesar y analizar muestras de semen humano ha sido publicada por la Organización Mundial de la Salud (OMS) (6). Las muestras pueden ser recolectadas en el hogar o en el laboratorio, debiendo ser mantenidas a temperatura ambiente y analizadas dentro de una hora. El paciente debe haber mantenido abstinencia sexual por 3 a 5 días (3). Los valores de normalidad y anormalidad de los diferentes parámetros medidos en el espermiograma han cambiado durante los años. Los valores de referencia actuales son los publicados por la OMS en 2010, derivados de un estudio poblacional internacional de hombres fértiles (1). Los valores anormales se definieron como los que se encuentran bajo el percentil 5 y se presentan en la Tabla 2.
Criterios de anormalidad de parámetros seminales (percentil 5) oms 2010
| PÁRAMETRO | VALOR EN P5 |
|---|---|
| Volumen seminal | 1,5mL |
| Número de total de espermatozoides | 39 millones / eyaculado |
| Concentración de espermatozoides | 15 millones / mL |
| Movilidad total (progresiva+no progresiva) | 40 % |
| Movilidad progresiva | 32 % |
| Vitalidad (espermatozoides vivos) | 58% |
| Morfología (formas normales) | 4 % |
| pH | > 7,2 |
| Leucocitos | < 1 millón / mL |
Un volumen seminal bajo 1,5ml puede ser el resultado de recolección incompleta de la muestra, baja testosterona, eyaculación retrógrada u obstrucción de los conductos eyaculadores. Esta última se sospecha cuando el semen tiene un pH < 7,2 con baja fructosa (ausencia del aporte alcalino, rico en fructosa, de las vesículas seminales) (5).
Oligozoospermia se define como una concentración espermática bajo el percentil 5 (15 millones/ml), y puede estar reflejando múltiples condiciones. No se debe diagnosticar azoospermia (ausencia de espermatozoides en el eyaculado) hasta centrifugar la muestra. Si posteriormente se confirma la ausencia de espermatozoides, se debe continuar el estudio para diferenciar si es que se está frente a una azoospermia obstructiva (OA) o no obstructiva (NOA) (1,3,5).
La presencia de leucocitozoospermia (>1 millón de leucocitos/ml) puede estar reflejando una infección genitourinaria. La anamnesis, examen físico y estudios microbiológicos específicos podrán confirmar el diagnóstico. En el análisis seminal no se debe considerar como sinónimos las células redondas y los leucocitos, ya que las primeras también reflejan la presencia de células germinales inmaduras en el eyaculado.
Astenozoospermia se define, según los criterios de OMS 2010, como una movilidad progresiva menor a 32% o una movilidad total menor a 40%. Es una variable inespecífica, que puede estar en el contexto de varicocele, defectos espermáticos ultraestructurales, anticuerpos anti-espermáticos, o puede ser idiopática (5). Teratozoospermia se define como menos de 4% de formas normales, y se ha relacionado con fracaso en técnicas de reproducción asistida como fertilización in vitro (FIV) o inseminación intrauterina (IUI). No se ha descrito una clara influencia sobre el éxito en embarazos producto de inyección intracitoplasmática de espermatozoides (ICSI) o embarazos espontáneos (7, 8).
4Evaluación endocrinaLas alteraciones del eje hipotálamo-hipófisis-gónadas son causas frecuentes de infertilidad masculina. Con una adecuada evaluación endocrina, se pueden diferencias fallas testiculares primarias (hipogonadismo hipergonadotrófo) de fallas hipofisiarias o hipotalámicas (hipogonadismo hipogonadotrófo). Está indicada una evaluación básica con hormona folículo estimulante (FSH) y testosterona en todos los pacientes con alteraciones en el espermiograma, alteraciones de la función sexual o con hallazgos clínicos sugerentes de endocrinopatía (3).
Si el nivel de testosterona es bajo, se debe completar el estudio con hormona luteinizante (LH) y prolactina. Los micro y macroadenomas productores de prolactina son los tumores hipofiasirios más comunes, produciendo un efecto negativo sobre las células productoras de gonadotrofinas. La medición de prolactina será de especial importancia en pacientes con disminución de la libido, disfunción sexual, ginecomastia o galactorrea (5). Una FSH normal no garantiza una función testicular normal, sin embargo, una FSH elevada es indicativa de una falla en la espermatogénesis (1).
5Análisis de orina post-eyaculaciónSe debe realizar este examen a todos los pacientes con un volumen seminal menor a 1,5ml, en los cuales se ha descartado previamente CBAVD e hipogonadismo. Esta prueba se realiza centrifugando la muestra seminal por 10 minutos a 300xg, con posterior observación del pellet con una magnificación de 400x. La observación de un número significativo de espermatozoides es indicativa de eyaculación retrógrada (1).
6Ecotomografía testicular y transrectalSe debe realizar una ecotomografía testicular a los pacientes en que existe dificultad o imposibilidad de realizar un adecuado examen escrotal (obesos, cirugía escrotal previa, testículos altos o grandes hidroceles). Con este examen se podrá objetivar patología testicular, epididimaria o del cordón espermático. La ecotomografía escrotal también debe ser solicitada cuando, en el examen físico, se palpa una masa testicular sospechosa (5). Se podría recomendar este examen a todos los pacientes que presentan alteraciones en el espermiograma, por el mayor riesgo de cáncer testicular descrito en este grupo específico.
La ecotomografía transrectal está indicada en el estudio de azoospermia u oligozoospermia de origen obstructivo. Se debe solicitar en pacientes con azoospermia u oligozoospermia severa con muestras seminales de bajo volumen, acidóticas, de baja fructosa. La visualización de vesículas seminales dilatadas (diámetro anteroposterior mayor a 2cm), conductos eyaculadores dilatados o quistes prostáticos de línea media apoyan el diagnóstico de obstrucción parcial o completa de conductos eyaculadores (3,9).
7Pruebas genéticasAnormalidades cariotípicas y microdeleciones del cromosoma Y son comunes en pacientes con alteración de la espermatogénesis (3). Se observan alteraciones cromosómicas, como deleciones, translocaciones, duplicaciones e inversiones en el 6% de los hombres con infertilidad. Su transmisión a la descendencia puede resultar en abortos espontáneos, malformaciones congénitas, infertilidad masculina y una diversidad de síndromes genéticos. El síndrome de Klinefelter (47 XXY) es, por mucho, la anormalidad cromosómica más diagnosticada en estos pacientes; 1 de cada 500 hombres en la población general presenta esta genopatía (5).
Aproximadamente, el 10 a 13% de pacientes con azoospermia es portador de una microdeleción del cromosoma Y (11). Pudiendo ser diagnosticadas utilizando sequence tagged sites y reacción en cadena de la polimerasa. Su diagnóstico tiene implicancias pronósticas y éticas. La identificación de microdeleciones AZFa y AZFb se asocia a síndrome de Sertoli solo y detención de la maduración, no existiendo posibilidad de encontrar gametos viables con ninguna técnica de recuperación espermática. La microdeleción AZFc se asocia a oligozoospermia severa, existiendo un éxito cercano al 80% de recuperación espermática para su posterior utilización en ICSI. Esta mutación se transmitirá de forma invariable a la descendencia masculina, provocando infertilidad en estos individuos (12-14).
Se recomienda solicitar consejería genética, cariotipo y microdeleciones del cromosoma Y a todos los pacientes con azoospermia no obstructiva y oligozoospermia severa (< 5 millones por ml). El 70% de los pacientes con CBAVD sin síntomas o signos de fibrosis quística pose una mutación del gen del receptor de conductancia transmembrana de fibrosis quística (CFTR) (15,16). Aunque se han descrito más de 1300 mutaciones para CFTR, las pruebas más utilizadas se basan en la búsqueda de 30 a 50 mutaciones más comunes; por lo que un resultado negativo no es sinónimo de ausencia de una mutación. La mayoría de los pacientes con agenesia de conductos deferentes, presentan también hipoplasia o agenesia de vesículas seminales, presentando bajo volumen de eyaculado. En pacientes azoospérmicos con agenesia unilateral, la realización de una ecotomografía transrectal puede confirmar atresia contralateral de conductos deferentes o vesículas seminales, explicando una azoospermia obstructiva (3,17).
Se les debe ofrecer detección de mutación de CFTR y consejería genética a todos los hombres con CBAVD. También se le debe ofrecer a la pareja femenina, si es que se utilizará el semen de un paciente con CBAVD en técnicas de reproducción asistida. Se debe indicar estudio ecográfico renal a pacientes con agenesia unilateral de conductos deferentes, para identificar posibles malformaciones renales. Por último, se debe considerar secuenciar el gen CFTR completo en pacientes con CBAVD con un panel de mutaciones negativo y una pareja femenina portadora de mutaciones del gen de la fibrosis quística (3).
8Pruebas especializadas8.1Integridad del DNALa medición de integridad del DNA se refiere a una variedad de pruebas de laboratorio que evalúan el grado de fragmentación del DNA espermático (3). Las dos pruebas más utilizadas son el sperm chromatin structure assay (SCSA) y el terminal deoxynucleotidyl transferase dUTP Nick end-labeling (TUNEL). La primera informa el porcentaje de espermatozoides con DNA desnaturalizado (una hebra), denominado índice de fragmentación del DNA, cuyo valor normal es 20%. La segunda prueba objetiva los espermatozoides con hebras de DNA fragmentados mediantes marcación con un fluoróforo, los resultados se expresan con el porcentaje de espermatozoides positivos para TUNEL. Existe controversia en relación a la utilidad de estas pruebas (5,17). Diversos estudios han relacionado la fragmentación del DNA con fracaso en concepción natural e IUI. El valor pronóstico en pacientes sometidos a FIV e ICSI no es muy claro (19-21).
8.2Anticuerpos antiespermáticosLas tasas de embarazo parecieran estar reducidas cuando existen anticuerpos antiespermáticos en el semen (22). Los factores de riesgo para presentar estos anticuerpos son obstrucción ductal, infecciones genitales, trauma testicular, cirugías testiculares/epididimarias y antecedentes de vasectomía. Se debe considerar solicitarlos en pacientes con astenozoospermia, aglutinación espermática o un test post-coital anormal (3).
8.3Otras pruebas especializadasLas pruebas de viabilidad espermática, mediante tinción supravital o test hipoosmótico, son útiles en pacientes con astenozoospermia; para diferenciar espermatozoides muertos de inmóviles, que podrían ser utilizados posteriormente en ICSI. El test post-coital es la examinación microscópica del mucus cervical, realizado antes de la ovulación, unas horas después de una relación sexual. Determina si los espermatozoides alcanzan y penetran la barrera del mucus cervical. Puede ser útil en casos de semen hiperviscoso, infertilidad no explicada, concentración espermática normal en eyaculados de alto o bajo volumen y en los casos de anatomía peneana anormal (5).
Las pruebas de función espermática, como la prueba de penetración espermática, la evaluación de reacción acrosomal y la prueba de hemizona, evalúan la capacidad de adhesión y penetración de los espermatozoides en el ovocito. Pueden estar indicadas cuando se debe decidir la técnica de reproducción asistida más adecuada o cuando se está investigando la causa de fracasos recurrentes en reproducción asistida (3, 5). En el líquido seminal, leucocitos y espermatozoides defectuosos producen especies reactivas de oxígeno (ROS). Diversos estudios han postulado que el desbalance entre ROS y sustancias antioxidantes (estrés oxidativo) juega un rol fundamental en diversas condiciones relacionadas a infertilidad masculina, como el varicocele. Actualmente existen pruebas de laboratorio que cuantifican el daño oxidativo de diferentes estructuras espermáticas. La medición de 8-hidroxi-2-deoxiguanosina refleja la acción oxidante de ROS sobre el DNA espermático (3).
Tratamiento de causas modificablesTratamiento del varicoceleSe define como una dilatación excesiva del plexo venoso pampiniforme del cordón espermático, que puede ser identificado clínicamente o a través de visualización de reflujo venoso en ecografía doppler. Frecuentemente aparece en la pubertad precoz. La prevalencia es de 12 a 15% de los adolescentes masculinos. Se considera la causa, corregible quirúrgicamente, más frecuente de infertilidad masculina (1).
En su etiología, se destaca el aumento de presión en la vena renal izquierda causada por anastomosis venosas colaterales e incompetencia valvular. Anatómicamente, la vena espermática izquierda drena a la vena renal izquierda, mientras que la vena espermática derecha drena directamente en la vena cava.
El varicocele se puede clasificar en:
- -
Subclínico: No se puede observar ni palpar. Sólo se identifica con ecodoppler testicular.
- -
Grado 1: Palpable sólo con maniobra de valsalva.
- -
Grado 2: Palpable en reposo, pero no visible.
- -
Grado 3: Visible y palpable en reposo.
Los efectos en el crecimiento testicular y fertilidad podrían ser consecuencia del aumento de temperatura local, disrupción vascular y desbalance endocrino. En el último tiempo, el estrés oxidativo ha sido postulado como un elemento importante en la fisiopatología. En pacientes infértiles, el patrón clásico del espermiograma muestra disminución de la concentración, movilidad y aumento de las formas anormales de los espermatozoides (oligoastenoteratozoospermia).
El tratamiento del varicocele ha sido durante años un tema controversial en urología. Aunque se ha demostrado que mejora la movilidad, concentración y disminuye el daño del DNA; su real utilidad en aumentar la tasa de recién nacidos no ha sido demostrada (23).
Actualmente se recomienda tratar cuando (1):
- -
Se ha objetivado una alteración progresiva en el desarrollo testicular ipsilateral.
- -
Se debe considerar en los casos de varicocele clínico (palpable), oligozoospermia e infertilidad no explicada por otras causas.
Existen múltiples alternativas terapéuticas, entre las que se encuentran: escleroterapia, embolización y varicocelectomía escrotal, inguinal, ligadura alta, subinguinal, microquirúrgica (inguinal y subinguinal) y laparoscópica. Las menores tasas de persistencia y recurrencia, y los mejores resultados en cuanto a parámetros seminales, atrofia testicular e hidrocele post-operatorio, se observan con la técnica microquirúrgica. Diversos estudios han informado mejores resultados en la tasas de embarazo con esta técnica (1,24-26).
Tratamiento del hipogonadismoTestosterona disminuida, asociada a valores bajos de FSH y LH son compatibles con hipogonadismo hipogonadotrófo, pudiendo ser congénito (ej. síndrome de Kallman), adquirido (ej. tumores hipofisiarios) o idiopático. Adenomas hipofisiarios productores de prolactina son una causa frecuente de esta condición, pudiendo ser tratados con agonistas dopaminérgicos como carbegolina (5).
En pacientes hipogonádicos, se puede establecer una espermatogénesis normal con terapia de reemplazo de gonadotrofinas (5). La acción de FSH sobre las células de sertoli se puede reemplazar con gonadotropina menopáusica humana o con FSH recombinante. La acción de LH sobre las células de Leydig se puede sustituir con gonadotrofina coriónica humana (5).
En pacientes con testosterona baja, y gonadotrofinas elevadas, se debe realizar el diagnóstico de falla testicular. No se debe implementar una terapia de reemplazo androgénica, ya que la testosterona exógena inhibirá la espermatogénesis. Se debe buscar la causa de la falla testicular primaria. Algunas de éstas tienen tratamiento específico, otras permiten la recuperación espermática para posterior reproducción asistida, y otras no permiten obtener gametos viables por lo que la adopción o utilización de semen de donante deben ser consideradas (5). Un grupo específico de estos pacientes presenta niveles de estradiol elevados, pudiendo ser tratados con inhibidores de aromatasa. Estudios han demostrado una mejoría significativa de los parámetros seminales con este tratamiento (27).
Tratamiento de azoospermia obstructivaEl 40% de las azoospermias se incluyen en este grupo. La obstrucción puede ser intratesticular, epididimaria, deferencial o en los conductos eyaculadores. Se observan testículos de tamaño normal, epidídimos dilatados, bajo volumen seminal y FSH normal. Los dos principales tratamientos incluyen la corrección quirúrgica y la recuperación espermática seguida de ICSI. En casos de obstrucción epididimaria o deferencial, el sitio preciso de obstrucción puede ser determinado a través de una vesiculo-deferentografía o exploración quirúrgica. La cirugía de corrección debe ser realizada por un cirujano con experiencia en microcirugía. Las tasas de presencia de espermatozoides en el eyaculado son de 80%-90% para la vasovasostomía (reversión de la vasectomía) y de 40%-60% para la epididimovasostomía. Si la obstrucción está ubicada en los conductos eyaculadores, la cirugía de elección es la resección transuretral. Las tasas de embarazo no asistido después de cirugía son de 30-75%, 20-40% y 25-29%, respectivamente. (5).
La recuperación espermática para ICSI es la terapia de elección cuando existen factores femeninos que requieren reproducción asistida, cuando la reconstrucción es imposible (como en CBAVD) o cuando fracasan las técnicas de corrección. Se utilizarán diferentes técnicas, como la aspiración espermática microquirúrgica desde epidídimo (MESA), la aspiración espermática percutánea desde epidídimo (PESA) o la extracción espermática desde testículo (TESE), dependiendo del sitio de obstrucción y la experiencia del cirujano (1,28).
Tratamiento de azoospermia no obstructiva (NOA)La NOA refleja un daño severo de la espermatogénesis. Se caracteriza clínicamente por testículos pequeños y blandos, asociados a FSH elevada. Múltiples condiciones que producen falla testicular, tienen como producto final la NOA. Su tratamiento se ha revolucionado desde que se describió TESE, pudiéndose optimizar al realizarla con microdisección (m-TESE). En esta técnica, se pueden reconocer visualmente los túbulos seminíferos que más probablemente contienen espermatozoides, para su posterior extracción (29). Las tasas de recuperación exitosa son de 35%-63%, dependiendo de la etiología de la NOA y la experiencia del cirujano (30). En pocas patologías se puede predecir de forma irrefutable el fracaso de TESE, las microdeleciones completas de las zonas AZFa y AZFb del cromosoma Y son una de ellas (5).
Tratamiento de las disfunciones sexuales y eyaculatoriasLas disfunciones sexuales pueden interferir con las relaciones sexuales y/o eyaculación intravaginal. Trastornos de la libido, asociados a baja testosterona, pudieran ser tratados con moduladores del receptor de estrógenos (clomifeno o tamoxifeno), inhibidores de aromatasa o gonadotrofina coriónica humana. La disfunción eréctil puede ser tratada con inhibidores de fosfodiesterasa 5 o inyecciones intracavernosas (5). En el caso de eyaculación retrógrada, se pueden utilizar agentes simpaticomiméticos como efedrina o imipramina; o se pueden recuperar espermatozoides desde orina post-eyaculación. Para pacientes aneyaculatorios, se puede utilizar estimulación peneana vibratoria, electroeyaculación transrectal o recuperación espermática quirúrgica (31-33).
Tratamiento antioxidanteEl tratamiento con antioxidantes orales se basa en múltiples estudios que demuestran una mayor concentración de ROS y sus productos de degradación, en plasma seminal de pacientes infértiles, con alteración de diferentes parámetros seminales. Existe evidencia controversial en relación a los efectos que tienen los antioxidantes sobre la concentración, movilidad, estructura espermática e integridad del DNA (34). Sin embargo, una revisión Cochrane del año 2012 que incluyó 34 estudios con 2876 parejas, demostró que la terapia con antioxidantes orales aumenta la tasa de embarazos y recién nacidos vivos, sin aumentar los efectos adversos (35). Entre los agentes utilizados, los con mayor evidencia son la L-carnitina, vitamina C y vitamina E. Las dos últimas, utilizadas en conjunto, lograrían proteger a las estructuras espermáticas lipídicas (vitamina E) e hidrofílicas (vitamina C), frente al ataque de ROS.
ConclusionesExiste un factor masculino en aproximadamente la mitad de las parejas infértiles. La adecuada evaluación del paciente con anamnesis, examen físico, espermiograma y exámenes básicos de laboratorio, permitirá identificar las condiciones que tienen tratamiento específico; las que no tienen tratamiento, pero permiten recuperar gametos viables; las que no permitirán recuperar espermatozoides, debiendo asesorar en relación a adopción o utilización se semen de donante; y las condiciones que pueden poner en riesgo la vida del paciente. En los últimos años, el desarrollo de diferentes técnicas de recuperación espermática e ICSI, han permitido que pacientes con severas alteraciones de la espermatogénesis o del transporte espermático, puedan tener descendencia. La elección de la técnica más adecuada, con la mayor tasa de éxito, depende de haber logrado un diagnóstico específico correcto.
Los autores declaran no tener conflictos de interés, con relación a este artículo.