En una pareja con infertilidad, la evaluación masculina es fundamental por dos razones principales. En primer lugar, es la única causa de infertilidad en el 20% de las parejas y en el 50% se encuentra asociada a una causa de infertilidad femenina; en segundo lugar, existe evidencia de la relación entre infertilidad masculina y comorbilidades, como enfermedades cardiovasculares, oncológicas, reumatológicas e incluso con aumento de la mortalidad. Por esto, los pacientes deben ser evaluados por urólogos-andrólogos entrenados que permitan llegar al diagnóstico etiológico, como también buscar comorbilidades asociadas. Una correcta historia clínica, examen físico, espermiograma y exámenes complementarios permitirán obtener el diagnóstico etiológico y por lo tanto el tratamiento adecuado. Las causas genéticas de infertilidad son al menos el 15% de las etiologías, aumentando hasta el 25% en casos de azoospermia. A través del desarrollo y avance en biología molecular, en el futuro se podrán identificar otras causas genéticas que actualmente son categorizadas como infertilidad de origen idiopático.
When treating infertility, a study of the male partner is necessary for two main reasons: 1) In 20% of cases of infertility there is only a male root cause and in addition, in 50% of the cases the root cause is associated with the male and the female. 2) There is supporting and growing evidence that male infertility is related to comorbidities, including cardiovascular disease, cancer, rheumatologic disease, and even mortality. A thorough clinical history, physical examination, semen analysis and auxiliary tests will help us identify the cause and the correct treatment. Near 15% of male infertility are attributed to genetic causes, and this goes up to 25% in cases of azoospermia. With evolving advances and development of molecular biology, some causes of male infertility currently classified as idiopathic, will be specifically identified and categorized.
La infertilidad se define como la inhabilidad de lograr embarazo espontáneo en parejas sexualmente activas sin utilizar métodos anticonceptivos en un año. Una de cada ocho parejas tiene dificultades en concebir el primer hijo (infertilidad primaria), y una en seis para lograr un embarazo después del primero1 (infertilidad secundaria). En alrededor del 20% de los casos se encuentra un factor masculino como única causa de la infertilidad, y en un 50% se encuentra un factor masculino asociado a un factor femenino. Si se encuentra un factor masculino, éste se encuentra acompañado la mayoría de las veces de alteraciones del espermiograma. Sin embargo, otros factores pueden jugar un rol inclusive cuando los parámetros seminales son normales (ej. disfunciones sexuales, trastornos eyaculatorios, etc.)2. En el 30-40% de los pacientes con alteraciones del espermiograma, el examen físico y las pruebas de laboratorio no logran objetivar una causa específica de la infertilidad, clasificando a estos pacientes como portadores de una infertilidad masculina idiopática.
El objetivo de esta revisión descriptiva es presentar de un modo actualizado, aspectos fisiológicos de la espermatogénesis, así como las causas y los métodos de estudio de la infertilidad masculina, con énfasis en los factores genéticos de infertilidad.
Fisiología de la espermatogénesisFase de multiplicación o mitosisDurante el desarrollo embrionario, la expresión del gen SRY gatilla el inicio de la diferenciación desde una gónada bipotencial a una masculina. Durante este proceso las poblaciones de células madre primordiales evolucionarán a la formación de gonocitos.
En los primeros 3 meses post parto, inducidos por la mini pubertad, los gonocitos evolucionan a espermatogonias madre (EM). Las EM se auto renuevan y a su vez deben generar espermatogonias progenitoras (As, Apr, Aal), que posteriormente entran en el proceso de espermatogénesis. La mayoría de las espermatogonias Aal se diferencian a espermatogonias A1 sin mediar división celular y luego se producen 5 divisiones celulares sucesivas pasando por espermatogonias A2, A3, A4, Intermedias (In) y B.
En el hombre, cada 16 días un grupo determinado de espermatogonias A se diferencian a espermatogonias A1, las que desde este punto demorarán aproximadamente 74 días hasta la liberación de un espermatozoide a los conductos seminíferos.
Fase de meiosisLa primera sub-fase de la meiosis se denomina Meiosis I. Esta comienza a su vez con la Profase I, la más larga de la espermatogénesis, donde se produce la duplicación del DNA y la formación de cromátidas hermanas, dando como resultado a los espermatocitos primarios (2n, 4c).
En Metafase I los cromosomas se sitúan en el ecuador y en Anafase I se separan de manera uniforme arrastrados por las fibras del huso meiótico. Al llegar a Telofase I, cada célula tendrá la mitad del número de cromosomas, pero éstos estarán conformados por dos cromátidas hermanas.
Finalmente, se completa la separación celular dando como resultado la producción de 2 espermatocitos secundarios (1n, 2c).
La Meiosis II es una fase más breve que su antecesora, similar a una mitosis, con la única diferencia que los espermatocitos secundarios son células haploides.
En esta fase se separan las cromátidas hermanas y se produce una nueva separación celular dando como resultado 2 espermátidas redondas (1n, 1c).
EspermiogénesisEs la fase final y de transformación morfo-funcional que se inicia a partir de una espermátida redonda y finaliza con la formación de un espermatozoide maduro que es liberado al lumen del túbulo seminífero.
Durante esta fase, se produce un reordenamiento completo de los organelos y una pérdida importante de material citoplasmático.
El aparato de Golgi se desplaza a uno de los extremos de la célula, quedando ubicado en lo que será la cabeza del espermatozoide, donde dará origen al acrosoma, estructura fundamental para la fecundación.
El núcleo se alarga y se compacta, quedando ubicado en la cabeza de la célula, por detrás del acrosoma y las mitocondrias migran al cuello del espermatozoide. La cola se forma a partir de los centriolos en el polo opuesto al acrosoma, dotando al espermatozoide de una estructura flagelada que le otorga movilidad.
Estudios diagnósticos de la infertilidad masculinaEstudio básico:
- -
Anamnesis
- -
Examen físico
- -
Dos espermiogramas separados por un mínimo de 3 semanas
- -
Ecografía Doppler
- -
FSH – LH – Testosterona Total
Estudio extendido:
- -
PCRs en semen u orina de primer chorro para:
Chlamydia trachomatis
Neisseria gonorrhoea
- -
Cultivo seminal corriente
- -
Cultivo seminal
Ureaplasma urealiticum
Mycoplasma genitalium
- -
Fragmentación del DNA espermático
El objetivo de la evaluación masculina es identificar2:
- a)
Condiciones potencialmente reversibles (e hipogonadismo hipogonadotrópico, varicocele, infecciones, disfunciones sexuales, entre otros).
- b)
Condiciones irreversibles en la cual las terapias de reproducción asistida (TRA) permiten la utilización de espermatozoides del paciente (ej Criptorquidia).
- c)
Condiciones irreversibles en las cuales las TRA no permiten la utilización de espermatozoides del paciente y requiere utilización de semen de donante o adopción.
- d)
Enfermedades graves y/o de riesgo vital, que pueden producir infertilidad y requieren atención médica (ej. cáncer testicular).
- e)
Enfermedades genéticas que pueden afectar la salud de la descendencia al utilizar TRA.
El hombre debe ser evaluado en toda pareja que consulta por infertilidad, a través de una historia médica completa, y un espermiograma. En caso de encontrarse este último alterado, debe ser repetido3. La evaluación por un urólogo-andrólogo especialista debe ser realizada siempre en caso de encontrar alteraciones del espermiograma y/o en la historia clínica4, considerada en parejas con infertilidad de causa no explicada y en aquellas parejas con infertilidad femenina tratada y persistencia de infertilidad2.
Esta evaluación se realiza cuando las parejas no logran concebir en un año sin métodos anticonceptivos, o posterior a 6 meses, si el paciente tiene antecedentes de factores de riesgo, como por ejemplo criptorquidia.
Historia clínica debe incluir4:
- a)
Frecuencia coital
- b)
Duración de la infertilidad y fertilidad previa
- c)
Enfermedades de la infancia
- d)
Enfermedades sistémicas
- e)
Cirugías previas
- f)
Disfunciones sexuales
- g)
Infecciones de transmisión sexual.
- h)
Exposición a tóxicos, incluyendo calor
Examen físico4:
- a)
Caracteres sexuales secundarios (distribución vello corporal, ginecomastia)
- b)
Pene, incluyendo localización del meato
- c)
Palpación de la consistencia y tamaño testicular (normal >20cm3)
- d)
Ausencia de testículos palpables
- e)
Presencia de conductos deferentes y epidídimo (diagnóstico de agenesia conductos deferentes es clínico)
- f)
Presencia de varicocele
- g)
Tacto rectal en caso necesario
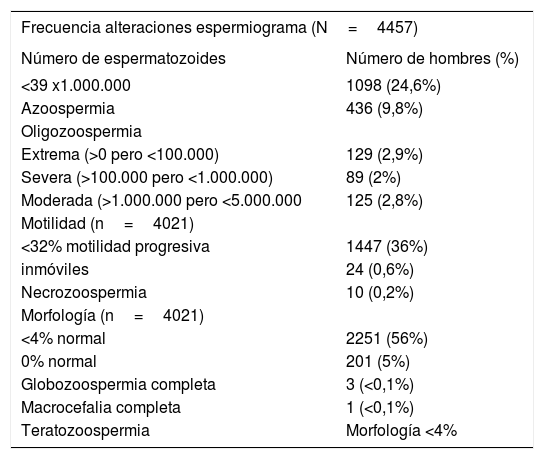
Para una correcta interpretación del espermiograma, deben ser utilizados los criterios de la Organización Mundial de la Salud (OMS) 20103,4. En la Tabla 1, se señalan los valores normales y las alteraciones más importantes. Es importante recalcar que los valores de anormalidad son definidos como inferiores al percentil5; es decir, un 5% de los hombres fértiles tienen parámetros seminales inferiores al número de referencia y un 95% de los hombres fértiles tienes parámetros seminales superiores al valor de referencia. El valor predictivo de los parámetros seminales usados individualmente es bajo en el diagnóstico de infertilidad ya que no discrimina completamente a los hombres fértiles de infértiles, así como números bajos no excluyen éxito de fertilización asistida. Sin embargo, se observa mayor correlación con infertilidad cuando existe combinación de parámetros alterados5. En la Tabla 2 se muestra la frecuencia de alteraciones en el espermiograma de una cohorte europea de hombres en estudio por infertilidad, en el año 20106.
Espermiograma. Valores de normalidad y alteraciones
| Parámetros Normalidad Espermiograma | |
|---|---|
| Volumen | >1,5 ml |
| Concentración | >15.000.000/ml |
| Motilidad Progresiva | >32% |
| Vitalidad | >58% |
| Morfología | >4% |
| Alteraciones espermiograma | |
| Azoospermia | Ausencia de espermatozoides en el eyaculado |
| Oligozoospermia | Concentración <15.000.000/ml |
| Astenozoospermia | Motilidad progresiva <32% |
| Teratozoospermia | Morfología <4% |
Modificado de Jungwirth A, Giwercman A, Tournaye H, et al. European Association of Urology guidelines on Male Infertility: the 2012 update. Eur Urol 2012; 62:324-32. (Ref. 3).
Frecuencia de alteraciones del espermiograma en una cohorte europea de hombres en estudio por infertilidad
| Frecuencia alteraciones espermiograma (N=4457) | |
|---|---|
| Número de espermatozoides | Número de hombres (%) |
| <39 x1.000.000 | 1098 (24,6%) |
| Azoospermia | 436 (9,8%) |
| Oligozoospermia | |
| Extrema (>0 pero <100.000) | 129 (2,9%) |
| Severa (>100.000 pero <1.000.000) | 89 (2%) |
| Moderada (>1.000.000 pero <5.000.000 | 125 (2,8%) |
| Motilidad (n=4021) | |
| <32% motilidad progresiva | 1447 (36%) |
| inmóviles | 24 (0,6%) |
| Necrozoospermia | 10 (0,2%) |
| Morfología (n=4021) | |
| <4% normal | 2251 (56%) |
| 0% normal | 201 (5%) |
| Globozoospermia completa | 3 (<0,1%) |
| Macrocefalia completa | 1 (<0,1%) |
| Teratozoospermia | Morfología <4% |
Lancet Diabetes Endocrinol 2017; 5(7):544-53.(Ref. 6).
Para la evaluación del eje hipotálamo-hipofisis-gónada, se realiza la medición de FSH y testosterona. Se ha reportado esta etiología hasta en el 5% de los casos7. Además, la medición de FSH es fundamental en el diagnóstico diferencial de azoospermias secretoras y obstructivas8. Generalmente los niveles de FSH están inversamente relacionados con el número de espermatogonias presentes en la gonada9. Si se encuentra niveles disminuidos de testosterona, es importante repetir el examen junto con niveles de prolactina para descartar una hiperprolactinemia10.
Los métodos de apoyo al diagnóstico por imágenes pueden aportar luces respecto a la etiología. Se debe solicitar una ecografía doppler testicular, que permitirá por un lado una evaluación anatómica específica, confirmar sospechas como, por ejemplo, una criptorquidia o la presencia de varicocele, y por otro, descartar la presencia de un tumor testicular, el cual se encuentra asociado en mayor frecuencia en los pacientes con alteraciones del espermiograma que en la población general11. En el caso de sospechar una azoospermia de origen obstructivo (volumen seminal bajo, pH ácido y ausencia de espermatozoides) se podría solicitar una ecografía transrectal o una resonancia magnética pelviana12.
En un 15% de los pacientes con espermiograma normal pueden existir valores alterados de fragmentación del DNA. Hay creciente evidencia de la relación de altos valores de fragmentación del DNA espermático y bajas probabilidades de embarazo espontáneo y asociados a inseminación intrauterina13. La evidencia sobre resultados en ICSI (intracytoplasmic sperm injection) es aún controversial14,15. No existe un consenso definido sobre cuando solicitarlo. En nuestro centro lo realizamos a pacientes mayores de 45 años, quimioterapia reciente, infertilidad idiopática, falla al tratamiento de reproducción asistida, varicocele, exposición a tóxicos, infecciones seminales y aborto recurrente.
Factores pronósticos de infertilidadEn el manejo de una pareja con infertilidad, los factores pronósticos más importantes serán:
- a)
Duración de la infertilidad
- b)
Infertilidad primaria o secundaria (si ha tenido hijos previamente)
- c)
Resultado del espermiograma
- d)
Edad y status reproductivo de pareja (factor más importante).
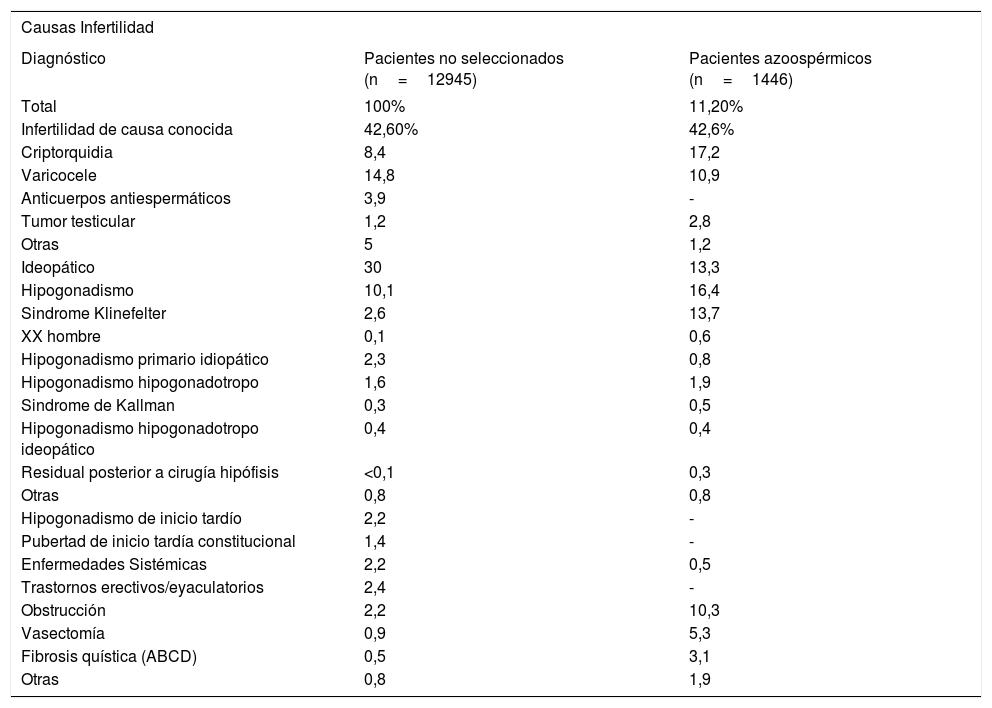
Las causas de infertilidad se resumen en la Tabla 317
Causas de Infertilidad masculina
| Causas Infertilidad | ||
|---|---|---|
| Diagnóstico | Pacientes no seleccionados (n=12945) | Pacientes azoospérmicos (n=1446) |
| Total | 100% | 11,20% |
| Infertilidad de causa conocida | 42,60% | 42,6% |
| Criptorquidia | 8,4 | 17,2 |
| Varicocele | 14,8 | 10,9 |
| Anticuerpos antiespermáticos | 3,9 | - |
| Tumor testicular | 1,2 | 2,8 |
| Otras | 5 | 1,2 |
| Ideopático | 30 | 13,3 |
| Hipogonadismo | 10,1 | 16,4 |
| Sindrome Klinefelter | 2,6 | 13,7 |
| XX hombre | 0,1 | 0,6 |
| Hipogonadismo primario idiopático | 2,3 | 0,8 |
| Hipogonadismo hipogonadotropo | 1,6 | 1,9 |
| Sindrome de Kallman | 0,3 | 0,5 |
| Hipogonadismo hipogonadotropo ideopático | 0,4 | 0,4 |
| Residual posterior a cirugía hipófisis | <0,1 | 0,3 |
| Otras | 0,8 | 0,8 |
| Hipogonadismo de inicio tardío | 2,2 | - |
| Pubertad de inicio tardía constitucional | 1,4 | - |
| Enfermedades Sistémicas | 2,2 | 0,5 |
| Trastornos erectivos/eyaculatorios | 2,4 | - |
| Obstrucción | 2,2 | 10,3 |
| Vasectomía | 0,9 | 5,3 |
| Fibrosis quística (ABCD) | 0,5 | 3,1 |
| Otras | 0,8 | 1,9 |
Tomado de Nieschlag E, Behre HM and Nieschlag S (eds) Andrology. In Male reproductive health and dysfunction. 3rd ed. Berlin: Springer Verlag, Chapter 5, pág. 90. (Ref. 16).
Los factores genéticos son la causa de al menos el 15% de la infertilidad masculina. Hombres con azoospermia son los de mayor riesgo de ser portadores de una anomalía genética llegando al 25% de los casos. Este riesgo disminuye progresivamente mientras aumenta la concentración espermática18.
1. Aneuploidías
Son las responsables del 15% de las azoospermias no obstructivas y oligozoospermias severas (menores a 5 millones/ml)19,20. Se diagnostican a través de la realización de un cariotipo. La más frecuente es el síndrome de Klinefelter (47XXY), que se presenta en 1 de 500-600 nacidos vivos21 y que en azoospermias no obstructivas puede tener una frecuencia de 1 en 722. Es una causa frecuente, pero sub diagnosticada.
Las manifestaciones clínicas del síndrome de Klinefelter son variadas y a veces, sutiles23
Recién Nacido/Infancia: Criptorquidia bilateral, pene pequeño, escroto bífido (poco frecuente), fisura paladar, cardiopatía congénita.
Etapa escolar: Dislexia, problemas de lenguaje, dificultades de aprendizaje, descoordinación motora, problemas de interacción social.
Pubertad/adolescencia: Ginecomastia, testes pequeños y firmes, talla alta con tronco relativamente más corto que extremidades inferiores.
Adultos: Infertilidad (el 10% de los pacientes azoospérmicos tiene síndrome de Klinefelter), hipogonadismo hipergonadotropo, diabetes tipo 1 y 2, síndrome metabólico, osteoporosis, tumores gonadales, tumores mediastínicos, cáncer de mama (30 veces más que 46 XY), linfoma, leucemia, trastornos inmunológicos.
El 92% de los pacientes con síndrome de Klinefelter son azoospérmicos. La biopsia testicular bajo microscopio (M-TESE) es la técnica con mejores tasas de éxito de recuperación espermática (recuperación en el 30-50% de los pacientes24). Realizar M-TESE en etapa puberal o post puberal inmediata para aumentar posibilidades de encontrar espermatozoides es una opción controversial con pros y contras que se debe evaluar caso a caso con el paciente y sus padres. Es importante mencionar que este grupo de pacientes presenta múltiples comorbilidades, por lo que, aunque el paciente no desee fertilidad debe ser seguido por el equipo de salud.
2. Alteraciones estructurales de cromosomas
Dentro de las anomalías estructurales en cromosomas autosómicos, las translocaciones Robertsonianas, inversiones o translocaciones reciprocas se encuentran 10 veces más frecuentes en hombres con oligozoospermia severa (4-8%) que en hombres normozoospérmicos25.
Microdeleción del cromosoma YEn la región AZF del brazo largo del cromosoma Y, se encuentran múltiples genes que participan en la espermatogénesis26. La microdeleción del cromosoma Y (MCY) se encuentra en el 8-12% de hombres azoospérmicos y 3-5% de oligozoospermias severas26. Es una mutación de novo - prevalencia 1:1000 a 1:5000 recién nacidos vivos.
La microdeleción del cromosoma Y tiene 3 variantes según el sector que afecte:
Microdeleción de AZFa – se asocia a síndrome de solo células de Sertoli y nula posibilidad de encontrar espermatozoides en una biopsia testicular.
Microdeleción de AZFb – se asocia a arresto de la espermatogénesis y nula posibilidad de encontrar espermatozoides en una biopsia testicular.
Microdeleción de AZFc – se asocia a hipo espermatogénesis y es posible encontrar espermatozoides en la biopsia testicular en un 30% de los casos.
En nuestro centro (datos no publicados) se analizaron en forma retrospectiva las microdeleciones del cromosoma Y en 496 hombres infértiles con diagnóstico de azoospermia u oligozoospermia severa, definida como la presencia de <5×106 espermatozoides/ml en el eyaculado, entre noviembre de 2012 y agosto de 2019; encontrando un 7.8% de microdeleciones del cromosoma Y. La distribución, en relación a la región comprometida, fue la siguiente: AZFc 3,8% (n=19), AZFb/c 2,6% (n=13), AZFa 0,8% (n=4) y AZFb 0,6% (n=3).
La prevalencia de microdeleciones del cromosoma Y en Chile es similar a la descrita en la literatura. La microdeleción más frecuente es la AZFc, en estos pacientes existe la posibilidad de encontrar gametos en una biopsia testicular. Sin embargo, si la microdeleción se encuentra en AZFa o AZFb la biopsia testicular será infructuosa ya que el compromiso genético de la espermatogénesis impide la obtención de espermatozoides. Aquí radica la relevancia del estudio de las microdeleciones en hombres azoospérmicos, ya que se pueden evitar muchas biopsias testiculares frustras en hombres infértiles. Por otra parte, el estudio es también relevante para un adecuado consejo genético, los pacientes con microdeleción AZFc que se traten mediante ICSI, debido a que transmitirán está deleción a su descendencia de sexo masculino.
Existe además la deleción gr/gr. Esta consiste en una deleción parcial la zona AZFc. La expresión fenotípica en los pacientes es variable dependiendo de etnicidad, y se ha reportado mayor riesgo de oligozoospermia27.
Frente a la presencia de una azoospermia no obstructiva (NOA) o oligo zoospermia severas (concentración <5 millones/ml) solicitamos un cariotipo y una microdeleción del cromosoma Y de forma rutinaria.
3. Variantes patogénicas (mutaciones)
Síndrome de KallmannEs la principal causa de infertilidad por afectación del cromosoma X, dado por la mutación de diferentes genes (ANOS1, PROKR2, FGFR1, KALIG-1, entre otros) 28. Se han identificado mutaciones de genes autonómicos que también producen este síndrome29. Estos pacientes se manifiestan con un hipogonadismo hipogonadotrópico y anosmia. El tratamiento es la estimulación con gonadotrofinas.
Mutaciones del gen CFTR(Cystic fibrosis transmembrane regulator gene)
Agenesia bilateral de conductos deferentes (ABCD) causas genéticas de infertilidad de tipo obstructivo. El diagnóstico es clínico, a través del examen físico no identificando los conductos deferentes. Generalmente los pacientes presentan tamaño testicular normal, en el espermiograma un bajo volumen seminal con azoospermia y la FSH se encuentra dentro de rangos normales4. La frecuencia de ABCD es de 1:1600 hombres y todos los pacientes con fibrosis quística (FQ) son portadores de ABCD. Una vez sospechado, es importante solicitar mutaciones del gen CFTR (cystic fibrosis transmembrane regulator gene), ya que se considera una variante genital de la fibrosis quística y se encuentra al menos una mutación aproximadamente en 70-80% de los casos30. Aunque se han descrito más de 1300 mutaciones para CFTR, las pruebas más utilizadas se basan en la búsqueda 50 mutaciones más comunes; por lo que un resultado negativo no es sinónimo de ausencia de una mutación. La mayoría de los pacientes con ABCD, presentan también hipoplasia o agenesia de vesículas seminales, y por esto presentan bajo volumen de eyaculado. En pacientes azoospérmicos con agenesia unilateral, la realización de una resonancia magnética de pelvis puede confirmar atresia contralateral de conductos deferentes o vesículas seminales. En los pacientes con estudio genético positivo para CFTR es fundamental la evaluación de la presencia de la mutación en la pareja, si la pareja del paciente es portadora de la misma mutación que el paciente la probabilidad de tener un hijo con FQ es de 25% si es heterocigoto y 50% si es homocigoto. Si la pareja es negativa para mutaciones conocidas del gen, la probabilidad de tener mutaciones desconocidas es de 0,4%. En esas circunstancias la posibilidad de que un hijo tenga FQ si el padre es heterocigoto es de 1:700.
Por último, se debe indicar estudio ecográfico renal a pacientes con agenesia unilateral de conductos deferentes, para identificar posibles malformaciones renales, y considerar secuenciar el gen CFTR completo en pacientes con CBAVD con un panel de mutaciones negativo y una pareja femenina portadora de mutaciones del gen de la fibrosis quística.
Existen alteraciones genéticas que afectan la morfología espermática. La macrozoospermia se caracteriza por espermatozoides de gran cabeza y multiflagelados. Es una afectación poco frecuente y se asocia con oligoastenozoospermia31. Se produce por la mutación en el gen AURKC. Estos pacientes deben ser estudiados genéticamente previo al tratamiento de reproducción asistida, ya que, si la alteración es homocigota, todos los espermatozoides serán poliploides no logrando un embrión viable. En caso de no encontrar mutación se podría intentar TRA y se puede proponer la realización de diagnóstico genético preimplantacional18–32.
La globo-zoospermia también muy infrecuente (0,1%), se caracteriza por cabezas redondas, sin acrosomas, por lo que no pueden fertilizar. La mutación más frecuente observada es la DPY19L2. La única opción en casos de 100% de globo-zoospermia es la realización de un ICSI18.
En aproximadamente 40% de hombres con alteración en la espermatogénesis no se encuentra la causa posterior al estudio. Es probable que existan factores genéticos no dilucidados por el momento y diversos estudios genéticos se están realizando actualmente buscando nuevas etiologías18.
Infertilidad como indicador de saludComo fue mencionado previamente, existe asociación entre cáncer testicular e infertilidad11. Estudios de cohorte danés de Jacobsen, con más de 32.000 pacientes, evidencian que hombres con alteraciones seminales presentan mayor frecuencia de cáncer testicular que la población general33, también existe asociación entre infertilidad y linfoma no Hodgkin34. Dentro del área metabólica, se ha encontrado asociación de pacientes con infertilidad y enfermedad cardiovascular y diabetes35. Recientes publicaciones señalan que pacientes con infertilidad presentan mayor riesgo de desarrollar enfermedades autoinmunes como lupus eritematoso sistémico, artritis reumatoide, psoriasis, colitis ulcerosa y enfermedades tiroideas36. Jensen, también en una cohorte danesa de más de 4300 pacientes, encontró una asociación entre infertilidad y mortalidad en pacientes con alteraciones de parámetros seminales, a mayor grado de oligo zoospermia mayor mortalidad37.
SíntesisExiste un factor masculino en aproximadamente la mitad de las parejas infértiles. La adecuada evaluación del paciente con anamnesis, examen físico, espermiograma y exámenes básicos de laboratorio, permitirá identificar las condiciones que tienen tratamiento específico; las que no tienen tratamiento, pero permiten recuperar gametos viables; las que no permitirán recuperar espermatozoides, debiendo asesorar en relación a adopción o utilización se semen de donante; y las condiciones que pueden poner en riesgo la vida del paciente. Los pacientes deben ser evaluados por urólogos-andrólogos entrenados que permitan llegar al diagnóstico etiológico, como también buscar comorbilidades asociadas. Una correcta historia clínica, examen físico, espermiograma, y exámenes complementarios nos permitirán obtener el diagnóstico etiológico y por lo tanto el tratamiento adecuado. Las causas genéticas de infertilidad son al menos el 15% de las etiologías, aumentando hasta el 25% en casos de azoospermia. A través del desarrollo y avance en biología molecular, creemos que en el futuro podremos identificar otras causas genéticas que actualmente son categorizadas como infertilidad de origen idiopático.
Declaración de conflicto de interésLos autores declaran no tener conflictos de interés con relación a este manuscrito.