La mejor comprensión de la fisiología reproductiva y la disponibilidad de más y mejores recursos diagnóstico/terapéuticos permiten individualizar la estimulación ovárica y hacerla más efectiva (mejores resultados), eficiente (en menos tiempo y con dosis más bajas), segura (con menos y más leves complicaciones), cómoda (menos molestias y autonomía) y accesible (para más personas, a menores costos). Con tecnología de ADN recombinante se dispone ahora de todas las gonadotrofinas e incluso algunas con formas moleculares modificadas para aumentar la duración de acción y disminuir el número de inyecciones. El esquema más utilizado es el de FSH recombinante junto con antagonistas de GnRH. Hay indicaciones específicas para agregar LH o coadyuvantes como hGH o andrógenos transdérmicos. La estimulación ovárica, además de infertilidad, se usa para la preservación de la fertilidad. Cada vez se implementan más estrategias como acumulación de óvulos, esquemas no convencionales (random start, DuoStim y otros) junto a vitrificación ovular, estudio genético preimplantatorio, transferencias embrionarias diferidas y la investigación continúa. Se pronostican mejoras en un futuro próximo, entre otras antagonistas por vía oral y estudio genético de pacientes para diagnosticar mutaciones o polimorfismos de gonadotrofinas y sus receptores. Aunque ya es factible individualizar la estimulación y volverla más efectiva, segura y amigable, así como ofrecer otras opciones a pacientes de mal pronóstico.
Due to an increased understanding of reproductive physiology and to the availability of more and better diagnostic/therapeutic agents, ovarian stimulation through individualization, has become more effective (improved results), efficient (shorter span and lower doses), safe (less and milder complications), comfortable (less discomfort and dependance) and affordable (for more people at lower cost). All gonadotrophins are now available by recombinant DNA technology, including some modified compounds for specific purposes such as longer action and fewer injections. The most popular ovarian regime uses recombinant FSH and GnRH antagonist. There are precise indications for adding LH or adjuncts like hGH or transdermal androgens. Besides infertility, ovarian stimulation is also indicated for fertility preservation. Strategies like oocyte accumulation, non-conventional stimulation protocols (random start, DuoStim and others), oocyte vitrification, preimplantation genetic testing, freeze-all, deferred embryo transfer for particular cases are becoming popular, and the research still goes on. Future advances like oral GnRH antagonists, and the study of mutations and polymorphisms for gonadotropins and its receptors are foreseen. Today through individualization, ovarian stimulation is safe, effective and friendly, also we can offer good options to bad prognosis patients.
Aunque se descubrieron a principios del siglo pasado, hasta 19381 se logró ovulación en mujeres anovulatorias con gonadotrofinas de origen animal (provenientes de hipófisis ovinas y porcinas o, de suero de yeguas embarazadas), con malos resultados por la rápida formación de anticuerpos. El posterior uso de gonadotrofinas de hipófisis humanas postmortem2 requería muchas hipófisis e incrementó el riesgo de la enfermedad de Creutzfeld-Jakob, por lo que su empleo pronto se abandonó.
Con aportes fundamentales de dos químicos (Frank P. Palopoli y Pietro Donini) a mediados del siglo pasado, se aprobó el uso comercial de inductores de ovulación como el citrato de clomifeno (CC)3 y las gonadotrofinas hipofisarias extraídas de orina de mujeres posmenopáusicas llamadas menotropinas o gonadotrofinas menopáusica humana (hMG, por sus siglas en inglés)4; así inició el tratamiento específico de la anovulación. Antes, las opciones eran empíricas: cambios en el estilo de vida (disminuir o evitar estrés, obesidad, adicciones, exceso de ejercicio, etc.), administrar corticoides, hormonas tiroideas, resección cuneiforme, e incluso radiación ovárica5. El CC se volvió el fármaco más utilizado para la causa más frecuente de anovulación, el síndrome de ovarios poliquísticos (SOP) y las hMG se reservaban para fallas a su tratamiento y para otras causas de anovulación. A fines de los setentas apareció la fertilización in vitro (FIV, IVF) al principio en ciclos naturales o de mínima estimulación con CC o hMG, pero poco después, inició la estimulación ovárica (EO, OS) para procurar un desarrollo folicular múltiple, más óvulos en la aspiración folicular y mejores tasas de embarazo.
En los ochentas aparecieron formas purificadas (p), altamente purificadas de FSH (hp) y preparaciones con más FSH que LH en diferentes proporciones, para pacientes con cifras altas de LH y bajas de FSH. A principios de los noventas, aumentó la demanda de gonadotrofinas. Para mayor pureza y consistencia en la respuesta y para disminuir el riesgo de infecciones por utilizar productos biológicos, se sintetizó la primera FSH con tecnología de ADN recombinante (FSHr), la cual junto con los análogos de GnRH (primero agonistas (ag) y luego antagonistas (ant) así como del empleo de diversos coadyuvantes (metformina, inositol, cabergolina, corticoides, andrógenos, hormona del crecimiento, etc.) de acuerdo a las características de las pacientes, se utilizan en muy diversos esquemas, no solo como tratamiento de anovulación sino de múltiples causas de infertilidad (endometriosis, alteraciones espermáticas y tubarias, infertilidad de causa desconocida, baja reserva ovárica, etc.) e incluso para preservación de fertilidad por diversas indicaciones.
Inducción de ovulación en tratamientos de baja complejidadLa reproducción asistida (RA, AR, por sus siglas en inglés) o médicamente asistida (RMA) involucra el uso de tecnología avanzada (TRA, ART, por sus siglas en inglés) para la manipulación de gametos y/o embriones. Se divide en: baja (BC) o alta complejidad (AC). En BC se induce ovulación de uno o dos óvulos y se manejan solo espermatozoides incluyendo su criopreservación, mientras que en AC la EO procura un desarrollo folicular múltiple (de ocho a doce folículos en promedio), los cuales hay que aspirar antes de la ovulación, luego manipularlos antes y después de la fertilización, para incrementar tasas de implantación y recién nacidos sanos y, disminuir tasas de abortos y alteraciones congénitas. La inseminación terapéutica (antes denominada artificial, AI, por sus siglas en inglés) se efectúa con espermatozoides de la pareja u homóloga (IAH, AIH, por sus siglas en inglés) o de donador o heteróloga (IAD, AID, por sus siglas en inglés). Todas son intrauterinas (IIU o IUI, por sus siglas en inglés) y en ciclos naturales o modificados, pero hay mejores resultados con inducción de ovulación (IO, OI, por sus siglas en inglés)6,7 porque se incrementan las probabilidades de interacción de óvulos y espermatozoides al asegurar y programar la ovulación, obtener más de un folículo, mejorar las características del endometrio y de los espermatozoides. Éstos se utilizan en fresco o después de criopreservación.
Los esquemas de IO para IIU varían según las características de los pacientes. Sus riesgos: el síndrome de hiperestimulación ovárica (SHO, OHSS, por sus siglas en inglés) y los embarazos múltiples (EM). Para evitarlos hay que cancelar el disparo de hCG en presencia de tres o más folículos de 17mm de diámetro o más. Como se ve con mayor amplitud en la sección de SOP existen diversos fármacos entre los que destacan los inhibidores de aromatasas en diferentes esquemas8 y protocolos de bajas dosis de FSH con incrementos cada 7 días para un desarrollo monofolicular.
La luteinización prematura (niveles de LH y progesterona mayores a 10 UI/L y 1 ng/ml el día del disparo de la hCG) en IO para IIU es más frecuente de lo que se suponía, con cifras de 25 a 30% en algunas series, y condiciona fallas al tratamiento. Por la disponibilidad de GnRHant, su aplicación es una excelente opción9. Disminuye la cancelación de ciclos, aunque no ha demostrado que aumente las tasas de embarazo10. En un estudio de 14.519 ciclos de IIU en 8.583 parejas con infertilidad inexplicable las tasas de embarazo fueron superiores a las obtenidas en ciclos naturales (6,2%) con IIU estimuladas con CC (8,9%), con letrozol (9,4%) y con gonadotrofinas (9,5%) y las tasas acumuladas de embarazos con tres ciclos fueron de 18.4% para el ciclo natural y 25,7%, 26,2% y 23,7% con el uso de CC, letrozol y gonadotrofinas11. Muchos otros estudios12, corroboran estos hallazgos con diferentes cifras, pero enfatizan un mayor riesgo de embarazos múltiples si no se aplican criterios de cancelación estrictos13 y la necesidad de reconocer casos donde es lo más conveniente es la fertilización in vitro14.
Estimulación ovárica para tratamientos de alta complejidadEs fundamental individualizar la estimulación según características de cada paciente (edad, reserva ovárica, índice de masa corporal, respuesta a ciclos previos, presencia o no de adicciones, patología adicional, etc.), para establecer un pronóstico de respuesta probable a la EO: normal (NR), alta (AR) o baja (BR) y, decidir la dosis inicial diaria de FSH que, con algunas variantes, es de 150 UI para AR, 225 para NR y 300 para BR. Determinar si hay o no indicación de agregar LH a la FSH15 (Tabla 1) coadyuvantes o, algún tipo de preparación. Interesa el número y la calidad de óvulos que se procura obtener. Según la edad, varía el número mínimo de óvulos requerido para ofrecer una buena probabilidad de transferir al menos un blastocisto euploide16–18 (Tabla 2).
Número mínimo de ovocitos necesarios para obtener un blastocisto euploide
| <35 años | >35 – 40 años | >40 – 43 años |
|---|---|---|
| 6 CCCO | 10 CCCO | 16 CCCO |
| 5 ovocitos MII | 8 ovocitos MII | 13 ovocitos MII |
| 4 ovocitos fertilizados | 6 ovocitos fertilizados | 10 ovocitos fertilizados |
| 2 blastocistos | 3 blastocistos | 5 blastocistos |
| Tasa de euploides | Tasa de euploides | Tasa de euploides |
| 60% | 30% | 20% |
| 1 blastocisto euploide | 1 blastocisto euploide | 1 blastocisto euploide |
Abreviaturas: CCCO: Complejo-cúmulo–corona-oocito; MII: metafase 2.
Además de la evaluación clínica de la reserva ovárica, disponemos de biomarcadores séricos y ultrasonográficos más precisos como la hormona antimülleriana (AMH, por sus siglas en inglés) y la cuenta folicular antral (CFA o AFC, por sus siglas en inglés)19. La AMH puede medirse en cualquier día del ciclo sin modificaciones por la interacción con otras hormonas como sucede con FSH y estradiol.
Cifras entre 1,26-3,36 ng/mL pronostican un NR, mientras que cifras más bajas o altas hacen favorecen una BR o AR respectivamente. Asimismo, alrededor de 5 folículos antrales en cada ovario, pronostican una NR. Como la correlación entre AMH y CFA es muy buena se ha intentado sustituir el juicio clínico integral con nomogramas20 con parámetros como edad, AMH y FSH para simplificar el cálculo de la dosis inicial de FSH en cada paciente. La sincronización de la cohorte folicular previa a la estimulación disminuye los folículos residuales al inicio de ella, facilita el desarrollo coordinado de múltiples folículos y la programación de los ciclos. Con GnRH ag en ciclos largos la supresión de gonadotrofinas es severa y aumentan las dosis requeridas. Con anticonceptivos orales en algunas pacientes disminuyen las tasas de implantación21. La tendencia es utilizar estrógenos solos22,23 (estradiol 4mg diarios) desde 10 días antes de la menstruación hasta el inicio de la estimulación, que puede retrasarse hasta 8 días mientras continúe su administración24, esto facilita la programación, sincroniza la cohorte folicular y reduce niveles iniciales de FSH. Para disminuir las elevaciones prematuras de LH y cancelación de ciclos, se utilizan los análogos de GnRH, al inicio agonistas en ciclos largos y posteriormente antagonistas por requerir menos inyecciones y sobre todo para reducir la incidencia del SHO, como se ve más adelante. El régimen con mejores resultados es el de inicio fijo (0,25mg diarios de cetrorelina o ganirelina) a partir del quinto día de estimulación y continuar hasta el día del disparo final de maduración25.
Medicamentos con otras indicaciones han demostrado su utilidad para mejorar la respuesta ovárica como coadyuvantes o adjuntos a la EO con gonadotrofinas y como se ha señalado los análogos de GnRH, los anticonceptivos y los estrógenos entran en esta categoría. Los indicados en pacientes con SOP (metformina, inositol, corticoides, inhibidores de aromatasa, etc.) se tratan en ese capítulo. Entre los coadyuvantes destacan la hormona del crecimiento (hGH) y los andrógenos transdérmicos. La hGH se utiliza más en pacientes de edad avanzada con diferentes esquemas, con base a los informes de que en ellas disminuyen hGH y su intermediario el factor I de crecimiento similar a la insulina (IGF-I) lo que aumenta la apoptosis de las células de la granulosa, fundamentales para la nutrición de los ovocitos. Meta-análisis26 y estudios prospectivos27,28 muestran mejoría significativa, más que en número de óvulos recuperados, en tasas de embarazo y recién nacidos en especial con el esquema microflare29. El esquema más usado es de 8 UI diarias desde el inicio (o a más tardar al día 7 de la estimulación), hasta el último día de gonadotrofinas.
Los andrógenos aumentan la síntesis de receptores para FSH y su administración previa a la estimulación ovárica incrementa la respuesta en BR30 acorde a la experiencia clínica de AR en pacientes con hiperandrogenemia. Se requiere su uso de 3 a 6 meses antes del ciclo de estimulación, ya que no actúa en los folículos antrales, sino en los preantrales. Los resultados varían por falta de estudios con controles adecuados, múltiples criterios para definir BR y diferentes andrógenos y vías de administración31. Como los niveles séricos son mayores con la vía transdérmica (50mg diarios en gel antes y durante la estimulación)32 se prefiere ésta sobre la oral. Los niveles de andrógenos séricos aumentan con el uso de inhibidores de aromatasa (IA) como el letrozol33.
Tendencias y avances en estimulación ováricaAspirar más de 15 óvulos no aumenta las tasas de embarazo en fresco34 (aunque sí las acumulativas35) pero sí las complicaciones, por ello, se procura obtener el número de ovocitos necesarios que brinde una buena oportunidad de transferir un blastocisto euploide, aprovechando los grandes avances en vitrificación y estudio genético preimplantacional (PGT, por sus siglas en inglés). El descubrir oleadas de crecimiento folicular en diferentes fases del ciclo36, permite, cuando el tiempo apremia, la estimulación en la fase lútea o el inicio en cualquier fase del ciclo (random start)8. Para pacientes de mal pronóstico y que no acepten ovodonación la acumulación de óvulos es una estrategia frecuente9. En edad avanzada, baja reserva ovárica, o antecedente de respuesta con tres o menos folículos, la doble estimulación (DuoStim)37,38 en el mismo ciclo en las fases folicular y lútea con solo 4 días de descanso después de la primera punción folicular para iniciar la estimulación en la fase lútea. Se utilizan, además de las gonadotrofinas, antagonistas de GnRH (que se dejan de administrar en los 4 días de descanso) y el disparo final con agonista de GnRH. Se obtiene un número similar de óvulos en ambas punciones y la transferencia se difiere para otro ciclo. Esto reduce el tiempo para lograr un número aceptable de óvulos y debe plantearse desde el inicio a pacientes de mal pronóstico. Las gonadotrofinas recombinantes tienen mayor pureza, seguridad, consistencia en resultados, mejor control de calidad, mayor bioactividad y capacidad ilimitada de producción. Se dispone ahora de FSH (en sus formas alfa, beta, delta39 y epsilon40) así como la modificación de ésta (corifolitropina alfa41) para aumentar la duración de su efecto a 7 días. También de LHr y hCGr. Hay presentaciones solas o combinadas en proporciones más fisiológicas y medición en microgramos de sustancia en lugar de las antiguas unidades internacionales, ello facilita la individualización de estrategias terapéuticas. Las preparaciones en líquido y los dispositivos actuales de inyección subcutánea dan mayor comodidad y autonomía a las pacientes. Más que superioridad de una u otra, lo que se requiere es decidir qué es lo más conveniente para cada paciente, considerando seguridad, efectividad, comodidad, disponibilidad y costos. Se han empezado a estudiar mutaciones y polimorfismos de gonadotrofinas y sus receptores para detectar sensibilidad o resistencia a las mismas42,43. Se anticipa la pronta disponibilidad de antagonistas de GnRH por vía oral44, así como de la kisspeptina45,47 para el disparo final de maduración.
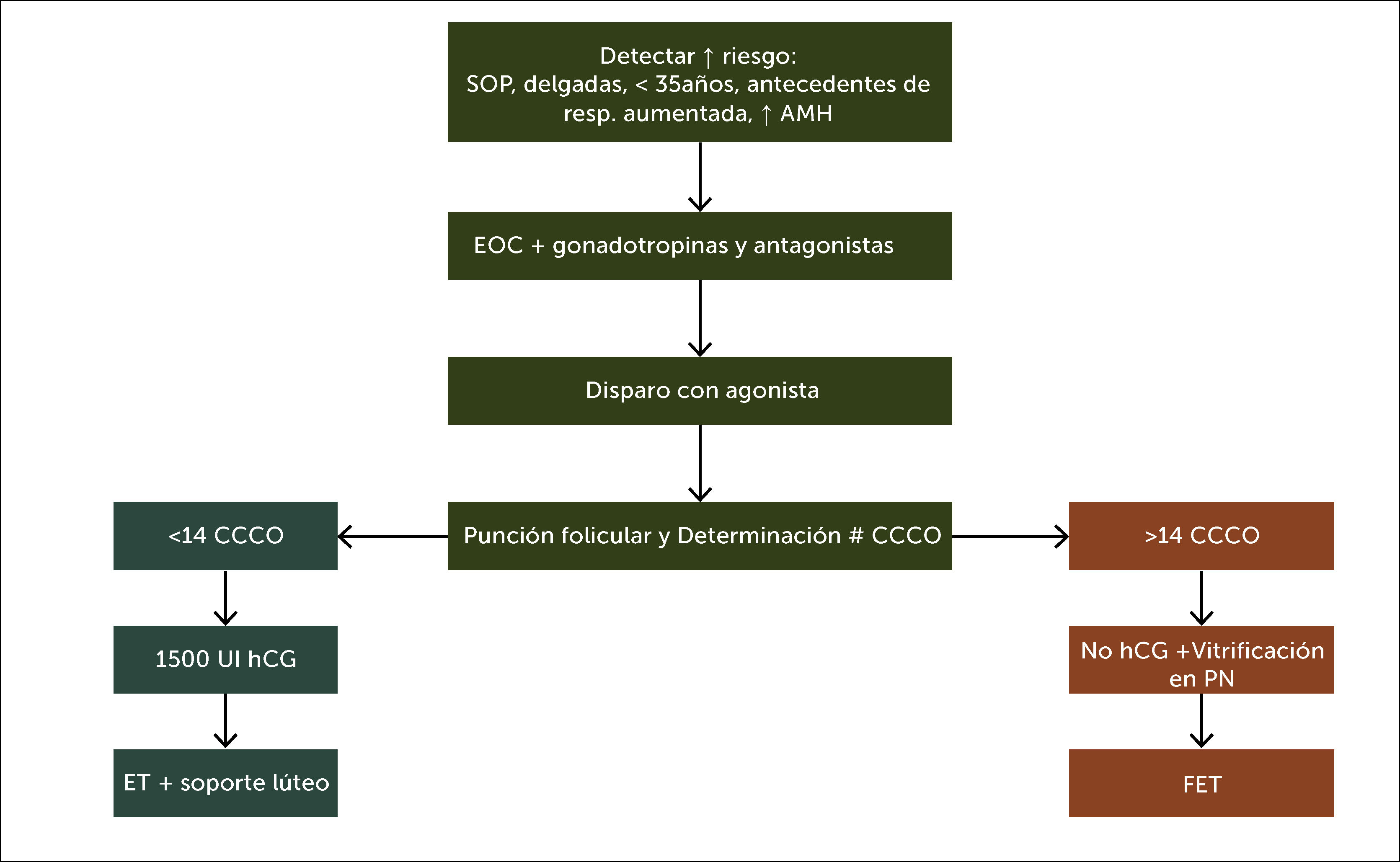
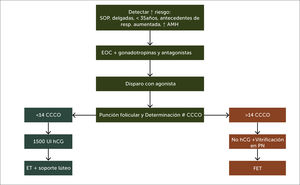
Prevención de complicaciones en estimulación ováricaEl SHO, la principal complicación de la EO es ahora raro y menos grave por la aplicación de estrategias para pacientes con alto riesgo (AR)48 como: detección oportuna, el uso de GnRHant junto a dosis bajas de gonadotrofinas, disparo con GnRHag49 y transferencia diferida cuando se obtienen más de 14 complejos-cúmulo-corona-ovocito (CCCO), para evitar, en caso de embarazo, la acción de la hCG (Figura 1). Cuando se anticipa una transferencia en fresco da mejores resultados agregar a la inyección final de maduración de 2mg de GnRHag, una dosis de1500 UI de hCG o su equivalente en mg de hCGr (dualtrigger) y luego el esquema de soporte lúteo tradicional con progesterona por la vía que se considere más conveniente. No hay diferencias en efectividad entre la administración intramuscular y la vaginal. Hay informes de buena absorción de dihidrogesterona por vía oral y se avizora la próxima disponibilidad de progesterona acuosa para aplicación subcutánea50.
Flujograma de procedimiento para prevenir complicaciones en la estimulación ovárica
Abreviaturas: CCCO: complejo-cúmulo–corona-oocito; SOP: síndrome ovario poliquístico; AMH: hormona antimülleriana; UI: unidades internacionales; hCG: hormona gonadotrofina coriónica humana; ET: Embryo Transfer; PN: pronúcleo; FET: Frozen Embryo Transfer.
Devroey et al. (2011) (Ref. 48).
Los autores declaran no tener ningún conflicto de interés en la realización de este artículo.
FinanciaciónEste trabajo no recibió ningún tipo de financiamiento externo para su realización.
Referencia no citada46.